INTRODUCCIÓN
El SM en realidad no es un síndrome, sino un conjunto de factores patológicos de carácter bioquímico y algunos de carácter clínico que se utilizan para evaluar el RCV, al que se le ha asignado otros nombres como síndrome plurimetabólico, el cuarteto de la muerte, síndrome de resistencia a la insulina, síndrome dismetabólico, entre otros.
Gerald Reaven, en el año 1988, explicó la secuencia de fenómenos biológicos que le permitieron plantear la existencia de un cuadro patológico que denominó síndrome X 1, en el cual la alteración fundamental era la resistencia a la insulina (RI), responsable de la mayor producción de insulina por el páncreas (hiperinsulinismo), acompañada de intolerancia a la glucosa, hipertrigliceridemia, disminución del colesterol HDL e hipertensión arterial, orientado principalmente a la explicación de la fisiopatología de la intolerancia a la glucosa y la diabetes tipo 2 (DM2).
Posteriormente, en base a esta concepción, varios grupos de investigadores e instituciones crearon una nueva categoría diagnóstica mediante consensos, que denominaron "síndrome metabólico" con el objeto de evaluar el RCV. Desafortunadamente, la utilización de muy diferentes criterios en lugar de favorecer su entendimiento, diagnóstico y tratamiento, ha llevado a una gran controversia, aún no resuelta. El presente artículo tiene como objetivo contribuir al esclarecimiento de la validez y utilidad del SM en el establecimiento del riesgo cardiovascular de las personas.
DESARROLLO DEL TEMA
Se efectuó una investigación bibliográfica de la literatura científica peruana e internacional vinculada al SM, revisando los repositorios bibliográficos SciELO, MedLine, Scopus y la página de resúmenes basados en evidencias MedScape. Producto de la búsqueda bibliográfica se analizaron las características de las guías de diagnóstico del SM propuestas por la Organización Mundial de la Salud (OMS) 2, Internacional Diabetes Federation (IDF) 3, National Cholesterol Education Program Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (NCEP ATP III) (4) , American Association of Clinical Endocrinologists (AACE) 5, International Lipid Information Bureau (ILIBLA) 6, American Heart Association/National Heart, Lung and Blood Institute (AHA/NHLBI) 7) y European Group for the Study of Insulin Resistance (EGIR) 8.
Se revisaron los resultados de la prevalencia del SM, halladas en estudios peruanos e internacionales, que utilizaron las guías mencionadas y se cuantificaron las diferencias utilizando la prueba Z de cálculo de probabilidades, mediante el programa PRIMER, para establecer su significado estadístico. Se evaluó el poder predictivo del desarrollo de eventos cardiovasculares de las guías y sus componentes en observaciones longitudinales.
Descripción y comparación de las guías de diagnóstico del síndrome metabólico
Al ofrecer el contraste entre las guías más difundidas y la propuesta original de Reaven (Tabla 1), se puede observar que las guías de la OMS y EGIR son las únicas que toman en cuenta a la RI. Las guías de la OMS, AACE, ILIBLA y EGIR consideran intolerancia a la glucosa o glucosa anormal en ayunas (GAA) o simplemente hiperglicemia, cuando la glicemia en ayunas excede 110 mg/dL; en cambio, para la IDF, ATP III, AHA/NHLBI y EGIR el límite es de 100 mg/dL. La OMS y AACE agregan que la glicemia postprandial no debe exceder 140 mg/dL Se considera hipertrigliceridemia cuando excede a 150 mg/dL en todas las guías excepto en EGIR que propone 178 mg/dL.
Tabla 1. Comparación de las guías de diagnóstico del síndrome metabólico más utilizadas.
| Propuesta/Guía | REAVEN ( 2 ) | OMS ( 3 ) | IDF( 4 ) | ATP III( 5 ) | AACE( 6 ) | ILIBLA ( 7 ) | AHA/NHLBI ( 8 ) | EGIR( 9 ) |
|---|---|---|---|---|---|---|---|---|
| RI | X | X | X | |||||
| GAA, mg/dL | X | >110 | >100 | > 100 | >110 | >110 | >100 | >110 |
| GPP, > 140 mg/dl | X | X | ||||||
| Hiperinsulinismo | X | X | ||||||
| Trigliceridos >150 mg/dL | X | X | X | X | X | X | X | ≥178 mg/dL |
| HDL, ♀ <50 ♂ < 40 mg/dL | X | ♀< 39 ♂ < 35 | X | X | X | X | X | ≤ 39 mg/dL |
| HTA, ≥130/85 | X | ≥ 140/90 | X | X | X | X | X | ≥140/90 |
| CA cms | CC ♂ 0.90 ♀ 0.85 | CA* | ♂ 102 ♀ 88 | C/C ♂0,90 ♀0,85 | ♂ 102 ♀ 88 | ♂ 94 ♀ 80 | ||
| Microalbuminuria | X | |||||||
| Factores de riesgo y diagnóstico de SM | 2 mas RI | Obesidad central + 2 | 3 o más | Criterio Clínico | 3 o mas | 3 o mas | 2 mas RI |
Adaptado de Lizarzaburu 9. OMS: Organización Mundial de la Salud; IDF: International Diabetes Federation; NCEP -ATP III: National Cholesterol Education Program Adult Treatment Panel III; AACE: American Association of Clinical Endocrinologists; ILIBLA: Oficina Internacional de Información de Lípidos de Latinoamérica; AHA/NHLBI: American Heart Association/ National of Heart, Lung,Blood Institute; EGIR: European Group of Insulin Resistance. RI: resistencia a la insulina; GAA: glucosa anormal en ayunas; GPP: glucosa postprandial; C/C: relación cintura/cadera; CA circunferencia abdominal; CA* circunferencia abdominal de acuerdo al grupo racial. La X señala los criterios propuestos
Se considera colesterol HDL bajo cuando es menor de 50 mg/dL en las mujeres y menor de 40 mg/dL en los varones en la mayoría de guías, excepto la OMS que señala 35 mg/dL para varones y 39 mg/dL para las mujeres y EGIR 39 mg/dL para ambos sexos
La HTA es definida por la OMS y EGIR cuando la presión arterial es ≥ 140/90, en cambio en las otras guías se considera ≥135/80.
Todas las guías introdujeron un nuevo criterio de evaluación a la obesidad central, que tampoco es uniforme. La OMS e ILIBLA consideran el índice cintura/cadera, >0,90 para varones y >0,85 para mujeres; en la NCEP ATP III, el límite de la circunferencia abdominal (CA) es 102 cm en varones y 88 cm en mujeres; en EGIR >94 cm para varones y >80 para mujeres; para IDF varía de acuerdo al grupo racial.
Asimismo, se advierte que los criterios para diagnosticar el SM varían en cada una de las guías. La OMS y EGIR aceptan que una persona tiene SM cuando tiene dos componentes más RI; la IDF obesidad central más dos componentes; AACE se apoya en el criterio clínico; ATP III, ILIBLA y AHA/NHLBI cuando las personas tienen tres o más componentes. Este punto es fundamental, porque la prevalencia puede variar de acuerdo a que componentes tomados en cuenta; en unos casos podría ser RI, obesidad central e hipertrigliceridemia, en otros HTA, colesterol HDL bajo y GAA elevada, entre otras combinaciones que debilitan el poder predictivo de RCV de las guías del SM 9.
Lo expuesto demuestra que las guías son muy diferentes y que su aplicación puede llevar a resultados dispares.
Comparación de los resultados sobre la prevalencia del SM
A nivel internacional se efectuaron múltiples comparaciones de la prevalencia del SM en niños, adolescentes y adultos, que demuestran estadísticamente que efectivamente existe una gran disparidad de resultados de acuerdo a las guías que se utilicen. En Europa, Balkau y col. utilizaron las guías de la OMS y de EGIR en 8200 hombres y 9363 mujeres de 8 países europeos, de 40 a 55 años. Con la guía de la OMS en hombres el SM varió de 7% a 36% y en mujeres de 5% a 22%; en cambio, con EGIR en hombres fluctuó entre 1% a 22% y en mujeres 1% a 14% 10.
En el estudio de Onesi e Ignatius se compararon las prevalencias de SM de acuerdo a 5 guías diferentes en 96 personas mayores de 30 años aparentemente normales de África. Con la guía de la OMS la prevalencia alcanzó a 13,5 %, con la de NECP ATP III 22,9%, NCEP ATP III-R 29,2%, IDF 39,6 % y AACE 4,2%; las diferencias fueron estadísticamente significativas cuando se las compara con la OMS 11.
En una población rural de China, mayores de 30 años, 2145 hombres y 2603 mujeres, Wen y col. encontraron diferentes prevalencias del SM, cuando aplicaron los criterios de la OMS, Chinese Diabetes Society, NCEP ATP III, IDF y Join Interin Statement; siendo estas para hombres: 11,5%, 14,8%, 32,4%, 27,5%, 39,7%; y para mujeres 15,7%, 20,7%, 54,2%, 51,5% y 54,2%, respectivamente 12.
En el análisis de la literatura peruana, se han publicado resultados disímiles de prevalencia del SM; así, de las 14 publicaciones analizadas, cuatro han tomado como patrón solo a la propuesta del NCEP ATP III, dos solo a la del IDF y las restantes, dos o más guías al mismo tiempo (Tabla 2)
Tabla 2. Comparación porcentual de la prevalencia del síndrome metabólico en el Perú.
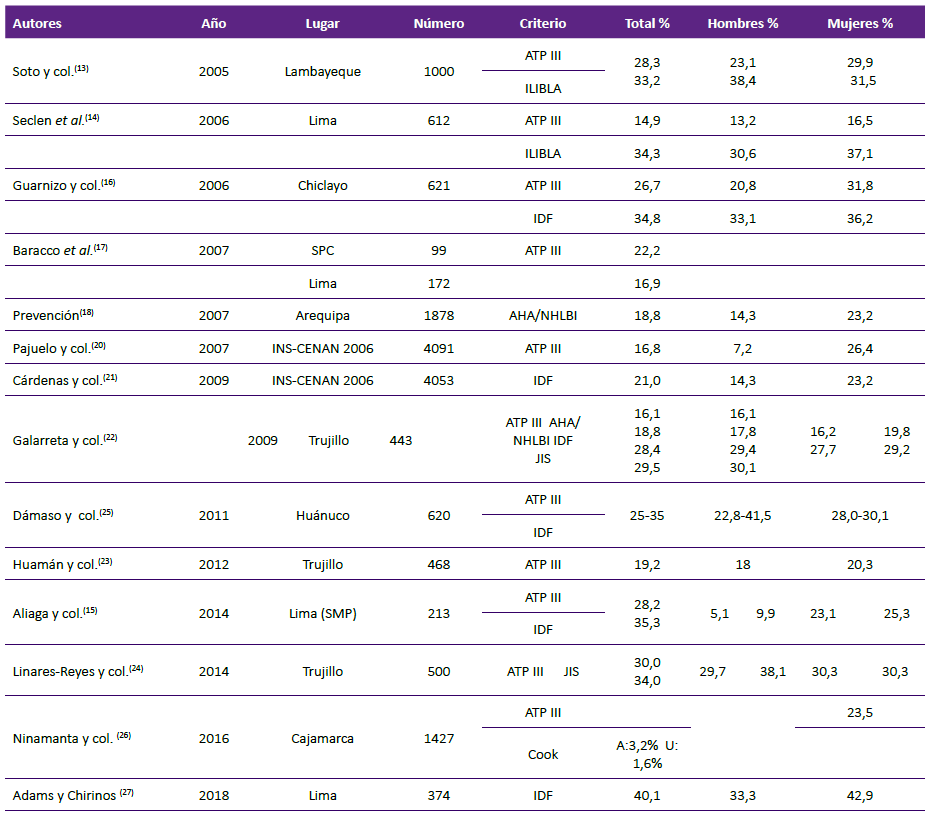
ATP III: Adult Treatment Panel III; ILIBLA: Oficina Internacional de Información de Lípidos de Latinoamérica; IDF: International Diabetes Federation; AHA/NHLBI: American Heart Association/National of Heart, Lung, Blood Institute; SPC: San Pedro de Cajas; SMP: San Martín de Porres; A adolescentes; U: Universitarios
En el trabajo de Soto y col. 13, con una muestra de 758 mujeres jóvenes y 242 varones del departamento de Lambayeque, se encontró una prevalencia global de SM de 28,3% con los criterios de NCEP ATP III y 33,4 % con los de ILIBLA, cuya diferencia fue significativa (p<0,02), la prevalencia de los valores en varones fue 23,1% y 38,4 %, mostrando también significancia estadística (p < 0,001) 13.
En una población de 612 personas mayores de 30 años de los distritos de San Martín de Porras, Rímac y Los Olivos de Lima, Seclén y col. 14 encontraron una prevalencia de general de 14,9% de SM aplicando los criterios de ATP III, 16,5 % en 418 mujeres y 13,2% en 294 varones, destacándose que en este caso, la diferencia entre ambos sexos no fue significativa 14.
Aliaga y col. en una población de 312 adultos mayores (60 a 89 años) del distrito limeño de San Martín de Porres, encontraron una prevalencia de 28,2% y 35,5% de síndrome metabólico según los criterios de ATP III e IDF, en mujeres 23,1 y 25,3 y en varones 9,9% y 5,1% respectivamente, que estadísticamente no fueron diferentes 15.
Guarnizo y col. estudiaron la prevalencia de SM en 641 personas, 54% mujeres, de dos localidades de Chiclayo, Monsefú de carácter agropecuario; y Santa Rosa, localidad pesquera. En esta publicación utilizaron tres guías (IDF, ATP III e IBIBLA), encontrando una prevalencia de 34,8%, 26,7% y 34,3%, respectivamente. La prevalencia general de SM en Chiclayo fue significativamente menor con la guía ATP III que con las otras dos 16.
En la comparación de la prevalencia de SM entre poblaciones de nivel del mar y altura, Baracco y col. no encontraron diferencias significativas de la prevalencia de SM bajo la evaluación de los criterios de NCEP ATP III. Señalaron que en la altura hubo una mayor prevalencia de hipertrigliceridemia (17) .
En el estudio PREVENCION, realizado en el año 2007, se utilizó las normas de AHA/NHLBI, evidenciándose una prevalencia global del 18,8%, mayor en mujeres 23,2% que en varones 14,3% (p <0,001) 18. Posteriormente este grupo definió la obesidad abdominal para pobladores andinos tomando como límites de corte a la circunferencia abdominal (CA) de 97 cm para varones y 87 cm para mujeres 19.
Es muy llamativo, que para la misma base de datos, Pajuelo y col. usando los criterios de NCEP ATP III (20) y Cárdenas y col. 21) usando el de la IDF, encontraran prevalencias del SM muy diferentes, con diferencias estadísticamente significativas (Tabla 2).
En la ciudad de Trujillo, en una población de 20 a 79 años, 221 varones y 232 mujeres, Galarreta y col. 21 efectuaron una comparación de la prevalencia de SM utilizando cuatro diferentes criterios ATP III, AHA/NHLBI, IDF y JIS (Join Interin Statement); y obtuvieron cuatro diferentes prevalencias que fluctuaron de 16,1% a 29,5 %, cuyos valores fueron estadísticamente diferentes entre si 22. Estos resultados difieren de los encontrados por Huamán y col. en una población de 222 varones y 246 mujeres de 20 a 79 años de edad, también en Trujillo, en el cual utilizando los criterios ATP III, se evidenció una prevalencia de 19,2 % de SM, sin diferencia entre varones y mujeres 23.
Adicionalmente, Linares-Reyes y col. en una población de 500 personas, 261 mujeres y 239 varones de Trujillo, encontraron concordancia entre SM y la cintura hipertrigliceridémica; sin embargo, la prevalencia con la guía NCEP ATP III fue 22% y con el JIS 38,6% 24.
En una población de 620 trabajadores de Huánuco, la prevalencia del síndrome metabólico fue 35,2% utilizando el criterio de la IDF, y según el criterio de la ATP III fue 25,64%, encontrándose que las diferencias entre estas proporciones eran significativas (p<0,006); asimismo, en la evaluación de la IDF se evidenció una mayor prevalencia en varones que en mujeres, lo que no sucede mediante el criterio de la NCEP ATP III 25.
En las ciudades de Cajamarca y Chota se investigó la prevalencia del SM en 586 estudiantes de los dos primeros grados de secundaria utilizando la guía de Cook (3,2%); en 305 jóvenes universitarios y en 536 madres jóvenes (34,2 ± 8,1 años) utilizando la guías ATP III (1,6% y 23,5%, respectivamente) (26) .
En el trabajo de Adams y Chirinos, efectuado en 374 usuarios (71,1% mujeres) de los comedores populares de Lima, se encontró una prevalencia de SM de 40,1% utilizando los criterios de la IDF, sin diferencia estadística entre las tasas encontradas en hombres (33,3%) y mujeres (42,9%) 27. Para la evaluación de la obesidad central tomaron en cuenta los criterios étnicos para poblaciones subasiáticas: ≥ 90cm para la circunferencia abdominal de los varones y ≥80 cm para las mujeres. Lo que puede explicar la alta prevalencia (3) .
En la comparación de los resultados obtenidos en una misma circunscripción con la misma guía también se obtienen resultados diferentes; así, en Trujillo con la guía NCEP ATP III, Galarreta y col. encontraron una prevalencia de 16,1% (22) . Mientras que Linares y col. reportaron una prevalencia de 22% 24. En Lima, con la guía NCEP ATP III, Seclen y col. encontraron una prevalencia de 14,9% 14; sin embargo, Aliaga y col., utilizando el mismo instrumento, encontraron 28,2% 15.
Los resultados de estos estudios demuestran que la prevalencia del SM es diferente de acuerdo a la guía que se utilice y los componentes de la guía que se hayan usado; por lo tanto, no se puede llegar a conocer la real magnitud del RCV en el Perú utilizando las guías del SM.
Valor predictivo de eventos cardiovasculares del SM
En el estudio de Hunt y col. realizado en 2815 personas del segmento de la población general, compararon la tasa de riesgo (hazard ratio) de muertes por causa cardiovascular en una observación promedio de 12,7 años (28) . Utilizando la guía del NCEP ATP III, la concentración de glucosa tuvo un hazard ratio (HR) de 2,87 (1,96-4,20) y el SM 2,53 (1,74-3,67); mientras que, con la guía de la OMS, el SM tuvo HR de 1,63 (1,13-2,36), la glicemia de 1,80 (1,22-2,66) y la HTA, 1,76 (1,20-2,59), lo que demuestra que los componentes simples del SM pueden tener un mayor poder predictivo del RCV que el SM en su conjunto. Este hecho, aparentemente contradictorio, podría explicarse porque las guías de diagnóstico de SM consideran dos o tres componentes del conglomerado que no son necesariamente las mismas ni las más importantes.
El estudio de Qiao y col. comprendió a 4041 hombres y 3812 mujeres, de 25 a 74 años, de seis cohortes de Finlandia y Suecia, en un seguimiento de 4 a 21 años; se produjeron para hombre/mujer 113/47 accidentes cerebrovasculares (ACV) isquémicos, 43/15 ACV hemorrágicos y 235/50 casos de enfermedad cardíaca coronaria 29. Se puede comprobar que la glicemia mayor de 100 mg/dL, la HTA y la obesidad central como FRCV individuales tienen un mayor poder predictivo que las guías de SM más utilizadas (Tabla 3).
Tabla 3. Poder predictivo de enfermedad cardíaca coronaria del SM y FRCV independientes.
| Documentos o factores | Hombres (n=4041) | Mujeres (n=3812) | ||
|---|---|---|---|---|
| Eventos (n=235) | Hazard ratio | Eventos (n=50) | Hazard ratio | |
| Guías de SM | ||||
| OMS | 104 | 1,57(1,21-2,04) | 14 | 1,32(0,69-2,51) |
| NCEP original | 78 | 1.51 (1.15-1.99) | 18 | 1.54 (0.85-2.79) |
| NCEP revisado | 98 | 1,63 (1,25-2,13) | 23 | 1,81 (1,02-3,21) |
| IDF | 109 | 1,46 (1,12-1,89) | 30 | 2,47 (1,37-4,45) |
| FRCV independientes | ||||
| Glicemia > 100 mg/dl | 126 | 1,64 (1,26-2,13) | 16 | 0,91(0,49-1,68) |
| Triglicéridos > 150 g/dL | 94 | 1,31 (1,0-1,73) | 19 | 1,58 (0,85-2,92) |
| HDL ♂<40 ♀<50 mg/dl | 62 | 1,35 (1,01-1,82) | 20 | 1,94 (1,10-3,44) |
| HTA ≥140/90 mmHg | 177 | 1,73 (1,27-2,35) | 37 | 2,31 (1,17-4,54 |
| HTA ≥ 135/85 mmHg | 210 | 2,27 (1,49-3,48) | 40 | 1,49 (0,71-3,11) |
| IMC >30 | 188 | 1,18 (0,86-1,63) | 28 | 1,98 (1,11-3,50) |
| CA >♂ 102 ♀ 88 cms | 56 | 1.27 (0.94-1.72) | 22 | 1.62 (0.92-2.86) |
| ICC >♂ 94 ♀ 80 cms | 134 | 1.16 (0.90-1.51) | 38 | 1.89 (0.98-3.66) |
Adaptado de Qiao y col. 29 ICC: índice cintura/cadera; CA: circunferencia abdominal
Estos estudios, muy bien documentados, demuestran que la utilización de los FRCV independientes es suficiente para predecir el RCV de las personas. De allí que hayan surgido opiniones, debidamente sustentadas, que señalan que es innecesario acudir a la aplicación de las guías del SM para cuantificar el RCV cuando es suficiente considerar si las personas tienen uno o más factores de riesgo cardiovascular 30,31,32.
En la revisión que se ha efectuado, se ha podido demostrar que las siete guías más utilizadas para la consideración del SM difieren en las características de sus componentes, comenzando con la RI que solo la OMS y EGIR la toman en cuenta. De acuerdo a la concepción original de Reaven, la RI es el fenómeno central, en el que no considera a la obesidad y que puede existir en sujetos con tolerancia normal a la glucosa; en otras palabras, la RI no implica necesariamente la existencia de hiperglicemia ni de obesidad y que el 50% corresponde a un origen genético 1,32.
La RI puede ser primaria (defectos en la formación de la insulina o de los receptores insulínicos), secundaria (envejecimiento, gestación, obesidad, HTA, intolerancia a la glucosa, síndrome de ovarios poliquísticos, etc) o por condiciones particulares congénitas raras (leprechaunismo, lipodistrofia, acantosis nigricans, síndrome de Rabson Mendelhall) 33.
La razón sustancial de establecer el RCV de las personas reside en la posibilidad de evitar o disminuir la morbi-mortalidad por el desarrollo de eventos cardiovasculares, llámese enfermedad cardíaca coronaria, infarto del miocardio, accidente cerebro vascular, insuficiencia vascular periférica, entre otros. Con este propósito, es necesario efectuar estudios longitudinales que demuestren si la existencia de un FRCV o la concurrencia de varios en las más diversas combinaciones, tienen el suficiente poder de predecir el daño cardiovascular que las personas pudieran desarrollar en razón del tiempo 28,29,30.
Los FRCV han sido divididos en modificables y no modificables. Los FRCV no modificables comprenden al envejecimiento, gestación y género masculino. Los FRCV modificables comprende a los tradicionales como la obesidad, diabetes mellitus, dislipoproteinemia, hipertensión arterial, sedentarismo, tabaquismo, y no tradicionales son las poblaciones migrantes por cambio del estilo de vida, violencia, personas con el antecedente de bajo peso al nacer o con macrosomía fetal, historia de enfermedad vascular temprana, síndrome de ovarios poliquísticos, acromegalia, inflamación, infecciones, intoxicaciones, injurias inmunológicas, factores trombogénicos, estrés psicosocial, contaminación ambiental y otros que se van incorporando en el tiempo, cada uno de los cuales son FRCV independienes. Es obvio que a tantos más tenga una persona el RCV es más severo. Así, en el estudio "formación de placas ateromatosas en pacientes con riesgo cardiovascular", publicado en el año 2014 34, se hizo una correlación entre el grado de obstrucción de las arterias carótidas y los FRCV, encontrándose una correlación positiva entre el grado de obstrucción con la edad, circunferencia abdominal, presión arterial diastólica, glicemia y el número de FRCV que los pacientes poseían.
Por todo lo anteriormente señalado, compartimos la opinión de otros investigadores que no es necesario recurrir al diagnóstico de SM para establecer el grado de RCV, cuando es más simple y directo establecer cuáles y cuantos FRCV tienen ellas para conocer el grado del RCV y tomar las medidas de prevención necesarias para evitar o disminuir los eventos cardiovasculares 35-38.
Finalmente, se concluye que el SM es una creación científico intelectual, no reconocida como entidad patológica específica, elaborada por grupos de expertos de diferentes organizaciones, en base a la contribución original de Gerald M Reaven del síndrome X. El SM tiene una concepción imprecisa, no tiene una patogénesis conocida y existe duda que sea un marcador de RCV.
Se ha demostrado que la prevalencia del SM varía de acuerdo a la guía que se utilice, en consecuencia no se llega a conocer la real magnitud del problema. Por ejemplo, la concepción original de Reaven considera a la RI como el factor inicial y fundamental del denominado síndrome X; sin embargo, solo la OMS y el grupo de estudio EGIR lo toman en cuenta. Los investigadores deben considerar que si utilizan varias guías en el mismo estudio para medir la prevalencia del SM, se obtendrán resultados diferentes, lo que puede impactar en las conclusiones que puedan obtener.
Asimismo, la prevalencia del SM está sujeta a diferencias raciales, etnias, características ambientales, edad y sexo, lo que es fundamental tener en cuenta para llegar a conclusiones valederas. Las guías de diagnóstico del SM no consideran FRCV importantes como el colesterol LDL, ni al colesterol NoHDL que contiene otras fracciones aterógenas que no son medidas por los procedimientos clínicos usuales.
Existen evidencias que los componentes individuales de las diferentes guías de SM tienen un valor predictictivo igual o mayor a largo plazo del desarrollo de eventos cardiovasculares que el SM en su conjunto.















