INTRODUCCIÓN
Las células dendríticas (CD) son consideradas presentadoras profesionales de antígenos, pues reconocen, capturan, procesan y presentan los antígenos a los linfocitos T (LT) para inducir su activación 1,2. Las CD al ser estimuladas por citoquinas proinflamatorias (IL-1β, IL-6, IL-8, IL-12 y TNF-α) o por ligandos de CD40 -expresado en el LT CD4+-, se activan y expresan un perfil de maduración (CD80, CD86, CD54). A su vez, modifican su patrón de expresión perdiendo los receptores CCR1 y CCR5, y expresando CCR7 y CXCR4 permitiéndoles migrar a los órganos linfoides secundarios 3,4.
Las CD reclutadas al entorno tumoral pueden verse afectadas en su maduración, diferenciación y presentación antigénica resultando en CD tolerogénicas o inmunosupresoras 5,6, de esta manera contribuyen al crecimiento y diseminación tumoral 7. En el microambiente tumoral, las señales estimuladoras y supresoras condicionan la capacidad funcional y fenotipo de las CD 8. Se ha demostrado el efecto del microambiente tumoral sobre un fenotipo polarizado de CD reguladoras protumorales en exposición a un modelo murino de cáncer del pulmón 9. Además, se ha descrito variación en los niveles de secreción de citoquinas proinflamatorias e inmunosupresoras cuando son expuestas a entornos tumorales 10,11, como la producción de VEGF, IL-6, IL-10 que conducen a la inhibición de la maduración y activación de CD in vitro12. Por otro lado, se ha identificado la expresión de IL-10 en entornos tumorales como melanoma, mieloma múltiple, cáncer de pulmón que han contribuido a la proliferación tumoral 8,9.
Las CD son versátiles en su función durante el proceso de maduración, presentación antigénica y posterior activación de linfocitos T, y como se ha descrito, su funcionalidad varía según las señales a las que se encuentran expuestas en el entorno y según el tipo tumoral. Sin embargo, este fenómeno requiere de más estudios y descripción de los mecanismos involucrados. Los resultados de estos estudios podrían ayudar a mejorar la eficacia en la respuesta antitumoral de las CD 13-15. Por lo descrito, nuestro objetivo fue evaluar la variación en la actividad de las CD en función a la secreción de citoquinas proinflamatorias, inmunosupresora y de la expresión de CXCR4 Y CCR7 frente a un entorno tumoral de células hepatocarcinoma (HCC, por sus siglas en inglés).
MÉTODOS
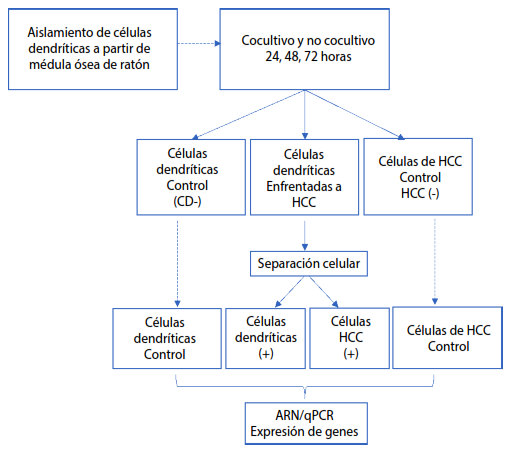
Se realizó un estudio experimental según las etapas que se muestran en la figura 1. Los ensayos in vitro se realizaron con CD extraídas de ratón y una línea tumoral murina de hepatocarcinoma. Los ensayos se realizaron tres veces y por triplicado. El experimento fue realizado en el laboratorio de investigación: Cultivo Celular, Inmunología y Biología Celular, de la Facultad de Medicina Humana de la Universidad de Piura, Lima-Perú, y en el Centro de Investigación Médica Aplicada de la Universidad de Navarra, España, entre enero y mayo del año 2022.
Línea celular murina de hepatocarcinoma
La línea murina tumoral de HCC: PM299L (MYCoe-LucOS CTNNB1deltaNT) fue generada simultáneamente mediante la sobreexpresión constitutiva del oncogén c-Myc y el noqueo del anti-oncogén Tp53, El procedimiento consistió en la inyección hidrodinámica de los plásmidos: pT3-EF1a-Myc o pT3-EF1a-Myc-IRES-lucOS, px330-sg-p53 y CMV-SB13 en el lóbulo derecho del modelo murino generando. A partir de dichos tumores, se aislaron las líneas y se mantuvieron en cultivo16.
Para los ensayos de este estudio, la línea tumoral murina descrita fue donada por Ruiz de Galarreta y colaboradores (Tisch Cancer Institute, Precision Immunology Institute, Icahn School of Medicine at Mount Sinai, New York, USA) 16 y fue cultivada en medio RPMI-1640 con 10% Suero Bovino Fetal (SBF), 100 U/mL penicilina/estreptomicina (P4333, Sigma, St. Louis, MO, USA), 0,1% de 2-mercaptoetanol (Gibco, UK) manteniéndose en crecimiento celular y realizando pases cada 3 días.
Aislamiento de células dendríticas
A partir de muestras de fémur y tibia de ratones macho BALB/c de 5 semanas se extrajeron las médulas óseas en condiciones de esterilidad. Se disgregaron en placas de cultivo celular con medio RPMI-1640 (Sigma, St. Louis, MO, USA). Se realizaron lavados mediante centrifugaciones (1800 rpm por 5 minutos a 4 °C) y se adicionó buffer de lisis para eritrocitos durante un 1 minuto con lavados consecutivos. Finalmente, se realizó un recuento celular y se sembraron en una densidad de 0,5 x 106 células/mL suplementado con 20 ng/mL de GM-CSF (SRP3201, Sigma, St. Louis, MO, USA) en placas de cultivo celular de 12 pocillos en 3 mL de medio RPMI-1640 con 10% Suero Bovino Fetal (SBF), 100 U/mL penicilina/estreptomicina (P4333, Sigma, St. Louis, MO, USA), 0,1% de 2-mercaptoetanol (Gibco, UK). A los 3 y 5 días fue realizado un cambio de medio de cultivo completo suplementado con 20 ng/mL GM-CSF. Al quinto día el volumen de renovación de medio fue de 2,5 mL. Al sexto día se utilizaron para realizar los cocultivos
Cocultivo de células dendríticas y línea tumoral de hepatocarcinoma
La línea tumoral fue cocultivada en una densidad de 0,5 x 106 células/pocillo en 500 µL sobre las CD previamente cultivadas en placa de 12 pocillos (relación de cocultivo CD a línea tumoral fue 1:1). Se incubaron durante 24, 48 y 72 horas a 37° C con 5% de CO2. A las 24 horas se recogieron las líneas celulares y se realizó una separación celular empleando kit de selección positiva CD11c+ MicroBeads (Life Technologies), siguiendo las especificaciones del fabricante. Mediante la separación celular MACS Dissociator (Miltenyi Biotec) se obtuvo una fracción positiva de células dendríticas y una fracción negativa con la línea tumoral. Se procedió de la misma manera para las incubaciones de 48 y 72 horas. Los cocultivos fueron realizados en pocillos por triplicado y cada ensayo se realizó tres veces.
Expresión de genes asociados a la maduración, activación y regulación de células dendríticas
Posterior a la separación celular se extrajo ARN empleando TRI Reagent (T9424, Invitrogen), se siguieron las especificaciones del protocolo hasta la cuantificación del ARN. Seguidamente, se realizó la reacción de retro-transcripción con DNAse, EDTA, DTT, RP, RNAsa Out, MMLV (Invitrogen). Finalmente, se realizó una qPCR (CFX96 Dx System-Bio-Rad) usando Syber-green dye (Applied Biosystems) para evaluar la expresión de los genes del perfil proinflamatorio: IL-12, IL-6, IL-1, TNFα; citoquina inmunosupresora: IL-10; receptores de maduración y migración celular: CCR7, CXCR4.
Análisis estadístico
La comparación de las concentraciones de ARNm de las citoquinas y receptores expresados por las CD expuestas a las líneas tumorales versus las no expuestas fue realizada con la prueba U de Mann-Whitney. Esta prueba de hipótesis fue aplicada para las 24, 48 y 72 horas. Seguimos el mismo procedimiento para comparar las HCC cocultivadas versus no cocultivadas. Para comparar las concentraciones de las citoquinas y receptores en cada punto de tiempo (tres grupos: 24, 48 y 72 horas) aplicamos la prueba Kruskall-Wallis, y realizamos la comparación entre pares de puntos con la prueba de comparaciones múltiples de Dunn. Se usó un nivel de significancia estadística del 5%. Los datos fueron analizados y los gráficos generados mediante el programa GraphPad Prism 9.5.0.
RESULTADOS
Perfil de expresión de citoquinas proinflamatorias
A las 24 y 48 horas las CD en presencia de un entorno tumoral de HCC expresaron una mayor concentración de ARNm de citoquinas proinflamatorias (IL-1β, IL-6, IL-12, TNF-α) comparadas con las del grupo control (Figura 2). Las diferencias se mantuvieron significativas a las 72 horas, pero con una menor magnitud. La concentración de estas citoquinas mostró un incremento entre las 24 y 48 horas, pero tuvieron una disminución marcada a las 72 horas; en el caso de la IL-6 los niveles llegaron a ser similares, y en la IL-12 y TNF-α los niveles fueron inferiores que el medido a las 24 horas (Material Suplementario S1).
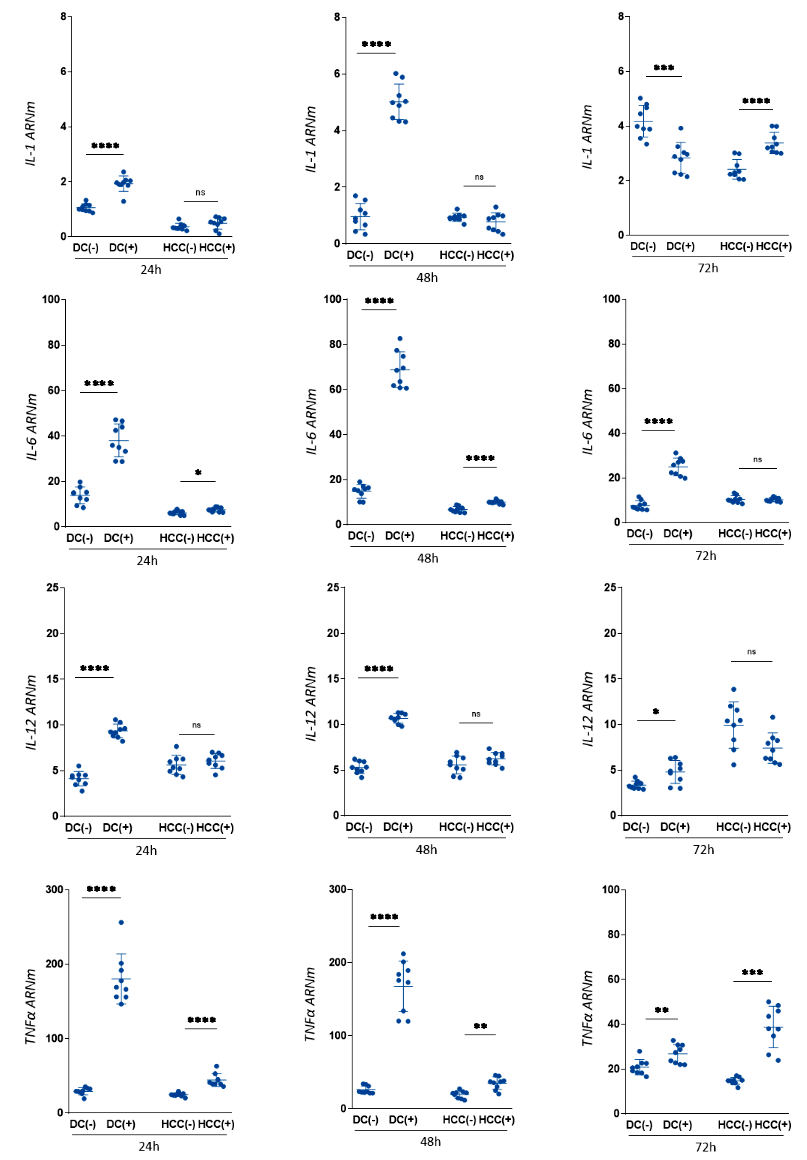
CD (-): Células dendríticas control, sin exposición a la línea tumoral; CD (+): Células dendríticas expuestas a la línea tumoral; HCC (-): Línea tumoral control no cocultivada; HCC (+): línea tumoral tras cocultivo con CD. Niveles de expresión de genes normalizados por valores Ct del gen de histona. Los gráficos muestran valores de expresión relativa calculados usando el método ΔΔCt.
ns: p ≥ 0,05; * 0,01 ≤ p < 0,05; ** p < 0,01; *** p < 0,001; **** p< 0,0001; prueba U de Mann-Whitney.
Figura 2. Expresión de IL-1, IL-6, IL-12, TNFα en células dendríticas (CD) enfrentadas a la línea tumoral de hepatocarcinoma (HCC) durante 24, 48 y 72 horas de exposición.
Expresión de IL-10
La expresión de IL-10, tanto en CD y HCC expuestas en cocultivo, fue mayor en comparación con sus grupos controles, estas diferencias fueron observadas a las 24, 48 y 72 horas (Figura 3). Además, observamos un incremento significativo en los niveles de expresión desde las 24 hasta las 72 horas, especialmente, en las CD cocultivadas (Material Suplementario S2).
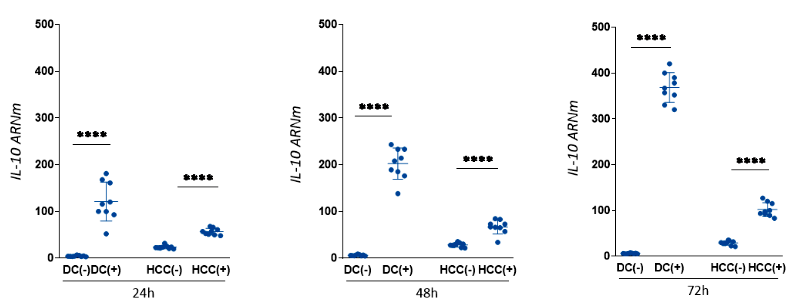
CD (-): Células dendríticas control, sin exposición a la línea tumoral; CD (+): Células dendríticas expuestas a la línea tumoral; HCC (-): Línea tumoral control no cocultivada; HCC (+): línea tumoral tras cocultivo con CD. Niveles de expresión de genes normalizados por valores Ct del gen de histona. Los gráficos muestran valores de expresión relativa calculados usando el método ΔΔCt.
ns: p ≥ 0,05; * 0,01 ≤ p < 0,05; ** p < 0,01; *** p < 0,001; **** p< 0,0001; prueba U de Mann-Whitney.
Figura 3. Expresión de IL-10 en células dendríticas (CD) enfrentadas a la línea tumoral de hepatocarcinoma (HCC) durante 24, 48 y 72 horas de exposición.
Expresión de receptores asociados a migración y maduración
Los niveles de expresión de los receptores CXCR4 y CCR7 de las CD expuestas a la línea tumoral fueron superiores comparados con aquellas no expuestas; sin embargo, la magnitud de dicha diferencia, aunque significativa, se fue reduciendo de las 24 a las 72 horas. Las HCC enfrentadas a las CD expresaron mayores niveles de CXCR4 y CCR7 comparadas con las HCC control, estas diferencias se incrementaron a mayor tiempo de cocultivo (Figura 4). Los niveles de CXCR4 y CCR7 en las CD expuestas disminuyeron en el transcurso del tiempo de cocultivo, mientras que en las HCC cocultivadas dichos niveles se incrementaron (Material Suplementario S3).
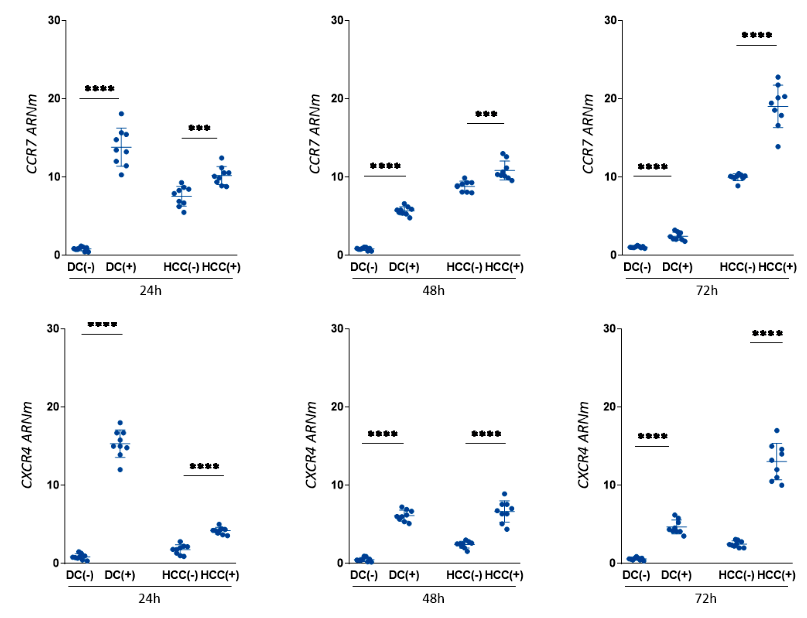
CD (-): Células dendríticas control, sin exposición a la línea tumoral; CD (+): Células dendríticas expuestas a la línea tumoral; HCC (-): Línea tumoral control no cocultivada; HCC (+): línea tumoral tras cocultivo con CD. Niveles de expresión de genes normalizados por valores Ct del gen de histona. Los gráficos muestran valores de expresión relativa calculados usando el método ΔΔCt.
ns: p ≥ 0,05; * 0,01 ≤ p < 0,05; ** p < 0,01; *** p < 0,001; **** p< 0,0001; prueba U de Mann-Whitney.
Figura 4. Expresión receptores CCR7 y CXCR4 en células dendríticas (CD) enfrentadas a la línea tumoral de hepatocarcinoma (HCC) durante 24, 48 y 72 horas de exposición.
DISCUSIÓN
Nuestros resultados revelan un perfil dinámico de expresión de citoquinas proinflamatorias, IL-10, y receptores asociados a migración y maduración en CD expuestas a un entorno tumoral de HCC durante diferentes periodos de tiempo. Estos hallazgos ofrecen una visión detallada de la interacción entre las CD y un entorno tumoral mostrando la complejidad de la respuesta inmunitaria en el contexto del HCC.
Los resultados mostraron un incremento significativo en la expresión del ARN mensajero (ARNm) de citoquinas proinflamatorias (IL-1β, IL-6, IL-12, TNF-α) asociadas a la actividad inmunogénica y respuesta antitumoral, en las CD expuestas al entorno tumoral en comparación al grupo control, especialmente a las 24 y 48 horas. Estos resultados son consistentes con estudios previos que han medido la participación de estas citoquinas en la promoción de la inflamación y la modulación de la respuesta inmunitaria en el contexto del cáncer. Estudios previos han demostrado que las CD pulsadas con antígenos asociados al tumor o lisados tumorales produjeron citoquinas con capacidad inflamatorias 17, y que las CD expuestas a modelos tumorales de melanoma y cáncer colorrectal produjeron niveles altos IL-12, IL-6, TNF-α 18. Así mismo, se sabe que la expresión de IL-6 y TNF-α pueden promover la progresión tumoral y la angiogénesis en el HCC 19.
Un hallazgo resaltante en nuestro estudio fue la notoria disminución de las mismas citoquinas a las 72 horas de exposición, con la posibilidad de una disminución de la respuesta funcional de las CD. Estudios en modelos murinos de HCC a los cuáles se les inoculó CD intratumoralmente, reportaron incremento en la inmunoestimulación mediante el aumento de las moléculas de activación y maduración como CD80 y CD86 20. Con ello, los resultados sugieren que el entorno tumoral conduce a la expresión de citoquinas proinflamatorias por parte de las CD contribuyendo a la actividad antitumoral, sin embargo, en nuestro estudio, a mayor tiempo de exposición, estos niveles disminuyen lo que indicaría que la actividad proinflamatoria se vería comprometida por una posible modulación de la actividad de las CD.
Respecto a la expresión de la IL-10 -citoquina relacionada con la actividad inmunosupresora-, nuestros resultados muestran un aumento significativo de su expresión a lo largo del tiempo de cocultivo (24, 48 y 72 horas), especialmente notable en las CD expuestas a la línea tumoral de HCC. Este resultado es relevante dado el conocido papel de IL-10 como un regulador clave de la respuesta inmunitaria, promoviendo la inmunosupresión en el microambiente tumoral. Nuestros resultados sugieren que las CD pueden contribuir a la generación de un microambiente inmunosupresor favoreciendo la progresión tumoral. Además, en la misma línea tumoral detectamos la expresión de la IL-10 especialmente a mayor tiempo de exposición, contribuyendo de esta manera a la inhibición de la respuesta antitumoral. Estos resultados guardan concordancia con el aumento de la expresión de citoquinas proinflamatorias durante las primeras horas, las cuales a mayor tiempo de exposición disminuyeron su expresión, en contraposición a la expresión de IL-10 durante las 24 a 72 horas. Estos resultados son coherentes con la literatura descrita sobre la disminución de la capacidad migratoria, presentación antigénica y activación de LT, en CD productoras de IL-10 en entornos tumorales10. La expresión de IL-10 por las CD, las induce -así mismas- a un perfil tolerogénico con capacidad de promover LT reguladores 13,15,21.
En cuanto a la expresión de receptores asociados a migración y maduración, nuestros hallazgos indican que las CD expuestas a la línea tumoral de HCC expresaron niveles aumentados de CXCR4 y CCR7 en comparación con las no expuestas, aunque la magnitud de esta diferencia disminuyó con el tiempo de cocultivo de 48 y 72 horas. Este hallazgos sugiere que el tiempo de comunicación intercelular puede modular la expresión de receptores en células dendríticas, lo que potencialmente afecta su migración y función en el contexto del cáncer. Este resultado es consistente con estudios previos donde han observado que la exposición prolongada de las CD al microambiente tumoral resultaba en un aumento gradual en la expresión de CXCR4 y CCR7 en comparación con una exposición a corto plazo 22,23.
Así mismo, encontramos una relación entre las CD células cocultivadas con niveles altos de receptores CXCR4 y CCR7 a las 24 horas de exposición, luego los receptores CXCR4 y CCR7 decrecieron en su expresión a mayor tiempo de cocultivo, lo cual conduciría a una respuesta inmunitaria suprimida y mayor susceptibilidad al crecimiento tumoral. Por otro lado, el incremento de expresión de CXCR4 y CCR7 en líneas celulares tumorales está asociada con la capacidad metastásica, y la progresión tumoral en varios tipos de cáncer, incluido el hepatocarcinoma 24,25. Estos receptores pueden promover la migración de las células tumorales hacia tejidos distantes que expresan sus ligandos, lo que facilita la diseminación del cáncer 26. Estudios en cáncer gástrico 27, de esófago 28, de mama, colorrectal y de próstata han evidenciado que la expresión aumentada de CXCR4 en las células tumorales se correlacionaba con una mayor invasión, metástasis y peor pronóstico en estos cánceres 29.
Nuestros resultados son consistentes con los estudios previos, sin embargo, no se había reportado un incremento de la expresión de ambos receptores durante un periodo de observación mayor de 72 horas en modelos tumorales de hepatocarcinoma. Estos datos nos sugieren que la expresión de ambos receptores CXCR4 y CCR7 en modelos de HCC desempeñan un papel importante en la progresión y metástasis del cáncer de hígado, de modo que pueden ser de utilidad como marcadores de mal pronóstico de HCC.
A pesar de los reportes existentes; replicar y validar estos hallazgos en diferentes condiciones experimentales y periodos de tiempo contribuye a fortalecer la evidencia y la comprensión de los mecanismos inmunológicos involucrados en la modulación de la actividad en CD y progresión tumoral del HCC. De tal manera, aunque los reportes previos hayan analizado la expresión de citoquinas proinflamatorias, IL-10 y receptores CXCR4 y CCR7, en células dendríticas expuestas a modelos tumorales, nuestro estudio ha considerado 3 tiempos de cocultivo de manera progresiva, no considerados previamente, lo que ha permitido una mayor comprensión sobre la caracterización temporal de la respuesta inmunitaria. Así mismo, el estudio ha empleado una línea tumoral de HCC que porta las más frecuentes mutaciones en la patogénesis del HCC, este diseño experimental no ha sido empleado previamente en estudios sobre la modulación de CD.
Entre las limitaciones del estudio, en vista de tratarse de un estudio in vitro debemos considerar en la interpretación de resultados que el HCC es un tumor que se desarrolla a través de un lento proceso basado en fenómenos de inflamación crónica, por ende, el estudio sobre una línea tumoral de HCC -con procesos más rápidos-, no reflejan los eventos que ocurren en la patogenia del hepatocarcinoma. Sin embargo, hemos tratado de simular algunas de las particularidades inmunológicas del HCC, mediante la utilización de una línea que genera tumores con propiedades equivalentes a las observadas en seres humano. En concreto, la línea PM299L (MYCoe-LucOS CTNNB1deltaNT) deriva de un HCC primario generado tras la administración hidrodinámica de plásmidos que codifican el oncogén Myc y una versión modificada activada de betacatenina, rasgos frecuentes en HCC. Este modelo celular ha sido empleado en diversos estudios in vitro de HCC 16. Por estos motivos, creemos que el modelo empleado ha permitido analizar los mecanismos de respuesta inmunológica de las CD.
Concluimos que la actividad de las CD se encuentra influenciada por el entorno tumoral de HCC y el tiempo de interacción. Esta exposición se expresa en la modulación de su función proinflamatoria, de presentación antigénica, maduración y activación. Los resultados obtenidos sugieren potenciales dianas terapéuticas, al observar un aumento significativo en la expresión de receptores y citoquinas supresoras. Basado en estos hallazgos es plausible plantear el desarrollo de terapias dirigidas a modular estas respuestas inmunitarias y mejorar la eficacia del tratamiento contra el cáncer de hígado.