INTRODUCCIÓN
El cáncer de colon es producido por una alteración patológica del epitelio del colon, esto debido a cambios genéticos y epigenéticos 1. Según la GLOBOCAN 2020 a nivel mundial, indica que el cáncer colorrectal ocupa el tercer lugar en términos de incidencia y el segundo en términos de mortalidad 2. En América del Sur en el 2020, se estimaron las tasas estandarizadas por edad de incidencia de cáncer de colon de 12,8 en varones y de 10,8 en mujeres, por 100 000 habitantes 2. En el Perú, entre el 2003 y 2016 se estimó que 14 977 personas fallecieron por cáncer colorrectal (7,1% de los fallecidos por cáncer) 3.
La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud) elaboró la guía de práctica clínica (GPC) basada en evidencias para el manejo del cáncer de colon, cuyas recomendaciones y puntos de buena práctica clínica se apliquen por profesionales de la salud en EsSalud. El presente artículo es un resumen de dicha GPC.
METODOLOGÍA
El proceso para la elaboración de la presente GPC está detallado en su versión “in-extenso”, que se encuentra disponible la página web del IETSI de EsSalud (https://ietsi.essalud.gob.pe/guias-de-practica-clinica-2).
En resumen, se siguieron las siguientes acciones para la elaboración de la GPC:
Conformación del grupo elaborador de la guía (GEG)
Se conformó un GEG, que incluyó metodólogos y médicos especialistas en oncología.
Formulación de preguntas
En concordancia con los objetivos y alcances de esta GPC, el GEG formuló 9 preguntas clínicas (Tabla 1), cada una de las cuales pudo tener una o más preguntas PICO (Population, Intervention, Comparator, Outcome). A su vez, cada pregunta PICO albergó uno o más desenlaces de interés.
Búsqueda de GPC
Se realizó una búsqueda sistemática de GPC en diferentes repositorios y base de datos. Se encontraron 6 GPC sobre el tema de interés con una adecuada calidad metodológica; sin embargo, no fueron consideradas para su adopción debido a que los temas abordados no se involucraron en el ámbito de la GPC 4,5, y a que fueron realizadas en contextos diferentes al nuestro 3,6,7,8; por ello, se decidió elaborar una GPC de novo.
Búsqueda y selección de la evidencia
Para cada pregunta PICO, se realizó la búsqueda y selección de la evidencia. Para ello, durante febrero y mayo del 2023 se buscaron revisiones sistemáticas (RS) realizadas como parte de una GPC previa (mediante la búsqueda sistemática de GPC realizada en el punto anterior) o publicadas como artículos científicos (mediante búsquedas sistemáticas en PubMed) (Material Suplementario 1). Cuando se encontraron RS de calidad aceptable, se escogió una RS para la toma de decisiones, la cual fue actualizada cuando el GEG lo consideró necesario. Cuando no se encontró ninguna RS de calidad aceptable, se realizó una búsqueda de novo de estudios primarios (ensayos clínicos aleatorizados [ECA] o estudios observacionales [EO]).
Evaluación de la certeza de la evidencia:
La certeza de la evidencia para cada desenlace de cada pregunta PICO pudo ser alta, moderada, baja, o muy baja (Tabla 2). Para evaluar la certeza de la evidencia, se siguió la metodología de Grading of Recommendations Assessment, Development and Evaluation (GRADE) y se usaron tablas de resumen de evidencias de GRADE 9 (Material Suplementario 2). Finalmente, se determinó el nivel de certeza de la recomendación (el nivel más bajo los desenlaces críticos).
Formulación de las recomendaciones
El GEG revisó la evidencia seleccionada para cada pregunta clínica en reuniones periódicas, y formuló recomendaciones fuertes o condicionales (Tabla 2) usando la metodología GRADE. Para ello, se tuvo en consideración: 1) Beneficios y daños de las opciones, 2) Certeza de la evidencia, 3) Valores y preferencias de los pacientes, 4) Uso de recursos, 4) Impacto en la equidad, 5) Aceptabilidad por parte de los profesionales de salud y pacientes; y 6) Factibilidad de las opciones en los establecimientos de salud de EsSalud. Luego de discutir estos criterios para cada pregunta, el GEG formuló las recomendaciones por consenso o por mayoría simple. Asimismo, para la formulación de puntos de buenas prácticas clínicas (BPC), el GEG se basó en las GPC de la National Clinical Effectiveness Committee (NCEC) 2020 10, European Society for Medical Oncology (ESMO) 2020 11, American Society of Colon and Rectal Surgeons (ASCRS) 2022 12, la GPC de Irlanda 10, Japón 13, y la National Comprehensive Cancer Network (NCCN) 2023 14.
Revisión por expertos externos
La presente GPC fue revisada en reuniones con médicos especialistas representantes de otras instituciones y tomadores de decisiones. Asimismo, su versión in-extenso fue enviada por vía electrónica a expertos externos para su revisión (mencionados en la sección de agradecimientos). El GEG tuvo en cuenta los resultados de estas revisiones para modificar las recomendaciones finales.
Aprobación de la GPC
La presente GPC fue aprobada para su uso en EsSalud, con Resolución N° 140-IETSI-ESSALUD-2023.
Actualización de la GPC:
La presente GPC tiene una vigencia de cinco años. Al acercarse al fin de este período, se procederá a realizar una RS de la literatura para su actualización, luego de la cual se decidirá si se actualiza la presente GPC o se procede a realizar una nueva versión.
Recomendaciones
La presente GPC abordó 9 preguntas clínicas, en base a las cuales se formularon 7 recomendaciones (7 recomendaciones condicionales), 11 BPC, y 1 flujograma (Tabla 1 y Figura 1).
A continuación, se expondrán las recomendaciones para cada pregunta clínica, así como un resumen del razonamiento seguido para llegar a cada recomendación. No se incluyó las justificaciones de los puntos de BPC, las cuales se puede leer en el documento in-extenso.
Para cada pregunta, los detalles sobre la búsqueda sistemática se exponen en el Material Suplementario 1. El balance de beneficios daños en forma de tablas Summary of Findings (SoF), así como la justificación en extenso de cada decisión en forma de tablas Evidence to Decision (EtD), se exponen en el Material Suplementario 2.
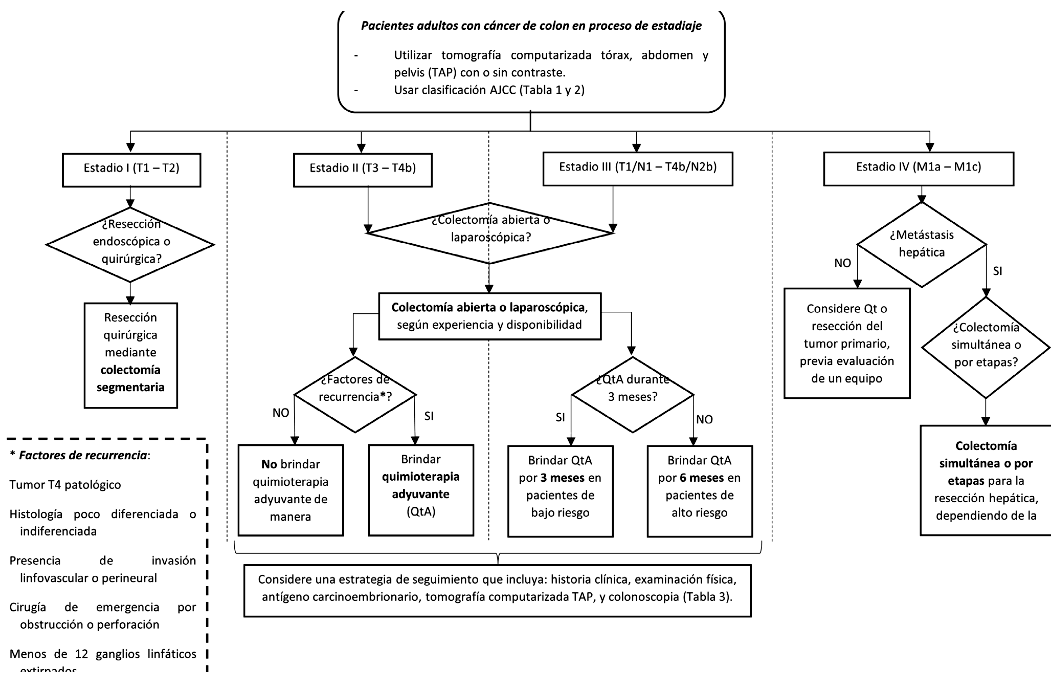
1. En pacientes adultos con cáncer de colon en proceso de estadiaje, ¿se debería realizar tomografía computarizada (TC) (tórax, abdomen y pelvis) o tomografía por emisión de positrones (PET/TC)?
Evidencia: Encontramos una RS publicada como artículo científico Brush 2011 15. Sin embargo, la RS no encontró evidencia para la comparación plateada en la PICO, por lo cual se procedió a realizar una búsqueda de novo de ECA desde la última fecha de búsqueda de dicha RS, sin encontrar nuevos estudios. Finalmente, se planteó la búsqueda de estudios observacionales, de los cuales se encontró un estudio: Engelmann 2014 16. No obstante, el estudio encontrado evaluó la exactitud diagnóstica de cada prueba (TC o PET/TC) de forma individual. Por ese motivo, se decidió emitir una BPC en base a la evidencia disponible.
Justificación de las BPC relevantes: Otras GPC emiten enunciados a favor de considerar el uso de la TC para el estadiaje inicial (NCEC 2020 10, ESMO 2020 11); por otro lado, la GPC de ASCRS 2022 12 no recomienda el uso rutinario de la tomografía por emisión de positrones (PET/TC) para el estadiaje del cáncer de colon. Respecto al uso de la TC en lugar de la PET/TC, los costos serían menores y el impacto en la equidad se incrementarían. Además, la TC para el estadiaje inicial se consideró potencialmente aceptable por los profesionales de salud y es factible de implementar. Adicionalmente, el GEG consideró importante indicar la clasificación del estadiaje, según el Comité Conjunto Estadounidense sobre el Cáncer (AJCC, por sus siglas en inglés), el cual se detalla en la GPC de ASCRS 2022 12.
2. En pacientes adultos con cáncer de colon en EC I, ¿se debería realizar resección endoscópica (RE) o resección quirúrgica (RQ)?
Evidencia: Encontramos tres RS 17-19, se decidió actualizar la de RS de Silva 2016 18, sin embargo, no se encontraron nuevos estudios. Se eligieron las RS de Yeh 2020 17, Silva 2016 18 y Li 2021 19 por tener una calidad metodológica aceptable.
Beneficios: Si a 1000 personas se le realiza la RE en lugar de RQ, posiblemente disminuyamos las complicaciones 18, aunque la evidencia es incierta. En contraste, no modificaremos la sobrevida libre de recurrencia 17, aunque la evidencia es incierta.
Daños: Si a 1000 personas se le realiza la RE en lugar de RQ, posiblemente 127 menos personas sobrevivan (IC 95%: -164 a -82) 17, disminuyamos la sobrevida libre de enfermedad (SLE) 19, disminuyamos 120 casos de resección en bloque (IC95%: -200 a -40) 18 y disminuyamos 120 casos de resección curativa (IC95%: -200 a -40) 18, aunque la evidencia es incierta.
Recomendación: En adultos con cáncer de colon en EC I, los beneficios de realizar RE en lugar de RQ se consideraron pequeños puesto que se encontró un efecto beneficioso sobre la reducción de complicaciones. En relación con los daños, estos se consideraron moderados puesto que hubo una disminución de la sobrevida global (SG), SLE, tasa de resección en bloque y tasa de resección curativa. Por ello, se emitió una recomendación en contra del uso de la RE. Debido a que la certeza general de la evidencia fue muy baja, esta recomendación fue condicional.
3. En pacientes adultos con cáncer de colon EC I-III, ¿se debería realizar la colectomía segmentaria mediante cirugía mínimamente invasiva o cirugía abierta (CA)?
Evidencia: Encontramos diez RS 20-29, se decidió utilizar la RS de Ohtani 2012 26 por tener la mayor cantidad de estudios incluidos; no obstante, dado su antigüedad se realizó la actualización de la búsqueda encontrándose nueve ECA 30-38.
Beneficios: Si a 1000 personas les realizamos CL en lugar de CA, podría ser que evitemos 68 casos de complicaciones posoperatorias (IC 95%: -96 a -31) (26, 30-35); además, podría ser que disminuyamos 101,12 mL la pérdida de sangre (IC 95%: -159,06 a -43,18) 26,31,34,36,38, y disminuyamos 2,37 días la estancia hospitalaria (IC 95%: -4,00 a -0,73) 26,31,33,34,36,38, aunque la evidencia es incierta.
Daños: Si a 1000 personas les realizamos CL en lugar de CA, probablemente no haya diferencia estadísticamente significativa sobre la mortalidad (26, 30-32), y el número total de ganglios linfáticos extraídos 26,30,31,35-37. Además, podría ser que no haya diferencia estadísticamente significativa sobre la SLE 21, y podría ser que, no haya diferencia estadísticamente significativa sobre la SG 21 e incrementemos el tiempo operatorio 43,64 (IC 95%: +31,68 a +55,60) 26,31,33,34,38, aunque la evidencia es incierta.
Recomendación: En pacientes adultos con cáncer de colon EC I-III los beneficios del realizar CL en lugar de CA se consideraron moderados, y los daños se consideraron pequeños. Si bien el balance de los efectos favorece probablemente a la intervención, el brindarlo representa un incremento moderado de los costos y dependerá de la disponibilidad de recursos en cada establecimiento de salud y la experiencia de los especialistas. Por ello, se emitió una recomendación a favor de la intervención o del control. La certeza de la evidencia fue muy baja. Por ello, esta recomendación fue condicional.
4. En pacientes adultos con cáncer de colon EC II resecado y sin o con factores de riesgo de recurrencia, ¿se debería brindar quimioterapia adyuvante (QtA)?
Subpoblación - pacientes adultos con cáncer de colon EC II resecado, sin factores de recurrencia
Evidencia: Encontramos una GPC que realizó una RS ASCO 2022 5, se seleccionó este estudio por ser reciente y reportar los desenlaces priorizados.
Beneficios: Si brindamos QtA en lugar de no brindarla, podría ser que no modifiquemos la SG, ni modifiquemos la SLE, aunque la evidencia es incierta.
Daños: Si a 1000 personas les brindamos QtA en lugar de no brindarla, podría ser que aumentemos el riesgo de recaída aunque la evidencia es incierta (aHR: 3,01, IC 95%: 1,10 a 8,23). Por otro lado, en los estudios evaluados no se encontró evidencia para los desenlaces de mortalidad, eventos adversos (EA), ni calidad de vida.
Recomendación: En pacientes adultos con cáncer de colon EC II resecado y sin factores de riesgo de recurrencia los beneficios de brindar QtA en lugar de no brindarla se consideraron desconocidos puesto que, los efectos deseables sobre la SG y la SLE no fueron observables, y la evidencia en la que se basan estos efectos fue incierta; y los daños se consideraron pequeños puesto que, el efecto de la supervivencia específica de la enfermedad fue observable después del ajuste por confusores, no obstante, la evidencia fue incierta. Por ello, se emitió una recomendación en contra de la intervención. La certeza de la evidencia fue muy baja. Por ello, esta recomendación fue condicional.
Subpoblación - pacientes adultos con cáncer de colon EC II resecado, con factores de recurrencia
Evidencia: Encontramos una GPC que realizó una revisión sistemática ASCO 2022 5 y dos RS publicadas como artículo científico (39,40, se seleccionó la RS de Similis 2020 39 por ser la de mayor calidad y más reciente.
Beneficios: Si a 1000 personas les brindamos QtA en lugar de no brindarla, podría ser que, disminuyamos el riesgo de muerte (HR: 0,61, IC 95%: 0,54 a 0,69) y de recaída (HR: 0,51, IC 95%: 0,38 a 0,69), aunque la evidencia es incierta; y podría ser que no modifiquemos la supervivencia específica de la enfermedad, aunque la evidencia es incierta.
Daños: Aunque, no se encontró evidencia sobre la mortalidad, EA, y calidad de vida; es bastante conocido los efectos secundarios de los productos farmacéuticos oncologicos, siendo los más frecuentes infección, anemia, neutropenia, disnea, diarrea, fatiga, aumento de enzimas hepáticas, entre otras 41.
Recomendación: En pacientes adultos con cáncer de colon EC II resecado y con al menos un factor de riesgo de recurrencia los beneficios de brindar QtA en lugar de no brindarla se consideraron moderados, y los daños se consideraron pequeños. Por ello, se emitió una recomendación a favor de la intervención. La certeza de la evidencia fue muy baja. Por ello, esta recomendación fue condicional.
5. En pacientes adultos con cáncer de colon resecado en EC III, ¿se debería brindar QtA durante 3 meses o 6 meses?
En los últimos años, la duración óptima de la QtA en pacientes con cáncer de colon resecado en EC III ha sido objeto de debate 8. La terapia estándar tradicionalmente utilizada ha sido de 6 meses de QtA con FOLFOX o CAPOX 42; sin embargo, estudios recientes han sugerido que una duración de 3 meses de QtA podría ser una opción viable y efectiva en pacientes seleccionados 43.
Evidencia: Encontramos dos GPC que realizaron una RS: NICE 2020 4 y MINSAL Chile 2019 44, una RS publicada como artículo científico 45, y un análisis combinado de André 2020 42. Finalmente, se decidió tomar la evidencia de este último análisis combinado.
Beneficios: Si brindamos QtA por 3 meses en lugar de 6 meses, podría ser que no modifiquemos la SG, y podría ser que causemos 19 casos de SLE (IC 95%: +5 a +35), aunque la evidencia es incierta.
Daños: Si a 1000 personas brindamos QtA por 3 meses en lugar de 6 meses, podría ser que evitemos 285 EA serios (IC 95%: -298 a -271).
Recomendación: En adultos con cáncer de colon resecado en EC III, los beneficios de brindar QtA por 3 meses en lugar de 6 meses se consideraron moderados y los daños se consideraron pequeños. Además, al considerar el análisis post-hoc en el grupo de bajo riesgo, se evidenció que la SG a 5 años y la SLE a 3 y 5 años son comparables entre la terapia de 3 meses y la de 6 meses. Destaca la considerable disminución en EA graves con la terapia de 3 meses, lo que sugiere la posibilidad de proporcionar un QtA más breve y menos tóxico sin comprometer la eficacia en pacientes de bajo riesgo. Por ello, se emitió una recomendación a favor de brindar QtA por 3 meses en pacientes de bajo riesgo. La certeza global de la evidencia fue muy baja. por ello, esta recomendación fue condicional.
6. En pacientes adultos con metástasis irresecables de cáncer de colon, ¿se debería brindar como esquema inicial quimioterapia sola (Qt) o resección quirúrgica (RQ) del tumor primario?
Evidencia: Encontramos la RS de Liang 2023 46, a pesar de, que la RS presentó evidencia para la comparación planteada en la PICO, se encontraron limitaciones importantes en las características basales de los grupos de estudio como el sesgo de selección debido a que, los pacientes que se sometieron a una RQ del tumor tenían más probabilidades de tener una enfermedad metastásica limitada o metástasis únicas. Sin embargo, los pacientes con metástasis múltiples con extensión ganglionar tenían más probabilidades que reciban Qt, esto producía que los grupos no sean comparables según sus características clínicas basales. Esta asignación de tratamiento a los grupos de estudio según los autores era algo esperable ya que el tratamiento depende de las características del paciente. Por lo tanto, considerando que la decisión sobre realizar un procedimiento sobre otro depende de varios factores relacionados al paciente (estado funcional, metástasis, extensión de enfermedad ganglionar, etc.), se decidió emitir una BPC en base a la evidencia disponible.
Justificación de las BPC relevantes: Algunas GPC como las de Irlanda 10 y Japón 13 abordaron esta pregunta y no emitieron recomendación a favor de alguna intervención, sino que refirieron que la decisión sobre la elección del tratamiento depende del estado de salud general de paciente y según las características del tumor (metástasis y extensión ganglionar). Además, refirieron que la decisión de realizar alguno de estos tratamientos depende de la evaluación de un equipo multidisciplinario. Por lo tanto, considerando lo referido por estas GPC y según lo evidenciado en la RS de Liang 46 se emitió esta BPC. Además, se decidió adoptar lo referido por la GPC de Irlanda 10 en la que menciona que la decisión del tratamiento se debería realizar por un equipo multidisciplinario que cuente con experiencia quirúrgica adecuada antes de someterse a cualquier tratamiento.
7. En pacientes adultos con cáncer de colon y obstrucción colónica izquierda aguda, ¿se debería colocar stent colónico o brindar cirugía de emergencia?
El uso de stent colónico ha demostrado mejoras significativas en el manejo del cáncer colorrectal obstructivo del lado izquierdo, tanto en el tratamiento paliativo como en el “puente a la cirugía” 47. Sin embargo, su uso ha sido objeto de debate debido a los posibles riesgos y aunque ofrece ventajas a corto plazo, existen preocupaciones sobre su impacto en la recurrencia local y la SG a largo plazo 48.
Evidencia: Encontramos una GPC que realizó una RS de NICE 2020 8 y tres RS publicadas 49-51. Además, la RS de NICE 2020 tuvo acceso a los resultados preliminares del ECA CReST 2022 52. Aunque este estudio no fue incluido en los metaanálisis, sus resultados fueron consistentes con la evidencia sintetizada. Se decidió tomar como evidencia la RS de NICE 2020 por tener buena calidad metodológica y ser la más reciente.
Beneficios: Si a 1000 personas se les brinda colocación de stent colónico en lugar de cirugía de emergencia, probablemente no modifiquemos la SG pero si, evitemos 201 casos de ostomía (IC 95%: -100 a -275), podría ser que no modifiquemos la SLE; además, podría ser que no modifiquemos la mortalidad, y la incidencia de fuga anastomótica, pero podría ser que evitemos 107 casos de infección del sitio quirúrgico, aunque la evidencia es incierta.
Daños: El 30,5% (54/133) de los participantes del grupo asignado a colocación de stent colónico presento perforación intestinal no logró el éxito en la descomprensión intestinal. El 9,8% (13/133) de los participantes del grupo asignado a colocación de stent colónico presentó perforación intestinal. Asimismo, el GEG tomó en cuenta los resultados del ECA CReST 2022 (66) donde el grupo asignado a la colocación de stent presentó un mayor éxito en la descompresión intestinal (86/106, 81,1%) y una menor incidencia de perforación intestinal relacionada con la colocación del stent (4/119, 3,3%).
Recomendación: Los beneficios de brindar la colocación de stent colónico en lugar de cirugía de emergencia se consideraron pequeños, y los daños se consideraron pequeños. Por ello, se emitió una recomendación a favor de la intervención y del control. La certeza de la evidencia fue muy baja, por ello, esta recomendación fue condicional.
8. En pacientes adultos con metástasis hepáticas resecables de cáncer de colon, ¿se debería realizar colectomía simultánea (CS) o colectomía por etapas (CPE) con resección hepática y/o pulmonar?
Los pacientes con cáncer de colon resecable presentan cerca del 20 al 50% de metástasis hepáticas secundarias de manera sincrónica 53, para ello, existen dos tipos de abordajes quirúrgicos denominados CS o CPE 54.
Evidencia: Encontramos tres RS 54-56 potenciales. Se decidió utilizar la RS de Hajibandeh 2020 54, por ser la más reciente y tener una adecuada calidad metodológica.
Beneficios: Si a 1000 personas se les realiza la CS en lugar de CPE, podría ser que, disminuyamos el tiempo operatorio 23,64 minutos (IC 95%: -79,96 a -32,68), evitemos 14 casos de sangrado (IC 95%: -23 a -2), y disminuyamos la estancia hospitalaria 5,4 días (IC 95%: -6,62 a -4,17) aunque la evidencia es incierta. Además, podría ser que no modifiquemos la mortalidad perioperatoria y la SG, aunque la evidencia es incierta.
Daños: Si a 1000 personas se les realiza la CS en lugar de CPE, podría ser que, no modifiquemos la morbilidad perioperatoria, la fuga anastomótica, la infección en la herida, la reoperación, y la recurrencia de la enfermedad; aunque la evidencia es incierta.
Recomendación: En pacientes adultos con metástasis hepáticas resecables de cáncer de colon, los beneficios del realizar CS en lugar de CPE se consideraron pequeños, y los daños se consideraron triviales. Si bien el balance de los efectos favorece probablemente a la intervención, el brindarlo representa un incremento de la inequidad, brindarla dependerá del estado clínico del paciente, de la disponibilidad de recursos en cada establecimiento de salud y de la experiencia del equipo quirúrgico. Por ello, se emitió una recomendación a favor de la intervención o del control. La certeza de la evidencia fue muy baja. Por ello, esta recomendación fue condicional.
9. En pacientes adultos con cáncer de colon operado no metastásico, y con QtA ¿cuál sería la prueba de seguimiento colonoscopia o TC contrastada?
Evidencia: Producto de la búsqueda sistemática no se encontró ninguna RS que evaluara la pregunta clínica planteada. Adicionalmente, se observó entre los estudios excluidos que, los estudios actuales evalúan diferentes estrategias de TC y colonoscopia, que podrían no estar disponibles en nuestra institución o que serían de difícil acceso; por ese motivo, el GEG consideró no necesario la búsqueda de ECA, ya que probablemente los estudios actuales sigan esa línea de investigación, y ya no consideren evaluar estrategias convencionales como la planteada en la pregunta clínica. Por ese motivo, se decidió emitir una BPC en base a la evidencia de las guías de práctica clínica de referencia.
Justificación de las BPC relevantes: Otras GPC emiten enunciados a favor de considerar el uso de la TC con contraste endovenoso (de tórax, abdomen, y pelvis) y de la colonoscopía para el seguimiento de los pacientes con cáncer de colon no metastásico y con QtA (ESMO 2020 11 y NCCN 2023 14). Adicionalmente, estas GPC consideran la evaluación de la historia médica, examinación física, y antígeno carcinoembrionario, por lo que, fue incluido también como parte de la estrategia de seguimiento. Además, el GEG consideró indicar la frecuencia del uso de las estrategias de seguimiento según el año en el cursa la enfermedad después de haber iniciado la QtA, esto con el objetivo de optimizar el uso de los recursos, tomando en cuenta que, habrán ocasiones en los que se necesite de una combinación entre las estrategias planteadas. Respecto al uso de la TC o de la colonoscopia, el GEG estableció que no hay impacto sobre la equidad. También, la TC o la colonoscopia como estrategias de seguimiento son aceptables por los profesionales de salud y son factibles de implementar.