INTRODUCCIÓN
El cáncer de mama es uno de los tipos de cáncer más frecuentemente diagnosticados y es la quinta causa de muerte por cáncer a nivel global. Según GLOBOCAN, en 2020 se estimaron 2,3 millones de nuevos casos en todo el mundo 1. Además, la Organización Mundial de la Salud calculó que en 2016 esta enfermedad provocó 19,6 millones de años de vida ajustados por discapacidad (AVAD) 2.
En Perú, el cáncer de mama es la segunda neoplasia más común. En 2020, se reportaron 6860 nuevos casos de cáncer de mama en el país, representando el 9,8% del total de diagnósticos de cáncer ese año 3. En el Seguro Social de Salud (EsSalud), entre 2008 y agosto de 2021, se diagnosticaron 59 361 nuevos casos de cáncer de mama. En 2019, la mayor incidencia se observó en la población de 70 a 79 años 3.
El tamizaje y la detección temprana del cáncer de mama son estrategias potencialmente efectivas para reducir la mortalidad asociada con esta enfermedad 4. Por esta razón, EsSalud desarrolló esta guía de práctica clínica (GPC) con el fin de establecer directrices basadas en evidencia para gestionar de manera óptima los procesos y procedimientos de tamizaje para el cáncer de mama.
La GPC fue elaborada por la Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) de EsSalud.
METODOLOGÍA
El proceso para desarrollar esta GPC se describe en detalle en su versión “in extenso”, disponible en el sitio web del IETSI de EsSalud (https://ietsi.essalud.gob.pe/gpc-guias-de-practica-clinica/).
En resumen, se siguió la siguiente metodología:
Conformación del grupo elaborador de la guía (GEG)
Se conformó un GEG compuesto por metodólogos y especialistas en ginecología oncológica, radiología, ginecología obstétrica y medicina familiar.
Formulación de preguntas
De acuerdo con los objetivos y alcances de la GPC, el GEG formuló 5 preguntas clínicas (Tabla 1), cada una de las cuales pudo tener una o más preguntas PICO (Population, Intervention, Comparator, Outcome). A su vez, cada pregunta PICO pudo tener uno o más desenlaces (o outcomes) de interés.
Búsqueda y selección de la evidencia
Para cada pregunta PICO, entre marzo y agosto del 2022, se buscaron revisiones sistemáticas (RS) publicadas como artículos científicos (mediante búsquedas sistemáticas en PubMed y CENTRAL) o realizadas como parte de una GPC previa (mediante una búsqueda sistemática de GPC), según se describe en el Material Suplementario 1. Cuando se encontraron RS de calidad aceptable según el instrumento A Measurement Tool to Assess Systematic Reviews-II (AMSTAR II) modificado por EsSalud 5, se escogió una para cada desenlace de interés, la cual fue actualizada cuando el GEG lo consideró necesario. Si no se encontraba una RS de calidad aceptable, se realizó una búsqueda de novo de estudios primarios.
Evaluación de la certeza de la evidencia y cálculo de efectos absolutos
Para cada desenlace de cada pregunta PICO, se evaluó la certeza de la evidencia siguiendo la metodología de Grading of Recommendations Assessment, Development, and Evaluation (GRADE) 6.
También se calcularon los efectos absolutos para cada desenlace (diferencias de riesgos para desenlaces dicotómicos y diferencias de medias para desenlaces numéricos), considerando la incidencia reportada en el grupo control, salvo indicación contraria para alguna pregunta. (Material Suplementario 2).
Formulación de las recomendaciones
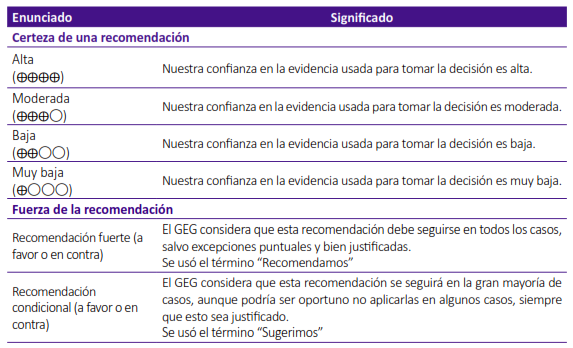
El GEG revisó la evidencia seleccionada para cada pregunta clínica en reuniones periódicas, usando los marcos Evidence to Decision (EtD) de la metodología GRADE 7,8. Para ello, tuvo en consideración: 1) Beneficios y daños de las opciones, 2) Valores y preferencias de los pacientes, 3) Aceptabilidad por parte de los profesionales de salud y pacientes, 4) Equidad, 5) Factibilidad de las opciones en EsSalud, y 6) Uso de recursos. Tras discutir estos criterios, el GEG, mediante consenso o mayoría simple, formuló las recomendaciones, asignando una fuerza (fuerte o condicional) y una certeza de evidencia (alta, moderada, baja o muy baja) (Tabla 2).
Revisión por expertos externos
La GPC fue revisada en reuniones con especialistas de otras instituciones, tomadores de decisiones de EsSalud y pacientes. Asimismo, su versión extensa fue enviada por vía electrónica a expertos externos para su revisión (mencionados en la sección de agradecimientos). Cuando fue pertinente, el GEG tuvo en cuenta los resultados de estas revisiones para modificar las recomendaciones finales.
Aprobación de la GPC
La GPC fue aprobada para su uso en EsSalud mediante la Resolución N° 98-IETSI-ESSALUD-2022.
Actualización de la GPC
Esta GPC tendrá una vigencia de tres años. Al final de este período, se realizará una RS de la literatura para determinar si se necesita actualizar la GPC o elaborar una nueva versión.
Recomendaciones
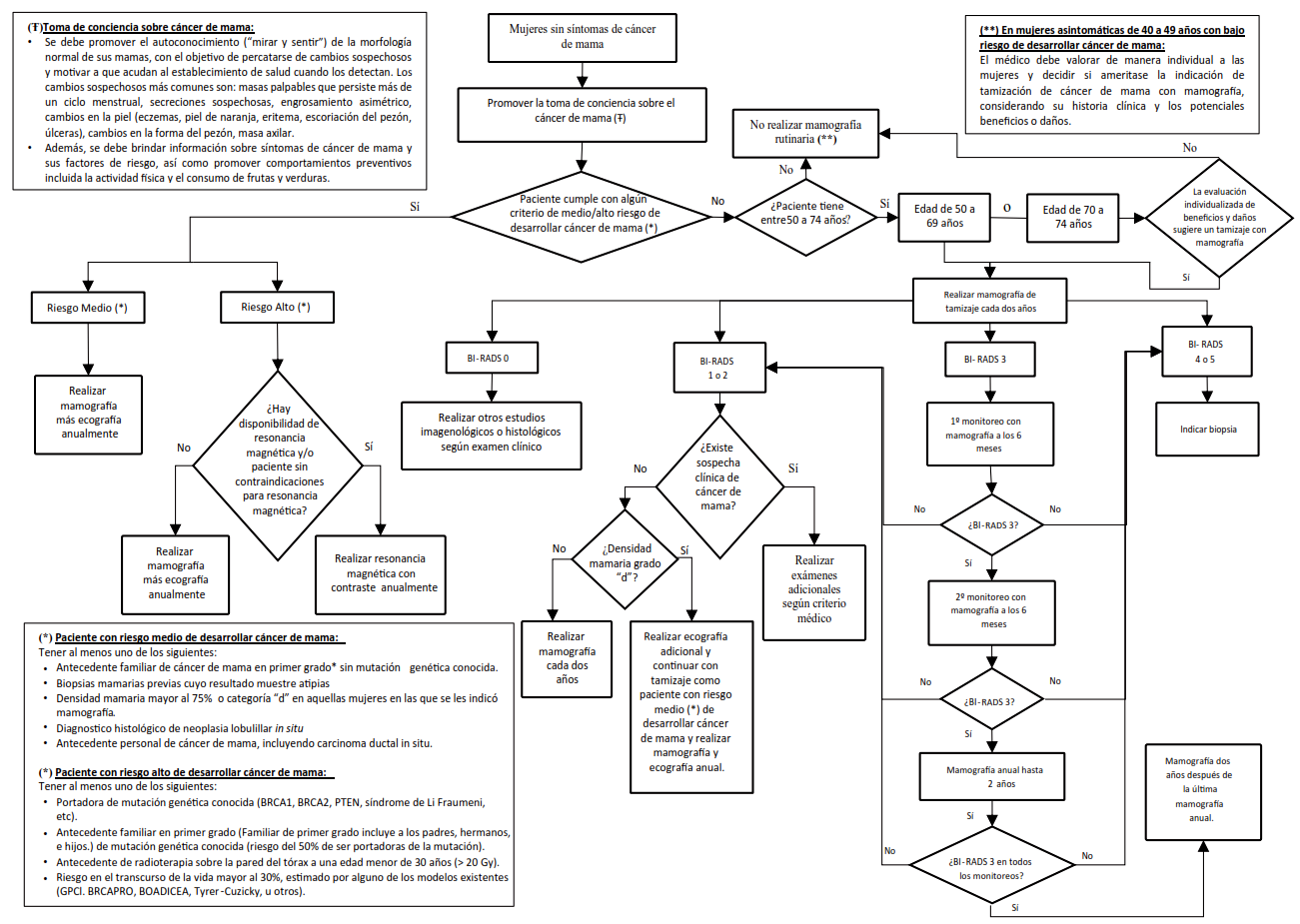
La presente GPC abordó 5 preguntas clínicas, y se formularon 8 recomendaciones (2 fuertes y 6 condicionales), 7 BPC, y 1 flujograma (Tabla 1 y 2, Figuras 1).
Tabla 1. Lista completa de recomendaciones y buenas prácticas clínicas (BPC).
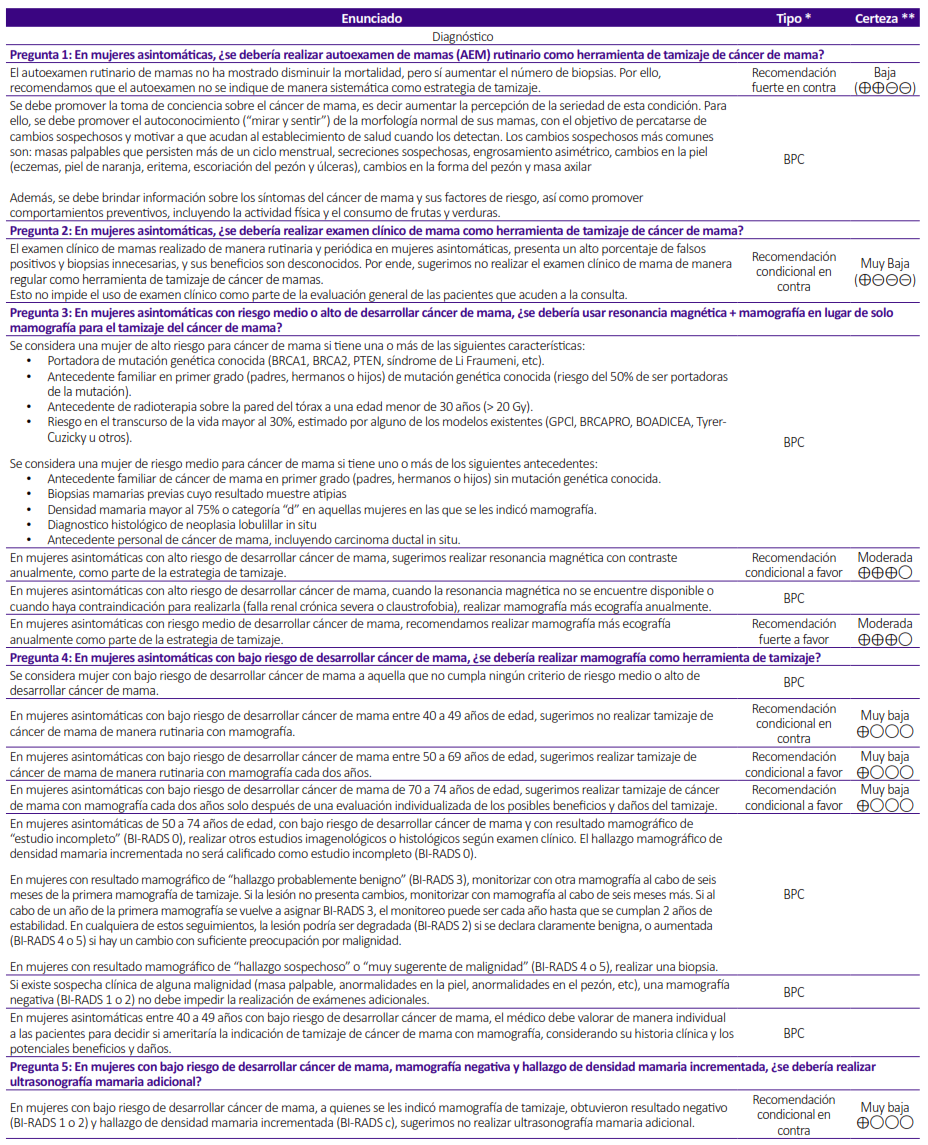
* Recomendación basada en evidencias, (R) o buenas prácticas clínicas (BPC) basadas en consenso.
** La certeza de la evidencia solo se establece para las recomendaciones, mas no para las BPC.
Pregunta 1. En mujeres asintomáticas, ¿se debería realizar autoexamen de mamas (AEM) rutinario como herramienta de tamizaje de cáncer de mama?
Evidencia: Encontramos tres RS (9-11. Elegimos la RS de la GPC de Canadá 10 para mortalidad por cáncer de mama y la de Kosters 2003 11 para biopsia con resultado negativo, debido a su calidad metodológica y a que reportaban los desenlaces de interés.
Para esta pregunta comparamos dos escenarios: el escenario 1 fue realizar el AEM y el escenario 2 fue no realizar el AEM. En el escenario 1, si se realiza el AEM y se detecta alguna anomalía en la mama se realizará exámenes diagnósticos (biopsia, mamografía diagnóstica, entre otros) para el cáncer de mama, y si no, no se realizarán exámenes diagnósticos. Por otro lado, sobre el escenario 2, si no se realiza el AEM, no se realiza ningún examen de diagnóstico por lo que se detecta anomalías mamarias cuando el signo es grosero o no se detecta anomalía.
Beneficios: La RS de la GPC de Canadá 10 encontró que, si 1000 mujeres sin síntomas de cáncer de mama realizan el escenario 1 en lugar del escenario 2, probablemente no modificaremos el riesgo de mortalidad por cáncer de mama. No se encontró evidencia para el desenlace de mortalidad general ni calidad de vida.
Daños: La RS de Kösters 2003 11 encontró que, si 1000 mujeres sin síntomas de cáncer de mama realizan el escenario 1 en lugar del escenario 2, podría ser que aumenten en 8 biopsias con resultado benigno (IC 95%: +7 a +9). No se encontró evidencia para el desenlace de sobrediagnóstico ni sobretratamiento.
Recomendación: Dado que el uso de AEM no mostró beneficios en la reducción de la mortalidad por cáncer de mama y podría estar asociado con daños menores, el GEG decidió emitir una recomendación en contra del uso de AEM rutinario para el tamizaje de esta enfermedad. Aunque la certeza de la evidencia fue baja, implementar esta intervención conllevaría costos moderados y podría afectar negativamente la equidad, por lo cual el GEG acordó emitir una recomendación fuerte. Asimismo, se emitió un BPC sobre la toma de conciencia del cáncer de mama.
Pregunta 2. En mujeres asintomáticas, ¿se debería realizar examen clínico de mama (ECM) como herramienta de tamizaje de cáncer de mama?
Evidencia: Encontramos dos RS 9,12. Elegimos la RS de Nelson 2009 9 debido a su calidad metodológica y a que realizó su búsqueda más recientemente.
Para esta pregunta comparamos dos escenarios: el escenario 1 fue realizar el ECM y el escenario 2 fue no realizar el ECM. Sobre el escenario 1, si se realiza el ECM y se detecta anomalía en la mama, se realizará exámenes diagnósticos (biopsia, mamografía diagnóstica, entre otros) para el cáncer de mama. Si no se detecta anomalía en la mama, no se realiza exámenes diagnósticos. En el escenario 2, no se realiza el ECM pero sí exámenes diagnósticos del cáncer de mama.
Beneficios: La RS de Nelson 2009 9 encontró un ECA que pretendió evaluar el efecto de realizar ECM como estrategia de tamizaje en mortalidad por cáncer de mama, pero debido a baja adherencia, el ECA fue descontinuado y no se obtuvieron datos de ello. No se encontró evidencia para el desenlace de mortalidad general ni calidad de vida.
Daños: En mujeres sin síntomas de cáncer de mama, si 1000 realizan el escenario 1 en lugar del escenario 2, podría ser que 602 mujeres tengan un resultado falso negativo, 969 tengan un resultado falso positivo, y 512 tengan biopsias innecesarias, aunque la evidencia es incierta.
Recomendación: Se determinó que los beneficios del examen clínico de mamas no están claramente establecidos, pero que existen daños potenciales asociados, como el elevado porcentaje de falsos negativos y las biopsias innecesarias. Los falsos negativos podrían resultar en la falta de seguimiento con tamizaje adicional, lo que retrasaría el diagnóstico de la enfermedad y posiblemente aumentaría la mortalidad por cáncer de mama. Además, las biopsias innecesarias podrían generar una sobrecarga en la demanda de servicios de biopsia. Por estos motivos, se emitió una recomendación en contra de la intervención. Dado que la certeza de la evidencia es muy baja, se estableció una fuerza condicional a la recomendación, aunque esto no excluye el uso del examen clínico como parte de la evaluación integral de las pacientes en consulta.
Pregunta 3. En mujeres asintomáticas con riesgo medio o alto de desarrollar cáncer de mama, ¿se debería usar resonancia magnética + mamografía en lugar de solo mamografía para el tamizaje del cáncer de mama?
Evidencia: No encontramos RS, pero se hallamos el ECA de Saadatmand 2019 13. Para esta pregunta comparamos dos escenarios: el escenario 1 fue realizar la resonancia magnética y mamografía, y el escenario 2 fue realizar solo mamografía. Sobre el escenario 1, si se realiza la resonancia magnética y la mamografía, y se detecta anomalía en la mama, se diagnóstica el cáncer de mama. Si no se detecta anomalía en la mama, no se diagnóstica el cáncer de mama. De similar manera, sobre el escenario 2, si se realiza solo mamografía y se detecta anomalía en la mama, se diagnóstica el cáncer de mama. Si no se detecta anomalía en la mama, no se diagnóstica el cáncer de mama.
Beneficios: En mujeres sin síntomas de cáncer de mama, pero con riesgo medio o alto de desarrollarlo, si 1000 realizan el escenario 1 en lugar del escenario 2, probablemente se detecte 6 casos de cáncer de mama adicional y habría 175 sobrediagnósticos menos. En los estudios evaluados, no se encontró evidencia para el desenlace de mortalidad general, mortalidad por cáncer de mama, calidad de vida, ni detección de cáncer metastásico.
Daños: En mujeres sin síntomas de cáncer de mama, pero con riesgo medio o alto de desarrollarlo, si 1000 realizan el escenario 1 en lugar del escenario 2, probablemente se sobrediagnostique 175 cánceres de mama menos. En los estudios evaluados, no se encontró evidencia para el desenlace de mortalidad general, mortalidad de cáncer de mama, calidad de vida, ni detección de cáncer metastásico.
Recomendación: En mujeres asintomáticas con alto riesgo de desarrollar cáncer de mama, los beneficios de la intervención fueron considerados moderados, superando a los daños menores, por lo que se decidió establecer una recomendación a favor de dar la intervención de manera anual. Aunque la certeza de la evidencia fue moderada, se tuvo en cuenta que la resonancia magnética podría no estar disponible en todos los contextos y podría ser reemplazada por la combinación de otras pruebas de tamizaje, lo que llevó a establecer una fuerza condicional a la recomendación.
Recomendación: Para mujeres asintomáticas con riesgo medio de desarrollar cáncer de mama, aunque los beneficios de la intervención también fueron moderados y superiores a los daños pequeños, la implementación de la resonancia magnética en el contexto peruano podría no ser viable para un grupo más amplio como el de riesgo medio. Por ello, se optó por establecer una recomendación a favor del comparador (mamografía) y adicionar ultrasonografía de manera anual. La certeza de la evidencia fue moderada por lo que llevó a emitir una fuerza fuerte a la recomendación.
Además, se incluyó un BPC sobre las características de las personas con riesgo alto y medio de desarrollar cáncer de mama, así como sobre las alternativas a la resonancia y mamografía cuando estas no estén disponibles.
Pregunta 4. En mujeres asintomáticas con bajo riesgo de desarrollar cáncer de mama, ¿se debería realizar mamografía como herramienta de tamizaje?
Subpoblación de mujeres asintomáticas con bajo riesgo de desarrollar cáncer de mama entre 40 a 49 años de edad
Evidencia: Encontramos seis RS 10,14-18. Elegimos la RS de Canadá 10 para los desenlaces de biopsia por falsos positivos para mujeres entre 40 y 49 años, 70 y 74 años y mortalidad general, la RS de Canelo-Aybar 2021 para biopsia y ansiedad por falsos positivos para mujeres entre 50 y 69 años, mortalidad por cáncer de mama, cáncer de mama avanzado, cáncer de mama metastásico y sobrediagnóstico 17, y la RS de Salz 2010 14 para ansiedad por falsos positivos para mujeres entre 40 y 49 años, 70 y 74 años, debido a su calidad metodológica y a que reportaban los desenlaces de interés.
Para esta pregunta comparamos dos escenarios: el escenario 1 fue realizar mamografía, y el escenario 2 fue no realizar mamografía. Sobre el escenario 1, si se realiza la mamografía, y se detecta anomalía en la mama, se realizará exámenes diagnósticos (biopsia, mamografía diagnóstica, entre otros) para el cáncer de mama. Si no se detecta anomalía en la mama, no se realiza exámenes diagnósticos. Por otro lado, sobre el escenario 2, si no se realiza la mamografía, no se realiza ningún examen de diagnóstico por lo que se detecta la anomalía en la mama cuando el signo es grosero o no se detecta anomalía en la mama.
Beneficios: En mujeres entre 40 y 49 años sin síntomas de cáncer de mama y bajo riesgo de desarrollarlo, si 1000 realizan el escenario 1 en lugar del escenario 2, podría ser que no se modifique la mortalidad general 10, aunque la evidencia es incierta, ni la mortalidad por cáncer de mama 17. En los estudios evaluados, no se encontró evidencia para el desenlace de calidad de vida.
Daños: En mujeres entre 40 y 49 años sin síntomas de cáncer de mama y bajo riesgo desarrollarlo, si 1000 realizan el escenario 1 en lugar del escenario 2, podría ser que 90 atraviesen biopsias innecesarias 10, lo cual podría producir ansiedad por falso positivo 14, aunque la evidencia es incierta. En los estudios evaluados, no se encontró evidencia para el desenlace de sobrediagnóstico.
Recomendación: Dado que los beneficios fueron mínimos y no superaron los posibles daños identificados, se decidió establecer una recomendación en contra de la intervención. Debido a la muy baja certeza de la evidencia, se asignó una fuerza condicional a la recomendación.
Subpoblación de mujeres asintomáticas con bajo riesgo de desarrollar cáncer de mama entre 50 a 69 años de edad
Beneficios: En mujeres entre 50 y 69 años sin síntomas de cáncer de mama y bajo riesgo de desarrollarlo, si 1000 realizan el escenario 1 en lugar del escenario 2, podría ser que evitemos 1 muerte por cáncer de mama (-2 a -1) si la prevalencia de cáncer de mama es 0.6%, y podría ser que evitemos 1 cáncer regional o metastásico, si la prevalencia es 0.2% (-1 a 0), aunque la evidencia es incierta. Sin embargo, podría ser que no modifiquemos la mortalidad general, ni el número de cáncer avanzado (estadío IIA o mayor), aunque la evidencia es incierta.
Daños: En mujeres entre 50 y 69 años sin síntomas de cáncer de mama y bajo riesgo de desarrollarlo que realicen el escenario 1 en lugar del escenario 2, podría ser que se produzca un sobrediagnóstico del 17.3% (IC 95% 14.7%-20.0%), aunque la evidencia es incierta, también podría ser que haya de 8% hasta un 21% de falsos positivos lo que se relacionó con un riesgo acumulado de 2.9% (1,8% - 6,3%) de experimentar un procedimiento invasivo; además, podría ser que aumentemos los casos de ansiedad, angustia, miedo, y preocupación por el cáncer de mama en mujeres con falso positivo.
Recomendación: Dado que el GEG considera que el balance de beneficios probablemente favorece el uso de mamografía, se optó por emitir una recomendación a favor de hacer mamografía cada dos años. Sin embargo, debido a la muy baja certeza de la evidencia y los costos moderados, se emitió una recomendación condicional.
Subpoblación de mujeres asintomáticas con bajo riesgo de desarrollar cáncer de mama entre 70 a 74 años de edad
Beneficios: En mujeres entre 70 y 74 años sin síntomas de cáncer de mama y bajo riesgo de desarrollarlo, si 1000 realizan el escenario 1 en lugar del escenario 2, podría ser que no modifiquemos la mortalidad general, aunque la evidencia es incierta, ni la mortalidad por cáncer de mama. En los estudios evaluados, no se encontró evidencia para el desenlace de calidad de vida.
Daños: En mujeres entre 70 y 74 años sin síntomas de cáncer de mama y bajo riesgo de desarrollarlo, si 1000 realizan el escenario 1 en lugar del escenario 2, podría ser que 68 mujeres atraviesen biopsias innecesarias y se podría producir ansiedad por falso positivo, aunque la evidencia es incierta.
Recomendación: Aunque se identificaron algunos beneficios y daños menores, la evidencia disponible no fue suficiente para realizar un balance claro de los efectos. No obstante, el GEG consideró que, en este grupo poblacional, no existen otras herramientas de tamizaje accesibles para el cáncer de mama, y que esta población es vulnerable a resultados desfavorables de la enfermedad. Por lo tanto, se concluyó que el uso de mamografía para el tamizaje contribuiría a mejorar la equidad. En consecuencia, se emitió una recomendación a favor de hacer mamografía cada dos años. Debido a la muy baja certeza de la evidencia, se estableció una fuerza condicional a la recomendación y se especificó que la intervención debe realizarse tras una evaluación individual de los posibles beneficios y riesgos del tamizaje.
Se emitieron BPC sobre las características de las mujeres con bajo riesgo de desarrollar cáncer de mama, la interpretación de mamografías según BI-RADS, y las circunstancias en las que el tamizaje con mamografía podría ser pertinente en mujeres de 40 a 49 años.
Pregunta 5. En mujeres asintomáticas, ¿se debería realizar autoexamen de mamas (AEM) rutinario como herramienta de tamizaje de cáncer de mama?
Evidencia: Encontramos seis RS 19-24. Elegimos la RS de Yuan 2020 19 para los desenlaces de sensibilidad y especificidad, la RS de Rebolj 2018 20 para la tasa de detección. y la RS de Hadidi 2021 23 para la tasa de solicitud de más exámenes, debido a su calidad metodológica y a que reportaban los desenlaces de interés.
Para esta pregunta comparamos dos escenarios: el escenario 1 fue realizar ultrasonografía adicional a mamografía, y el escenario 2 fue no realizar ultrasonografía adicional a mamografía. Sobre el escenario 1, si se realiza ultrasonografía adicional a mamografía, y se detecta anomalía en la mama, se realizará exámenes diagnósticos (biopsia, mamografía diagnóstica, entre otros) para el cáncer de mama. Si no se detecta anomalía en la mama, no se realiza exámenes diagnósticos. Por otro lado, sobre el escenario 2, si no se realiza ultrasonografía adicional a mamografía, se continúa tamizaje con mamografía después de dos años.
Beneficios: Tomando en cuenta una probabilidad de tener cáncer de mama de 0,4% (20), en mujeres sin síntomas de cáncer de mama, bajo riesgo de desarrollarlo, mamografía negativa y hallazgo de densidad mamaria incrementada, si 1000 realizan el escenario 1 en lugar del escenario 2, podría ser que 4 (IC 95%: 4 a 4) tengan resultados verdaderamente positivos 19 y se les daría tratamiento temprano de cáncer de mama. Además, 876 (IC 95%: 867 a 876) tengan un resultado verdadero negativo 19 y se confirmaría el descarte de cáncer de mama, aunque la evidencia es incierta.
Daños: Según la RS de Hadidi 2021 23, en mujeres sin síntomas de cáncer de mama, bajo riesgo de desarrollarlo, mamografía negativa y hallazgo de densidad mamaria incrementada, si 1000 realizan el escenario 1 en lugar del escenario 2, podría ser que 120 (IC 95%: 120 a 129) tengan un resultado falso positivo, por lo cual se les indicaría exámenes diagnósticos adicionales innecesarios. Además, podría ser que a 26 (IC 95%: +26 a +30) más se soliciten exámenes adicionales y que no se detecten falsos negativos, aunque la evidencia es incierta.
Recomendación: Debido a que los posibles daños, como tratamientos innecesarios y resultados falsos negativos, se consideraron mayores que los beneficios potenciales de añadir ultrasonografía a una mamografía negativa, y dado que los costos serían moderados, el GEG decide emitir una recomendación en contra de la ultrasonografía adicional a mamografía en mujeres con densidad mamaria grado “c”. Dado que la certeza de la evidencia es muy baja, se estableció una recomendación condicional.