INTRODUCCIÓN
La endometriosis se caracteriza por la presencia de tejido semejante al endometrio en ubicaciones fuera del útero que puede manifestarse como lesiones en el peritoneo, implantes superficiales, quistes ováricos o lesiones con infiltración profunda 1.
La Organización Mundial de la Salud estima que alrededor del 10% de las mujeres y niñas en edad reproductiva en todo el mundo tienen endometriosis, lo que corresponde a aproximadamente 190 millones de casos a nivel global 2. No obstante, esta cifra podría ser mayor, ya que la endometriosis a menudo no se diagnostica 3, en gran parte debido a la subvaloración de los síntomas y sus consecuencias. Tanto el público como muchos profesionales de la salud no siempre reconocen que el dolor pélvico relacionado con la endometriosis puede afectar gravemente la calidad de vida de las pacientes, lo que conduce a la normalización de los síntomas y a retrasos considerables en el diagnóstico y el tratamiento de la enfermedad 4.
Una evaluación y tratamiento adecuados de los casos de endometriosis podrían mitigar sus efectos negativos sobre la calidad de vida y la fertilidad en las mujeres afectadas. Por este motivo, el Seguro Social de Salud (EsSalud) ha priorizado la elaboración de esta guía de práctica clínica (GPC) para establecer directrices basadas en evidencia que optimicen la atención y manejo de esta condición.
Esta GPC ha sido desarrollada por la Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) de EsSalud. Su propósito es proporcionar recomendaciones para el diagnóstico y tratamiento de la endometriosis, buscando mejorar la calidad de vida y disminuir las complicaciones en las pacientes que padecen esta enfermedad.
METODOLOGÍA
El proceso utilizado para desarrollar esta GPC se describe en detalle en su versión “in extenso”, disponible para descargar en el sitio web del IETSI de EsSalud (https://ietsi.essalud.gob.pe/gpc-guias-de-practica-clinica/).
En resumen, la metodología aplicada fue la siguiente:
Conformación del grupo elaborador de la guía (GEG)
Se creó un GEG compuesto por metodólogos y especialistas en ginecología y obstetricia.
Formulación de preguntas
De acuerdo con los objetivos y alcances de esta GPC, el GEG elaboró 6 preguntas clínicas (Tabla 1). Cada una de estas preguntas podría incluir una o más preguntas PICO (Population, Intervention, Comparator, Outcome). A su vez, cada pregunta PICO pudo tener uno o más desenlaces (o outcomes) de interés.
Búsqueda y selección de la evidencia
Para cada pregunta PICO, se llevó a cabo una búsqueda de revisiones sistemáticas (RS) entre diciembre de 2021 y febrero de 2022. Estas revisiones podían ser artículos científicos, localizados mediante búsquedas sistemáticas en PubMed y CENTRAL, o realizadas como parte de una GPC previa, encontradas a través de una búsqueda sistemática de GPC (Material Suplementario 1). Si se identificaba una RS de calidad aceptable según el instrumento A Measurement Tool to Assess Systematic Reviews-II (AMSTAR II) modificado por EsSalud 5, se seleccionaba una para cada desenlace relevante y se actualizaba si el GEG lo consideraba necesario. En caso de no encontrar RS de calidad adecuada, se procedía con una búsqueda de novo de estudios primarios.
Evaluación de la certeza de la evidencia y cálculo de efectos absolutos
Para cada desenlace de cada pregunta PICO, se evaluó la certeza de la evidencia utilizando la metodología de Grading of Recommendations Assessment, Development, and Evaluation (GRADE) 6.
Además, se calcularon los efectos absolutos para cada desenlace, ya sea como diferencias de riesgos para desenlaces dicotómicos o diferencias de medias para desenlaces numéricos. En el cálculo de las diferencias de riesgos, se utilizó la incidencia del desenlace en el grupo control reportada por la evidencia, a menos que se indique lo contrario para alguna pregunta específica (Material Suplementario 2).
Formulación de las recomendaciones
El GEG evaluó la evidencia seleccionada para cada pregunta clínica en reuniones periódicas, utilizando los marcos Evidence to Decision (EtD) de la metodología GRADE 7,8. Para esto, se consideraron los siguientes aspectos: 1) Beneficios y daños de las opciones, 2) Valores y preferencias de los pacientes, 3) Aceptabilidad por parte de los profesionales de salud y pacientes, 4) Equidad, 5) Factibilidad de las opciones en EsSalud, y 6) Uso de recursos. Después de discutir estos puntos para cada pregunta, el GEG formuló cada recomendación mediante consenso o mayoría simple, asignando una fuerza (fuerte o condicional) y una certeza de la evidencia (alta, moderada, baja, o muy baja) (Tabla 2).
Formulación de buenas prácticas clínicas
El GEG desarrolló las buenas prácticas clínicas (BPC) principalmente basándose en su experiencia clínica y en la adopción de guías o protocolos existentes.
Revisión por expertos externos
Esta GPC fue sometida a revisión en reuniones con especialistas representantes de otras instituciones y tomadores de decisiones de EsSalud. Además, la versión extensa se envió electrónicamente a expertos externos para su revisión (como se detalla en la sección de agradecimientos). Los comentarios recibidos durante estas revisiones se consideraron para ajustar las recomendaciones finales, cuando resultó pertinente.
Aprobación de la GPC
La presente GPC fue aprobada para su uso en EsSalud, con Resolución N° 62-IETSI-ESSALUD-2022.
Actualización de la GPC:
La GPC tiene una vigencia de cinco años. Al final de este período, se llevará a cabo una RS de la literatura para su actualización, para decidir si se actualiza la GPC o se elabora una nueva versión.
Recomendaciones
La presente GPC abordó 6 preguntas clínicas, y se formularon 8 recomendaciones (1 fuerte y 7 condicionales), 21 BPC, y 2 flujogramas (Tabla 1, Figuras 1 y 2).
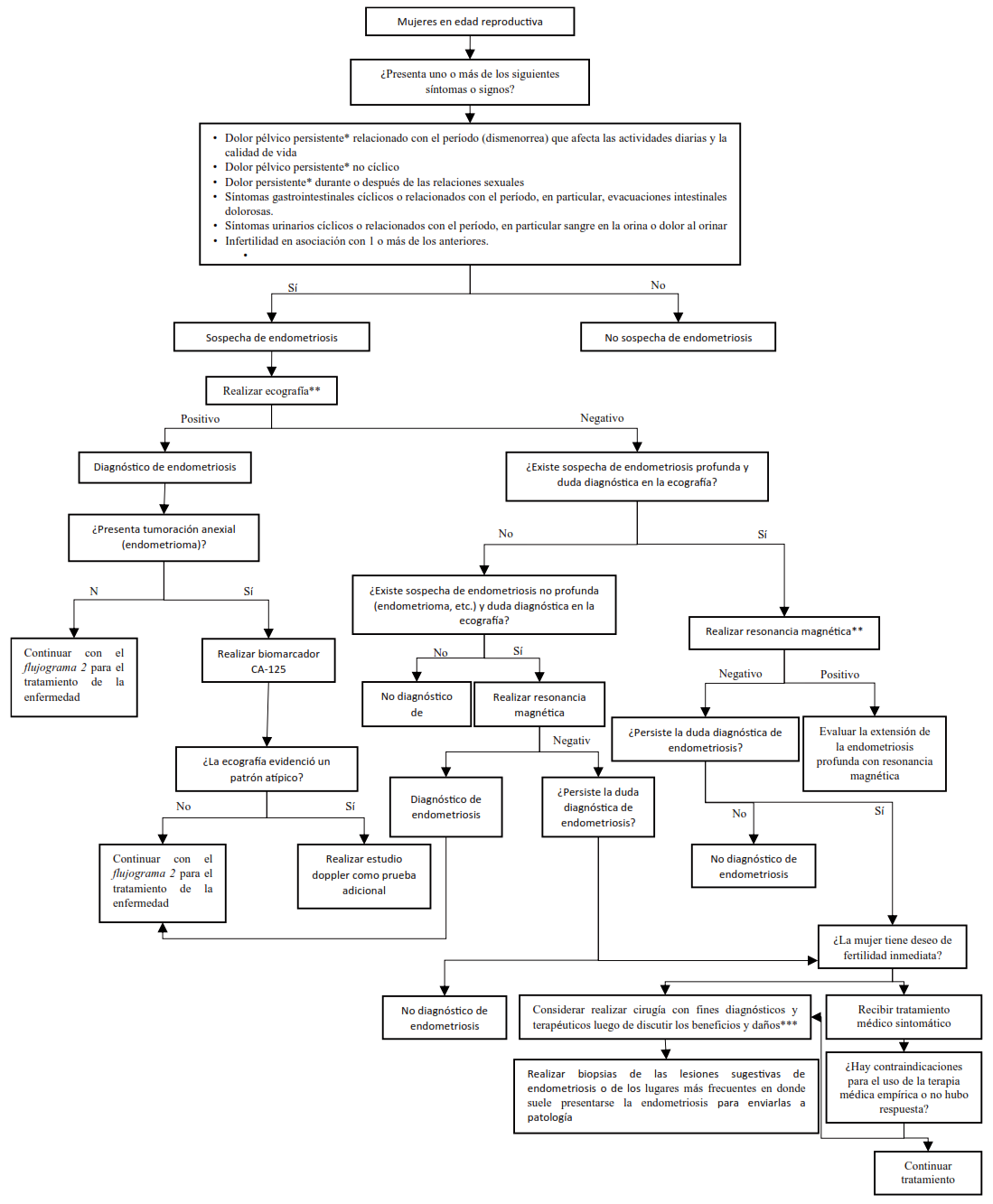
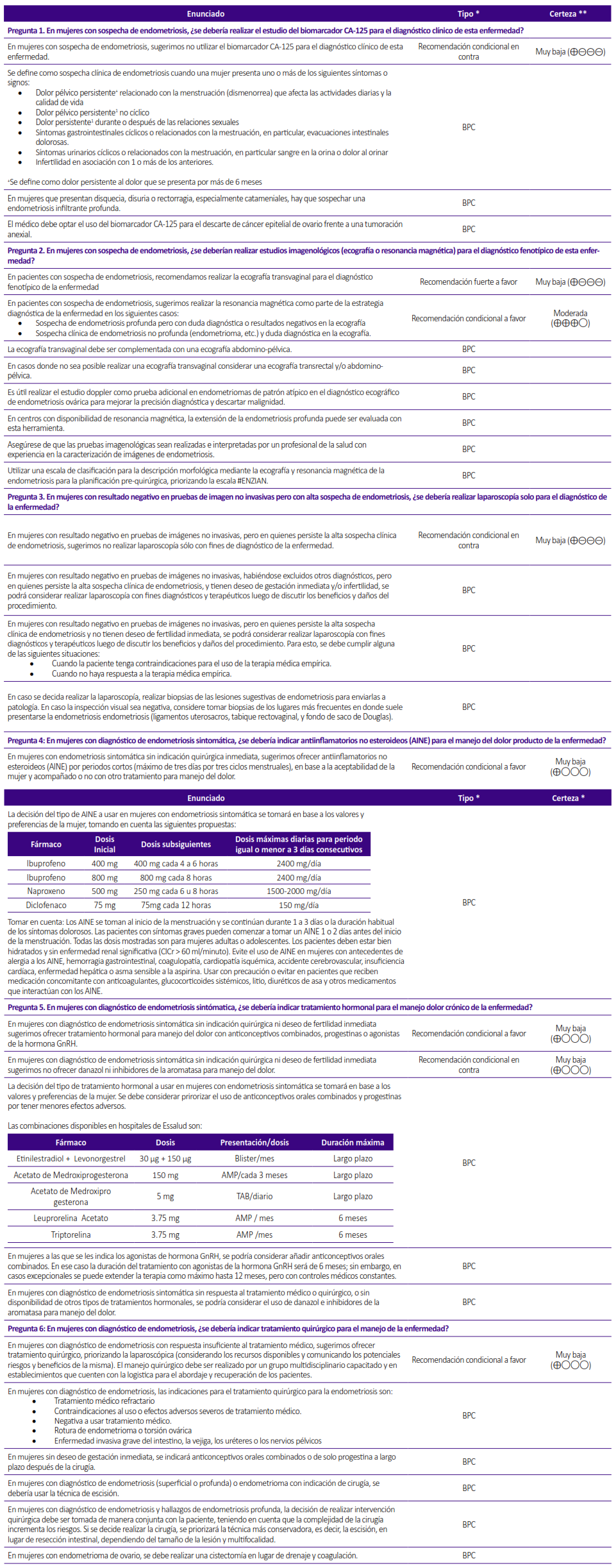
*Se define como dolor persistente al dolor que se presenta por más de 6 meses
** Utilizar una escala de clasificación para la descripción morfológica mediante la ecografía y resonancia magnética de la endometriosis en la planificación pre-quirúrgica, priorizando la escala #ENZIAN.
*** Se considerará la cirugía cuando la paciente tenga contraindicaciones para el uso de la terapia médica empírica o cuando no haya respuesta a la terapia médica empírica.
Figura 1. Flujograma para el diagnóstico de endometriosis.
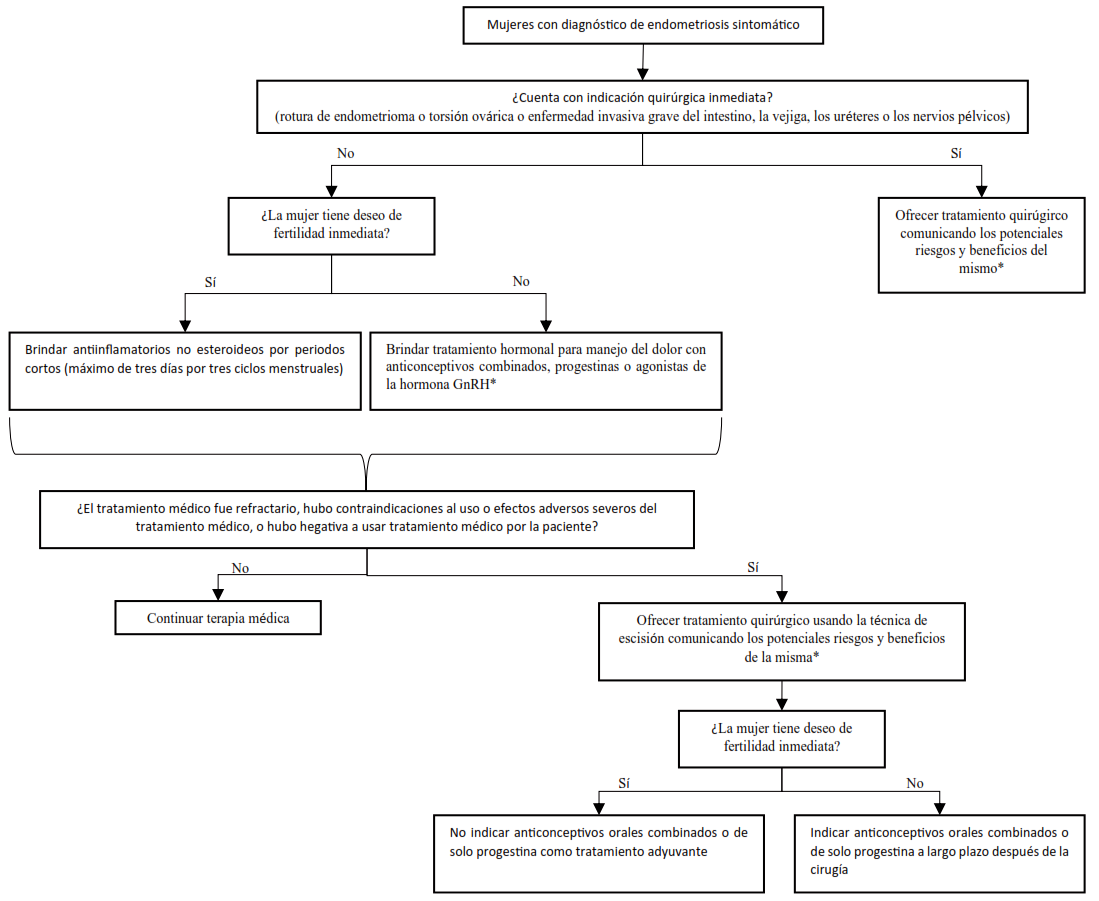
*Se priorizará la laparoscópica como tratamiento quirúrgico, considerando los recursos disponibles.
Figura 2. Flujograma para el manejo de la endometriosis.
Pregunta 1. En mujeres con sospecha de endometriosis, ¿se debería realizar el estudio del biomarcador CA-125 para el diagnóstico de esta enfermedad?
Evidencia: Encontramos tres RS 9-11, de las cuales elegimos la RS de Nisenblat 2016 11 por ser la de mayor calidad y más reciente. Esta RS evaluó la exactitud diagnóstica de CA-125 teniendo como prueba de referencia la cirugía (laparotomía o laparoscopía).
Para esta pregunta comparamos dos escenarios: el escenario 1 fue realizar la evaluación de CA-125 y el escenario 2 fue no realizar el CA-125. Sobre el escenario 1, si se obtiene un valor <35 U/ml, no se realiza las pruebas de imágenes no invasivas (ecografía y resonancia magnética) y se concluye que la paciente no tiene endometriosis. Sin embargo, si se obtiene un valor ≥35 U/ml, se realiza las pruebas de imágenes no invasivas. Por otro lado, sobre el escenario 2, si no se realiza la evaluación de CA-125, se realiza las pruebas de imágenes no invasivas a todos los pacientes. Para estos escenarios, consideramos una probabilidad de tener endometriosis del 10% según el Reporte mundial de la Organización Mundial de Salud 12.
Beneficios: Si se realiza el escenario 1 como estrategia diagnóstica de endometriosis en lugar de realizar el escenario 2 a 10 mujeres con endometriosis, posiblemente 4 (Intervalo de confianza al 95% [IC95%]: 3 a 5) saldrían positivas a la prueba de CA-125, por lo cual se les realizaría pruebas de imagen no invasivas (ecografía y resonancia magnética) adicionales para el diagnóstico de endometriosis.
Si se realiza el escenario 1 como estrategia diagnóstica de endometriosis en lugar de realizar el escenario 2 a 90 mujeres sin endometriosis, posiblemente 83 (IC95%: 80 a 85) mujeres no hubieran recibido pruebas de imagen no invasivas innecesarias.
Daños: Si se realiza el escenario 1 como estrategia diagnóstica de endometriosis en lugar de realizar el escenario 2 a 10 mujeres con endometriosis, posiblemente 6 (IC95%: 5 a 7) mujeres con endometriosis no recibirían pruebas de imagen no invasivas y se les describiría erróneamente como mujeres sin endometriosis.
Si se realiza el escenario 1 como estrategia diagnóstica de endometriosis en lugar de realizar el escenario 2 a 90 mujeres sin endometriosis, posiblemente 7 (IC95% 5 a 10) mujeres saldrían positivas a la prueba de CA-125, por lo cual se les realizaría pruebas de imagen no invasivas innecesariamente al realmente no tener endometriosis.
Recomendación: Debido a que el uso del biomarcador CA-125 presenta una sensibilidad reducida en comparación con la prueba de referencia, lo que podría resultar en un elevado número de falsos y retrasar tanto el diagnóstico como el tratamiento de la endometriosis, se optó por realizar una recomendación en contra del uso de CA-125 para el diagnóstico de esta enfermedad. Dado que la evidencia disponible tenía una certeza muy baja, se formuló una recomendación condicional.
Pregunta 2. En mujeres con sospecha de endometriosis ¿se deberían realizar estudios imagenológicos (ecografía y resonancia magnética) para el diagnóstico de la enfermedad?
Ecografía transvaginal:
Evidencia: Encontramos una RS 13, la cual fue elegida debido a que incluyó los desenlaces de interés. Esta RS evaluó la exactitud diagnóstica de la ecografía transvaginal teniendo como prueba de referencia la cirugía (laparotomía o laparoscopía).
Para esta pregunta comparamos dos escenarios: el escenario 1 fue realizar ecografía transvaginal y el escenario 2 fue no realizar ecografía transvaginal. Sobre el escenario 1, si se obtiene un valor positivo, se brinda tratamiento médico o quirúrgico para endometriosis. Sin embargo, si se obtiene un valor negativo, se descarta el diagnóstico de endometriosis. Por otro lado, en el escenario 2, si no se realiza ecografía transvaginal, se brinda tratamiento médico empírico para endometriosis. Para estos escenarios, consideramos una probabilidad de tener endometriosis del 10% según el Reporte mundial de la Organización Mundial de Salud 12.
Beneficios: Si se realiza el escenario 1 a 100 mujeres en lugar de realizar el escenario 2, posiblemente 7 (IC95% 3 a 10) mujeres recibirían tratamiento médico temprano al tener endometriosis.
Si se realiza el escenario 1 a 100 mujeres en lugar de realizar el escenario 2, posiblemente en 86 (IC95%: 80 a 90) mujeres se evitaría un tratamiento innecesario.
Daños: Si se realiza el escenario 1 a 100 mujeres en lugar de realizar el escenario 2, posiblemente 3 (IC95%: 0 a 7) mujeres no recibirían tratamiento médico temprano al realmente tener endometriosis.
Si se realiza el escenario 1 a 100 mujeres en lugar de realizar el escenario 2, posiblemente 4 (IC95%: 0 a 10) mujeres recibirían tratamiento médico innecesariamente al realmente no tener endometriosis.
Recomendación: Dado que la ecografía transvaginal ofrecería un beneficio moderado al diagnosticar correctamente a un gran número de paciente con endometriosis, y los daños asociados con su uso serían muy pequeños, se optó por una recomendación a favor de la prueba. Aunque la certeza de la evidencia es muy baja, se tuvo en cuenta que, además del beneficio moderado, la prueba es factible de aplicar y no generaría costos significativos, lo que llevó a formular una fuerza fuerte a la recomendación.
Resonancia magnética
Evidencia: Encontramos una RS 13, la cual fue elegida debido a que incluyó los desenlaces de interés. Esta RS evaluó la exactitud diagnóstica de resonancia magnética teniendo como prueba de referencia la cirugía (laparotomía o laparoscopia) en mujeres con sospecha clínica y/o ecográfica de endometriosis.
Para esta pregunta comparamos dos escenarios: el escenario 1 fue realizar resonancia magnética y el escenario 2 fue no realizar resonancia magnética. Sobre el escenario 1, si se obtiene un valor positivo, se brinda tratamiento médico o quirúrgico para endometriosis. Sin embargo, si se obtiene un valor negativo, se descarta el diagnóstico de endometriosis. Por otro lado, sobre el escenario 2, si no se realiza resonancia magnética, se brinda tratamiento médico empírico para endometriosis. Para estos escenarios, consideramos una probabilidad de tener endometriosis del 10% según el reporte mundial de la Organización Mundial de Salud 12.
Beneficios: Si se realiza el escenario 1 a 100 mujeres en lugar de realizar el escenario 2, posiblemente 8 (IC95% 7 a 9) mujeres recibirían tratamiento médico temprano al tener endometriosis.
Si se realiza el escenario 1 a 100 mujeres en lugar de realizar el escenario 2, posiblemente en 65 (IC95%: 46 a 83) mujeres se evitaría un tratamiento innecesario.
Daños: Si se realiza el escenario 1 a 100 mujeres en lugar de realizar el escenario 2, posiblemente 2 (IC95%: 1 a 3) mujeres no recibirían tratamiento médico temprano al realmente tener endometriosis.
Si se realiza el escenario 1 a 100 mujeres en lugar de realizar el escenario 2, posiblemente 25 (IC95%: 7 a 44) mujeres recibirían tratamiento médico innecesariamente al realmente no tener endometriosis.
Recomendación: Considerando que la resonancia magnética mostró un beneficio moderado en la detección de la enfermedad, superando los daños mínimos observados, se decidió especificar una recomendación a favor de su uso en situaciones específicas. Aunque la evidencia tenía una certeza moderada, se reconoció que en nuestro contexto la disponibilidad de la resonancia magnética es limitada y que otras pruebas de imagen, más accesibles, podrían reemplazarla. Por ello, se decidió formular una recomendación condicional.
Pregunta 3. En mujeres con resultado negativo en pruebas de imagen no invasivas, pero con alta sospecha de endometriosis, ¿se debería realizar laparoscopía solo para el diagnóstico de la enfermedad?
Evidencia: Encontramos dos RS sobre estar pregunta 14,15. Seleccionamos la RS de Wykes 2004 15 para el desenlace de complicaciones de la prueba y la RS de la GPC NICE 2017 14 para los desenlaces de sensibilidad y especificidad, teniendo como prueba de referencia la histopatología.
Para esta pregunta comparamos dos escenarios: el escenario 1 fue realizar la laparoscopía diagnóstica y el escenario 2 fue no realizar la laparoscopía diagnóstica. Sobre el escenario 1, si se obtiene un valor positivo, se brinda tratamiento médico. Sin embargo, si se obtiene un valor negativo, se clasifica como dolor pélvico crónico y se exploran otros diagnósticos. Por otro lado, sobre el escenario 2, si no se realiza la laparoscopía diagnóstica, se brinda tratamiento médico empírico para endometriosis. Para estos escenarios, consideramos una probabilidad de tener endometriosis del 70% según consenso del panel dada la alta sospecha clínica.
Beneficios: Si se realiza el escenario 1 a 100 mujeres en lugar del escenario 2, posiblemente 24 (IC95%: 23 a 25) mujeres no hubieran recibido tratamiento médico innecesario al realmente no tener endometriosis.
Daños: Si se realiza el escenario 1 a 100 mujeres en lugar del escenario 2, posiblemente 2 (IC95%: 1 a 4) mujeres no hubieran recibido tratamiento médico de forma temprana al realmente tener endometriosis.
Recomendación: En mujeres con pruebas de imagen no invasivas negativas, pero con una alta sospecha clínica de endometriosis y que no buscan fertilidad de inmediato, se consideró que los beneficios de realizar una laparoscopía diagnóstica frente a no realizarla y optar por terapia médica empírica eran triviales (puesto que si bien el número de mujeres en quienes se hubiera evitado el tratamiento médico innecesario al no tener realmente endometriosis fue importante, los eventos adversos del tratamiento médico serían infrecuentes y generalmente manejables). Los daños también se consideraron triviales (puesto que pocas mujeres con endometriosis no recibirían el tratamiento médico temprano, y tanto las consecuencias de no brindar el tratamiento médico tempranamente como las complicaciones de realizar la laparoscopía podrían ser poco frecuentes y potencialmente manejables). Sin embargo, los costos asociados no justifican los beneficios. Por lo tanto, se emitió una recomendación en contra. Dado que la evidencia tenía muy baja certeza y la aceptabilidad de la laparoscopía varía entre pacientes, la recomendación fue condicional.
Pregunta 4: En mujeres con diagnóstico de endometriosis sintomático, ¿se debería indicar antiinflamatorios no esteroideos (AINE) para el manejo del dolor producto de la enfermedad?
Evidencia: Encontramos dos GPC 14,16 que realizaron una RS para esta pregunta y una RS publicada como artículo científico 17. Se seleccionó la GPC de NICE 2017 14 debido a que presentaba los desenlaces de interés a través de riesgos relativos.
Beneficios: Si brindamos AINE a 1000 mujeres en lugar de no brindarlos, podría ser que no modifiquemos significativamente el alivio del dolor ni el uso de analgesia suplementaria, aunque la evidencia es incierta. Sin embargo, la evidencia muestra una tendencia a favor de los AINE en ambas situaciones (281 más por 1000 vs160 menos por 1000).
Daños: Si brindamos AINE a 1000 mujeres en lugar de no brindarlo, podría ser que no observemos diferencias entre los efectos no deseados del tratamiento, aunque la evidencia es incierta.
Recomendación: El GEG evaluó que, aunque la evidencia directa no proporciona información concluyente sobre el efecto de los AINE en mujeres con endometriosis, los beneficios potenciales sugeridos por evidencia indirecta en mujeres con dismenorrea primaria 14 parecen superar los posibles riesgos cuando los AINE se utilizan a corto plazo. Además, se tomó en cuenta el beneficio en términos de mejorar la equidad. Por estas razones, se emitió una recomendación a favor del uso de AINE. Sin embargo, dado el muy bajo nivel de certeza de la evidencia y la posible variabilidad en la aceptación según la experiencia de las mujeres, se decidió hacer una recomendación condicional.
Pregunta 5. En mujeres con diagnóstico de endometriosis sintomática, ¿se debería indicar tratamiento hormonal para el manejo dolor crónico de la enfermedad?
Evidencia: Encontramos ocho RS 17-22, de los cuales seleccionamos la RS de Brown 2018 17 para abordar los anticonceptivos orales combinados; la RS de Samy 2021 22 para abordar las progestinas (acetato de medroxiprogesterona), el danazol, los agonistas de la hormona GnRH, y los inhibidores de la aromatasa; la RS de Brown 2010 19 para abordar los agonistas de la hormona gonadotrofina; y la RS de Farquhar 2007 20 para abordar el danazol.
Beneficios: Si brindamos anticonceptivos combinados a 1000 mujeres en lugar de no brindarlos, podría ser que disminuyamos en promedio 23,68 mm en dismenorrea medido con la Escala Visual Analógica (EVA), cuyos valores van de 0 a 100 mm (donde a mayor valor, mayor dolor), al final de tratamiento (IC 95% -28,75 a -18,62). Asimismo, utilizando la misma escala, podría ser que aumentemos en promedio 1 mm el valor del dolor no menstrual (IC 95% +0,3 a +1,7) y 1,4 mm el valor de la dispareunia (IC 95% + 0,46 a + 2,34), aunque la evidencia es incierta.
Si brindamos acetato de medroxiprogesterona a 1000 mujeres en lugar de no brindarlo, podría ser que observemos una disminución en promedio de 0,64 puntos (IC 95% -1,12 a -0,16) en la dismenorrea a los 6 meses medida con la escala de Biberoglu-Behrman (B&B), cuyos valores van de 0 a 3 puntos (donde a mayor puntaje, mayor severidad de síntoma). Así mismo, no observamos cambios en el dolor pélvico no menstrual a los 6 meses ni embarazo clínico.
Si brindamos agonistas de la hormona GnRH a 1000 mujeres en lugar de no brindarlo, podría ser que se disminuya en promedio 18,1 mm (IC 95% -24,7 a -11,4) de dolor a los 6 meses medido con la EVA. Además, podría ser que se disminuya 1,79 puntos (IC 95% -2,17 a -1,42), y 0,35 puntos (IC 95% -0,67 a -0,03) en el cambio en dismenorrea y dispareunia a los 6 meses, respectivamente, medidas con la escala de B&B. Asimismo, conllevaría a una mayor probabilidad de embarazo clínico (Razón de odds [OR] 1,68; IC 95% 1,07 a 2,46).
Si brindamos danazol a 1000 mujeres en lugar de no brindarlo, podría ser que se disminuya 1,22 puntos (IC 95% -1,90 a -0,54) el cambio de dismenorrea a los 3 meses mediante el uso de la escala de B&B de 0 a 3 puntos, y se reduzca el dolor a los 6 meses. Sin embargo, no modificaríamos el cambio en dismenorrea a los 6 meses, dolor pélvico no menstrual a los 3 meses, y la dispareunia a los 3 meses.
Por último, si brindáramos inhibidores de la aromatasa podría conllevar una disminución en el puntaje de dolor, dismenorrea y dispareunia, y no modificaría el embarazo clínico, pero la evidencia es incierta.
Daños: Si brindáramos los anticonceptivos combinados orales a 1000 mujeres, posiblemente se produzcan 107 y 108 casos más de spotting, sangrado irregular, y menorragia (IC 95% +33 a +234) y náuseas (IC 95% +27 a +293). Sin embargo, no habría diferencias en el abandono de tratamiento ni efectos adversos del tratamiento.
Si brindáramos acetato de medroxiprogesterona podría ser que haya una mayor probabilidad de abandono de tratamiento (OR 3,5; IC 95% 1,27 a 9,66).
Si brindáramos agonistas de la hormona GnRH a 1000 mujeres, podría ser que se presenten 472 casos más de alteración del sueño (IC 95% + 119 a + 1000). Asimismo, no observaríamos diferencias en el abandono de tratamiento ni sofoco, aunque la evidencia es incierta.
Por último, si brindáramos danazol podría ser que observemos una mayor probabilidad de acné al termino de tratamiento (OR: 10,8; IC 95% 2,7 a 42,8), calambre muscular al termino de tratamiento (OR: 9,7; IC 95% 1,7 a 55,3), edema al termino de tratamiento (OR: 7,11; IC 95% 1,5 a 31,6), y spotting vaginal al termino de tratamiento (OR: 10,8; IC 95% 2,7 a 42,8).
Recomendación: El GEG evaluó que los beneficios potenciales de los anticonceptivos orales combinados, las progestinas y los agonistas de la GnRH superarían los daños asociados y, además, contribuirían a mejorar la equidad. Por lo tanto, el GEG decide emitir una recomendación a favor. En contraste, el GEG consideró que los posibles daños del danazol y los inhibidores de aromatasa superan los beneficios esperados, sumado a que ambas terapias tendrían altos costos. Por ende, el GEG decide emitir una recomendación en contra del danazol y los inhibidores de la aromatasa. Dado que la evidencia disponible tenía un nivel de certeza muy bajo, el GEG decide emitir una recomendación condicional para ambas recomendaciones.
Pregunta 6: En mujeres con diagnóstico de endometriosis, ¿se debería indicar tratamiento quirúrgico para el manejo de la enfermedad?
Evidencia: Encontramos tres RS 14,23,24 para esta pregunta, seleccionándose la GPC de NICE 2017 14 para los desenlaces de mejoría del dolor, dismenorrea, y dispareunia; y la RS de Bafort 2020 23 para los desenlaces de dolor, calidad de vida, pérdida de embarazo, y efectos adversos.
Beneficios: Si brindamos cirugía a 1000 personas en comparación de no brindarla, posiblemente mejoraría el dolor a los 6 meses (DM: 0,90 puntos; IC 95% + 0,31 a + 1,49); medido con las puntuaciones globales de dolor general (no se reportó la escala), sin embargo, también muestra que posiblemente no tenga efecto sobre dismenorrea, dispareunia, calidad de vida y pérdida del embarazo cuando no se considera el fenotipo de la endometriosis.
Daños: Si se brinda cirugía a 1000 personas en comparación de no brindarla, no se observaría diferencias entre los eventos adversos como injuria de órgano sólido, vascular, y visceral, necesidad de transfusión sanguínea, e infección.
Recomendación: El GEG evaluó que los beneficios potenciales de la cirugía superarían los posibles riesgos, además de que podría mejorar la equidad, especialmente en mujeres para quienes el tratamiento médico no ha sido efectivo. Por ello, el GEG decide emitir una recomendación a favor. Sin embargo, dado que la certeza de la evidencia fue muy baja y la aceptación entre las pacientes varía, el GEG emitió una recomendación condicional.