INTRODUCCIÓN
El cultivo del "langostino blanco" Litopenaeus vannamei ha sido desarrollado desde la década del 70, y posee una gran importancia económica en la región norte del Perú. Esto ha conllevado al avance tecnológico enfocado en la reproducción en laboratorio (Gutiérrez et al., 2012), así como en programas de mejoramiento genético (Castillo-Juárez et al., 2015) con el objetivo de optimizar su cultivo.
La criopreservación de gametos es de gran relevancia en la acuicultura ya que permite preservar el material genético de variedades de especies de gran valor, y ha sido utilizado de manera exitosa en peces (Figueroa et al., 2016; Tirpan et al., 2016; Cuevas et al., 2017,) en algunos moluscos de los géneros Crassostrea (Yang et al., 2013; Riesco et al., 2017) y Ostrea (Horváth et al., 2012; Hassan et al., 2017), equinodermos como el erizo de mar (Adams y Hessianand, 2004) y en crustáceos como cangrejos (Jeyalectumie y Subramoniam, 1989) y langostas (Fatihah et al., 2016). Mediante la criopreservación es posible preservar los gametos a temperaturas de -196 °C, donde el metabolismo disminuye deteniendo el envejecimiento celular hasta su posterior uso mediante inseminación artificial.
El éxito de los protocolos de criopreservación depende del uso de adecuadas soluciones para la protección celular ante caídas extremas de temperatura y el uso de tasas de congelamiento y descongelamiento óptimos para cada tipo celular. Las soluciones de crioprotección incrementan la sobrevivencia celular ante una reducción de temperatura, así que deben ser mínimamente tóxicos (Barrett y Woodruff, 2010). Algunos de las soluciones más utilizadas en la acuicultura son el DMSO, con una gran eficiencia en gametos de una amplia variedad de especies animales (Bart et al., 2006; Tirpan et al., 2016; Riesco et al., 2017), pero también se han utilizado el metanol, el etilenglicol (Vuthiphandchai et al., 2007; Ciereszko et al., 2014; Wei et al., 2018) y el MgCl , aunque con una frecuencia menor (Memon et al., 2012). Estos compuestos, a su vez, pueden ser utilizados en combinación o en complemento con soluciones de extensión para mejorar la sobrevivencia de las células (Muchlisin et al., 2005). Por ejemplo, el gel de Aloe vera y la yema de huevo fueron utilizados en la criopreservación de esperma de la tilapia roja (Yong et al., 2017), donde la yema de huevo permitió mejores tasas de sobrevivencia.
Además de las soluciones de crioprotección, la velocidad de cambio de la temperatura juega un rol importante para la protección celular en el proceso de congelamiento y descongelamiento. Es así como se han diseñado procedimientos de congelación lenta, los cuales son realizados con ayuda de un equipamiento especial (Baust et al., 2009), y aquellos de congelación rápida también llamados vitrificación (Tavukcuoglu et al., 2012).
En este contexto, el objetivo del presente estudio fue optimizar un protocolo de criopreservación para el espermatóforo y masa espermática del langostino blanco Litopenaeus Vannamei evaluando seis soluciones crioprotectoras y nueve protocolos de congelamiento para la criopreservacion de ambas muestras en nitrógeno líquido.
MATERIALES Y MÉTODOS
Ubicación del Estudio y Langostinos
Los langostinos reproductores L. vannamei con madurez sexual alcanzada fueron provistos por el centro de investigación y desarrollo de poslarvas de langostinos de la empresa Marinasol S.A., ubicada en la región Tumbes, Perú. Los trabajos experimentales con los animales y parte de los análisis fueron desarrollados en sus instalaciones, y otra parte en el laboratorio de la empresa Incabiotec SAC, Tumbes. Se utilizaron langostinos saludables acondicionados en un estanque rectangular de 2 m3 de agua de mar, a temperatura entre 27 y 29 °C. El alimento utilizado fue pellet Vitalis (Skretting), suministrado tres veces al día en complemento con alimento fresco. El peso promedio de los langostinos machos utilizados en el estudio fue de 33.35 g.
Colecta de Espermatóforos y Masa Espermática
Se colectaron 296 espermatóforos de machos maduros mediante la técnica de estimulación manual aplicando una leve presión sobre la base de la esquina exterior de los espermatóforos hasta ser expulsado por el poro genital ubicado en la base del quinto par de periopodos. En el caso de ensayos con masa espermática, estas fueron extraídas con ayuda de unas pinzas a partir de los espermatóforos; es decir, una muestra de masa espermática fue extraída de un espermatóforo.
Los espermatóforos y las masas espermáticas fueron colocados inmediatamente y de forma individual en crioviales de 2 ml conteniendo 500 µl de solución de crioprotección o 250 µl de solución base (grupo en tratamiento) y 500 µl de solución tampón libre de calcio suplementado con vitamina C a 5 mM (grupo control).
Soluciones Crioprotectoras
Se preparó una solución tampón libre de calcio (NaCl 21.63 g/l, KCl 1.12 g/l, H BO, 0.53 g/l, NaOH 0.19 g/l, MgSO, 4.93 g/l) suplementado con vitamina C a 5 mM. Posteriormente, con esta solución se prepararon seis soluciones crioprotectoras de prueba:
Solución 1: 500 µl de una solución de sucrosa a 0.2M y MgCl al 15%. El tiempo de exposición fue de 30 min (Hossain y Osuamkpe, 2007; Memon et al., 2012).
Solución 2: 500 µl de una solución de sucrosa a 0.2M y MeOH al 20%. El tiempo de exposición fue de 30 min (Lezcano et al., 2004; Vuthiphandchai et al., 2007).
Solución 3: 250 µl de una solución de yema de huevo al 10% y sucrosa a 0.2M (medio base) durante 5 min. Luego de la toma de muestra, se adicionó 250 µl de MgCl (Solución stock al 30%) llegando a una concentración final de 15%. El tiempo de exposición fue de 10 min y fue contado a partir de la conformación de la solución crioprotectora según Lezcano et al. (2004) y Memon et al. (2012) con las modificaciones descritas.
Solución 4: 250 µl de una solución de yema de huevo al 10% y sucrosa a 0.2M (medio base) durante 5 min. Luego de la toma de muestra, se adicionó 250 µl MeOH (Solución stock al 20%) llegando a una concentración final de 10%. El tiempo de exposición fue de 10 min y fue contado a partir de la conformación de la solución crioprotectora según Lezcano et al. (2004) y Vuthiphandchai et al. (2007) con las modificaciones descritas.
Solución 5: 250 µl de una solución de gel de Aloe vera al 10% y sucrosa a 0.2M (medio base) durante 5 min. Luego de la toma de muestra, se adicionó 250 µl de MgCl (Solución stock al 30%) llegando a una concentración final de 15%. El tiempo de exposición fue de 10 min y fue contado a partir de la conformación de la solución crioprotectora según Memon et al. (2012), Melo et al. (2015) y Yong et al. (2017) con las modificaciones descritas.
Solución 6: 250 µl de una solución de suero fetal bovino al 10% y sucrosa a 0.2M (medio base) durante 5 min. Luego de la toma de muestra, se adicionó 250 µl de MgCl (Solución stock al 30%) llegando a una concentración final de 15%. El tiempo de exposición fue de 10 min y fue contado a partir de la conformación de la solución crioprotectora según Memon et al. (2012) y Mizuno et al. (2018) con las modificaciones descritas.
Como grupo control se utilizaron muestras frescas inmersas en solución tampón libre de calcio suplementada con vitamina C a 5 mM.
Posteriormente, las muestras en solución crioprotectora fueron colocados en un criocongelador programable (ASYMPTOTE-VIA Freeze Research), donde la temperatura descendió desde 25 °C hasta -35 °C utilizando una tasa de 2 °C/min. Se mantuvieron en dicha temperatura durante 5 min y luego se colocaron en nitrógeno líquido (196 ºC) por 1 h para la selección de la solución crioprotectora óptima. Transcurrido el tiempo de almacenamiento en nitrógeno líquido, las muestras fueron descongeladas en baño maría a 20 °C por 4 min para proceder a la evaluación de la viabilidad espermática. En este ensayo se utilizaron cuatro espermatóforos y cuatro masas espermáticas por tratamiento.
Curvas de Congelamiento
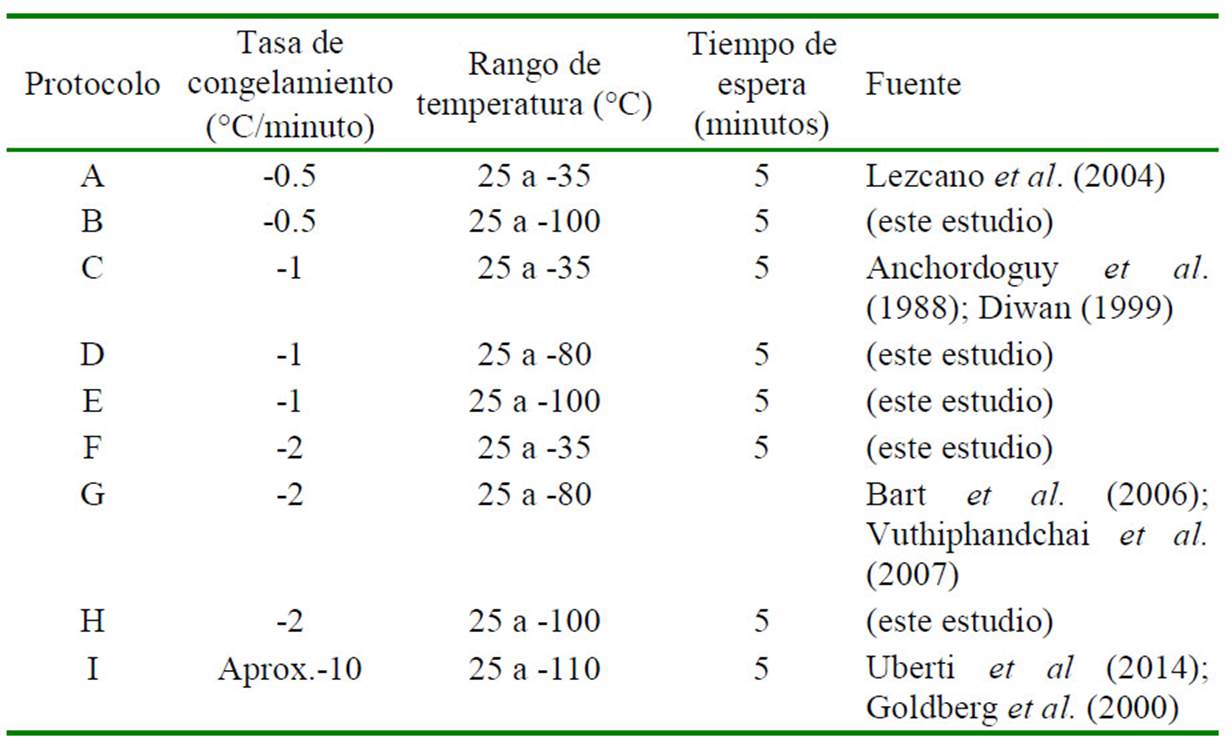
A partir del ensayo anterior se seleccionaron las dos soluciones de crioprotección con mayor éxito en la preservación de las células espermáticas de langostino. Para determinar el mejor protocolo de criopreservación se prepararon las muestras con ambas soluciones, como fue indicado en el ensayo previo. Se evaluaron nueve protocolos de congelación, siendo ocho de congelación lenta utilizando el criocongelador y uno de naturaleza semirápida por exposición de las muestras en vapor de nitrógeno líquido (Cuadro 1). Al final del mantenimiento de las muestras en la temperatura más baja, las muestras fueron almacenadas en nitrógeno líquido a -196°C.
Los crioviales fueron almacenados en nitrógeno líquido por 24 h. El descongelamiento de las muestras se realizó a 35 °C por 4 min. Como grupo control se utilizaron muestras frescas inmersas en solución tampón libre de calcio suplementada con vitamina C a 5 mM. En este ensayo se utilizaron seis espermatóforos y seis masas espermáticas por tratamiento.
Viabilidad Espermática
Los crioviales fueron descongelados y centrifugados a 1500 rpm por 5 min y se retiró la solución crioprotectora. En el caso de la masa espermática se resuspendió el pellet directamente en 200 µl de sucrosa a 0.2 M y se dejó por 10 min para permitir la hidratación celular. En el caso de espermatóforos se adicionaron 200 µl de sucrosa a 0.2 M dejando reposar por 1 min, luego se extrajo la masa espermática y se resuspendió en la misma solución por 10 min.
La evaluación de la viabilidad espermática fue realizada mediante la tinción eosina-nigrosina (eosina Y al 5% y nigrosina al 10%) y observación al microscopio (Vuthiphandchai et al., 2007). Un volumen de 10 µl de células espermáticas fueron colocados en una lámina con 5 µl de colorante y se dejó secar a temperatura ambiente durante 30 s. Las lecturas se realizaron en microscopio óptico a 400X y se contaron 250 células espermáticas. El cálculo de la viabilidad espermática (ASV) se realizó según la fórmula: ASV (%) = (N° de células viables/N° total de células contadas) x 100. Se consideró la presencia de la "espina" en las células espermáticas como señal de viabilidad según refiere Lezcano et al. (2004).
Análisis de Datos
Los datos de la viabilidad espermática fueron evaluados mediante un análisis de varianza de dos vías usando un nivel de significancia de p<0.05 y las diferencias entre tratamientos para los ensayos de soluciones crioprotectoras y de curvas de congelamiento fueron evaluadas mediante el método de Tukey y Duncan. Los datos fueron expresados como promedio ± desviación estándar. El programa utilizado para el análisis fue SPSS 21.
RESULTADOS
Solución de Crioprotección
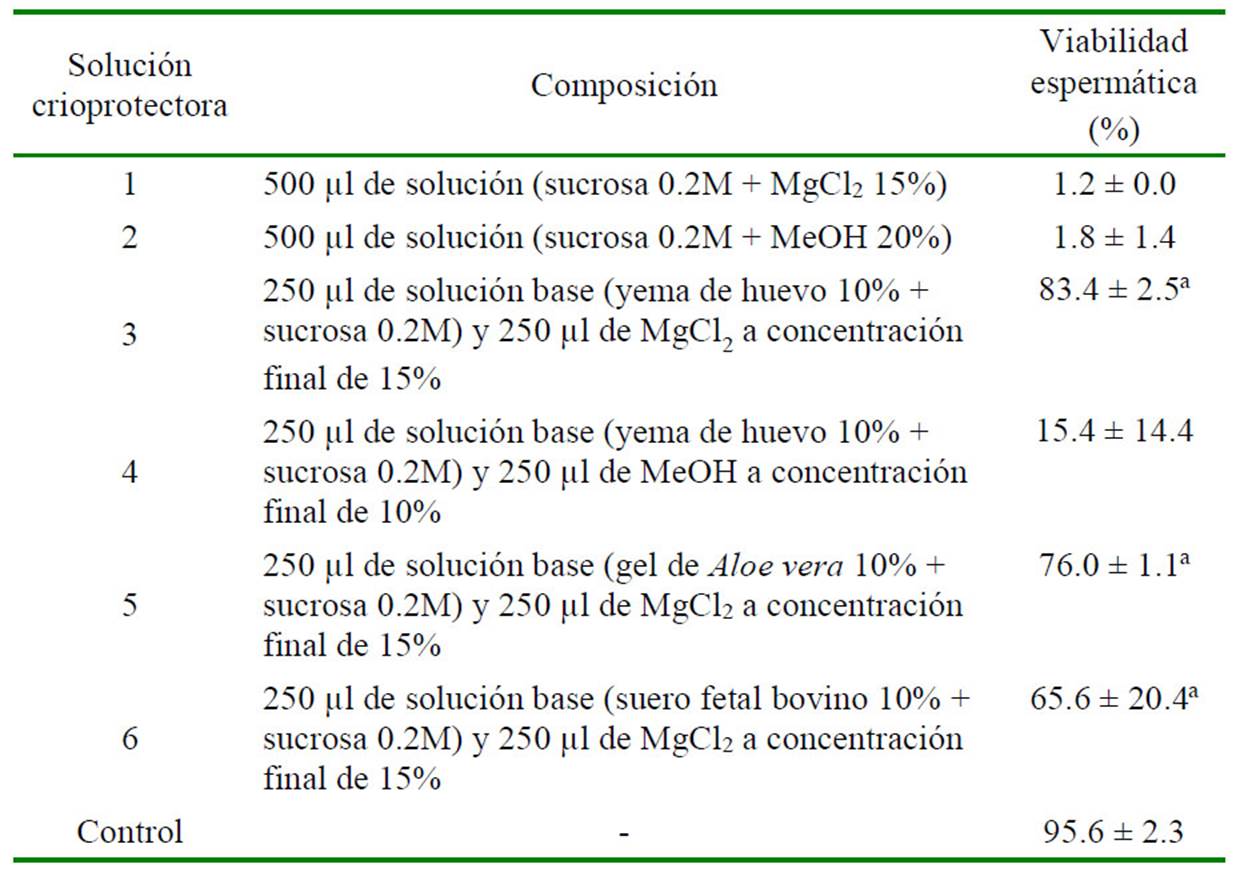
Las evaluaciones realizadas con los espermatóforos (Cuadro 1) y con las masas espermáticas (Cuadro 2) indican que los grupos tratados con las soluciones 3, 5 y 6 presentaron tasas de viabilidad estadísticamente semejantes al grupo control (no congelado), en tanto que las dos soluciones con metanol tuvieron una nula o baja vialibilidad y significativamente diferente al grupo control (p<0.05) (Cuadro 1).
Cuadro 2 Efecto de seis soluciones crioprotectoras sobre la viabilidad espermática (promedio ± DE) en espermatóforos de Litopenaeus vannamei

a Valores con mayor viabilidad espermática y que no presentan diferencias significativas respecto al control (p>0.05)
El grupo control consiste en espermatóforo frescos
Las soluciones 3, 5 y 6 mostraron el mayor grado de preservación de la viabilidad, tanto para espermatóforos como para masa espermática. En el sentido de la selección de una solución crioprotectora óptima tanto para espermatóforos como para masa espermática la solución 6 no fue considerada en los siguientes ensayos debido a la gran desviación estandar mostrada en masa espermática, a diferencia de la solución 3 y la solución 5 con las cuales se obtuvieron porcentajes de viabilidad semejantes y óptimas en ambas muestras.
Criopreservación
El estudio del efecto de las nueve curvas de congelamiento fue realizado para las muestras de espermatóforo y de masa espermática con la solución 3 (yema de huevo 10%, sucrosa 0.2M y MgCl 15%) y la solución 5 (gel de Aloe vera 10%, sucrosa 0.2M y 250 µl de MgCl, 15%.
El protocolo de congelación C (-1 °C/min desde 25°C hasta -35°C) utilizando la solución con gel de Aloe vera obtuvo el mayor porcentaje de viabilidad espermática con espermatóforos (83.00 ± 7.25%) y fue estadísticamente similar al grupo control no congelado (97.53 ± 5.04%). Por otro lado, los demás protocolos de congelación presentaron valores significativamente inferiores al grupo control (p<0.05) (Cuadro 3).
Cuadro 3 Efecto de seis soluciones crioprotectoras sobre la viabilidad espermática (promedio ± DE) en la masa espermática de Litopenaeus vannamei
a Valores con mayor viabilidad espermática y que no presentan diferencias significativas respecto al control (p>0.05)
El grupo control consiste en espermatóforo frescos
En el ensayo con la masa espermática utilizando la solución que contenía el gel de Aloe vera, se encontró que el protocolo F (-2 °C/min desde 25°C hasta -35°C) presentó el mayor porcentaje de viabilidad espermática (79.00 ± 18.36%) y sin diferencia significativa con el grupo control no congelado (94.67 ± 10.35%). Por otro lado, los demás protocolos de congelación presentaron valores significamente inferiores al grupo control (p<0.05) (Cuadro 4).
Cuadro 4 Efecto de nueve protocolos de congelamiento sobre la viabilidad espermática del espermatóforo usando la Solución 51
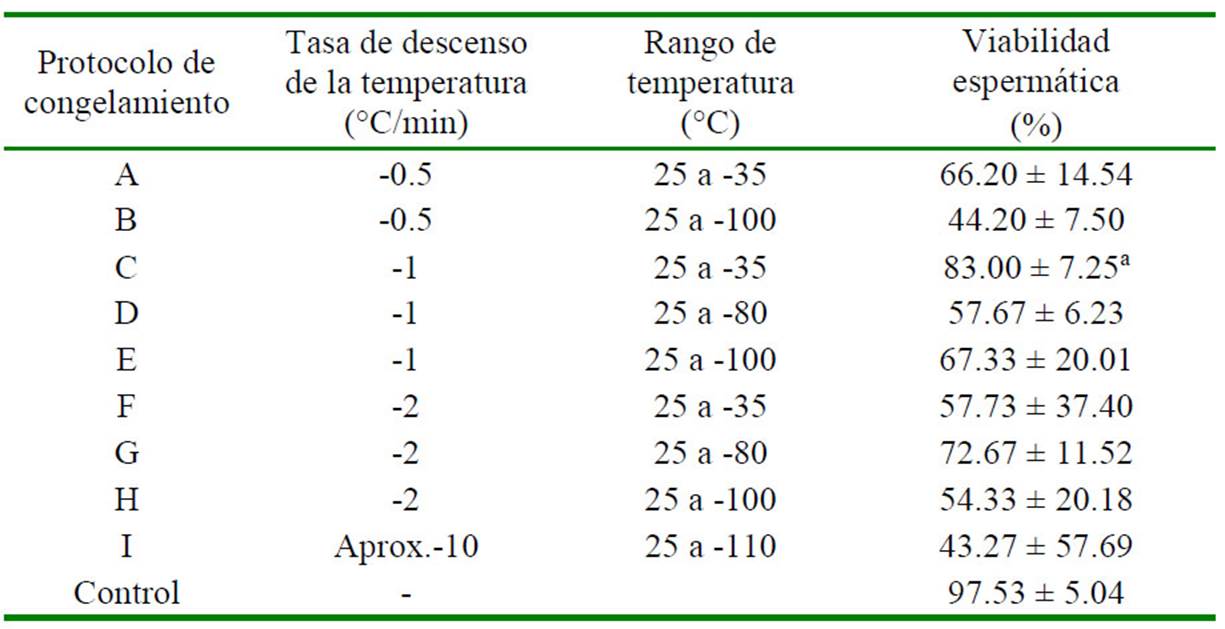
1 250 µl de solución base (gel de Aloe vera 10% + sucrosa 0.2M) y 250 µl de MgCl2 a concentración final de 15%
a Valor con mayor viabilidad espermática y que no presentan diferencias significativas respecto al control (p>0.05)
El grupo control consiste en espermatóforo frescos
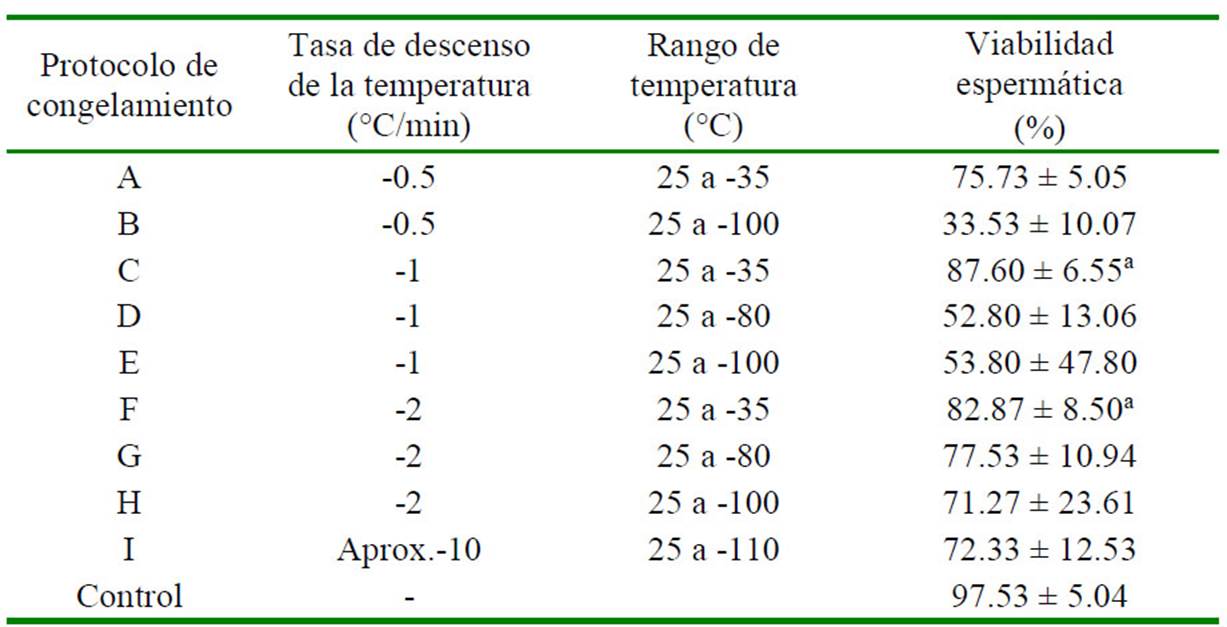
En los ensayos que utilizaron la yema de huevo dentro de la solución crioprotectora para la congelación de las muestras de espermatóforo se obtuvo un mayor porcentaje de viabilidad cuando se congelaron las muestras con el protocolo C (-1 °C/min desde 25 °C hasta -35 °C), obteniendo 87.6 ± 6.55% de viabilidad espermática luego de la congelación, y sin diferencia significativa con el grupo control no congelado (97.53 ± 5.04%); mientras que los demás tratamientos presentaron valores significativamente inferiores (p<0.05) con excepción del protocolo F (82.87 ± 8.5 %) (Cuadro 5).
Cuadro 5 Efecto de nueve protocolos de congelamiento sobre la viabilidad espermática de la masa espermática usando la Solución 51
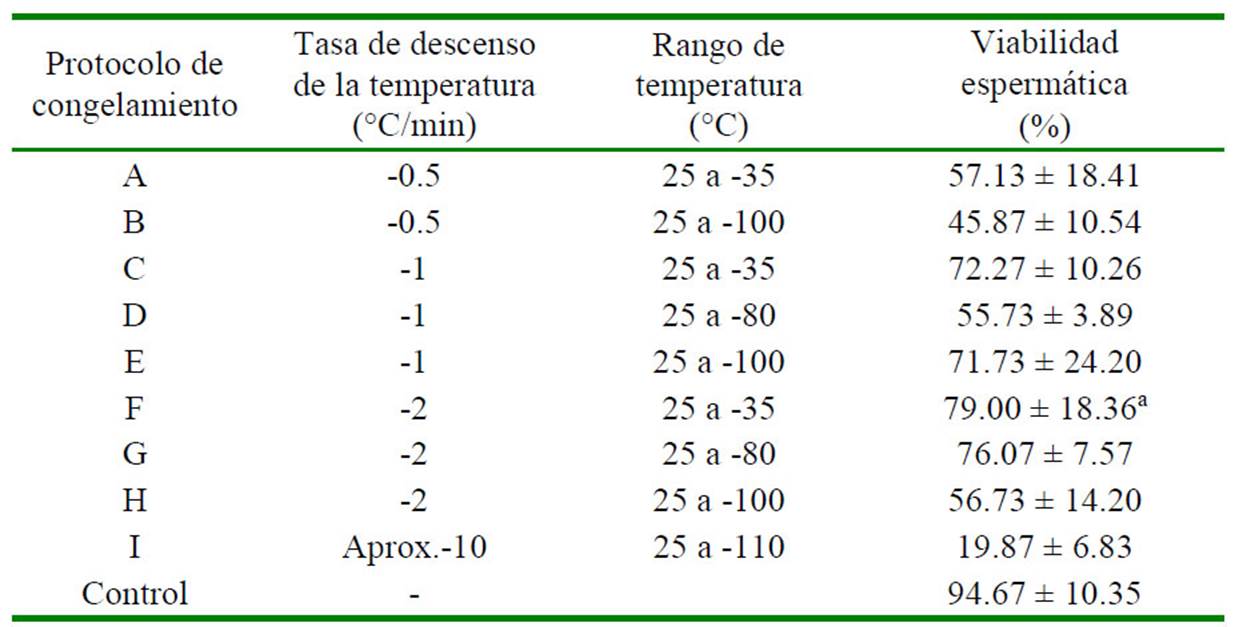
1 250 µl de solución base (gel de Aloe vera 10% + sucrosa 0.2M) y 250 µl de MgCl2 a concentración final de 15%
a Valor con mayor viabilidad espermática y que no presentan diferencias significativas respecto al control (p>0.05)
El grupo control consiste en espermatóforo frescos
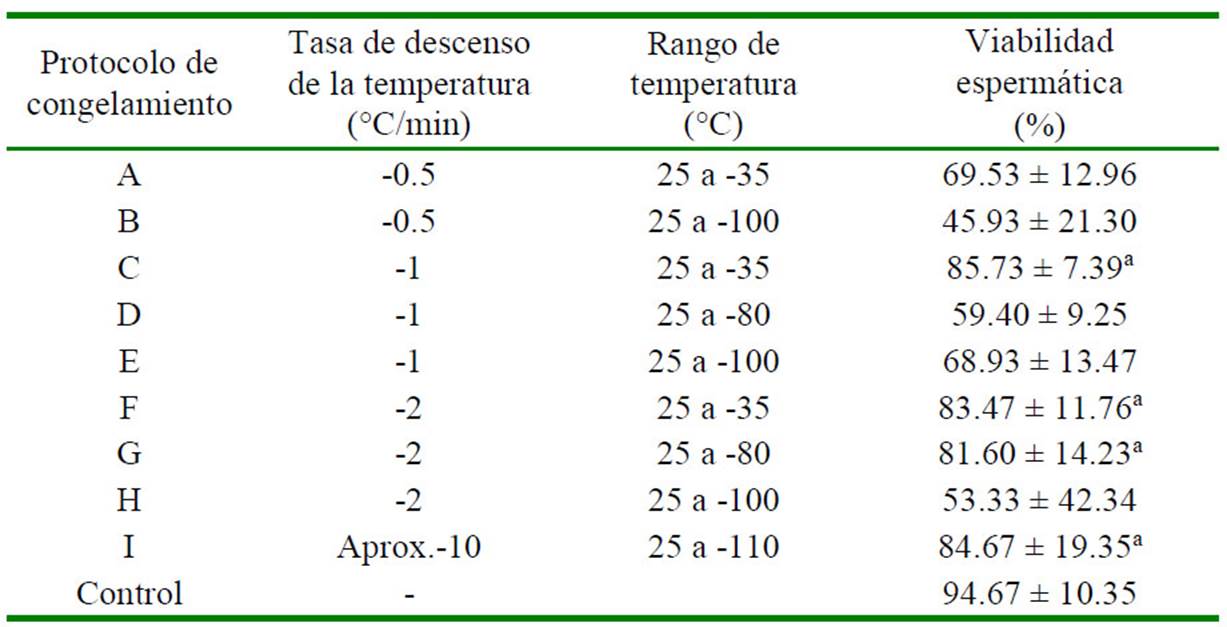
En el caso de las muestras de masa espermática congeladas utilizando la solución con yema de huevo, el protocolo C presentó igualmente el mayor porcentaje de viabilidad espermática pos-congelación (85.73 ± 7.39%), aunque estadísticamente similar a los resultados de los protocolos F, G e I (Cuadro 6 y Cuadro 7).
Cuadro 6 Efecto de nueve protocolos de congelamiento sobre la viabilidad espermática del espermatóforo usando la Solución 31
1 250 µl de solución base (gel de Aloe vera 10% + sucrosa 0.2M) y 250 µl de MgCl2 a concentración final de 15%
a Valor con mayor viabilidad espermática y que no presentan diferencias significativas respecto al control (p>0.05)
El grupo control consiste en espermatóforo frescos
Cuadro 7 Efecto de nueve protocolos de congelamiento sobre la viabilidad espermática de la masa espermática usando la Solución 31
1 250 µl de solución base (gel de Aloe vera 10% + sucrosa 0.2M) y 250 µl de MgCl2 a concentración final de 15%%
a Valor con mayor viabilidad espermática y que no presentan diferencias significativas respecto al control (p>0.05)
El grupo control consiste en espermatóforo frescos
DISCUSIÓN
Los resultados obtenidos en este estudio muestran el éxito en la preservación en nitrógeno líquido a corto plazo de espermatóforos y masa espermática del langostino Litopenaeus vannamei. La mayoría de los estudios enfocados en la preservación del esperma de langostinos emplea el espermatóforo como muestra; así en Penaeus monodon (Bart et al., 2006), Litopenaeus vannamei (Uberti et al., 2014), Machrobrachium rossenbergii (Valentina et al., 2016) y Penaeus merguiensis (Memon et al., 2012), aunque también se ha utilizado la masa espermática para el congelamiento (Castelo et al., 2015) con altos valores de viabilidad luego de una vitrificación. Por otro lado, algunos estudios compararon la congelación del espermatóforo, masa espermática y células en suspensión (Lezcano et al., 2004; Salazar et al., 2008), encontrando que la masa espermática soporta mejor los tratamientos de congelación, posiblemente debido a que en la suspensión espermática hay una mayor exposición conduciendo a una mayor toxicidad para las células, mientras que el ingreso a las células en los espermatóforos puede ser heterogéneo al estar demasiado protegidas. No obstante, en el presente estudio no hubo diferencias notables en la viabilidad espermática obtenida entre el grupo de espermatóforo y de masas espermáticas.
Además del tipo de muestra, las soluciones de criopreservación son de gran importancia debido a las propiedades fisicoquímicas que poseen, protegiendo las células en el proceso de congelamiento. En el presente trabajo se evaluaron soluciones de criopreservación basadas en el uso del metanol al 20% y de MgCl, al 15% más sucrosa 0.2M, comparando su efecto con las mismas soluciones en conjunto de aditivos (gel de Aloe vera y yema de huevo). Los resultados muestran una relativa mayor viabilidad espermática al utilizar MgCl, con yema de huevo (Solución 3) con porcentajes de viabilidad mayores al 80% en muestras de espermatóforo y masa espermática. Luego, se observaron valores altos de viabilidad utilizando MgCl, con suero fetal bovino (Solución 6), pero solo en el congelamiento de espermatóforos (80 ± 1.7%), a diferencia del uso de MgCl, con gel de Aloe vera (Solución 5), el cual mostró niveles altos de viabilidad espermática en ambos tipos de muestras.
A pesar de que el metanol es considerado citotóxico a temperatura ambiente (Arun y Subramoniam, 1997), es uno de los agentes crioprotectores más comunes, ya que debido a su pequeño tamaño molecular penetra rápidamente la membrana celular a bajas temperaturas propiciando así una rápida deshidratación celular, evitando el daño por la formación de cristales en el interior celular (Hubalek, 2003). El metanol ha sido utilizado como solución crioprotectora de manera exitosa en la preservación de la masa espermática o espermatóforo de L. vannamei (Lezcano et al., 2004; Vuthiphandchai et al., 2007) sobre otros reactivos como DMSO, etilenglicol, propilenglicol o formamida. Así también, se demostró una alta viabilidad espermática luego de una vitrificación de la masa espermática de L. vannamei utilizando el metanol al 10% como crioprotector (Castelo et al., 2015). Por otro lado, Salazar et al. (2008) demostraron que no existieron diferencias significativas cuando se comparó su efecto con el DMSO y glicerol en masa espermática de L. vannamei. Sin embargo, otros estudios han mostrado menor capacidad de preservación espermática en langostinos (Memon et al., 2012; Valentina et al., 2016).
El MgCl, ha sido menos reportado que el metanol como agente de criopreservación, siendo mencionado en un estudio en P. merguiensis superando a otros agentes protectores en capacidad de preservación espermática (Memon et al., 2012). De manera distinta, el MgCl, ha sido utilizado principalmente como parte de diluyentes celulares previos a la congelación en especies acuícolas (Babiak et al., 1997; Diwan y Kandasami, 1997; Zhang et al., 2003; Yavap et al., 2014) para mantener estables las condiciones extracelulares. En el presente estudio se encontraron regulares niveles de viabilidad usando el MgCl, con sucrosa (52.0 ± 23.2%), pero esto pudo ser debido a las propiedades crioprotectoras intrínsecas de la sucrosa (Hossain y Osuamkpe, 2007).
En el caso de los aditivos utilizados dentro de las soluciones de criopreservación, el gel de Aloe vera ha sido empleado por la presencia de azúcares que podrían beneficiar la protección de tipo extracelular frente a un congelamiento (Hu et al., 2009; Chauhan et al., 2014), además de contener antioxidantes como ácido fólico y zinc, que protegen a las células de procesos apoptóticos por el congelamiento (Pfeifer et al., 2001). Se ha reportado su uso en criopreservación de semen de pecarí y de cerdos en concentraciones de 20 y 10%, respectivamente (Souza et al., 2016; Guachun 2017), así como en la preservación de esperma del pez tambaqui (Colossoma macropomum), aunque en este caso los resultados mostraron una baja viabilidad que en combinacion con DMSO (Melo et al., 2015). En el presente estudio, la solución crioprotectora conformada por gel de Aloe vera junto con MgCl, (solución 5) mostró mejores resultados de viabilidad en masa espermática y espermatóforo en comparación a la solución con solo MgCl, (Solución 1).
Diversos estudios han demostrado que la yema de huevo en bajos porcentajes es muy considerada en la criopreservación debido a su composición de lípidos, proteínas y apopoliproteínas, las cuales pueden formar agregados dentro de una consistencia gelatinosa provocada por el plasma y los gránulos, a temperaturas de congelación, evitando la formación de cristales en las primeras etapas del congelamiento (Au et al., 2015). Este aditivo ha sido empleado en la criopreservación de esperma de pez gato africano (Clarias gariepinus) mostrando una alta tasa de fertilización y de eclosión (Muchlisin et al., 2015). Además, en el pez barbo plateado (Barbonymus gonionotus) se determinó que la conservación del esperma a -34 °C por 24 h resultó con alta viabilidad y movilidad (Abinawanto & Lestari 2013). Los resultados obtenidos en el presente trabajo están de acuerdo con lo anteriormente descrito, ya que la solución con yema de huevo al 10% permitió una viabilidad espermática estadísticamente similar al control y colocándola como un aditivo mejor que el gel de Aloe vera.
El suero fetal bovino (FBS) es convencionalmente incluido en las soluciones de criopreservación debido a que contiene una mezcla de factores de crecimiento y sustancias indefinidas (Tae et al., 2017) que potencian la supervivencia de los espermatozoides durante del proceso de criopreservación y descongelamiento (Yong et al., 2014). Se ha reportado su uso como agente crioprotector a concentraciones entre 10 a 20% lo cual se considera recomendable, dado que una mayor concentración presenta efectos negativos sobre la movilidad espermática (Mizuno et al., 2018). En este trabajo se utilizó FBS al 10% junto a sucrosa a 0.2M y MgCl, a concentración final 15% (Solución 6) obteniendo un porcentaje de viabilidad de 80.0 ± 1.7 (espermatóforos) y 65.6 ± 20.4 (masa espermática), estadísticamente semejante a los valores obtenidos con las soluciones seleccionadas. La gran desviación estándar en masa espermática podría relacionarse a la presencia de citocinas en FBS, lo cual podría inducir reacciones a nivel celular (Seah Park et al., 2018) generando inestabilidad en los resultados.
Los ensayos de evaluación de curvas de congelación demostraron mayor viabilidad espermática con tasas de descenso de temperatura hasta -35 °C, antes de ser sumergidas las muestras en nitrógeno líquido (protocolos C y F), a diferencias de los demás protocolos que permiten el descenso controlado hasta temperaturas mayores. Esto es acorde con el hecho de que una velocidad lenta de congelamiento podría generar mayor daño a nivel celular (Woods et al., 2004). Otros trabajos han reportado resultados concordantes con el uso de tasas pequeñas de enfriamiento, aunque no tanto con las temperaturas intermedias alcanzadas, tales como la preservación de espermatóforo de M. rosenbergii con una tasa de congelamiento de -1.5 °C/ min hasta -39°C logrando 64% de viabilidad (Valentina et al., 2016), de 2°C/min hasta de -80 °C en células espermáticas de espermatóforo de P. monodon (Vuthiphandchai et al., 2007) y de una tasa de enfriamiento entre 1.5 y 2.5°C hasta alcanzar 70 °C con espermatóforos de M. rosenbergii logrando una viabilidad mayor de 80% (Akarasanon et al., 2004). Sin embargo, otros autores han mostrado que el uso de tasas mayores de descenso de temperatura también puede ser efectivo; así Arun y Subramoniam (1997) utilizaron con éxito tasas de -5°C/min hasta -39°C.
CONCLUSIONES
El espermatóforo y la masa espermática del langostino L. vannamei pueden ser criopreservados utilizando una solución crioprotectora constituida por MgCl al 15%, sucrosa 0.2 M y gel de Aloe vera al 10% o yema de huevo al 10%.
Las tasas de congelamiento de -1 °C/min -2 °C/min a una temperatura inicial de 25°C y llegando hasta -35°C son eficientes para la congelación del espermatóforo y la masa espermática en nitrógeno líquido (-196 °C)












 uBio
uBio