INTRODUCCIÓN
La mastitis constituye una reacción inflamatoria de los tejidos de la ubre que se origina por numerosos mecanismos, incluyendo infecciones microbianas, afecciones mecánicas, químicas, termales o traumáticas (Seegers et al., 2003). En particular, la mastitis infecciosa, un padecimiento común en vacas lecheras, resulta en cuantiosas pérdidas económicas. El impacto económico directo se debe principalmente a la disminución en la producción lechera, cambios en la composición química de la leche, o al sacrificio temprano de los animales, mientras que las indirectas pueden ser más difíciles de evaluar, pero se asocian con costos de tratamiento o atención veterinaria (Gianneechini et al., 2002; Guimarães et al., 2017). Aun cuando las pérdidas económicas pueden ser un factor limitante para las explotaciones lecheras, la mastitis, especialmente la clínica, constituye además un serio problema para el bienestar animal, ya que se relaciona con intenso dolor y afectación de la calidad de vida (Leslie y Petersson, 2012).
Bacterias como Staphylococcus aureus, Streptococcus agalactiae (Strep. agalactiae), Strep. uberis, Strep. dysgalactiae y Escherichia coli se encuentran entre los más frecuentes en casos de mastitis (Reyher et al., 2012). Sin embargo, otros agentes etiológicos relacionados con esta patología pueden ser, en ocasiones subestimados, tales como Bacillus spp o Staphylococcus coagulasa negativa, microorganismos considerados como agentes productores de mastitis medioambiental, término acuñado para referirse a mastitis no contagiosas (Pyörälä, 2002). Este hecho sugiere que el tratamiento enfocado en el agente etiológico más probable (S. aureus, Strep. agalactiae, Strep. uberis, Strep. dysgalactiae o E. coli) puede ser en realidad una de las razones por la que los tratamientos fracasan y favorecen la aparición de bacterias resistentes (Reyher et al., 2012).
Por otro lado, las medidas de manejo para evitar o mitigar la mastitis en explotaciones lecheras forman parte de un complejo de medidas de control que requiere un profundo conocimiento de patrones epidemiológicos de mastitis (Sears y McCarthy, 2003; Hogeveen et al., 2021), en oposición a la terapia antimicrobiana.
Antibióticos de amplio uso en las ganaderías como los betalactámicos (penicilina y cefalosporina), tetraciclinas yaminoglucósidos (gentamicina), surgieron como una alternativa rápida, efectiva y segura para el tratamiento de la mastitis (Ying et al., 2009; Tomanic et al., 2023). Sin embargo, su uso frecuente e indiscriminado ha causado el surgimiento de bacterias multirresistentes (Escobar et al., 2022), que no solo comprometen la estabilidad económica de las explotaciones lecheras, sino que son un serio riesgo para la salud pública, animal y medioambiental (Demirci, 2023).
Las explotaciones lechereas de Ecuador comprenden en su mayoría predios familiares o de pequeña escala (Instituto Nacional de Estadística y Censos del Ecuador, 2010), y se desconoce mayormente la situación de la mastitis en comunidades campesinas, en donde las limitaciones económicas limitan la tecnificación de la producción o un manejo basado en evidencias (Hogeveen et al., 2021). Al considerar que la ganadería es una de las principales actividades de las familias campesinas, el objetivo de este estudio fue determinar la etiología de mastitis bovina, así como determinar su susceptibilidad a los agentes antibióticos más usados (penicilina, tetraciclina, gentamicina y cefalexina) en la Comunidad Tunshi -San Nicolás de la Provincia de Chimborazo - Ecuador.
MATERIALES Y MÉTODOS
Prevalencia de Mastitis
El estudio se llevó a cabo en la Comunidad Tunshi -San Nicolás de la parroquia Licto, provincia de Chimborazo, Ecuador, siendo el primer estudio realizado en el sector sobre producción bovina lechera, con una población indígena de bajos recursos, y con un manejo ganadero empírico, sin mayor orientación profesional. Se desconoce en esta población los tiempos de retiro de los medicamentos aplicados, especialmente de la penicilina. Del total de bovinos (n= 180 vacas) se seleccionaron las 90 vacas que se encontraban en lactación. Estas eran vacas multíparas con edades entre 4 y 7 años, cruce de criollo y Holstein Friesian. Las hembras presentaban producciones de 5 a 10 L/día, dividido en un ordeño en la mañana y otro en la tarde.
Se utilizó la prueba diagnóstica de California Mastitis Test (C.M.T® Laboratorios Life, Ecuador). Para esto, tras descartar el primer chorro de leche, se mezcló el reactivo CMT (2 ml) con un volumen igual de leche por 10 s en la paleta de prueba y se registraron los resultados dentro de los 20 s posteriores según las pautas del Consejo Nacional de Mastitis: 0 (negativo), trazas (sospechoso), 1+ (positivo débil), 2+ (positivo medio) y 3+ (positivo fuerte) (NMC, 2017). Cada cuarto fue evaluado por separado. Para calcular la prevalencia de mastitis, cada animal fue considerado como positivo si al menos un cuarto de la glándula mamaria resultó afectado.
Cultivo y Aislamiento Bacteriológico
Se tomaron muestras de leche de cada cuarto positivo a la prueba de CMT. Para ello, las ubres fueron lavadas con agua limpia y secadas con papel absorbente de un solo uso. Se descartó los cinco primeros chorros, se limpió la abertura del pezón con alcohol al 70% y se dejó secar. Finalmente, se colectó 10 ml de leche en tubos estériles con tapa y transportados a 4 °C en cajas isotérmicas hasta el Laboratorio de Biotecnología y Microbiología Animal «LABIMA» de la Facultad de Ciencias Pecuarias de la Escuela Superior Politécnica de Chimborazo (ESPOCH) para los análisis respectivos.
Los microorganismos relacionados con la mastitis fueron detectados utilizando pruebas estándar de laboratorio. Las muestras fueron sembradas en agar sangre (Agar Columbia - Difco, EE. UU.) enriquecido con 5% de sangre estéril de cordero y MacConkey (Difco, EE. UU.) e incubadas en un medio aeróbico a 37 °C durante 48 horas. Posteriormente se realizaron subcultivos para la caracterización morfológica y bioquímicas, basadas en Tinción Gram y pruebas bioquímicas, incluyendo oxidasa, catalasa, citrato y ureasa.
Prueba in vitro de Sensibilidad a los Antibióticos
El análisis de sensibilidad y resistencia bacteriana a los antibióticos se efectuó usando el protocolo Kirby-Bauer. En breve, los cultivos fueron esparcidos en agar Mueller-Hinton y la susceptibilidad a los siguientes antibióticos fue determinada: Penicilina G (PG, 10 unidades/disco), Tetraciclina (TC, 30 µg/disco), Gentamicina (GM, 30 µg/disco) y Cefalexin (30 µg/disco). Las zonas de inhibición se midieron tras 18 horas de incubación a 37 °C y los resultados fueron leídos de acuerdo con la escala de McFarland. Los resultados fueron expresados en términos de susceptible o resistente.
RESULTADOS
Prevalencia de mastitis
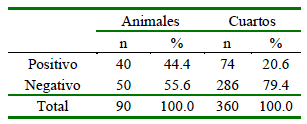
De las 90 vacas evaluadas, 40 (44.4%) resultaron positivas para la prueba CMT (Cuadro 1). La mayor parte de los animales (n = 20) estuvieron afectados en un solo cuarto, en tanto que 10 de ellas resultaron positivas en dos cuartos, 8 en tres cuartos y 2 en los cuatro cuartos.
Cuadro 1. Prevalencia de mastitis diagnosticadas mediante CMT según el total de vacas Holstein mestizas y total de cuartos mamarios en la Comunidad Tunshi San Nicolás, Chimborazo (n=90 vacas)
En el Cuadro 2 se presenta la frecuencia de mastitis subclínica por cuartos mamarios. La mayor parte de animales sufrió el proceso de mastitis en el cuarto posterior izquierdo (27.8%), seguido del cuarto posterior derecho (23.3%), no habiendo diferencias significativas entre cuartos posteriores.
Cuadro 2. Prevalencia de mastitis según el cuarto mamario en vacas Holstein mestizas de la Comunidad Tunshi San Nicolás, Chimborazo
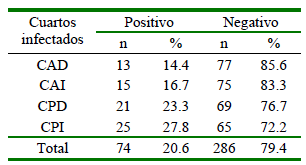
CAD: cuarto anterior derecho; CAI: cuarto anterior izquierdo; CPD: cuarto posterior derecho; CPI: cuarto posterior izquierdo
Cultivo y asilamiento bacteriológico
Los principales agentes etiológicos de mastitis resultantes del análisis microbiológico fueron Staphylococcus spp (84.1%), Escherichia spp. (73.8%), Klebsiella spp. (26.2%) y Streptococcus spp. (15.9%) (Cuadro 3).
Cuadro 3. Géneros bacterianos aislados de las muestras de leche de bovinos de la Comunidad Tunshi San Nicolás, Chimborazo (n= 40 vacas Holstein mestizas positivas / 74 cuartos mamarios positivos)
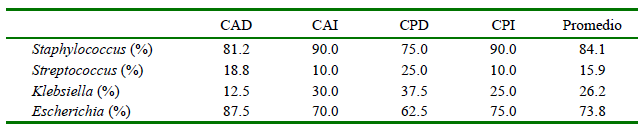
CAD: cuarto anterior derecho; CAI: cuarto anterior izquierdo; CPD: cuarto posterior derecho; CPI: cuarto posterior izquierdo
Prueba in vitro de sensibilidad a los antibióticos
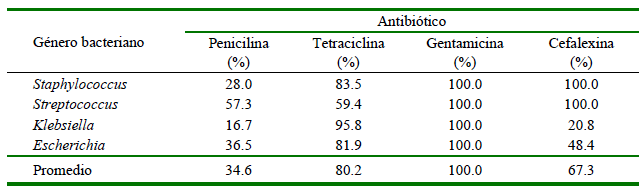
Los antibióticos con altos índices de sensibilidad fueron la gentamicina (100%) y la tetraciclina (80.2%) (Cuadro 4). Estos resultados indicaron que el mayor porcentaje de resistencia fue para la penicilina con 65.4% y para cefalexina y tetraciclina, aunque en porcentajes inferiores al 50%. La gentamicina y la cefalexina fueron sensibles en los aislados de bacterias Gram positivas (Staphyloccocus spp. y Streptococcus spp.), mientras que solo la gentamicina tuvo efecto en los aislados de bacterias Gram negativas (Klebsiella spp. y Escherichia spp.) (Cuadro 4).
DISCUSIÓN
La mastitis bovina es una de las enfermedades más comunes del ganado lechero del Ecuador. Su prevalencia varía según la zona geográfica. De acuerdo con este estudio, la prevalencia de mastitis subclínica en Chimborazo fue de 44.4%, mientras que en otras provincias como Pichincha (Mazón et al., 2023), Los Ríos (Sánchez et al., 2020) o el Oro (Amer et al., 2018) se han reportado prevalencias de 36.8, 52.2 y 72.0%, respectivamente. De igual forma, en países latinoamericanos se han reportado valores variables como en Colombia de 31.4% (Salamanca et al., 2023) y en Perú de 51% (Alvarado et al., 2019), dependiendo del tipo y manejo animal y de los factores medioambientales existentes en cada región.
Los cuartos mamarios más afectados fueron los cuartos posteriores en comparación a los cuartos anteriores, resultados concordantes con los estudios de Gómez et al. (2015) y Bonifaz y Conlago (2016). Las razones detrás de este evento incluyen el mayor contacto con heces, los golpes con los corvejones ocasionados al caminar y el almacenamiento de mayor cantidad de leche (Yera y Ramírez, 2016).
Los agentes causales de las mastitis detectadas fueron bacterias de los géneros Staphylococcus spp, Escherichia spp., Klebsiella spp. y Streptococcus spp., especialmente por los dos primeros con 84.1% y 73.8%. En el estudio de Balemi et al. (2021) también se identificó mayor prevalencia de Staphylococcus spp. (79.8%) y Escherichia spp. (9.4%); sin embargo, otros autores han indicado índices altos de Staphylococcus spp. y Streptococcus spp. (Saidi et al., 2013; Tegegne et al., 2020; Girma y Tamir, 2022).
Para el tratamiento de la mastitis se utilizan generalmente diferentes grupos de antibióticos como son los betalactámicos, las tetraciclinas y los aminoglucósidos. En este estudio se probaron cuatro fármacos (penicilina, cefalexina, tetraciclina y gentamicina), con resultados de 100% de sensibilidad para todos los gérmenes para la gentamicina y de 80.2% para la tetraciclina. En cambio, cerca del 65.4% de los aislados fueron resistentes a la penicilina. Estos resultados puede ser producto del uso prolongado e indiscriminado que se da a estos medicamentos antimicrobianos (Balemi et al., 2021).
Para Staphylococcus spp., el principal agente etiológico de la mastitis subclínica, los antibióticos más eficientes fueron la gentamicina (100%) y la cefalexina (100%) y el menos eficiente la penicilina (28.0%). Es importante indicar que la resistencia a los betalactámicos puede estar mediada a través de dos mecanismos la producción de betalactamasas (Naranjo y Slowey, 2023) o la formación de biopelículas (Oliveira et al., 2007).
En una investigación realizada también en el sector Tunshi, Chimborazo, Maldonado et al. (2022) encontraron que los antibióticos con mejores niveles de sensibilidad para Staphylococcus fueron la tetraciclina (86.1%) y la penicilina (36.1%), posiblemente debido al adecuado y controlado suministro de estos dentro de la explotación ganadera. En contraste a ello, Lämmler et al. (2011) manifiestan que a causa de que la penicilina ha sido considerada por mucho tiempo como la primera alternativa para el tratamiento de mastitis en bovinos, el desarrollo de la resistencia bacteriana ha resultado inevitable, de tal forma que este problema es común en las explotaciones lecheras, tal y como ha sido reportado por diversos autores (Mesquita et al., 2019; Balemi et al., 2021).
CONCLUSIONES
Los géneros bacterianos más frecuentes causantes de mastitis en bovinos de la Comunidad Tunshi San Nicolás, Chimborazo, en orden descendente fueron Staphylococcus spp, Escherichia spp, Klebsiella spp y Streptococcus spp.
El antibiótico con mayor índice de sensibilidad fue la gentamicina y el de mayor resistencia fue la penicilina.












 uBio
uBio