INTRODUCCIÓN
El cáncer de próstata es la segunda neoplasia maligna más frecuente y una de las principales causas de mortalidad por cáncer en varones a nivel mundial(1). Según estimaciones para Perú durante el 2020, esta neoplasia sería la más frecuente y la segunda más letal, independientemente de la edad y género (44,3 casos nuevos por cada 1000 habitantes, y 11,4 fallecimientos por 1000 habitantes, respectivamente)(2). En el Seguro Social de Salud de Perú (EsSalud), el cáncer de próstata representó el 3,8% de los años de vida perdidos por muerte prematura por tumores malignos en el 2018(3).
Para reducir las cifras de mortalidad causadas por cáncer de próstata y otras neoplasias, en 2012 se implementó en Perú el Plan Esperanza, el cual pretende cubrir los servicios de prevención, detección temprana, diagnóstico definitivo, estadiaje, tratamiento y cuidado paliativo(4). Pese a ello, la tendencia de mortalidad por cáncer de próstata en varones mayores de 50 años incrementó de 10,9% en el 2009 a 21,8% en el 2016(5). Además, el manejo del cáncer de próstata se ha vuelto más complejo con el advenimiento de nuevas formas de subclasificación de grupos de riesgo, y nueva evidencia sobre la eficacia y seguridad de las diferentes modalidades de tratamiento inicial para esta neoplasia(6,7,8).
Por ello, la Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) de EsSalud elaboró la guía de práctica clínica (GPC) basada en evidencias para el tamizaje, diagnóstico, y tratamiento inicial del cáncer de próstata localizado y localmente avanzado, cuyas recomendaciones (Tabla 1) serán aplicadas por profesionales de la salud en EsSalud. El presente artículo es un resumen de dicha GPC.
METODOLOGÍA
El procedimiento seguido para la elaboración de la presente GPC está detallado en su versión "in-extenso", la cual puede descargarse de la página web del IETSI de EsSalud (http://www.essalud.gob.pe/ietsi/guias_pract_clini.html).
En resumen, se aplicó la siguiente metodología:
Conformación del grupo elaborador de la guía local (GEG): Se conformó un GEG, que incluyó metodólogos y médicos especialistas en urología, oncología, y radioterapia oncológica.
Formulación de preguntas: En concordancia con los objetivos y alcances de esta GPC, el GEG formuló 06 preguntas clínicas (Tabla 1), cada una de las cuales pudo tener una o más preguntas PICO (Population, Intervention, Comparator, Outcome). A su vez, cada pregunta PICO pudo tener uno o más desenlaces (o outcomes) de interés.
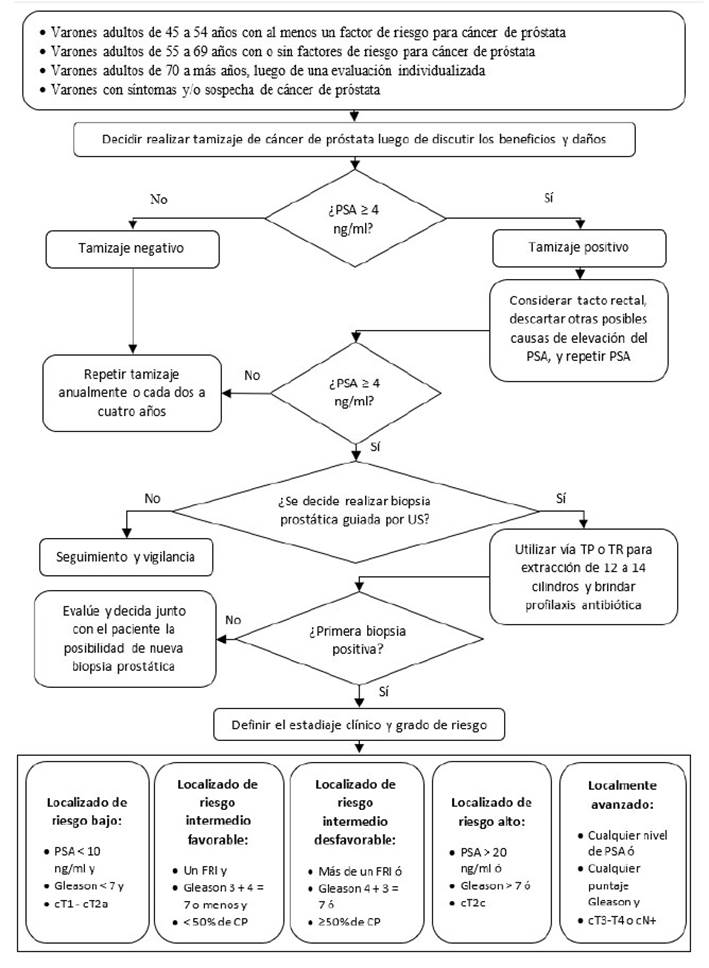
Tabla 1 Lista completa de recomendaciones.
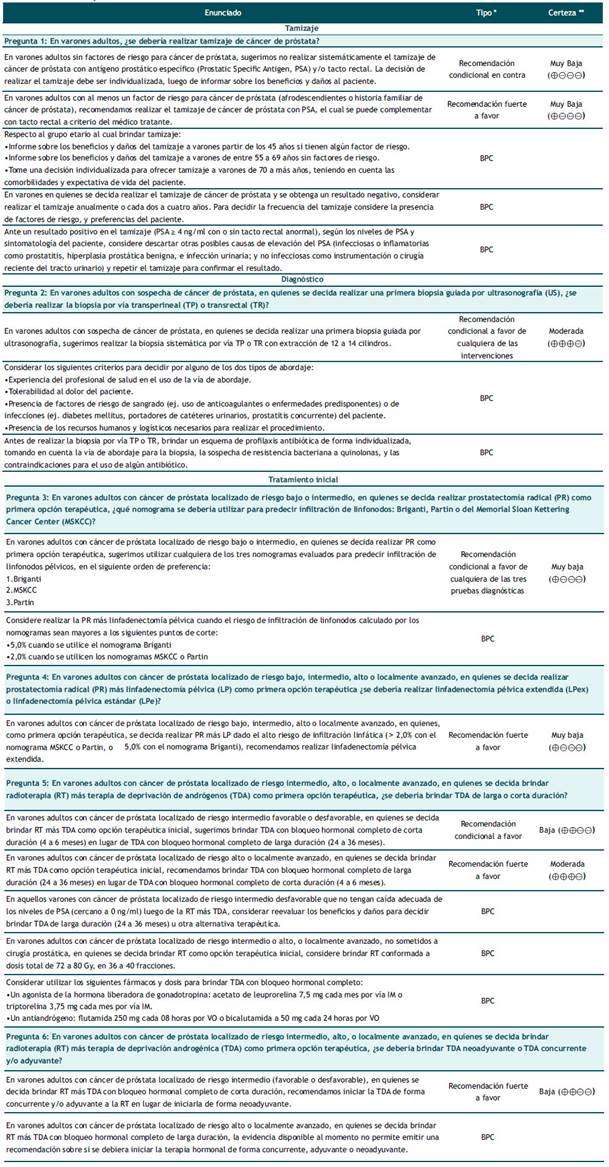
* Recomendación basada en evidencias (R) o punto de buena práctica clínica (BPC) basada en consenso.
** La certeza de la evidencia solo se establece para las recomendaciones, mas no para los puntos de BPC.
Búsqueda de GPC: Se realizó una búsqueda sistemática de GPC previas que puedan adoptarse. Si bien se encontraron 06 GPC sobre nuestro tema de interés que tuvieron adecuada calidad metodológica, se consideró que, debido a la antigüedad de algunas GPC y a que fueron realizadas en contextos diferentes al nuestro, no era posible adoptar ninguna de estas. Por ello, se decidió elaborar una GPC de novo.
Búsqueda y selección de la evidencia: Para cada pregunta PICO, se realizó la búsqueda y selección de la evidencia. Para ello, durante el 2020 y 2021 se buscaron revisiones sistemáticas (RS) realizadas como parte de una GPC previa (mediante la búsqueda sistemática de GPC realizada en el punto anterior) o publicadas como artículos científicos (mediante búsquedas sistemáticas en PubMed) (material suplementario 1). Cuando se encontraron RS de calidad aceptable, se escogió una RS para la toma de decisiones, la cual fue actualizada cuando el GEG lo consideró necesario. Cuando no se encontró ninguna RS de calidad aceptable, se realizó una búsqueda de novo de estudios primarios.
Evaluación de la certeza de la evidencia: La certeza de la evidencia para cada desenlace de cada pregunta PICO pudo ser alta, moderada, baja, o muy baja (tabla 2). Para evaluar la certeza de la evidencia, se siguió la metodología de Grading of Recommendations Assessment, Development, and Evaluation (GRADE) y se usaron tablas de resumen de evidencias de GRADE (material suplementario 2)(9) . Finalmente, se le asignó a la pregunta PICO el nivel de certeza más bajo alcanzado por alguno de estos desenlaces.
Formulación de las recomendaciones: El GEG revisó la evidencia seleccionada para cada pregunta clínica en reuniones periódicas, y formuló recomendaciones fuertes o condicionales (Tabla 2) usando la metodología GRADE. Para ello, se tuvo en consideración: 1) Beneficios y daños de las opciones, 2) Certeza de la evidencia, 3) Valores y preferencias de los pacientes, 4) Uso de recursos, 5) Impacto en la equidad, 6) Aceptabilidad por parte de los profesionales de salud y pacientes; y 7) Factibilidad de las opciones en los establecimientos de salud de EsSalud. Luego de discutir estos criterios para cada pregunta, el GEG formuló las recomendaciones por consenso o por mayoría simple. Asimismo, el GEG formuló puntos de buenas prácticas clínicas (BPC), usualmente en base a su experiencia clínica.
Revisión por expertos externos: La presente GPC fue revisada en reuniones con médicos especialistas representantes de otras instituciones y tomadores de decisiones. Asimismo, su versión in-extenso fue enviada por vía electrónica a expertos externos para su revisión (mencionados en la sección de agradecimientos). El GEG tuvo en cuenta los resultados de estas revisiones para modificar las recomendaciones finales.
Aprobación de la GPC: La presente GPC fue aprobada para su uso en EsSalud, con Resolución N°026-IETSI-ESSALUD-2021.
Actualización de la GPC: La presente GPC tiene una vigencia de tres años. Al acercarse al fin de este período, se procederá a realizar una RS de la literatura para su actualización, luego de la cual se decidirá si se actualiza la presente GPC o se procede a realizar una nueva versión.
RECOMENDACIONES
La presente GPC abordó 06 preguntas clínicas, en base a las cuales se formularon 08 recomendaciones (04 recomendaciones fuertes y 04 recomendaciones condicionales, 10 puntos de buena práctica clínica, y 04 flujogramas (ver Tabla 1 y Figuras 1 2,3,4).
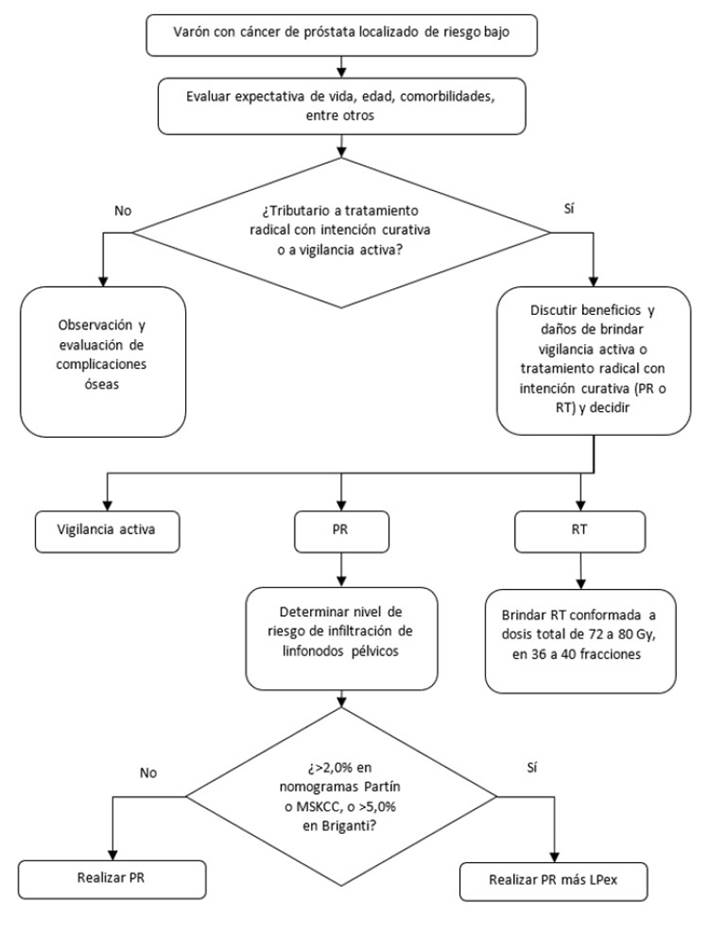
Figura 2 Flujograma de tratamiento inicial para pacientes con cáncer de próstata localizado de riesgo bajo
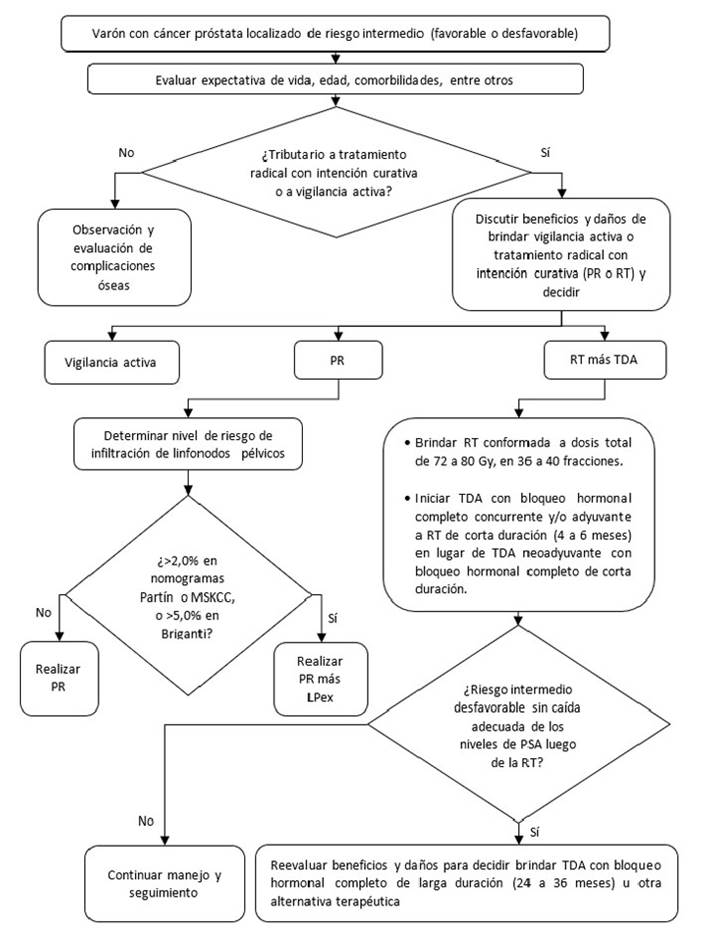
Figura 3 Flujograma de tratamiento inicial para pacientes con cáncer de próstata localizado de riesgo intermedio
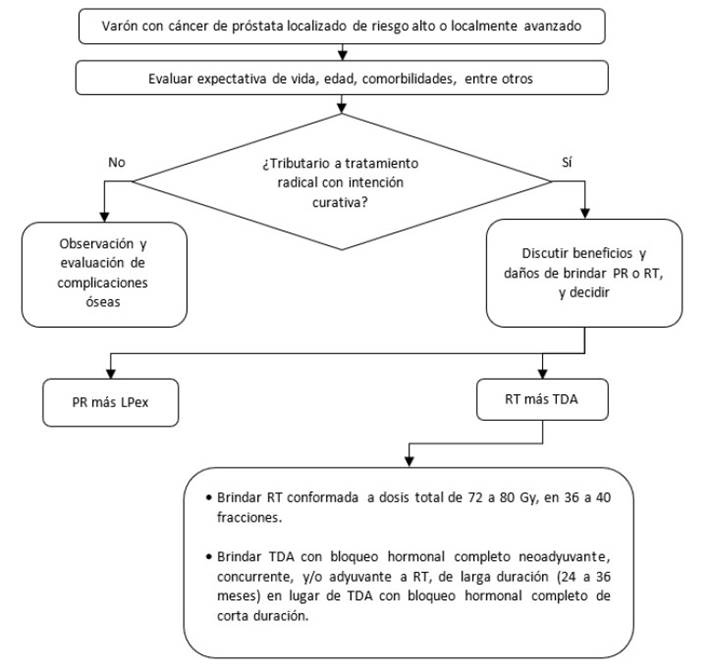
Figura 4 Flujograma de tratamiento inicial para pacientes con cáncer de próstata localizado de riesgo alto o localmente avanzado
A continuación, se expondrán las recomendaciones para cada pregunta clínica abordada, así como un resumen del razonamiento seguido para llegar a cada recomendación. No se incluyó la justificación de los puntos de BPC, la cual se puede leer en el documento in-extenso.
Para cada pregunta, los detalles sobre la búsqueda sistemática se exponen en el Material Suplementario 1. El balance de beneficios daños en forma de tablas Summary of Findings (SoF), así como la justificación en extenso de cada decisión en forma de tablas Evidence to Decision (EtD), se exponen en el Material Suplementario 2.
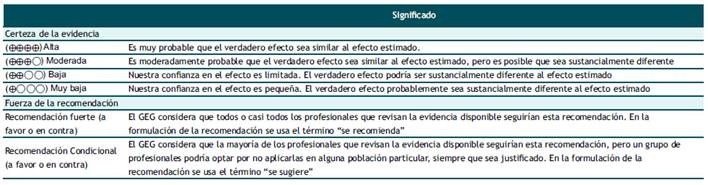
Pregunta 1: En varones adultos, ¿se debería realizar tamizaje de cáncer de próstata?
Subpoblación de varones sin factores de riesgo:
Evidencia: En la búsqueda sistemática se encontraron ocho RS(10,11,12,13,14,15,16,17), de las cuales se eligió la más reciente y de mejor calidad para evaluar los beneficios y daños de brindar tamizaje de cáncer de próstata en varones sin factores de riesgo(17).
Beneficios: El tamizaje incrementó la detección de casos de cáncer de próstata en cualquier estadio y cáncer de próstata localizado; y disminuyó modestamente la mortalidad debida específicamente al cáncer de próstata. Sin embargo, no se encontró diferencias en la mortalidad por cualquier causa ni calidad de vida entre aquellos que recibieron tamizaje y los que no.
Daños: Las complicaciones relacionadas a la biopsia posterior al tamizaje como hematuria, dolor, fiebre o sepsis; y relacionadas al tratamiento del cáncer de próstata como incontinencia urinaria o disfunción eréctil, fueron relativamente frecuentes. La frecuencia de falsos positivos en el primer, segundo y tercer tamizaje fueron mayores a 60%; y los casos falsos negativos variaron de 2,3 a 15,2%. Finalmente, la ansiedad debida al diagnóstico de cáncer estuvo asociada a un mayor riesgo de desarrollar eventos cardiovasculares.
Balance: Los beneficios se consideraron pequeños dada la modesta reducción de mortalidad específica por cáncer de próstata e incremento de detección de casos de cáncer de próstata. En contraste, los daños se consideraron moderados debido a que son relativamente frecuentes y por conllevar complicaciones de difícil manejo en algunos casos. Por ello, se emitió una recomendación en contra del uso sistemático del tamizaje.
Fuerza: La certeza de evidencia fue muy baja, los costos podrían ser moderados, y la aceptabilidad podría ser muy variable entre los pacientes y el personal de salud, por lo que la decisión de realizar el tamizaje debe ser individualizada luego de informar los beneficios y daños. Por ello, la fuerza de la recomendación fue condicional.
Subpoblación de varones con al menos un factor de riesgo:
Evidencia: La RS encontrada previamente sirvió para evaluar los daños(17), y una recomendación rápida publicada estimó los efectos absolutos de los beneficios de brindar tamizaje en varones con al menos un factor de riesgo para esta neoplasia, por lo que en sirvió de cuerpo de evidencia(18).
Beneficios: El tamizaje redujo la mortalidad por cualquier causa, mortalidad por cáncer de próstata; e incrementó la frecuencia de detección de cáncer de próstata en cualquier estadio y localizado en este grupo de riesgo.
Daños: Se consideraron los mismos daños encontrados para los varones sin factores de riesgo.
Balance: Los beneficios del tamizaje se consideraron moderados debido a la reducción de la mortalidad por cualquier causa y por cáncer de próstata, así como por el incremento importante en la frecuencia de detección de esta neoplasia. Los daños se consideraron moderados. Sin embargo, es crítico detectar oportunamente el cáncer de próstata en este grupo de varones. Por ello, se decidió emitir una emitir una recomendación a favor.
Fuerza: Si bien la certeza de evidencia fue muy baja, se encontraron beneficios importantes en mortalidad, y los costos podrían ser aceptables para dichos beneficios. Además, la mayoría de los profesionales de salud y pacientes estaría de acuerdo con brindar y recibir el tamizaje. Por ello, se decidió que la fuerza de la recomendación sea fuerte.
Pregunta 2: En varones adultos con sospecha de cáncer de próstata, en quienes se decida realizar una primera biopsia guiada por ultrasonografía (US), ¿se debería realizar la biopsia por vía transperineal (TP) o transrectal (TR)?
Evidencia: En la búsqueda sistemática se encontraron tres RS(19,20,21), de las cuales se eligió la de mejor calidad y más reciente(21).
Beneficios: La frecuencia de detección de cáncer de próstata fue similar entre aquellos a quienes se les realizó la biopsia de próstata por vía TP y aquellos en los que se utilizó la vía TR.
Daños: La frecuencia de complicaciones como sepsis, sangrado rectal, retención urinaria, hematuria, y fiebre fueron similares entre el uso de las dos vías. En contraste, el dolor fue más frecuente con el uso de la vía TP en comparación con la vía TR.
Balance: La frecuencia de detección de cáncer de próstata y la mayoría de las complicaciones tuvieron una frecuencia similar entre el uso de ambos abordajes. En base a que el balance entre beneficios y daños no favoreció a alguno de estos abordajes, la dirección fue a favor del uso de la biopsia sistemática de próstata por vía TP o TR.
Fuerza: Si bien la certeza de evidencia fue moderada, aún son inciertos los daños en grupos de riesgo propensos a sangrado o infecciones, en los cuales la biopsia por vía TR podrían ser más riesgosa. Además, la aceptabilidad del uso de la vía TP o TR puede ser variable por parte de los pacientes, y la factibilidad de brindar alguna de estas técnicas dependería de la capacitación de los profesionales de salud en el uso de estos abordajes; y la disponibilidad de recursos humanos y logísticos (tipo de anestesia, sala quirúrgica, entre otros). En base a ello, la fuerza de la recomendación fue condicional.
Pregunta 3: En varones adultos con cáncer de próstata localizado de riesgo bajo o intermedio, en quienes se decida realizar prostatectomía radical (PR) como primera opción terapéutica, ¿qué nomograma se debería utilizar para predecir infiltración de linfonodos: Briganti, Partin o del Memorial Sloan Kettering Cancer Center (MSKCC)?
Evidencia: En la búsqueda sistemática se encontró una RS(22), la cual se utilizó como cuerpo de evidencia para esta pregunta.
Hallazgos: La exactitud diagnóstica evaluada a través del área bajo la curva y la razón de odds diagnóstico, fueron similares entre los nomogramas Briganti, Partin, y MSKCC.
Balance: La exactitud diagnóstica de infiltración de linfonodos sería similar con el uso de los tres nomogramas evaluados. Por ello, la dirección fue a favor del uso de alguno de los tres nomogramas. Sin embargo, considerando que el nomograma Briganti podría ser más aceptable debido a que fue el único validado en pacientes que recibieron linfadenectomía pélvica extendida, la cual es frecuentemente utilizada en la actualidad, se propuso un orden en la elección del uso de estos nomogramas.
Fuerza: La certeza de evidencia fue muy baja, no se evaluaron desenlaces clínicos, los costos serían similares ya que utilizan variables similares para determinar el riesgo de infiltración de linfondos, y la aceptabilidad del uso de estos nomogramas sería variable entre los profesionales de salud. Por ello, la fuerza de la recomendación fue condicional.
Pregunta 4: En varones adultos con cáncer de próstata localizado de riesgo bajo, intermedio o alto o localmente avanzado, en quienes se decida realizar prostatectomía radical (PR) más linfadenectomía pélvica (LP) como primera opción terapéutica, ¿se debería realizar linfadenectomía extendida (LPex) o linfadenectomía estándar (Lpe)?
Evidencia: En la búsqueda sistemática se encontraron cuatro RS(23,24,25,26). Sin embargo, se realizó una búsqueda de ensayos clínicos aleatorizados (ECA) debido a que las RS tuvieron deficiente calidad metodológica y no ser suficientemente actuales. Producto de ello, se encontraron cuatro ECA(27,28,29,30), de los cuales uno fue retractado y no se incluyó como cuerpo de evidencia(28).
Beneficios: La LPex tuvo una tendencia a disminuir el Hazard de recurrencia bioquímica y metástasis en comparación con la LPe. Sin embargo, no se encontraron diferencias estadísticamente significativas, posiblemente debido al poco tamaño de muestra. Por otro lado, basados en el ECA con mayor número de participantes, mayor tiempo de seguimiento y menor riesgo de sesgo(30), se consideró que el uso de LPex detectaría más linfonodos positivos en comparación con el uso de Lpe.
Daños: Los resultados fueron contradictorios entre los estudios. Sin embargo, la frecuencia de linfocele posiblemente sea mayor con el uso de LPex en comparación con el uso de LPe. Los estudios encontrados no especificaron la frecuencia de complicaciones serias entre aquellos que utilizaron LPex y LPe, pero la frecuencia en general fue muy baja.
Balance: El potencial beneficio terapéutico de la LPex aún es incierto pero tuvo tendencia a mejorar desenlaces clínicos de supervivencia. La LPex detectaría una mayor proporción de linfonodos positivos en comparación con la LPe, lo cual es valioso para el correcto estadiaje y elección del tratamiento de los pacientes con cáncer de próstata. Los daños fueron considerados pequeños debido a que si bien el linfocele sería más frecuente con el uso de LPex, sería manejable y no letal. En adición, otras complicaciones serias fueron relativamente infrecuentes y posiblemente similares entre ambos tipos de LP. Por ello, se emitió una recomendación a favor del uso de Lpex.
Fuerza: Si bien la certeza de evidencia fue muy baja, los beneficios encontrados en la mayor capacidad de detección de linfonodos positivos con el uso con el uso de la LPex fueron considerados críticos para el correcto estadiaje y manejo de los pacientes. En adición, el uso de LPex no incurriría en costos excesivamente mayores, es factible de brindar debido a que el procedimiento quirúrgico ya se realiza actualmente, y sería aceptable por parte de profesionales de salud y pacientes. Por ello, se decidió emitir una recomendación fuerte.
Pregunta 5: En varones adultos con cáncer de próstata localizado de riesgo intermedio, alto, o localmente avanzado, en quienes se decida brindar radioterapia (RT) más terapia de deprivación de andrógenos (TDA) como primera opción terapéutica, ¿se debería brindar TDA de larga (24 a 36 meses) o corta duración (4 a 6 meses)?
Subpoblación de varones con cáncer de próstata localizado de riesgo intermedio:
Evidencia: En la búsqueda sistemática se encontraron cuatro RS(31,32,33,34). Sin embargo, las RS encontradas tuvieron deficiente calidad metodológica, el comparador no fue el actualmente empleado y utilizaban diferentes definiciones de duración de la terapia. Por ello, se realizó una búsqueda de ECA que hayan definido TDA de larga duración como un periodo de 24 a 36 meses, de corta duración como un periodo de 4 a 6 meses, cuyos grupos comparadores haya incluido el uso de la RT más TDA. En dicha búsqueda se encontraron dos ECA para este grupo de pacientes(35,36).
Beneficios: No se encontraron diferencias en la supervivencia global ni recurrencia bioquímica a 05 y 10 años de seguimiento; ni en la supervivencia libre de enfermedad a 10 años con el uso de la TDA de larga duración en comparación con la TDA de corta duración.
Daños: La incidencia de toxicidad aguda y tardía a la RT, así como la de toxicidad a la deprivación androgénica fueron similares entre aquellos que recibieron TDA de larga y corta duración. Sin embargo, se evidenció que una tendencia a que la toxicidad genitourinaria sería más frecuente con el uso de TDA de larga duración, los cuales podrían tener mayor impacto en un grupo de varones.
Balance: La TDA de larga duración tendría nulos beneficios y daños pequeños en este grupo de pacientes en comparación con el uso de la TDA de corta duración. Si bien, los ECA evaluados no presentan resultados diferenciados para pacientes con riesgo intermedio favorable o desfavorable, los daños con el uso de la TDA de larga duración podrían ser mayores en pacientes de riesgo intermedio favorable y en algunos pacientes que valoren más los efectos sobre la reducción de la libido, impotencia sexual, ginecomastia, entre otros. En base a ello, se decidió emitir una recomendación a favor del uso de TDA con bloqueo hormonal completo de corta duración en lugar que el uso de TDA con bloqueo hormonal completo de larga duración.
Fuerza: La certeza de evidencia fue baja, no se conoce con claridad el balance para pacientes con riesgo intermedio favorable y desfavorable, no se consideraron todos los desenlaces importantes para los pacientes, los daños podrían ser percibidos con una mayor magnitud por algunos pacientes, los costos serían moderados, y la mayoría de los profesionales de salud no aceptaría brindar TDA de larga duración pero un grupo de ellos podría reevaluar su uso en pacientes con características especiales. En base a ello, se decidió emitir una recomendación condicional.
Subpoblación de varones con cáncer de próstata localizado de riesgo alto o localmente avanzado:
Evidencia: Se decidió no elegir las RS encontradas por las razones mencionadas. Por ello, se realizó una búsqueda de ECA, tomando en cuenta los mismos criterios previamente mencionados. En consecuencia, se encontraron tres ECA(35,37,38).
Beneficios: La supervivencia global a 05 y 10 años, así como la supervivencia libre de enfermedad a 15 años fueron mayores con el uso de la TDA de larga duración en comparación con la TDA de corta duración. Se encontraron resultados contradictorios en la recurrencia bioquímica a 05 años pero a un tiempo de seguimiento de 15 años, la recurrencia bioquímica fue menor con el uso de la terapia de larga duración.
Daños: No se encontraron diferencias en la incidencia de toxicidad aguda, toxicidad tardía genitourinaria a la RT dentro de los 05 a 15 años de seguimiento, ni toxicidad tardía gastrointestinal a la RT a 05 y 6,4 años de seguimiento. Sin embargo, se encontró un pequeño incremento en la incidencia de toxicidad gastrointestinal a la RT con el uso de TDA de larga duración a 15 años de seguimiento.
Balance: La TDA de larga duración tendría grandes beneficios en este grupo de pacientes por el incremento de la supervivencia y reducción de la recurrencia bioquímica, en comparación con el uso de TDA de corta duración. En contraste, los daños se consideraron pequeños y relativamente poco frecuentes. Por ello, se emitió una recomendación a favor del uso de la TDA con bloqueo hormonal completo de larga duración en lugar del uso de TDA con bloqueo hormonal completo de corta duración.
Fuerza: La certeza de evidencia fue moderada, se evaluaron desenlaces críticos de supervivencia, los costos serían moderados pero justificables por el beneficio encontrado, la mayoría de los profesionales de salud y pacientes aceptaría brindar y recibir la TDA de larga duración; y sería factible de implementar. Por ello, se emitió una recomendación fuerte.
Pregunta 6: En varones adultos con cáncer de próstata localizado de riesgo intermedio, alto, o localmente avanzado, en quienes se decida brindar radioterapia (RT) más terapia de deprivación androgénica (TDA) como primera opción terapéutica, ¿se debería brindar TDA neoadyuvante o TDA concurrente y/o adyuvante?
Evidencia: En la búsqueda sistemática se encontró una RS(39), la cual evaluó la RT más TDA de corta duración neoadyuvante en comparación con la RT más TDA de corta duración concurrente y/o adyuvante en pacientes con cáncer de próstata localizado de riesgo intermedio, alto o localmente avanzado. Sin embargo, los ECA incluidos en la RS(40,41) no utilizaron la TDA de larga duración en pacientes con cáncer localizado de riesgo alto o localmente avanzado, por lo que se decidió no emitir una recomendación para ese grupo de pacientes.
Beneficios: No se encontraron beneficios en la supervivencia o metástasis con la TDA neoadyuvante en comparación con la TDA concurrente y/o adyuvante en pacientes con cáncer de próstata localizado de riesgo intermedio (favorable o desfavorable).
Daños: La incidencia de metástasis fue estadísticamente mayor y se encontró una tendencia a mayor mortalidad global específica por cáncer de próstata con el uso de TDA neoadyuvante en comparación con el uso de TDA concurrente y/o adyuvante a 15 años de seguimiento en pacientes con cáncer de próstata localizado de riesgo intermedio. No se encontraron diferencias en la toxicidad tardía genitourinaria ni gastrointestinal entre los grupos. Por otro lado, no se presentaron resultados por separado para los subgrupos de pacientes con riesgo intermedio favorable ni desfavorable.
Balance: El uso de la TDA neoadyuvante con bloqueo completo de corta duración tendría nulos beneficios y daños moderados en pacientes con cáncer de próstata localizado de riesgo intermedio. Si bien la RS no proporciona resultados diferenciados según riesgo intermedio favorable o desfavorable, los daños serían potencialmente mayores en pacientes de riesgo intermedio favorable. Por ello, se emitió una recomendación a favor del uso de la terapia concurrente y/o adyuvante de corta duración en lugar de una terapia neoadyuvante de corta duración.
Fuerza: Si bien la certeza de evidencia fue baja, la TDA neoadyuvante con bloqueo completo de corta duración podría incrementar la mortalidad. Además, el incrementó de progresión metastásica y recurrencia bioquímica, implica un pronóstico menos favorable y el uso de terapias más agresivas y prolongadas. Brindar neoadyuvancia implicaría mayores costos, sería poco aceptable tanto por los profesionales da salud como por los pacientes luego de conocer los beneficios y daños, y sería menos factible en comparación con iniciar la TDA concurrente a la radioterapia. En base a ello, se decidió emitir una recomendación fuerte.
AGRADECIMIENTOS
Agradecemos al Dr. Fernando Quiroa Vera, especialista en urología oncológica del Departamento de Urología del Instituto Nacional de Enfermedades Neoplásicas (INEN) de Perú; y al Dr. Martín Angel, especialista en oncología médica de la Unidad de tumores Genito Urinarios del Instituto Alexander Fleming de Argentina, por la revisión realizada a la presente guía