INTRODUCCIÓN
Los macrófagos son células del sistema inmune presentes en todos los tejidos que participan en la inflamación, reparación y homeostasis tisular 1. Poseen plasticidad fenotípica, es decir, la capacidad de cambiar de un fenotipo a otro en respuesta a los diferentes estímulos del entorno 2. Han sido descritos dos tipos de fenotipos de macrófagos: el fenotipo M1, o clásicamente activado, realiza la presentación de antígenos, promueve la inflamación y contribuye con el reclutamiento de linfocitos T y de células natural killer; mientras que el fenotipo M2, o alternativamente activado, suprime las señales inflamatorias, la inmunidad adaptativa y promueve la cicatrización, angiogénesis y remodelación tisular 3.
Los macrófagos que han polarizado hacia un fenotipo adquieren patrones metabólicos diferentes entre sí 4. Los macrófagos M1 priorizan la síntesis de citoquinas y concentran la producción de ATP en la glicólisis aeróbica, a la vez, mantienen un potencial de membrana mitocondrial elevado 5. Los macrófagos M2 priorizan la producción de ATP a través de la fosforilación oxidativa, así como la síntesis de metabolitos que son importantes para sus funciones de reparación tisular 6.
En un entorno tumoral, el microambiente influye en la polarización del macrófago y viceversa 7. Cuando el macrófago polariza hacia M1 contribuye con la eliminación tumoral mediante mecanismos de citotoxicidad, como la liberación de especies reactivas del oxígeno (ROS) y óxido nitroso. Por el contrario, si el macrófago polariza a M2, éste produce citoquinas y metaloproteinasas que permiten la proliferación y diseminación tumoral 8. Adicionalmente se ha descrito que estos macrófagos asociados a tumor (TAMs) promueven un entorno tumoral que inhibe la actividad terapéutica antineoplásica, generando resistencia, como se ha observado en tumores renales, de vejiga y pulmón tratados con quimioterapia 9,10. Por todas estas razones, los macrófagos vienen siendo estudiados como un posible blanco terapéutico para la medicina personalizada en determinados tipos de cáncer 8.
En ese contexto, resulta importante comprender cuáles son las diferentes variaciones metabólicas que sufren los macrófagos cuando están expuestas a las células tumorales. Este aspecto ha sido estudiado a través del análisis de la expresión de algunos mediadores, como interleucinas y proteínas de membrana 11; sin embargo, aún queda mucho por comprender acerca de la actividad de las enzimas de rutas metabólicas de la glucosa, lo que daría alternativas en la búsqueda de blancos terapéuticos. En el presente estudio comparamos in vitro la actividad de enzimas clave en la ruta metabólica de la glucosa en macrófagos cuando son expuestos a células de cáncer pulmonar de células no pequeñas y de hepatocarcinoma.
MÉTODOS
Se realizó un estudio experimental in vitro en el «Laboratorio de Investigación: Cultivo celular, Inmunología y Biología molecular (CIB)» de la Facultad de Medicina Humana de la Universidad de Piura, ubicado en la ciudad de Lima. Los experimentos fueron realizados entre el 2 de octubre al 5 de noviembre del 2022.
Líneas celulares
Se utilizaron macrófagos murinos ATCC Raw 264.7 12, células de hepatocarcinoma PM229L con la vía de β-catenina sobreactivada, y línea celular de cáncer de pulmón de células no pequeñas (CPCNP) portadora de la inversión paracéntrica BL-EML4-ALK. Todas las líneas celulares fueron donadas por el Centro de Investigación Médica Aplicada (CIMA) de la Universidad de Navarra (España).
Cada línea celular fue reconstituida en medio RPMI-1640 (Gibco) suplementado con 10% de suero fetal bovino (SFB) y 100 µg/ml de penicilina/ estreptomicina. Luego, cada línea fue subcultivada independientemente a 37°C con 5% de CO2 hasta lograr una confluencia celular de 90% antes de realizar el pase a las placas de experimentación.
Monocultivos y cocultivos
Se realizaron monocultivos mediante la siembra de 1,0 x 106 células/pocillo de los tres modelos celulares en microplacas de poliestireno de 96 pocillos (CorningTM, Estados Unidos), sobre un volumen final 50 µL. Para los cocultivos de macrófagos y células tumorales (un primer cocultivo macrófago y EML4-ALK, y uno segundo de macrófago y PM299L) se siguió el modelo de cultivo directo según el protocolo descrito por Holt, D. 13) sembrando 0,75 x 106 células de Raw 264,7 (macrófagos) y 0,25 x 106 células de HCC (PM299L) por pocillo con el mismo volumen final. Con la misma densidad celular se realizaron los cocultivos para la línea celular de CPCNP. Todos los ensayos fueron realizados por triplicado.
Medición de actividad enzimática
Se emplearon kits comerciales para medir la actividad inicial y final de las enzimas clave de la glicólisis aeróbica: hexoquinasa (HQN, Hexokinase Colorimetric Assay Kit MAK091, Sigma-Aldrich, USA), la glicólisis anaerobia: lactato deshidrogenasa (LDH, Lactate Dehydrogenase Activity Assay Kit MAK066, Sigma-Aldrich, USA), el ciclo de Krebs: isocitrato deshidrogenasa (IDH, Isocitrate Dehydrogenase Activity Assay Kit MAK062, Sigma-Aldrich, USA) y la vía de las pentosas fosfato: glucosa 6 fosfato deshidrogenasa (G6PD, Glucose-6-Phosphate Dehydrogenase Assay Kit MAK015). La actividad enzimática fue medida en unidades catalíticas (U).
Se usó cada kit según las especificaciones del fabricante 14. Las mediciones se hicieron por espectrofotometría (37°C, 450 nm) con capacidad de incubación (Thermo Scientific Multiskan, Estados Unidos).
Grupos de comparación
En el experimento para comparar la actividad enzimática del monocultivo de macrófago y en cocultivo con las células de hepatocarcinoma se tuvieron tres grupos: macrófagos (células Raw 264,7), línea tumoral PM299L y cocultivo macrófago-PM299L. En el experimento para el entorno tumoral de CPCNP los grupos fueron: macrófagos (células Raw 264,7), línea tumoral EML4-ALK y cocultivo macrófago-EML4-ALK.
La actividad enzimática en los grupos de comparación fue medida en cuatro puntos temporales: a las cero, dos, cuatro y seis horas. Estos puntos fueron definidos en función de los tiempos en el cual los macrófagos cultivados se activan y derivan a M1 o M2. Para cada punto de observación se empleó toda la densidad celular de las líneas celulares contenida en cada pocillo. De esta manera, la medición de la actividad enzimática tuvo atributos de mediciones no pareadas. Además, en cada punto de observación se midió por triplicado la actividad enzimática en cada uno de los tres grupos.
Análisis estadístico
En vista que en cada punto de observación se obtuvo tres valores de actividad enzimática se utilizó la comparación de medianas entre tres grupos. Para ello aplicamos la prueba no paramétrica de Kruskal-Wallis (estadístico H), este análisis fue realizado para las cuatro enzimas (LDH, IDH, G6P y HQN). Por el diseño del experimento no se consideró que los datos fueran pareados, por lo que el análisis fue realizado considerando grupos independientes. Además, realizamos la prueba de comparaciones múltiples de Dunn para identificar entre qué grupos hubo diferencias significativas.
Finalmente, para cada una de las cuatro enzimas se comparó la actividad enzimática de los cocultivos macrófago-EML4-ALK versus macrófago-PM299L, mediante la prueba de U de Mann-Whitney. Este análisis fue realizado con los datos de las cero, dos, cuatro y seis horas. Su objetivo fue identificar si en alguno de los entornos tumorales la actividad metabólica fue significativamente diferente y en que punto de observación.
Para todo el análisis se consideró un nivel de significancia estadística del 5%. El análisis fue realizado en el programa estadístico GraphPad Prism 10.0.2.
RESULTADOS
La morfología celular de los cultivos fue la adecuada en todos los casos, consiguiendo una confluencia máxima a las seis horas (Figura 1).
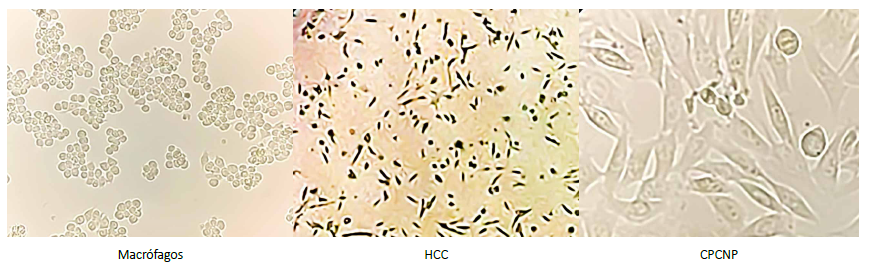
Figura 1. Monocultivos de líneas celulares de macrófagos, hepatocarcinoma (HCC) y cáncer de pulmón de células no pequeñas (CPCNP). Los macrófagos muestran una morfología redondeada, sin proyecciones citoplasmáticas y agrupadas en cúmulos pequeños. En contraste, las células de HCC y CPCNP muestran una morfología alargada y con espículas, teniendo más contacto estas últimas. La velocidad de crecimiento evaluada en los cultivos era evidentemente mayor en las células de HCC en comparación a las otras dos líneas.
Entorno tumoral del hepatocarcinoma
Al evaluar la actividad enzimática entre macrófagos, células de hepatocarcinoma y el cocultivo correspondiente, se encontró que para la enzima LDH hubo diferencias significativas entre las medianas de la actividad enzimática a las cero (H = 5,96, p = 0,03), dos (H = 6,49, p = 0,01) y seis horas de cultivo (H = 7,20, p = 0,004). A las dos y seis horas se encontró que la actividad enzimática de LDH fue superior en el cocultivo (Figura 2 - LDH).
Las enzimas IDH y la HQN tuvieron un comportamiento diferente. En los cocultivos mostraron menor actividad. Las medianas de la actividad enzimática de la IDH tuvieron diferencias significativas a las dos (H = 5,96, p = 0,03) y a las seis horas (H = 5,96, p = 0,03) (Figura 2 - IDH). En las medianas de la actividad de la HQN se encontró diferencias significativas a las cero (H = 5,96, p = 0,03), dos (H = 7,20, p = 0,004), cuatro (H = 5,96, p = 0,03) y seis horas (H = 7,20, p = 0,004). Se encontró que a las dos y seis horas la mediana de la actividad enzimática de la HQN en el cocultivo fue menor respecto a los monocultivos de macrófagos (Figura 2 - HQN).
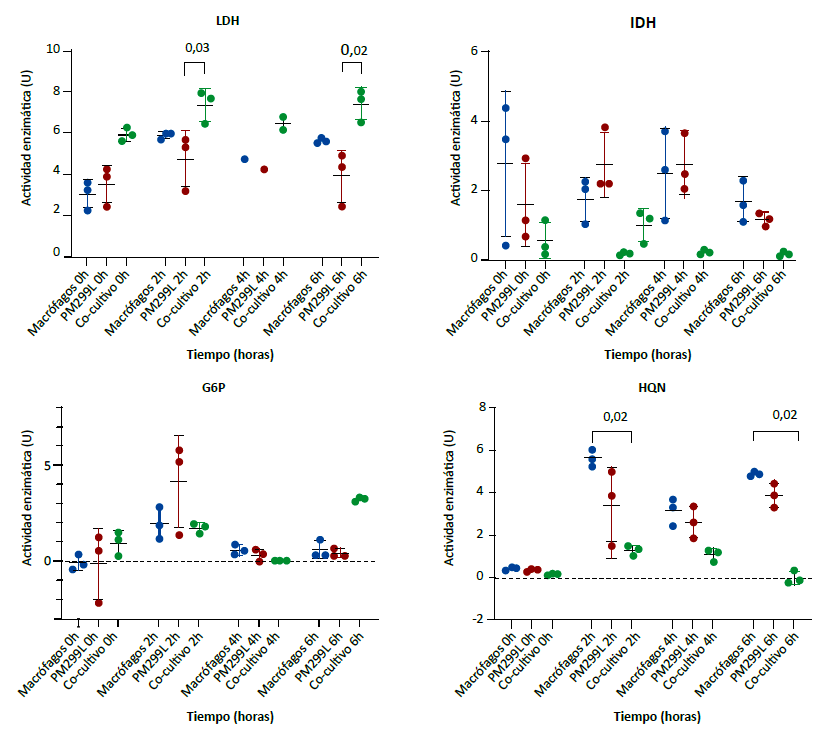
Comparación de medianas en tres grupos independientes con prueba de Kruskal-Wallis (H). LDH: 0h H = 5,96, p = 0,03; 2h H = 6,49, p = 0,01; 4h H = 2,70, p = 0,50; 6h H = 7,20 p = 0,004. IDH: 0h H = 2,76, p = 0,30; 2h H = 5,96, p = 0,03; 4h H = 5,42, p=0,07; 6h H = 5,96, p = 0,03. G6P: 0h H = 2,22; p = 0,38; 2h H = 1,07, p = 0,66; 4h H=3,20, p = 0,25; 6h H = 5,60, p = 0,05. HQN: 0h H = 5,96, p = 0,03; 2h H = 7,20, p = 0,004; 4h H = 5,96, p = 0,03, 6h H = 7,20, p = 0,004. Los valores sobre el corchete representan el valor de p de la prueba de comparaciones múltiples de Dunn. Solo se muestran aquellos significativos (p < 0,05).
Figura 2. Actividad enzimática de lactato deshidrogenasa (LDH), isocitrato deshidrogenasa (IDH), glucosa 6 fosfato deshidrogenasa (G6P) y hexoquinasa (HQN) en monocultivos y cocultivo de macrófagos con células tumorales de hepatocarcinoma.
Entorno tumoral de cáncer de pulmón de células no pequeñas
Las medianas de la actividad enzimática de LDH, G6P y HQN fueron significativamente diferentes entre los monocultivos y el cocultivo en todos los puntos de observación. Respecto a IDH, se observó también diferencias de las medianas, a excepción de la observación a la hora cero (Figura 3).
En las pruebas de comparaciones múltiples de Dunn se encontró que las medianas de la actividad de IDH en los cocultivos fueron menores comparadas con los macrófagos en monocultivo, a las dos, cuatro y seis horas. La HQN también tuvo menor actividad enzimática en los cocultivos respecto al monocultivo de macrófagos en todos los puntos de observación. A nivel descriptivo, se observó a la hora cero, que la G6P tuvo una mediana mayor en el cocultivo respecto al monocultivo de macrófago; sin embargo, a las dos, cuatro y seis horas la actividad enzimática de la G6P fue menor en el monocultivo (Figura 3).
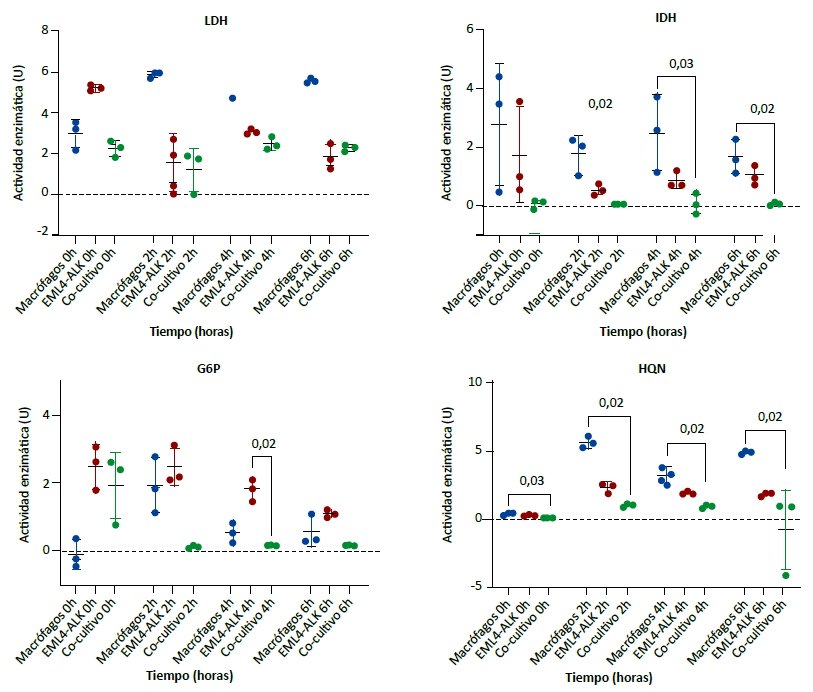
Comparación de medianas en tres grupos independientes con prueba de Kruskal-Wallis (H). LDH: 0h H = 5,96, p = 0,03; 2h H = 5,60, p = 0,05; 4h H = 5,14, p = 0,04; 6h H = 5,60 p = 0,05. IDH: 0h H = 5,42, p = 0,07; 2h H = 7,20, p = 0,004; 4h H = 6,49, p=0,01; 6h H = 6,49, p = 0,01. G6P: 0h H = 5,96; p = 0,03; 2h H = 5,96, p = 0,03; 4h H = 7,20, p = 0,004; 6h H = 5,96, p = 0,03. HQN: 0h H = 6,49, p = 0,01; 2h H = 7,20, p = 0,004; 4h H = 7,20, p = 0,004, 6h H = 7,20, p = 0,004. Los valores encima del corchete representan el valor de p de la prueba de comparaciones múltiples de Dunn. Solo se muestran aquellos significativos (p < 0,05).
Figura 3. Actividad enzimática de lactato deshidrogenasa (LDH), isocitrato deshidrogenasa (IDH), glucosa 6 fosfato deshidrogenasa (G6P) y hexoquinasa (HQN) en monocultivos y cocultivo de macrófagos con línea tumoral de cáncer de pulmón de células no pequeñas
Entorno tumoral de ambos cocultivos
Cuando se comparó la actividad enzimática del LDH, IDH, G6P y HQN entre los dos cocultivos no hubo diferencias estadísticamente significativas (Figura 4). Sin embargo, a nivel descriptivo se observó que las medianas de la actividad enzimática de LDH fueron mayores en el cocultivo con células de hepatocarcinoma (0h: 5,89 en HCC versus 2,29 en CPCNP; 2h: 7,67 en HCC versus 1,81 en CPCNP; 4h: 6,49 en HCC versus 2,37 en CPCNP; 6h: 7,63 en HCC versus 2,28 en CPCNP).
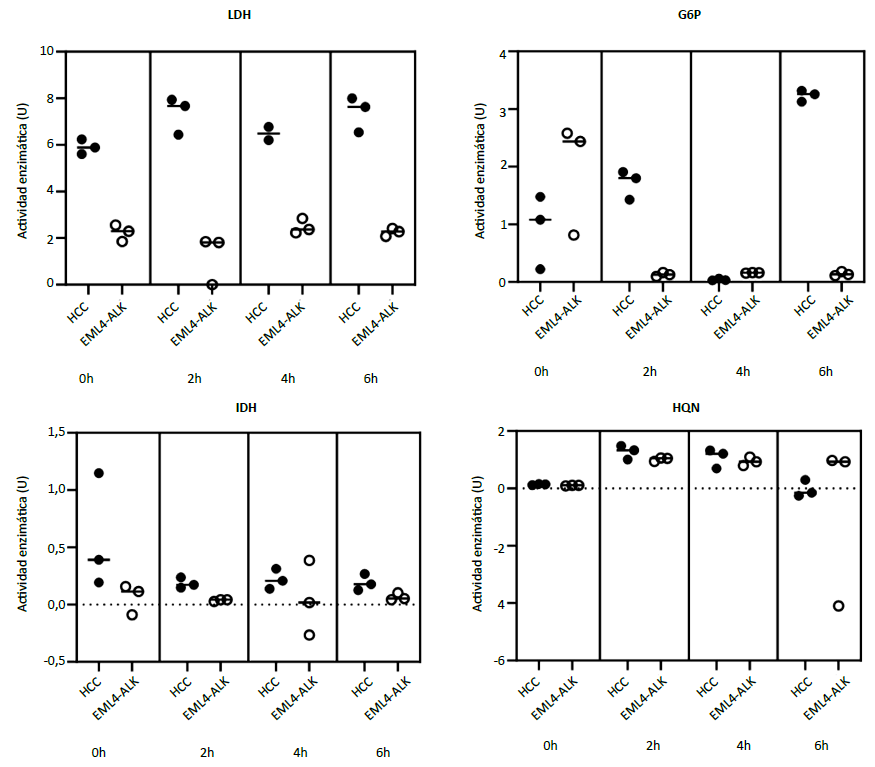
Comparación de medianas en dos grupos independientes con prueba de U de Mann-Whitney. LDH (0h: p = 0,10, 2h: p = 0,10; 4h: p = 0,20, 6h: p = 0,10). G6P (0h: p = 0,40, 2h: p = 0,10, 4h: p = 0,10, 6h: p = 0,10). IDH (0h: p = 0,10, 2h: p = 0,10, 4h: p = 0,70, 6h p = 0,10). HQN (0h: p = 0,10, 2h: p = 0,40, 4h: p = 0,70, 6h: p = 0,70).
Figura 4. Comparación de la actividad enzimática entre los cocultivos de macrófagos y línea celular de hepatocarcinoma (HCC) versus cocultivos de macrófagos y línea de cáncer de pulmón de células no pequeñas (EML4-ALK)
DISCUSIÓN
Según nuestro estudio, la línea de macrófagos expuesta a un entorno tumoral de células de hepatocarcinoma tuvo mayores niveles de actividad enzimática para LDH comparado con el monocultivo de macrófagos y respecto al monocultivo de células de hepatocarcinoma. Este hallazgo no fue observado con la actividad enzimática de HQN e IDH; por el contrario, estas enzimas tuvieron una actividad disminuida en este tipo de cocultivo. En los cocultivos de macrófagos expuestos a células de cáncer de pulmón de células no pequeñas, IDH, G6P y HQN tuvieron una menor actividad enzimática en los diferentes puntos de observación, comparados con los monocultivos (Figura 5).
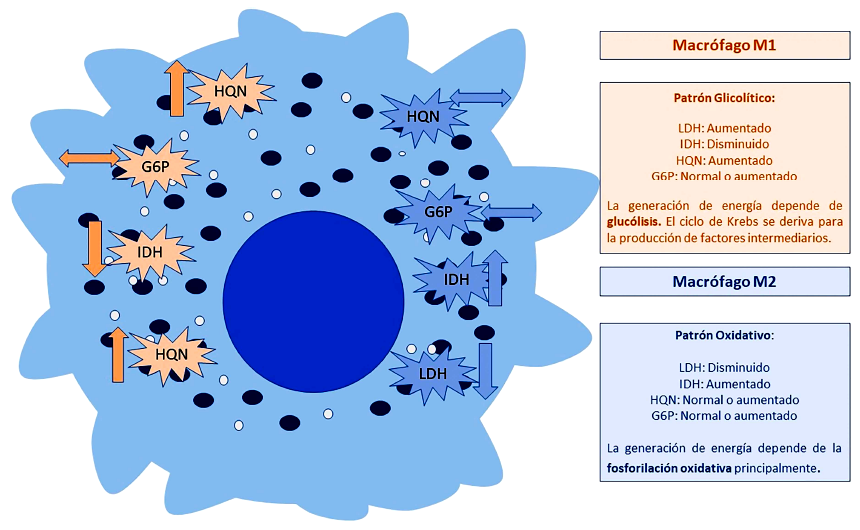
Figura 5. Patrón de actividad metabólica según incremento o disminución de actividad enzimática. El patrón principal que sigue el macrófago clásicamente activado es un patrón predominantemente glucolítico semejando lo descrito por el Warburg. El macrófago alternativamente activado, es predominantemente oxidativo, incrementando la actividad enzimática de aquellas involucradas en la fosforilación oxidativa.
Meiser et al. describieron en un subgrupo de macrófagos clásicamente activados con lipopolisacáridos, que los cambios inflamatorios en estas células incluyen un aumento de la actividad de las vías glucolíticas con disminución de actividad de IDH y acumulación de itaconato 15. Estos cambios suponen también que enzimas LDH y HQN deberían incrementarse para identificar correctamente al macrófago. Nuestro estudio observa un efecto similar para IDH en los cocultivos, ya que su actividad frente a ambos monocultivos parece ser menor. La evaluación de HQN en los cocultivos de ambas líneas tumorales fue menor respecto a los cultivos aislados. Por lo tanto, la actividad enzimática puede indicar un fenotipo clásicamente activado del macrófago. Esta información al contrastarse con lo encontrado por De Jesus et al. puede sugerir que los patrones de activación fenotípica caracterizados por actividad enzimática pueden ser equivalentes a estudios que caracterizan la expresión de proteínas 16.
Yang et al. evaluaron la respuesta a la radioterapia en CPCNP midiendo la inhibición de la actividad de un subtipo de LDH. En su estudio la actividad basal in vitro se encontraba incrementada en comparación al tejido circundante, y sugieren que se debe al incremento de la vía glucolítica. Esta actividad le conferiría al tumor una ventaja al disminuir la respuesta inmunológica incrementando las vías dependientes del factor inducido por hipoxia 1 (HIF-1) 17. En nuestro estudio, la actividad de LDH en los cocultivos macrófago-EML4-ALK tiende a ser menor frente a los monocultivos, especialmente frente a la actividad en el monocultivo de macrófago.
En los cocultivos de macrófagos expuestos a entorno tumoral de CPCNP, la actividad enzimática de la IDH fue menor respecto a los monocultivos, siendo esta diferencia significativa respecto a los macrófagos en monocultivo. Nuestros resultados contradicen lo reportado por Sun et al. quienes evaluaron la utilidad de una isoforma de la IDH (IDH1) como marcador tumoral precoz de CPCNP, y demostraron que esta tiene una actividad elevada tanto a nivel traduccional como transcripcional en comparación al tejido circundante. Los autores afirman que esta enzima se encuentra elevada en todos los tipos de CPCNP 18. No obstante, en nuestro estudio esta actividad no se encuentra, ya que, al contrario, disminuye a partir de las 2 horas de cultivo.
Comparando los cocultivos de macrófagos con las dos estirpes de células tumorales, impresiona un patrón más glucolítico conforme avanza el tiempo de cultivo de macrófagos enfrentados con células de HCC. En este cocultivo se observó un aumento de la actividad de LDH (glicólisis aerobia o efecto Warburg), mientras que simultáneamente hubo una disminución de la actividad de IDH (ciclo de Krebs). Por otro lado, en los cocultivos de macrófagos con células CPCNP, la actividad de LDH se mantuvo consistentemente alrededor de 2 U. De manera gráfica se puede apreciar que la actividad de esta enzima es casi el triple en cultivos de HCC; sin embargo, en estudios que han intentado delimitar la presencia de LDH y progresión tumoral, se ha visto que ciertas isoformas, como LDH-A, se mantienen más activas en este tipo de tumores, lo cual es probable en este caso 19.
Kim et al. observaron una mayor expresión de G6P y HQN en macrófagos solos respecto a cuando están enfrentados a células de HCC, en el cocultivo con HCC la expresión de HQN disminuyó 20. En nuestro estudio, a partir de las 2 horas de cocultivo la actividad enzimática de la HQN se redujo sostenidamente, y tuvo valores inferiores respecto al monocultivo de macrófago. Un fenómeno similar fue observado en los cocultivos con CPCNP.
La actividad de la G6P, reguladora de la vía de las pentosas, muestra diferencias según la línea tumoral enfrentada. Mientras que en el cocultivo con HCC esta tiende al alza conforme pasa el tiempo, en el caso del cocultivo con CPCNP es lo opuesto. Esto nos podría indicar una preferencia por la actividad de esta vía en las células tumorales hepáticas. En futuros experimentos se deberá determinar si la G6P cumple una función biosintética y/o de alternativa energética para la célula tumoral.
Los mecanismos metabólicos de la inmunidad antitumoral tienen algunas implicancias clínicas de relevancia. La actividad de la HQN, por ejemplo, se ha convertido en un blanco terapéutico en el CPCNP 21; mientras que, la LDH es un biomarcador de pronóstico en pacientes con HCC, por su relación con la progresión tumoral 22. Los estudios que intentan evaluar la polarización del macrófago con técnicas de biología molecular más avanzadas centran sus esfuerzos en determinar la expresión de proteínas relacionadas con algún fenotipo específico como la arginasa-1 23; sin embargo, no se suele caracterizar la interacción celular mediante la actividad enzimática. Por lo descrito, recomendamos investigaciones adicionales que profundicen sobre el entendimiento de las interacciones que puedan surgir a nivel enzimático.
El estudio tiene limitaciones; primero, las diferencias en la actividad metabólica de las líneas empleadas solo se pudieron evaluar comparando los 2 cocultivos celulares (M0 + CPCNP vs M0 + HCC). Al ser cultivos directos, no fue posible identificar de qué línea específica provino la variación de la actividad enzimática. Es necesario hacer uso de otras técnicas para complementar los datos obtenidos en este estudio. Segundo, los datos obtenidos fueron tomados de una población celular limitada al número máximo de ensayos que proporcionaba el kit, por lo que estos datos deberían interpretarse teniendo en cuenta una población celular limitada.
En conclusión, se observa que los macrófagos al ser enfrentados a líneas celulares de hepatocarcinoma y cáncer de pulmón de células no pequeñas exhiben una variación en la actividad metabólica respecto a sus cultivos individuales (no expuestos). Esto confirma que la forma de utilización de glucosa tiene un comportamiento diferente cuando los macrófagos se encuentran en un entorno tumoral y que esta varía preferentemente hacia el fenotipo glucolítico, con patrones distintos para la exposición a cada tipo de línea tumoral.















