INTRODUCCIÓN
Tras la pandemia por el nuevo coronavirus (COVID-19), se ha reportado que la infección viral puede desencadenar daño renal, manifestado como injuria renal aguda, hematuria, albuminuria o proteinuria nefrótica 1, producto de múltiples cambios glomerulares e intersticiales, que incluyen expansión mesangial, hialinosis arteriolar, arteriosclerosis, isquemia glomerular, trombos de fibrina, proliferación endotelial, edema intersticial, pérdida del borde en cepillo y necrosis tubular aguda 2. Este daño estaría mediado por diversos mecanismos como: la invasión directa del riñón, debido a la expresión de la enzima convertidora de angiotensina-2 en las células renales; la tormenta de citoquinas y nefritis intersticial aguda inducida por el propio virus y fármacos 3.
Se han descrito diversas glomerulopatías desencadenadas por el COVID-19 4. El espectro clínico encontrado abarca desde glomerulopatía colapsante, glomeruloesclerosis focal y segmentaria no colapsante, podocitopatía, glomerulonefritis membranosa, glomerulonefritis por inmunocomplejos, nefritis lúpica hasta nefritis túbulo intersticial aguda e infarto renal 3-6. Kudose et al. 5, encontraron que la glomerulopatía colapsante fue la forma histológica más frecuente en pacientes con COVID-19, y esto fue reportado por varios autores 7-9. También se encontró podocitopatía aislada o asociada a glomerulopatía colapsante 6.
Gran parte de los pacientes que desarrollaron injuria renal aguda y glomerulopatía colapsante post COVID-19, requirieron terapia de reemplazo renal 8-10. Sólo en algunos casos se administró corticoides o inmunosupresores 8,11 y el pronóstico fue malo con una evolución tórpida y permanencia en diálisis.
Presentamos el caso de una paciente de 29 años, con diagnóstico de enfermedad renal crónica estadio 4, lupus eritematoso sistémico (desde el 2011) y nefritis lúpica clase IV+V por biopsia renal en el 2017, con remisión de enfermedad y múltiples esquemas de tratamiento, quien, desde el 2021, tras desarrollar infección por COVID-19, presentó injuria renal aguda y compromiso de la función renal con ingreso a diálisis por anuria, por lo que se le realizó nueva biopsia renal cuyo resultado fue glomeruloesclerosis focal y segmentaria (GEFS), variante perihiliar. Debido a que se trata de una asociación infrecuente y que nuestra paciente presentó una evolución renal atípica inducida por la infección por COVID-19, es que se presenta este reporte, el cual cuenta con el consentimiento informado de la paciente.
REPORTE DE CASO
Paciente mujer de 29 años, procedente de Arequipa, Perú, con antecedente de lupus eritematoso sistémico (LES) desde el 2011, que debutó con compromiso respiratorio, hematológico y articular, e inició tratamiento regular con prednisona y ciclofosfamida. Durante los años posteriores presentó múltiples recaídas y hospitalizaciones debido a actividad lúpica con compromiso pulmonar, sin actividad renal, recibiendo diversos esquemas inmunosupresores en base a corticoide y ciclofosfamida.
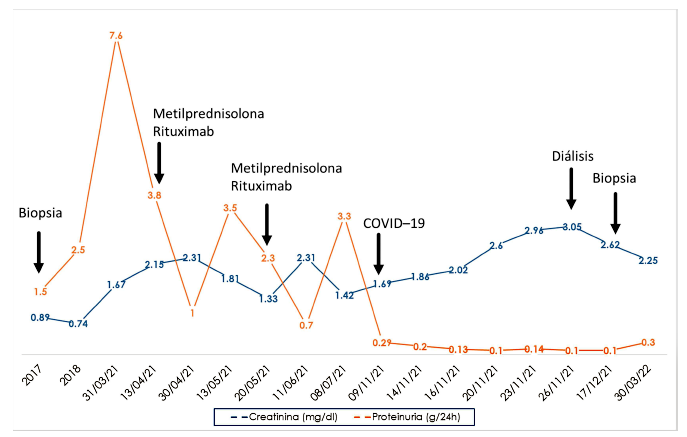
Posteriormente, el año 2017, ingresó por actividad lúpica renal y pulmonar con elevación de azoados, oliguria y hemorragia alveolar difusa, requiriendo pulsos de metilprednisolona e ingreso a unidad de cuidados intensivos. En dicha oportunidad, se le realizó biopsia renal (24/08/2017), la cual informó nefritis lúpica clase IV G (A/C) + V (patrón morfológico membranoproliferativa) e inmunofluorescencia positiva “full house” y recibió prednisona y micofenolato al alta, con posterior remisión de la proteinuria. La evolución de la creatinina y la proteinuria desde el año 2017, se detallan en la figura 1.
En abril del 2021, paciente reingresó por síndrome nefrótico (proteinuria 3,8g), elevación de azoados, crisis hipertensiva e insuficiencia respiratoria aguda, recibiendo tratamiento con metilprednisolona 1 g/día por tres días y pulso con 1 g de rituximab (14/4/2021) por reumatología. Un mes después, fue nuevamente hospitalizada por anasarca y oliguria recibiendo el segundo pulso de rituximab 1 g (sólo recibió 2 dosis) y metilprednisolona 1 g/día por tres días, con reducción de proteinuria. Al alta, continuó con micofenolato 2 g/día, prednisona 20 mg/día y furosemida 20 mg/día con remisión de la proteinuria, pero con elevación de azoados persistente, siendo evaluada en forma irregular por la pandemia COVID-19 y por mala adherencia al tratamiento, además no fue consultada al servicio de nefrología, por lo que no se le realizó biopsia renal.
En noviembre del 2021, paciente ingresó en mal estado general con insuficiencia respiratoria severa por neumonía por SARS-CoV-2, requiriendo apoyo ventilatorio por cánula de alto flujo con evolución favorable del cuadro de COVID-19. Concomitantemente, presentó anasarca, anuria, acidosis metabólica, uremia y persistencia de azoemia, requiriendo terapia dialítica. También se encontró anemia (hemoglobina 9 mg/dL), ausencia de hipoalbuminemia, leucopenia, linfopenia y plaquetopenia, dímero D y ferritina elevados, ANA positivo 1:80 patrón homogéneo, complemento C3 y C4 normales, sedimento urinario no activo, y tamaño renal disminuido en la ecografía.
Un mes después, tras resolverse el cuadro de COVID-19 y debido a que no hubo mejoría de la función renal, persistía la anuria, y a pesar de la ausencia de proteinuria se le realizó la segunda biopsia renal por deterioro inexplicado y persistente de la función renal. La biopsia informó: glomeruloesclerosis focal y segmentaria, variante perihiliar, con 25% de glomérulos esclerosados, 58% de glomérulos con esclerosis segmentaria, expansión mesangial leve, túbulos: atrofia tubular leve, algunos con epitelio atenuado e intersticio con discreto infiltrado a células linfomononucleares y fibrosis leve, además inmunofluorescencia (IgG, IgM, IgA, C3 y C1q) negativa. En la microscopía electrónica, se encontró escasos depósitos electrodensos de localización intramembranosa y mesangial, expansión mesangial leve sin hipercelularidad, con borramiento de los procesos podocitarios del 60% (Figura 2).
Actualmente, la paciente ha recuperado función renal, y ha sido retirada de hemodiálisis, sin embargo, debido a la esclerosis avanzada y la ausencia de actividad serológica e histológica, se decidió no incrementar la inmunosupresión y sólo recibe micofenolato 2 g/día y prednisona 5 mg/día.
DISCUSIÓN
Durante la pandemia por COVID-19, se observó un aumento en la incidencia de lesión renal aguda y glomerulopatías, ya que el virus produce injuria renal y podocitaria de forma directa con la consecuente necrosis tubular aguda, proteinuria y daño mitocondrial, e indirecta mediante la tormenta de citoquinas, principalmente interleucina-6 12.
En los pacientes con injuria renal aguda (IRA) asociada a COVID-19, se encontró injuria tubular aguda, glomerulopatía colapsante y microangiopatía trombótica, secundario a daño endotelial y activación del complemento; mientras que, en los que desarrollaron daño glomerular, se halló glomerulopatía colapsante y otras, como GEFS y enfermedad por cambios mínimos, aunque, algunos autores reportaron vasculitis ANCA positivo, enfermedad antimembrana basal glomerular, glomerulonefritis membranosa y nefritis lúpica 4,5,13. En la paciente del caso, se encontró glomeruloesclerosis focal y segmentaria, la cual ha sido reportada en pacientes con COVID-19, con cifras que varían entre 2.9% y 36.2% 4,14. Sin embargo, la variante más frecuente en la mayoría de series, fue la glomerulopatía colapsante 4,10,15,16.
También, se han reportado diversas glomerulopatías en pacientes que recibieron vacunación contra la COVID-19, como nefropatía por IgA, glomerulonefritis membranosa, enfermedad por cambios mínimos y glomeruloesclerosis focal y segmentaria, ocasionadas por una disregulación inmunológica de linfocitos, con respuesta inmune alterada, activada por la vacuna 17-19.
Clínicamente, los pacientes cursaron con edema, proteinuria, elevación de azoados, disminución del flujo urinario y hematuria 7,13,15,20, y fueron la proteinuria y la IRA, las indicaciones de biopsia más frecuentes 14. Aquellos que presentaron glomeruloesclerosis focal y segmentaria (no colapsante), cursaron con injuria renal aguda y síndrome nefrótico 13,21, sin embargo, en nuestro reporte, no se encontró proteinuria ni síndrome nefrótico, lo cual nos llamó la atención, ya que sería lo esperable en un patrón de focal y segmentaria, aunque la variante perihiliar suele cursar con proteinuria subnefrótica, y podría explicarse por la esclerosis avanzada encontrada en la biopsia renal.
Por otro lado, algunos de los hallazgos a nivel tubular e intersticial (atrofia tubular y fibrosis intersticial) podrían explicar el cuadro clínico de la paciente y la ausencia de proteinuria. Asimismo, la enfermedad renal crónica explica la esclerosis glomerular y el daño tubular, y en etapas avanzadas de la enfermedad suele verse patrón de glomeruloesclerosis focal y segmentaria en la biopsia renal, similar a lo hallado en la paciente.
Entre el 47% y 63% requirieron diálisis, sobre todo aquellos que tuvieron glomerulopatía colapsante 13,14,21. Se encontró una paciente de 77 años, que cursó con azoemia y proteinuria, a quien se le realizó biopsia renal con resultado de GEFS y microangiopatía trombótica y con pérdida difusa de los procesos pedicelares en la microscopía electrónica y que requirió diálisis al alta 21, similar a nuestro caso. La mayoría de pacientes no recibió manejo inmunosupresor y sólo continuaron en diálisis, al igual que nuestra paciente.
Otro aspecto interesante es que, la infección por COVID-19, puede desencadenar la activación del lupus eritematoso sistémico (LES). Se encontró tres pacientes con LES que desarrollaron COVID y que tuvieron recaída de la enfermedad, dos de ellos cursaron con nefritis lúpica y actividad serológica 22. Otra mujer con LES y síndrome antifosfolipídico desarrolló infección por COVID-19, proteinuria y azoemia, con resultado histopatológico de glomerulopatía colapsante sin evidencia de depósitos de inmunocomplejos o microangiopatía trombótica 23 y, a diferencia de nuestra paciente, no requirió diálisis y al seguimiento, tuvo una respuesta favorable a corticoides. Una paciente lúpica, presentó proteinuria y elevación de creatinina sin necesidad de diálisis, pero falleció por falla multiorgánica, por lo que no pudo realizarse biopsia renal 5. Debido a esto, consideramos que la infección por el SARS-CoV-2, induce activación del LES y daño glomerular, que puede manifestarse como glomerulopatía, como sucedió con nuestra paciente.
En conclusión, la glomeruloesclerosis focal y segmentaria secundaria al COVID-19 fue descrita por varios autores, pero es infrecuente su presentación en pacientes con lupus eritematoso sistémico, y es menos frecuente la ausencia de proteinuria. Además, la infección por COVID-19 puede causar falla renal aguda o empeorar una ERC de base, por lo que se reporta el presente caso.