INTRODUCCIÓN
La vitrificación de ovocitos y embriones de mamíferos fue implementada a mediados de los años 80 (Fahy et al., 1984; Rall y Fahy, 1985) como un método alternativo a la congelación lenta. Esta biotecnología se caracteriza por la utilización de una elevada concentración de crioprotectores y el enfriamiento ultrarrápido que previene la formación de cristales de hielo dentro y fuera de la célula (De Munck y Vajta, 2017). Sin embargo, tiene el inconveniente de causar daños ultraestructurales o estructurales en los ovocitos, incluyendo cambios en la bicapa lipídica, lisis de membranas citoplasmáticas y fragmentación nuclear, así como también inducir disrupción del huso cromático, cromosomas y microfilamentos (Moussa et al., 2014; Guo et al., 2017).
La melatonina (Mt), indolamina sintetizada en la glándula pineal y en otros órganos como el ovario, es un antioxidante universal, ya que su naturaleza anfipática le permite atravesar la membrana plasmática y secuestrar directamente los radicales libres uniéndose a secuencias específicas de ADN de genes antioxidantes (Manda et al., 2007; Reiter et al., 2009), aparentemente estimulando la expresión de genes antiapoptóticos (Zhao et al., 2016). Además, interactúa con moléculas citosólicas y su mayor concentración en el líquido folicular que en el plasma incrementa el desarrollo del folículo, lo que denota un rol importante en la función ovárica (Zhao et al., 2015).
Zhao et al. (2018) demostraron que la Mt mejora significativamente la maduración citoplasmática de los ovocitos bovinos, ya que facilitó la redistribución normal de organelas, incrementó los niveles de ATP y glutatión intracelular (GSH), aumentó la expresión de genes antioxidantes y moduló los eventos relacionados con la fecundación. Además, es un agente antiapoptótico que al secuestrar las especies reactivas de oxígeno (EROs), evita la reducción del potencial de membrana mitocondrial impidiendo su ruptura, liberación de proteínas como citocromo c, y la activación de la cascada de enzimas caspasas que ejecutan el programa apoptótico (Zhao et al., 2016, 2018).
El bovino criollo americano, descendiente del ganado de la península Ibérica, se adaptó a las condiciones ambientales propias de la región andina de Suramérica, lo que generó biotipos caracterizados por su resistencia a enfermedades, buena eficiencia reproductiva, facilidad de parto y baja producción (Tewolde et al., 1990; Primo, 1992). En la actualidad, la población de ganado bovino criollo en Ecuador se ha reducido considerablemente, motivo por el cual las iniciativas para la preservación del germoplasma son de suma importancia para conservar este valioso patrimonio genético (Aguirre et al., 2014). Una de las formas de preservarlo es la vitrificación de ovocitos, técnica que, aunque no ha alcanzado niveles de eficacia comparables con la vitrificación de embriones, representa una alterativa viable.
Con el fin de evaluar la factibilidad de preservar el germoplasma de los bovinos criollos de los Andes ecuatorianos, se estableció como objetivo de este estudio determinar el efecto de la adición de Mt en los medios de maduración y/o vitrificación de ovocitos obtenidos mediante aspiración folicular guiada por ultrasonido y de ovarios post mortem sobre la producción in vitro de embriones bovinos.
MATERIALES Y MÉTODOS
Productos Químicos
Todos los productos químicos usados en este estudio fueron adquiridos en Sigma Chemical Co. (St Louis, USA), a menos que se indique lo contrario.
Localización del Estudio
Esta investigación se llevó cabo en el Laboratorio de Biotecnología de la Reproducción Animal de la Universidad de Cuenca, ubicado en la granja de Irquis, parroquia Victoria del Portete, provincia del Azuay, Ecuador, a 2648 msnm.
Ovocitos de Ovarios de Matadero
Los ovarios bovinos fueron obtenidos en el matadero municipal de Cuenca (EMURPLAG EP), y fueron transportados a una temperatura entre 35 y 37 °C en un tiempo no mayor a tres horas desde el sacrificio al laboratorio. Los ovarios provinieron de vacas Holstein, de mestizas lecheras con alta proporción Holstein y de vacas criollas.
Los tejidos adyacentes de los ovarios fueron removidos e inmediatamente lavados con solución salina fisiológica estéril (NaCl al 0.9%) a 37 °C. Los complejos cúmuloovocitos (COCs) se aspiraron de folículos de 2-8 mm de diámetro por punción directa con una aguja calibre 18G x 1.5 pulgadas conectada a una jeringa desechable de 12 ml. El pellet recuperado fue colocado en una placa de búsqueda para identificar y clasificar los COCs, que fueron lavados tres veces en Fluido Oviductal Sintético con Hepes (H-SOF). Solo se utilizaron ovocitos con citoplasma homogéneo y con tres o más capas compactas de células del cúmulo.
Ovocitos de Vacas Criollas
Se utilizaron 10 vacas con características de animales nativos de las alturas de los Andes ecuatorianos (>3000 msnm), no lactantes y clínicamente sanas, las cuales fueron sometidas a repetidas aspiraciones foliculares para obtener los ovocitos. Los animales estaban alojados en la granja Irquis bajo condiciones de alimentación basada en pastoreo rotacional en potreros sembrados con Rye grass (Lolium perenne) y kikuyo (Pennisetum clandestinum).
Para facilitar la obtención de los COCs, las vacas fueron inmovilizadas en un brete y tranquilizadas con xilacina 2% (0.02 mg/kg IM), seguido del vaciamiento del contenido rectal y posterior aplicación del anestésico epidural bupivacaina 0.5% (0.3 mg/kg). Para realizar la aspiración folicular guiada por ultrasonido (ovum pick-up - OPU), se usó el ecógrafo Aloka Prosound 2 provisto de un transductor convexo de 5 MHz que contenía la guía de aspiración con una aguja de calibre 18G x 1½ conectado a una bomba de vacío calibrada a 65 mmHg (WTA BV 003D, Cravinhos, SP, Brasil).
Se usó un medio de recolección de ovocitos compuesto por PBS (Phosphate Buffered Saline), 1% de Suero Fetal Bovino (SFB) y 10 UI de heparina/ml. El producto de la punción (ovocitos, líquido folicular y restos celulares) fue colectado en un tubo Falcon de 50 ml en el medio precalentado a 38.5 °C. El líquido colectado fue llevado al laboratorio, filtrado y lavado con PBS atemperado a 38.5 °C. El filtrado fue vertido en una caja de búsqueda de 95 mm y bajo la luz del estereoscopio (Nikon, SMZ 745T, Japón) se aislaron y clasificaron los COCs, utilizándose únicamente los que tenían citoplasma homogéneo y estaban rodeados por tres o más capas compactas de células del cúmulo.
Maduración in vitro (MIV)
Los COCs seleccionados fueron incubados en microgotas de 50 µl en un medio de maduración TCM 199, suplementado con 10% de SFB, 100 µg/ml de piruvato de sodio, 0.75 mg/ml de L-glutamina, 0.01 UI/ml de FSH-rh y 250 µg/ml de gentamicina, en una estufa (Memmert, INCO 108, Alemania) de CO al 5%, humedad del 90% y temperatura de 38.5 °C por 22 horas.
Vitrificación y Calentamiento
Los ovocitos fueron desprovistos parcialmente de las células del cúmulo (denudados) por pipeteo moderado y expuestos a una solución de mantenimiento (SM; H-SOF + 20% de SFB) por al menos 1 minuto. Luego se colocaron por 5 minutos en la solución de vitrificación 1 (SM + 7% de etilenglicol y 7% de dimetilsulfóxido). Inmediatamente se transfirieron a la solución de vitrificación 2 (Sucrosa 0.5M + 16.5% de etilenglicol y 16.5% de dimetilsulfóxido [DMSO]) por 20 a 30 segundos, al cabo de los cuales los ovocitos fueron cargados individualmente por capilaridad, con un volumen mínimo de medio, en el dispositivo de vitrificación Cryotop (Vajta et al., 1998) y seguidamente sumergidos en nitrógeno líquido.
Los COCs se calentaron sumergiendo la punta del Cryotop en 800 µl de 0.5M de sucrosa (S 0.5M) por 2 periodos de 5 minutos, luego por 5 minutos en un medio de 400 µl de S 0.5M + 400 µl de SM y después en un medio de 800 µl de SM durante 5 minutos. Finalmente fueron incubados durante 2 horas en TCM 199 suplementado con 20% de SFB en un ambiente con 5% de CO2 , 38.5 °C y humedad de saturación.
Fecundación in vitro (FIV)
Transcurrido el tiempo de incubación, los ovocitos fueron transferidos al medio de fecundación (FIV-SOF) suplementado con 50 µg/ml de heparina, y al cual se le adicionaron 1 x 106 espermatozoides por ml. Estos fueron seleccionados por gradientes de Percoll (30, 60 y 90), e incubados durante 18-24 horas en un ambiente con 5% de CO2 , 38.5 y humedad de saturación.
Cultivo in vitro (CIV)
Luego de la fecundación, los presuntos cigotos fueron denudados totalmente en HSOF y transferidos al medio de cultivo SOF- citrato suplementado con 5% de SFB e incubados a 38.5 °C por 6 días en la estufa trigas (Thermo Fisher Scientific, Heracell 150i, USA) con 5% de CO2 , 5% de O2 y 90% de N, y humedad de saturación. A las 48 horas de la FIV (24 horas de la CIV) se evaluó el clivaje y a los 7 días pos-FIV la producción de embriones. Estos fueron clasificados según los criterios de la International Embryo Technology Society (IETS) (https:// www.iets.org/) y registrados según la cantidad de mórulas y blastocistos.
Diseño Experimental y Análisis Estadístico
Los ovocitos de ambas fuentes (OPU y OM) fueron designados aleatoriamente a cinco grupos: T1, madurados con melatonina (Mt) y vitrificados sin Mt; T2, madurados y vitrificados con Mt; T3, madurados sin Mt y vitrificados con Mt; T4 (control) madurados y vitrificados sin Mt; T5, madurados sin Mt y no vitrificados. La concentración de Mt en los medios de maduración, vitrificación 1 y vitrificación 2 fue de 0.01 micromolar (10-9 M).
Los datos fueron procesados mediante el programa estadístico SAS (Statistical Analysis System, 2012), utilizándose la regresión logística para comparar las proporciones de clivaje y de producción de embriones entre tratamientos. Se consideraron significantes los valores de p<0.05.
RESULTADOS Y DISCUSIÓN
En el Cuadro 1 se muestra el porcentaje de clivaje (PC) y de producción in vitro de embriones (PIV) de ovocitos madurados y/o vitrificados con Mt provenientes de OPU de vacas criollas y de ovarios de matadero. El PC de T4 y T5 fue superior y estadísticamente diferente a los demás tratamientos. Además, los ovocitos vitrificados produjeron porcentajes similares de embriones e inferiores a los producidos sin vitrificación (p<0.01; Cuadro 1).
Cuadro 1 Efecto de la melatonina en el medio de maduración y/o de vitrificación sobre las tasas de clivaje y de producción de embriones
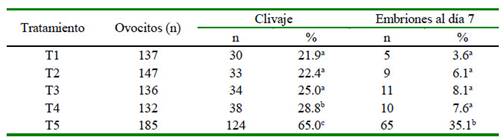
a,b,c Valores con letras distintas dentro de columnas son significativamente diferentes (p<0.01) T1, madurados con melatonina (Mt) y vitrificados sin Mt; T2, madurados y vitrificados con Mt; T3, madurados sin Mt y vitrificados con Mt; T4 (control) madurados y vitrificados sin Mt; T5, madurados sin Mt y no vitrificados
El Cuadro 2 indica el PC y de PIV según la fuente de los ovocitos. Considerando los obtenidos por OPU, el PC varió significativamente entre los grupos T1 y T4, entre T2 y T4, y entre T1, T2, T3 y T4 con T5; mientras que en PIV no hubo diferencia estadística entre T1 a T4, pero si entre estos y T5. En los ovocitos colectados de OM, tanto en PC como en PIV no hubo diferencias entre T1 al T4, pero se encontró entre estos y T5. Al comparar tratamientos similares entre las dos fuentes de ovocitos, se encontraron PC estadísticamente superiores en T1 y T2 en OM; y con relación al PIV, únicamente se observó diferencia estadística en T2, que fue superior en OM.
Cuadro 2 Efecto de la melatonina en el medio de maduración y/o de vitrificación sobre las tasas de clivaje y de producción de embriones, según la fuente de ovocitos
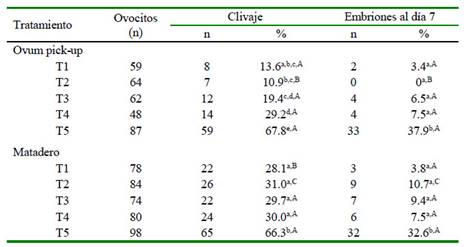
Valores con letras distintas en la misma columna para cada fuente de ovarios son significativamente diferentes: a,d p<0.05; b,d p<0.02; a-e, b-e, c-e, d-e; p<0.01; a,b p<0.01 Valores con letras distintas en la misma columna para tratamientos similares entre cada fuente de ovarios son significativamente diferentes: A,B p<0.05; B,C p<0.01 T1, madurados con melatonina (Mt) y vitrificados sin Mt; T2, madurados y vitrificados con Mt; T3, madurados sin Mt y vitrificados con Mt; T4 (control) madurados y vitrificados sin Mt; T5, madurados sin Mt y no vitrificados
En general, los resultados de este estudio demostraron que la adición de melatonina en el medio de maduración y/o de vitrificación no afectó los porcentajes de clivaje y de producción de embriones, aunque fueron inferiores a los indicados en un estudio similar (Zhao et al., 2016). En dicho estudio usaron ovarios de matadero encontrando que la adición de melatonina mejoró los porcentajes de clivaje y de producción de blastocistos con relación al grupo de ovocitos vitrificados sin adición de este antioxidante; además, los porcentajes de clivaje y de blastocistos fueron mayores a los de este estudio. Aunque las condiciones experimentales fueron diferentes (grupo racial de los donantes de ovocitos, altitud de la zona) entre ambos estudios, es poco probable que hayan sido factores determinantes para estas diferencias.
Se han señalado que el uso de melatonina exógena tiene algunas limitaciones debido a sus propiedades fisicoquímicas como su baja biodisponibilidad, corta vida media, rápida absorción y metabolismo, y baja solubilidad en el agua (Lee et al., 1994; Schaffazick et al., 2006). Así, el uso de nanocápsulas de núcleo lipídico con melatonina en su interior con el fin de mejorar la estabilidad de la molécula de Mt y mitigar su aparente reducida solubilidad en agua fue probado en la maduración de ovocitos bovinos y la subsecuente producción de embriones (Mt encapsulada, cápsulas sin Mt, Mt administrada en una solución), sin obtener diferencias en la tasa de maduración entre grupos, pero el porcentaje de blastocistos derivados de ovocitos que fueron madurados in vitro en presencia de Mt encapsulada fue significativamente superior (Reminião et al., 2016).
La vitrificación es un método útil para almacenar ovocitos de animales por extensos periodos de tiempo; sin embargo, el desarrollo embrionario es muy bajo comparado con los embriones obtenidos in vitro de ovocitos no vitrificados (Wiesak et al., 2017). Esto pudo comprobarse en el presente estudio, donde la tasa PIV de embriones provenientes de ovocitos no vitrificados fue similar a lo reportado en estudios en los cuales no se aplicó esta técnica de criopreservación (Tian et al., 2014; Rodrigues-Cunha et al., 2016).
En otro estudio, Zhao et al. (2015), evaluó el efecto de Mt sobre los eventos apoptóticos y la producción de EROs en ovocitos bovinos provenientes de ovarios de matadero, encontrando que la adición de 10-9 M de Mt a los medios de maduración y vitrificación resultó en un 88.1 y 48.4% de clivaje y PIV, en ovocitos con Mt solo en el medio de vitrificación fue de 80.3 y 42.3% respectivamente, mientras que en el grupo sin Mt en los medios fue de 53.3 y 26.4%, respectivamente. Por otro lado, en estudios donde los ovocitos fueron madurados con Mt sin someterlos a vitrificación, se obtuvieron valores mayores de PC y PIV a los obtenidos en los ovocitos madurados sin Mt (Tian et al., 2014; Rodrigues-Cunha et al., 2016), lo cual demuestra el efecto antioxidante de este compuesto que actúa incluso en ovocitos no sometidos a criopreservación (Zhao et al., 2018), pero que por ser madurados en un medio artificial producen mayores cantidades de radicales libres que los ovocitos que maduran en forma natural en los oviductos de las hembras de los mamíferos.
La comparación de tratamientos iguales entre las dos fuentes de ovocitos (Cuadro 2), demostró en algunos tratamientos una mayor PC en los ovocitos obtenidos de OM cuyos valores, en general, fueron superiores a los obtenidos con ovocitos colectados con OPU. En general, la calidad de los ovocitos recuperados mediante OPU es menor debido a la forma en que son obtenidos; es decir, debido a las múltiples fuerzas físicas a las que son sometidos en el recorrido entre el ovario y el tubo de colección (Bizarro et al., 2016).
CONCLUSIONES
En general, la adición de Mt al medio de maduración y/o de vitrificación en las condiciones experimentales de este estudio, no mejoró la tasa de clivaje de los ovocitos vitrificados y la posterior producción de embriones in vitro.
Cuando se consideró la fuente de los ovocitos, los obtenidos con OPU y sin Mt en el medio de maduración y de vitrificación, experimentaron un porcentaje de clivaje mayor que los tratados con Mt, mientras que esta variable fue similar entre los grupos experimentales de los obtenidos de OM.
En ambos casos, los porcentajes de clivaje y de producción de embriones de los ovocitos vitrificados, hayan o no estado expuestos a la Mt, fue significativamente inferior a los madurados sin Mt y no sometidos a vitrificación.












 uBio
uBio 

