INTRODUCCIÓN
El parasitismo transmitido por los alimentos es muy focalizado y puede provocar una morbilidad significativa entre las poblaciones vulnerables, principalmente en los países de ingresos bajos y medianos (Torgerson et al., 2015). La contaminación de las hortalizas por formas infectivas de protozoarios y helmintos, especialmente aquellas que se ingieren crudas, constituye el factor de mayor importancia en la epidemiología de las parasitosis del tracto gastrointestinal, principalmente debido a la gran resistencia de los quistes, ooquistes y huevos a las condiciones ambientales (González et al., 2018).
Los estadios ambientales de los parásitos persisten durante largos periodos en el agua, el suelo y en los campos de cultivo y su presencia se debe mayormente a la contaminación con excrementos humanos y aguas residuales (González et al., 2018). En diversos lugares es común la utilización de aguas residuales para el riego de vegetales, lo que ha llevado a que la investigación en hortalizas cobre una importancia particular en los mercados y centros de venta de alimentos en varios países de Latinoamérica. En cultivos de lechuga en Colombia se encontró que el 100% estaba contaminado con formas parasitarias, identificándose quistes y ooquistes de protozoarios, huevos de nematodos y trematodos (Polo et al., 2016).
En varias ciudades del Perú también se han llevado a cabo estudios en los que se han encontrado formas infectivas de parásitos en mercados y establecimientos de consumo de alimentos. En la ciudad de Puno se identificaron enteroparásitos en el 63.3% de las lechugas enteras y en el 33.3% de las ensaladas de lechuga en las pollerías (Torres y Llanos, 2015). Asimismo, en hortalizas de estos establecimientos y mercados de la ciudad de Trujillo se encontraron quistes y ooquistes de protozoarios, así como huevos de nematodos, cestodos y trematodos (Pérez-Cordón et al., 2008; Benites-Salcedo et al., 2019).
Las condiciones insalubres y la venta de hortalizas al aire libre, junto con el comercio ambulatorio en los mercados de la ciudad de Chiclayo, podrían ser factores que propicien la contaminación de las hortalizas con agentes infecciosos parasitarios, lo que a su vez podría llevar a la infección de los consumidores. En este contexto, la presente investigación se llevó a cabo con el objetivo de determinar la prevalencia e identificar los estadios ambientales y parasitarios (quistes, ooquistes y huevos) en muestras de hortalizas que se venden en los mercados de tres distritos de la provincia de Chiclayo, Perú.
MATERIALES Y MÉTODOS
Ubicación del Estudio y Muestras
El estudio se llevó a cabo durante seis meses en los principales mercados de los distritos José Leonardo Ortiz (Moshoqueque y alrededores, Atusparia y Villa Hermosa), Chiclayo (mercado Modelo y alrededores, 9 de Octubre, José Olaya, Buenos Aires y Santa Rosa) y La Victoria (A-Z, Inca y Antenor Orrego), en la provincia de Chiclayo, Lambayeque, Perú. El área de estudio se ubica a una altitud de 27 msnm, cuenta con clima árido seco y una temperatura promedio anual de 22 ºC.
El muestreo se llevó a cabo de manera no probabilística y aleatoria. Se recolectaron y procesaron 600 muestras de hortalizas. Se consideró una cantidad de 75 muestras por cada tipo de hortaliza, de los cuales 25 se colectaron en el distrito José Leonardo Ortiz, 30 en el distrito Chiclayo y 20 en La Victoria. Las hortalizas recopiladas incluyeron: lechuga (Lactuca sativa), cebolla china (Allium fistulosum), apio (Apium graveolens), rábano (Raphanus sativus), repollo (Brassica oleracea), cilantro (Coriandrum sativum), perejil (Petroselinum crispum) y espinaca (Spinacia oleracea).
Se tomó una muestra por cada hortaliza y por única vez en cada puesto de control. Estas muestras fueron compradas exclusivamente para el presente estudio. Los propietarios de cada puesto de venta tuvieron conocimiento del estudio y brindaron su consentimiento verbal. El muestreo se realizó distrito por distrito; es decir, una vez finalizado en un distrito, se continuó con el siguiente.
Cada muestra de hortaliza (aproximadamente 200 g) se colocó en una bolsa de polietileno estéril, etiquetada, y luego se introdujo en un contenedor isotérmico con hielo en gel (a una temperatura de 2-4 ºC). El contenedor se transportó al Laboratorio de Microbiología e Inmunología de la Facultad de Medicina Veterinaria de la Universidad Nacional Pedro Ruiz Gallo, en Lambayeque. Las muestras se almacenaron en un refrigerador específicamente destinado para esta investigación y a una temperatura de 2 a 4 ºC. El procesamiento se llevó a cabo al día siguiente de la recolección de las muestras. Se utilizaron materiales nuevos y etiquetados para cada muestra con el fin de evitar la contaminación cruzada. Dado que la investigación tuvo una duración de seis meses, se recolectaron 100 muestras cada mes hasta completar un total de 600 muestras.
Procesamiento de las Muestras
Las muestras se procesaron con la técnica de Traviezo-Valles et al. (2013) con algunas modificaciones. Se pesó 100 g de cada muestra, que fueron colocadas en frascos de vidrio con tapa, se agregó 200 mL de agua destilada estéril, y se agitó moderadamente invirtiendo el frasco cuatro veces. Los frascos se dejaron en reposo durante 6 h y se retiró la muestra con una pinza estéril. El agua del frasco se agitó y se homogenizó dejando reposar por 1 h. Se decantó 9/10 partes superiores de cada frasco y el sedimento se colocó en cuatro tubos de centrífuga de 15 mL de capacidad. Se centrifugó durante 5 min a 1000 g descartando el sobrante.
Se optó por estos cambios después de haberlo experimentado con un estudio piloto de 50 especímenes. De esta forma, se redujo el peso de cada muestra porque se pudo comprobar que bastaba 100 g y dejando en reposo solo 6 h se lograba el objetivo de hallar quistes/ooquistes y huevos de helmintos. Del mismo modo, se optó por este método de sedimentación, ya que después de examinar el sobrenadante en la muestra piloto no se hallaron quistes/ooquistes ni huevos de helmintos.
Estadios Parasitarios
Para la identificación de los quistes, ooquistes y huevos de helmintos, se tomó una gota de sobrenadante (0.05 mL) de cada tubo centrifugado, se agregó una gota de Lugol parasitológico fuerte con una pipeta Pasteur y se depositó sobre una lámina portaobjetos, se cubrió con una laminilla y se procedió a observar en microscopio óptico con objetivo de 10 y 40X. Se tomaron microfotografías de los quistes, ooquistes y huevos de helmintos con la cámara incorporada al microscopio. Estos se identificaron teniendo en cuenta las características morfológicas utilizando microfotografías de atlas de parasitología y de otros estudios (Ash y Orihel, 2010; López et al., 2012). La positividad de una muestra se determinó por la presencia de quistes, ooquistes o huevos de helmintos.
Análisis Estadístico
Se calcularon las prevalencias y el intervalo de confianza al 95%. Utilizando el programa IBM SPSS Statistics 25.0 se aplicó el estadístico de Kruskal-Wallis para identificar si existen diferencias entre las prevalencias de los estadios de los parásitos internos entre los lugares y especie de hortalizas. En las categorías que se detectaron diferencias se empleó la prueba U de Mann-Whitney para identificar al grupo diferente. Se consideró un nivel de significancia de p<0.05.
RESULTADOS
En el recorrido por los mercados se pudo identificar condiciones inadecuadas para la venta de alimentos. Diseños deficientes y ubicación poco adecuada propiciaban el hacinamiento y fomentaban el comercio ambulante. Los diversos tipos de alimentos, incluyendo las hortalizas, se encontraban colocados en cajones que hacían las veces de mesas de venta o simplemente estaban dispuestos en el suelo (Figura 1). En el interior de los mercados se detectaron canales de drenaje al descubierto y saturados de desperdicios, así como aguas residuales provenientes del lavado de carnes y pescados. Se observaron montones de basura en las calles adyacentes, algunos mercados se ubicaban en vías sin pavimentar, generando polvareda por el paso de vehículos y por el fuerte viento característico de la zona. Además, se notó la presencia de perros callejeros deambulando entre los puestos de venta. Por otro lado, los vendedores carecían de los equipos necesarios de bioseguridad, no utilizaban mandiles, gorros ni guantes.

Figura 1. Vistas de los puestos de venta de hortalizas en los mercados de tres distritos de Chiclayo, Perú: A y B. Puestos del mercado Modelo, Chiclayo; C. Puesto del mercado A-Z, La Victoria; D. Puesto mercado Moshoqueque, José Leonardo Ortiz
Se encontraron estadios de parásitos de interés médico en 306 (51% [IC95% 4755%]) muestras de hortalizas. Los mercados del distrito José Leonardo Ortiz presentaron un mayor porcentaje de contaminación, seguido del distrito de Chiclayo y el distrito La Victoria, aunque sin diferencias significativas (Cuadro 1).
Cuadro 1. Porcentaje de contaminación con estadios de parásitos en hortalizas de los principales mercados de tres distritos de la provincia de Chiclayo, Perú
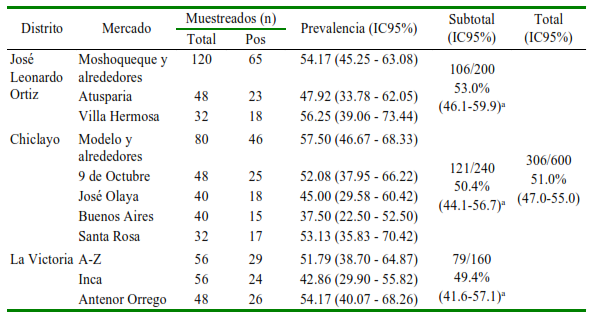
a Sin diferencia estadística entre mercados (p=0.66) y entre distritos (p=0.77) (Kruskal-Wallis, p>0.05) Pos: Positivos a enteroparásitos
La hortaliza más contaminada fue la lechuga, seguida de cebolla china, apio, rábano, repollo y culantro, mientras que el perejil y la espinaca presentaron las menores contaminaciones (p<0.05; Cuadro 2).
Cuadro 2. Porcentaje de hortalizas contaminadas con estadios infectivos de parásitos en los principales mercados de tres distritos de la provincia de Chiclayo, Perú
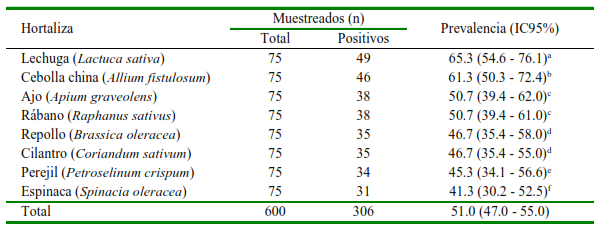
a-f Letras distintas en la columna indican diferencia estadística entre filas (Kruskal-Wallis + Mann-Whitney U Post hoc, p<0.05).
Se observó una variedad de estadios parasitarios (protozoos y helmintos). Se identificaron quistes y ooquistes de Entamoeba spp, Balantidium coli, Giardia spp, y huevos de huevos de Ascaris spp, Enterobius vermicularis, Hymenolepis nana, Taenia spp, Toxacara spp y Trichuris spp (Cuadro 3). Cabe aclarar que algunas especies son morfológicamente idénticas entre sí y no se pueden diferenciar por la morfología de los quistes/huevos. Este ejemplo se aplica a E. histolytica/E. dispar, Giarda, Taenia, Echinococcus granulosus, Ascaris. Las similitudes morfológicas en el caso de Entamoeba se superponen entre tres especies; es decir, E. histolytica, E. dispar y E. moshkovskii; por lo tanto, los resultados deben considerarse preliminares si se buscar conocer la especie de Entamoeba involucrada (Figura 2).
Cuadro 3. Prevalencia (%) de estadios endoparásitos identificados en hortalizas positivas comercializadas en los mercados de tres distritos de la provincia de Chiclayo, Perú
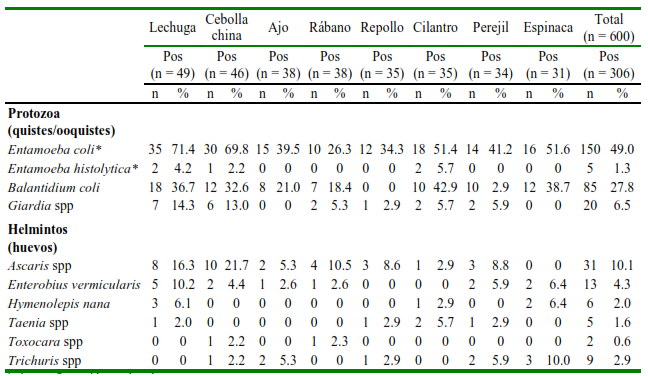
*Sin confirmación molecular
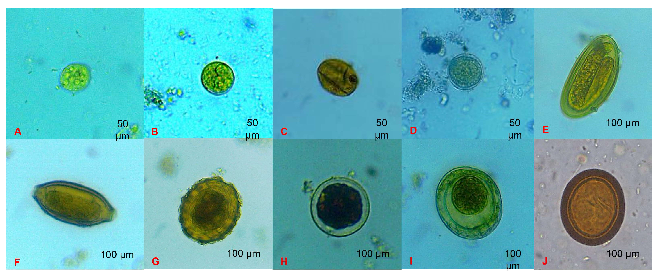
Figura 2. Estadios de endoparásitos identificados en hortalizas recolectadas en mercados de tres distritos de la provincia de Chiclayo, Perú. Montaje en húmedo. A. Quiste de Entamoeba coli (400X) (sin confirmación molecular), B. Ooquiste de Entamoeba histolytica (400X) (sin confirmación), C. Quiste de Giardia spp (400X), D. Quiste de Balantidium coli (400X), E. Huevo de Enterobius vermicularis (100X), F. Huevo de Trichuris spp (100X), G. Huevo de Ascaris spp (100X), H. Huevo de Toxara spp (100X), I. Huevo de Hymenolepis nana (100X) J. Huevo de Taenia spp (100X)
DISCUSIÓN
Se encontraron diversos estadios de parásitos entéricos en las hortalizas analizadas. Es posible que las condiciones deficientes en la producción, el transporte y la manipulación de las hortalizas sean las causas principales de la contaminación. Además, en situaciones de venta al aire libre y en el comercio ambulante, las hortalizas están expuestas al polvo, la presencia de perros callejeros y una gran afluencia de transeúntes.
En Perú se informó una prevalencia de 12.4±6.3% de contaminación por enteroparásitos en lechugas de restaurantes de comida criolla, cevicherías y pollerías, identificándose principalmente a Cryptosporidium parvum, Isospora sppy Giardia sp (Tananta et al., 2004). En otros países de América Latina se ha registrado la presencia de ente-ro-parásitos en varias hortalizas; así, por ejemplo, en Brasil, de 30 muestras de lechuga y perejil, 83.3% presentaba anquilostomidos, Balantidium coli, Isospora bellii, Ascaris sp y Entamoeba sp (Aiwny et al., 2020). En forma similar, se reportan en otros países diversos niveles de prevalencia de hortalizas contaminadas con enteroparásitos (Kudah et al., 2018; Slany et al., 2019; El Bakri et al., 2020; Hajipour et al., 2021).
Los géneros de los estadios parasitarios encontrados en las hortalizas fueron similares a los reportados en la mayoría de los estudios de este tipo. En Trujillo, por ejemplo, se han identificado quistes/ooquistes de Entamoeba coli, Entamoeba histolytica,y Giardia sp, así como huevos de helmintos como Ascaris sp, Enterobius vermicularis, Trichuris sp, Hymenolepis nana y Toxocara sp (Pérez-Cordón et al., 2008). Estos resultados pueden reflejar la diversidad parasitaria en la población humana en el Perú.
En este contexto, aunque los estudios de prevalencia de parasitosis suelen estar limitados a áreas geográficas específicas, como ciudades o distritos, un estudio retrospectivo que analizó los resultados de muestras de heces de cerca de 11 millones de personas atendidas en establecimientos de salud del país se diagnosticaron parasitosis por helmintos en todas las regiones del país y en todas las categorías de edad, desde niños hasta adultos mayores (Vidal-Anzardo et al., 2020). Sin embargo, es importante tener en cuenta que dicho estudio se basó en la población que buscó atención médica en establecimientos de salud, por lo que los resultados se aplican principalmente a esa población.
En diversos estudios se han identificado múltiples factores de riesgo de parasitismo; entre ellos, el bajo nivel de instrucción de los padres de los escolares, alto índice de hacinamiento, consumo de agua almacenada o no potable, bajos recursos económicos, hogares de zonas rurales y piso de tierra, sanidad medioambiental deficiente o carente, presencia de excretas expuestas, no lavarse las manos antes de comer, crianza de animales y contacto con perros y gatos (Mejía-Delgado et al., 2014; Nakandakari et al., 2016; Ticona-Bayta y Martínez-Barrios, 2016). A esta lista, se podría agregar el consumo de hortalizas contaminadas con formas infectivas de parásitos como otro factor de riesgo potencial para la adquisición de infecciones parasitarias.
Es importante destacar que los estadios parasitarios encontrados en las hortalizas pueden tener diferentes niveles de patogenicidad. Por ejemplo, Entamoeba coli no se considera patógena para los humanos, pero su presencia, junto con Giardia lamblia, es relevante desde el punto de vista epidemiológico, ya que indican una posible contaminación por heces humanas (Cazorla et al., 2013).
En el caso de los huevos de Enterobius vermicularis, su presencia podría atribuirse a la manipulación de las hortalizas por parte de los vendedores infectados con malos hábitos de higiene (Humbría-Heyliger et al., 2012; Baculima et al., 2019). Además, la presencia de huevos en el polvo del ambiente puede aumentar su dispersión, especialmente si los puestos de venta se encuentran cerca al suelo, como se muestra en la Figura 1. Esta situación se agrava en áreas donde las calles no están pavimentadas y se registran fuertes vientos, como en la ciudad de Chiclayo.
Los hallazgos que indican que la lechuga y la cebolla china suelen presentar una mayor contaminación y positividad concuerdan con varios estudios previos (Torres y Llanos, 2015; Kudah et al., 2018; Hajipour et al., 2021). Esta mayor susceptibilidad a la contaminación podría explicarse por la proximidad de estas hortalizas con el suelo y la morfología de sus hojas, que son sinuosas y pueden facilitar la retención de huevos, quistes/ooquistes y larvas de parásitos.
Si no se implementan buenas prácticas de manejo en todas las etapas de la cadena de producción, distribución y preparación para garantizar la calidad del producto para los consumidores, las hortalizas seguirán siendo una fuente principal de infección parasitaria intestinal (Maikai et al., 2013; Kudah et al., 2018). A pesar de que los quistes/ooquistes y huevos de parásitos pueden eliminarse mediante un lavado cuidadoso con agua potable en el hogar o en restaurantes, esta medida puede no ser factible en lugares de venta de comida rápida, incluyendo aquellos que ofrecen hortalizas, que operan en las calles y donde el riesgo de infección es más alto.
CONCLUSIONES
Se evidenció una alta contaminación de hortalizas por una variedad de estadios parasitarios en los principales mercados de tres distritos de la provincia de Chiclayo, Perú.
El consumo de hortalizas crudas adquiridas de estos mercados representa un alto riesgo de infección parasitaria.
Los quistes/ooquistes de protozoarios tuvieron mayor presencia en comparación a huevos de helmintos.
Las hortalizas más contaminadas fueron la lechuga (Lactuca sativa) y la cebolla china (Allium fistulosum).












 uBio
uBio 

