INTRODUCCIÓN
La leptospirosis es una enfermedad causada por una espiroqueta Gram negativa, con más de 300 serotipos basados en antígenos aglutinantes, que pueden afectar a más de 150 especies de mamíferos (Boey et al., 2019), e incluso ha sido reportada en anfibios y reptiles (Loffler et al., 2014). Los roedores son conocidos como el mayor reservorio de la enfermedad (Loffler et al., 2014; Roqueplo et al., 2014), así como los mayores transmisores, por su amplia relación con el hombre en el medio urbano y por su método de infección a través de laceraciones en la piel, inhalación de aerosoles o ingestión de alimentos contaminados con orina de animales positivos (Athanazio et al., 2008; Calderón et al., 2014).
La leptospirosis es una enfermedad que se encuentra distribuida en todo el mundo; sin embargo, de mayor importancia en las regiones tropicales por la influencia del clima, topografía, las prácticas de crianza de los animales domésticos y la poca asistencia sanitaria, lo cual favorece una mayor seroprevalencia del patógeno (Martins y Lilenbaum, 2013; Calderón et al., 2014).
Leptospira spp afecta generalmente al riñón, hígado, pulmón y corazón; sin embargo, puede presentar lesiones en otros órganos adyacentes y los signos clínicos pueden depender del serotipo que genere la infección y de la especie animal afectada (Adler y Moctezuma, 2010; Da Silva et al., 2012). En Colombia, Leptospira spp se encuentra ampliamente distribuida, alcanzando prevalencias entre 6 a 35% en humanos y entre 25 a 83% en roedores, siendo esta última especie la que presenta una mayor tasa entre todos los mamíferos (Carreño et al., 2017).
Existen diferentes técnicas diagnósticas para Leptospira spp. La prueba de referencia y de rutina es la micro aglutinación en placa (MAT) (OMSA, 2023). Además, se dispone de pruebas moleculares como la reacción en cadena de la polimerasa (PCR) convencional y la PCR cuantitativa, así como del diagnóstico histopatológico por tinción de Warthin Starry y los cultivos bacteriológicos (Fornazari et al., 2012). Las ratas, principalmente la rata noruega o rata marrón (Rattus norvergicus) y la rata negra (R. rattus), son consideradas como el mayor reservorio de la enfermedad y son relativamente resistentes a estas; no obstante, se dispone de diversos estudios en ratas infectadas natural o experimentalmente con la bacteria con resultados variables, debido a la variabilidad que se observa en las lesiones, especialmente en las alteraciones histopatológicas renales (Tucunduva et al., 2007; Boey et al., 2019). En el presente estudio se describe los hallazgos histopatológicos más comunes observados mediante la tinción Hematoxilina-Eosina en riñones de Rattus norvegicus infectados naturalmente y seropositivos a Leptospira spp mediante la técnica MAT.
MATERIALES Y MÉTODOS
Esta investigación es resultado de múltiples proyectos epidemiológicos financiados por las secretarias de salud de los municipios de Turbo, Antioquia, Colombia y Medellín, Antioquia, Colombia, y la participación voluntaria de un centro de conservación de fauna silvestre de Medellín, Antioquia, Colombia. Los proyectos se ejecutaron desde 2013 y 2014 con la recolecta de especímenes y realización de pruebas serológicas, y en 2015 con el análisis histopatológico de las muestras.
Consideraciones Éticas
Los animales fueron capturados por la Secretaría de Salud de Medellín y Turbo de Antioquia, Colombia, como estrategia de control de roedores y determinación de agentes infecciosos. Todos los procedimientos ejecutados cumplieron con las consideraciones éticas establecidas por el Comité de Ética para la Experimentación con Animales (CEEA) de la Universidad de Antioquia.
Captura de Roedores
Los roedores capturados fueron identificados como Rattus norvegicus, de acuerdo a las características morfológicas (cuerpo grande y robusto, orejas pequeñas y peludas, la longitud de la cola es más pequeña que el cuerpo, pelaje pardo a rojizo en dorsal y blancuzco en ventral) que los diferencia de otros roedores domésticos presentes en el país (Cruz-Céspedes, 2017). Se capturaron 165 roedores en varias ciudades de Antioquia, Colombia. En Turbo, en el nororiente antioqueño, se capturaron 57 individuos, en el centro de Medellín, en un parque de conservación de fauna silvestre se capturaron 50, y en la comuna cuatro de Medellín a 58 roedores. Las ratas fueron capturadas con trampas de captura viva tipo Tomahawk, posteriormente anestesiados con ketamina 5%, xilacina 2% y tramadol 5%, y sacrificados con punción intracardiaca con Eutanex® (Compuesto de Pentobarbital sódico 390 mg/ml, Difenilhidantoína sódica 50 mg/ml) en dosis de 0.1 ml/50 g de peso vivo.
Se extrajeron los riñones izquierdos y se conservaron en formaldehido al 10%. Los cadáveres de las ratas fueron descartados de acuerdo con el protocolo de disposición de material biológico según el lugar donde se realizó. Asimismo, se descartaron los riñones que no fueron debidamente conservados y aquellos de roedores que no fueron seropositivos a Leptospira spp por la prueba de microaglutinación en placa - MAT.
Microaglutinación en Placa
Se tomaron muestras de sangre (1-3 ml) por punción cardiaca en tubos sin anticoagulante. Las muestras fueron centrifugadas a 3810 x g) durante 20 min para extracción de suero. Todas las muestras se almacenaron a -20 °C hasta su procesamiento para la determinación de anticuerpos contra Leptospira spp mediante la prueba de MAT, realizada en el Instituto Colombiano de Medicina Tropical de Medellín, Colombia. Brevemente, esta técnica consiste en mezclar volúmenes iguales de sueros diluidos en serie con leptospiras vivas. La prueba se lee 2 h después de la incubación a 30 °C con un microscopio de campo oscuro. Los resultados se expresan como títulos de dilución de suero (Goris y Hartskeerl, 2014). Se consideraron las muestras positivas mayores a 1:200 (OMSA, 2008).
Histopatología Renal
Todas las muestras seropositivas por MAT (154/165) fueron procesadas en el Laboratorio de Patología Animal de la Universidad de Antioquia. Se procesó un riñón de cada roedor por lámina. Para esto, las muestras fueron embebidas en parafina y cortadas en secciones del tejido de 2 µm, y ser teñidas con Hematoxilina-Eosina (HE) para la descripción de alteraciones microscópicas, y la tinción de Warthin-Starry para la identificación de las bacterias. Esta última coloración es a base de nitrato de plata y se utiliza comúnmente para la visualización de espiroquetas, como Leptospira spp. Para más detalle de la coloración remitirse a Farouk et al. (2018).
Ambos procesos se analizaron en aumentos 40X, 100X y 400X con un microsco pio óptico Olympus CX23 (Olympus, Tokio, Japón). Se tomaron microfotografías de las lesiones más representativas con un microscopio con cámara adaptada Leica EC3 (Leica microsystems, Heerbrugg, Switzerland).
RESULTADOS
Se trabajó con 154 roedores Rattus norvegicus positivos a Leptospira spp. En la evaluación histopatológica se observaron depósitos de calcio y proteicos, presencia de pigmentos, infiltrados leucocitarios (eosinófilos, linfocitos, neutrófilos, macrófagos y/o plasmocitos), congestión vascular, edema intersticial, necrosis tubular, regeneración tubular, degeneración vacuolar, engrosamiento glomerular, proliferación glomerular yfibrosis. Algunas de estas lesiones se pueden observar en la Figura 1.
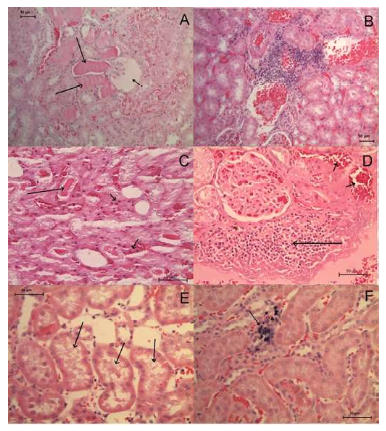
Figura 1. Alteraciones histopatológicas en riñones de roedores infectados naturalmente con Leptospira spp (A) señalado con flecha pequeña, glomérulo atrófico, con flechas largas, depósitos proteicos en túbulos renales. HE. 200x. (B) Infiltrado perivascular linfoplasmocitario y vasos congestionados. HE. 200x. (C) señalado con flechas pequeñas, necrosis tubular aguda, con flecha larga, depósito proteico en túbulo renal. HE. 400x. (D) señalado con flecha grande infiltrado intersticial linfoplasmocitario, con flecha pequeña, congestión. HE. 400x. (E) Señalado con flechas, degeneración vacuolar en túbulos renales. HE. 400x. (F) Señalado con flecha, depósito de calcio. HE. 400x
Las lesiones identificadas permitieron formular los diagnósticos morfológicos (Cuadro 1). Es importante resaltar que en algunos casos se dieron hasta dos diagnósticos morfológicos debido a que presentan similar relevancia dentro del paciente. El diagnóstico con mayor frecuencia fue la nefritis intersticial (45.0%), seguido de congestión vascular (20.1%) y pielonefritis intersticial crónica (10.6%). Los diagnósticos morfológicos en su mayoría fueron de grado moderado (73.1%) y con una menor cantidad de casos de forma leve (26.9%). No se clasificó ninguna muestra con un proceso patológico severo. Ninguna muestra fue positiva por Warthin-Starry.
Cuadro 1. Diagnóstico morfológico en riñones de 154 especímenes Rattus norvegicus seropositivos a Leptospira spp (Antioquia, Colombia, 2015)
| Diagnóstico | Frecuencia1 | |
|---|---|---|
| n | % | |
| Necrosis tubular | 10 | 5.3 |
| Pielitis crónica | 13 | 6.9 |
| Pielonefritis intersticial crónica | 20 | 10.6 |
| Nefritis intersticial crónica | 85 | 45.0 |
| Congestión vascular | 38 | 20.1 |
| Enfermedad proliferativa glomerular | 17 | 9.0 |
| Nefritis intersticial mixta | 6 | 3.2 |
1 En algunos casos se tuvo hasta dos tipos de diagnóstico
DISCUSIÓN
La nefritis intersticial crónica fue el diagnóstico morfológico más frecuente en este estudio (45.0%), el cual se caracterizó por presentar un infiltrado linfoplasmocitario y fibrosis en el estroma del riñón (Figura 1A y 1B). Este hallazgo ha sido reportado en roedores infectados con Leptospira spp en otros estudios (Tucunduva et al., 2007;Agudelo-Flórez et al., 2013; Torres-Castro et al., 2016).
En este estudio se encontraron lesiones histopatológicas que se relacionan tanto con procesos agudos como crónicos. Entre las lesiones de carácter agudo se halló degeneración vacuolar, necrosis tubular, depósitos hialinos en los túbulos renales, edema intersticial y congestión vascular. Da Silva et al. (2012) reportan que pocos días post infección, la principal lesión que se evidencia es la necrosis tubular, y es esta la que genera una inmunodeficiencia para el control de la infección. Sin embargo, en el presente estudio únicamente se encontró esta lesión en grado leve. Asimismo, Villanueva et al. (2014) encontraron principalmente congestión, ocasionalmente acompañada de necrosis tubular, sin presencia de infiltrado leucocitario, mientras todas las muestras que en la presente investigación presentaron congestión en algún grado (desde leve hasta severo); posiblemente debido a que la mayoría de los roedores evaluados en este estudio se encontraban en un estado subagudo.
Las lesiones que predominaron fueron de carácter crónico, como la presencia de infiltrado linfocitario y plasmocitario. Estas son las lesiones más comúnmente encontradas en pacientes que presentan la infección por Leptospira spp (Jubb et al., 2016; Seguel et al., 2017). Debido a las lesiones que se generan en el roedor, se plantea la hipótesis de que esta especie se le categorice más como un portador sintomático de la bacteria que como un reservorio. Sin embargo, estas lesiones no se pueden atribuir específicamente a esta bacteria, debido a que los roedores pudiesen haber estado expuesto a otros agentes.
Pese a que en este estudio se encontraron múltiples lesiones histopatológicas relacionadas con la infección con Leptospira spp y las serologías resultaron positivas por la técnica MAT a este patógeno, no fue posible visualizar la bacteria por medio de la coloración Warthin Starry. Fornazari et al. (2012) evaluaron la eficiencia de la técnica Warthin-Starry para el diagnóstico de Leptospira spp en comparación con otras pruebas diagnósticas, esta ´prueba resulta ser de baja especificidad, donde los casos dados como negativos no aseguran que el animal no presente infección; y alta sensibilidad, ya que permite la visualización directa de la bacteria en el tejido animal. Otro estudio evaluó la eficiencia de esta técnica en bovinos, en la cual demostró también ser una técnica de baja especificidad, donde de 20 muestras positivas por otras técnicas, sólo 21.7% resultó positivo por Warthin-Starry (Mineiro et al., 2011). Asimismo, en el estudio realizado por Agudelo-Flórez et al. (2013) con roedores en Medellín, Colombia, utilizando la tinción Warthin Starry se obtuvo 11.9% de positividad y utilizando PCR se obtuvo 68.7%.
CONCLUSIONES
Las lesiones histopatológicas características de la infección por Leptospira spp, aunque sin poder ser de diagnóstico definitivo, sugieren fuertemente la presencia de este agente.
Las lesiones histopatológicas y diagnósticos morfológicos microscópicos en roedores infectados con Leptospira spp son similares a los encontrados en animales que presentan la enfermedad.
De esta investigación se concluye que, la tinción Warthin-starry no debe ser considerada una técnica de diagnóstico de rutina, debido a que si bien tiene una alta sensibilidad, presenta una baja especificidad.












 uBio
uBio 


