INTRODUCCIÓN
Se observa un incremento del consumo de pescado en Chile, explicado en gran parte por los beneficios otorgados por este tipo de alimento para la salud de las personas (Valenzuela A y Valenzuela R, 2014).Dentro de este grupo se encuentran la merluza común (Merluccius gayi gayi), la merluza austral (Merluccius australis), la reineta (Brama australis), el congrio dorado (Genypterus blacodes) y la sierra (Thyrsites atun); sin embargo, corresponden a peces que presentan una alta carga parasitaria con nematodos (Torres et al., 2014) pertenecientes los géneros Anisakis, Pseudoterranova y Contracaecum (Osanz, 2001), los cuales son reconocidos en salud pública como causantes de importantes cuadros de intoxicación alimentaria (Suzuki et al., 2021).
Estos parásitos normalmente habitan en el sistema gastrointestinal de peces, pero cuando existe pérdida de la homeostasis del hospedero, el parásito migra hacia la musculatura, donde finalmente se enquista asegurando la continuidadde su ciclo biológico (Gea, 2015). Además de su cubierta cuticular, el quiste tiene la cualidad de otorgar una gran protección al parasito, resistiendo condiciones de estrés como refrigeración, congelación, y cocción, pudiendo ser encontrado más tarde en preparaciones gastronómicas, causando finalmente en el humano la enfermedad de transmisión alimentaria denominada anisakidosis (Baird et al., 2014).
La anisakidosis presenta tres formas clínicas: la gastroentérica, que corresponde a la forma más subdiagnosticada debido a signos clínicos inespecíficos y fácilmente confundibles con otras patologías gástricas (Fujikawa et al., 2018); la forma crónica, en donde la larva L3 comienza con la penetración y posterior migración desde el sistema gastrointestinal hacia otros órganos (Mattiucci et al., 2017) y, finalmente, la forma alérgica asociada a un agente etiológico en específico, el cual corresponde a Anisakis simplex que posee compuestos proteicos termoestables (Verga et al., 2017), en donde la signos pueden verse de 5 a 26 h pos-consumo, manifestando desde cuadros clínicos de urticaria hasta shock anafiláctico (Jofré et al., 2008). Se dispone de estudios que han descrito la capacidad de migración de larvas L3 de anisákidos en la anchoveta europea (Engraulis encrasicolus) (Cipriani et al., 2016) y estudios de motilidad (in situ) y migración in vitro a diferentes temperaturas (Guan et al., 2021).
Debido a la información descrita y a la escasa descripción de estos procesos en un pescado tan consumido en Chile como la merluza común, es que se requiere determinar la potencial capacidad de migración parasitaria de anisákidos extraídos de estos peces bajo la forma refrigerada a distintos tiempos, así como observar este proceso en músculos de pescado dispuestos a temperatura ambiente.
MATERIALES Y MÉTODOS
Muestras
El estudio fue de tipo descriptivo, transversal y exploratorio. Se determinó un tamaño muestral por conveniencia de 180 merluzas (Merluccius gayi gayi), que fueron adquiridas directamente desde botes pescadores de la caleta de Duao en la región del Maule, además de una reineta (Brama australis) y un congrio dorado (Genypterus blacodes), en estado fresco y sin eviscerar. Todos fueron refrigerados en forma inmediata a su adquisición. Se estimó un peso promedio de 500 g y un largo promedio de 30 cm para las merluzas, distribuidas en tres grupos similares, para su evaluación a las 24, 48 y 72 h de almacenamiento en refrigeración (4 °C) desde el momento de su captura, respectivamente.
Extracción de Larvas de Anisákidos
Cada merluza fue inspeccionada visualmente en forma detallada. Se realizó una incisión desde el opérculo a la cola para contabilizar los parásitos hallados en cavidad celómica. Posteriormente, en la musculatura epiaxial e hipoaxial se realizaron diversos cortes en forma de filete de no más de 5 mm de espesor en busca de la presencia de larvas. Cada larva extraída fue sometida a una prueba de vitalidad mediante la observación de la movilidad espontánea y con la estimulación directa con la ayuda de una pinza Adson. La vitalidad fue clasificada como: «0» sin movilidad, «+» presenta movilidad y «++» presenta clara movilidad.
Análisis de Datos
Los datos asociados a la presencia de larvas de anisákidos en las merluzas fueron presentados a través de los indicadores descritos por Bush et al. (1997):
Prevalencia: medida de frecuencia que corresponde a fracción de peces con larvas de anisákidos (número peces positivos / total de peces examinados x 100),
Intensidad media que corresponde al promedio de larvas considerando el total de peces positivos,
Abundancia media definida como el promedio de larvas en el total de peces examinados, con o sin larvas.
Para comparar las cargas parasitarias totales presentadas en las diferentes horas de almacenamiento en refrigeración, así como el número de larvas para un determinado grado de vitalidad se utilizó el análisis de varianza. Para establecer si existe alguna relación entre el tiempo de almacenamiento en refrigeración y el grado de vitalidad de las larvas halladas en cavidad celómica se utilizó el estadístico de Chi cuadrado, en ambos casos con un 95% de intervalo de confianza.
La capacidad de invasión de las larvas de anisákidos con vitalidad «++», obtenidas de merluzas con distintos tiempos de almacenamiento se compraró con la capacidad de invasión en músculos de otras especies de pescados y a temperatura ambiente. Para esto, se dispuso de un vaso precipitado con un trozo de músculo de merluza, otro con reineta y otro con congrio. Cada trozo muscular no tenía un espesor mayor a 2 cm y sobre estos se pusieron 10 larvas L3 que fueron dejados a temperatura ambiente por 24 h para evaluar la capacidad de invasión y posterior grado de vitalidad.
RESULTADOS
Prevalencia parasitaria
Las 180 merluzas presentaron parásitos en cavidad celómica. En el primer día de estudio con 24 h de almacenamiento se encontró una prevalencia de larvas L3 de anisákidos en músculo de 21.7% (13 de 60 merluzas). En forma similar, con 48 h de almacenamiento 7 de 60 (12%) presentaron anisákidos y con 72 h se encontraron 5 de 60 (8.3%) merluzas con anisákidos en musculatura. En estos casos se observó al menos una larva incrustada en el tejido muscular, indicando una disminución de esta frecuencia de positivos en la medida que aumenta el tiempo de almacenamiento del pescado en refrigeración (Cuadro 1).
Cuadro 1. Número de larvas halladas en cavidad celómica y músculo de merluzas (Merluccius gayi gayi) extraídas a distintos tiempos de almacenamiento en refrigeración
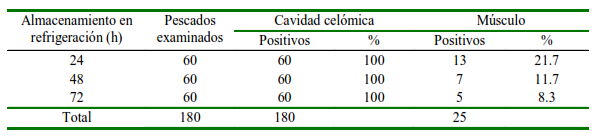
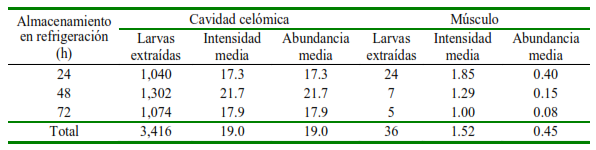
Un total de 3454 larvas L3 fueron extraídas de todas las merluzas en los tres días del estudio, de las cuales 3416 estaban en cavidad celómica y 38 incrustadas en musculatura (Cuadro 3). Los datos de intensidad y abundancia media para las larvas halladas en cavidad celómica no presentaron mayor variabilidad; sin embargo, estos valores en músculo fueron disminuyendo con las horas de almacenamiento del pescado, lo que significa que no solo el número de pescados positivos con larvas en músculo disminuye, sino que también el número de larvas en este tejido disminuye. El valor de abundancia disminuye en músculo hasta 4 veces desde el almacenamiento de 24 a 72 h (Cuadro 2).
Cuadro 2. Datos de intensidad y abundancia media de larvas de acuerdo con los tiempos de almacenamiento en refrigeración
Cuadro 3. Clasificación del grado de vitalidad para larvas extraídas de cavidad celómica y encontradas en musculatura de merluza común (Merluccius gayi gayi)
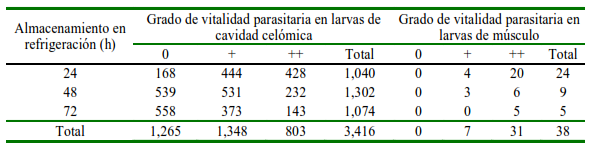
“0” sin movilidad, “+” presenta movilidad, “++” presenta clara movilidad
El total de los pescados presentaron parásitos en cavidad celómica, independiente del tiempo de almacenamiento en refrigeración usado en este estudio. En cuanto a la prevalencia en musculatura, en el primer día de estudio se alcanzó 21.7%, para el segundo día 12% y para el tercer día en el 8.3% del total de peces. En estos casos se observó al menos una larva incrustada en el tejido muscular, indicando una disminución en la medida que aumenta el tiempo de almacenamiento del pescado en refrigeración (Cuadro 1). Los datos de intensidad y abundancia media para las larvas halladas en cavidad celómica no presentan mayor variabilidad; sin embargo, estos valores en músculo fueron disminuyendo con las horas de almacenamiento del pescado, lo que significa que no solo el número de pescados positivos con larvas en músculo disminuye, sino que también el número de larvas en este tejido disminuye. El valor de abundancia disminuye hasta 4 veces desde el almacenamiento de 24 a 72 h (Cuadro 2).
Vitalidad parasitaria
El número de larvas sin vitalidad («0») en cavidad celómica aumentó con las horas de almacenamiento; en tanto que las larvas vitales «+» y «++» disminuyeron en número en la medida que aumentaba el tiempo de almacenamiento en refrigeración (Cuadro 3).
En el caso de la vitalidad de las larvas incrustadas en musculatura, se observó que hubo diferencias entre las medias de cargas parasitarias con vitalidad «++» al aumentar el tiempo de almacenamiento en refrigeración (p<0.001), indicando que el número de larvas en músculo va disminuyendo con el tiempo, y que en el estudio se presentó a las 48 h de almacenamiento en refrigeración (Cuadro 3). Asimismo, se pudo observar una asociación estadística negativa (p=0.0001) entre la vitalidad de las larvas halladas en cavidad celómica con las horas de almacenamiento en refrigeración de las merluzas.
Capacidad de invasión en distintos trozos musculares
Debido a que los pescados son expuestos en muchas ocasiones a temperatura ambiente para su venta, se evaluó si las larvas de anisákidos logran mantener su capacidad de invasión en músculo en esas condiciones ambientales. Para esto, las larvas con vitalidad «++» extraídas del primer grupo de pescados almacenados en refrigeración fueron puestas en la superficie de trozos musculares de tres especies de pescado, encontrando que luego de 24 h a temperatura ambiente al menos una larva de un total de 10 fue capaz de penetrar el tejido muscular de merluza y congrio, mas no así el trozo muscular de reineta.
Al utilizar larvas «++» en pescados con 48 h de almacenamiento en refrigeración, se observó que 2 larvas de un total de 10 penetraron el tejido muscular del trozo de merluza y de congrio, mas no así el de reineta. Por último, al utilizar larvas de 72 h de almacenamiento se encontró que 3 larvas de 10 invadieron el trozo muscular de merluza y sólo una en congrio y una en reineta. Estos resultados, por una parte, sugieren que la capacidad de invasión de las larvas aún se mantiene hasta 72 h de almacenamiento en refrigeración y, que en condiciones ambientales esta migración se hace más efectiva; por otra parte, estos resultados sugieren que puede existir cierta interacción benéfica del parásito con el músculo de merluza, mas no así con la del de congrio o reineta.
DISCUSIÓN
La prevalencia parasitaria obtenida para cavidad celómica concuerda con los datos mostrados por Silva et al. (2020) y Muñoz-Caro et al. (2022), quiénes indican que la merluza común presenta una gran infestación de larvas de anisákidos. Por otro lado, Pardo et al. (2007) reportaron 97.1% de prevalencia de estas larvas en Salminus affinis en Colombia, lo que muestra la gran adaptabilidad de este tipo de nematodo, tanto a nivel de hospedero como de medio ambiente.
En cuanto a la prevalencia parasitaria en la musculatura, los resultados indican que al cabo de 72 h de almacenamiento en refrigeración hubo escasa migración a este tejido desde la cavidad celómica. Estos datos de prevalencia en musculatura son similares a los encontrados por Cattan y Carvajal (1984) en merluza común (M. gayi gayi) con un 6.6% y por Torres (2013) en merluza austral (Merluccius australis) con 9.6%; resultados muy dispares de los encontrados por Madrid et al. (2016) y Silva et al. (2020) con prevalencias en musculatura sobre el 20%.
Se indicaba que no existe migración de larvas a musculatura en merluza chilena (Carvajal et al., 1979) y que incluso el almacenamiento a temperaturas de refrigeración o ambiental no influyen en esta migración (Cattan y Carvajal, 1984). Sin embargo, en el presente estudio se pudo observar que hubo menor migración cuando las merluzas chilenas se almacenaron más tiempo a temperatura de refrigeración, tal como lo evidenció Karl et al. (2011) al estudiar migraciones al musculo a temperaturas de refrigeración en especies salmonideas en Alaska. Recientemente, Cipriani et al. (2024) indicaron que la temperatura y el tiempo de almacenamiento juegan un rol importante en la migración post mortem y que se prevendría con temperaturas de almacenamiento menores a 2 °C.
Cabe destacar que, tanto la vitalidad como supervivencia larval están dadas por el tipo de almacenamiento del pescado. La recomendación es el almacenamiento por congelación, -24 °C por 24 h (Gea, 2015), sin embargo, en los hogares no siempre esto es posible ya que los refrigeradores domésticos solo alcanzan -18 °C y más crítico aún se hace cuando los pescados son vendidos en ferias libres sin métodos de refrigeración. Durante las primeras 48 h de almacenamiento a temperatura de refrigeración se pudo constatar que aún había una gran cantidad de larvas vitales en la cavidad celómica. En el músculo, la vitalidad parasitaria se estaría manteniendo a partir de las 48 h, lo cual podría explicarse por su resistencia a la inmunidad del hospedero (Nieuwenhuizen, 2016).
Los resultados obtenidos en el presente estudio podrían no ser conclusivos debido al tamaño muestral utilizado; sin embargo, concuerdan con la evidencia de que la temperatura ambiental sería un factor importante en la migración de las larvas L3 desde cavidad celómica a músculo, como se pudo evidenciar usando cortes musculares de merluza chilena, reineta y congrio. Cipriani et al. (2024) indican que, a pesar de factores tales como temperatura y tiempo de almacenamiento, las diferencias observadas de movilidad de anisakidos post mortem en diferentes especies de hospederos son atribuibles a las interacciones específicas hospedero-parasito. A partir de esto, se puede decir que dada la escasa literatura sobre la capacidad de invasión de las larvas de los anisákidos, se requiere estudiar estas interacciones hospedero-parásito, especialmente desde un enfoque molecular, ya sea genómico o proteómico.
CONCLUSIONES
La prevalencia parasitaria en cavidad celómica de merluza común en la Región del Maule, Chile, es del 100%, mientras que la prevalencia parasitaria de musculatura alcanzó el 13.8%.
A medida que aumentan las horas de almacenamiento a temperatura de refrigeración, disminuye paulatinamente la vitalidad parasitaria de las larvas extraídas de la cavidad celómica de merluza común, especialmente a partir de las 48 horas, sugiriendo ser la causa de la baja migración al músculo del pescado.












 uBio
uBio 

