INTRODUCCIÓN
El pez Dormitator latifrons (Richardson, 1844), llamado comúnmente chame, popoyote o pocoyo dormilón, es originario del Pacífico centro oriental, y habita en ecosistemas de manglares, lagunas costeras y zonas estuarinas (Massay et al., 1992; González-Martínez et al., 2020). Su capacidad para tolerar un amplio rango de condiciones ambientales tales como temperatura (10 a 40 °C), salinidad (0 a 40‰) e hipoxia (~0.5 mg de O2/L) permiten una mejor manipulación en cautiverio (Zapata et al., 2019). Además, su cuerpo robusto, alta palatabilidad y bajos costos de producción lo potencian como una especie idónea para la acuicultura (Gómez et al., 2021).
En Ecuador, la producción de chame es considerada incipiente, alcanzado apenas entre 800 a 1000 t/año (FAO, 2022). En este sentido, la información de su manejo a nivel poscosecha es escasa, particularmente la forma de expendio del producto en los mercados, ya que estos peces pueden ser conservados «vivos» fuera del agua (anhidrobiosis) durante varios días (Chang y Navas, 1984), lo cual puede alterar su frescura.
La comercialización del chame involucra desde la captura, transporte, almacenamiento, venta hasta su consumo final. Debido básicamente a razones económicas y a su tolerancia, el chame suele ser transportado dentro de recipientes sin agua hasta los centros de venta; no obstante, esta práctica conlleva a condiciones estresantes asociadas a la exposición aérea, hipoxia, manipulación, incremento de la temperatura corporal, inanición e interacción con otros individuos (Corredor-Castillo et al., 2019). D. latifrons es capaz de mantenerse bajo anhidrobiosis tras ejercer respiración aérea de manera facultativa, usando una protuberancia en la parte frontal de la cabeza que funciona como órgano de intercambio gaseoso, pudiendo reservar gases adicionalmente en la vejiga natatoria (Todd, 1973). Esta adaptación le permite sobrevivir fuera del agua durante 18 a 54 h, dependiendo de la humedad corporal. La tolerancia a la anhidrobiosis puede aumentar la tasa metabólica en estos peces, lo cual infiere un incremento en la producción de especies reactivas del oxígeno (EROs); radicales libres que pueden dañar moléculas fundamentales como los lípidos y proteínas (Bickler y Buck, 2007; Giraud-Billoud et al., 2024).
La frescura y calidad del chame depende principalmente de la temperatura a la cual sea conservado. Este parámetro organoléptico puede ser estimado a través de la evaluación sensorial (apariencia, olor, textura, color y aspecto de sus branquias), número de microorganismos asociados, así como su deterioro a través del incremento en los niveles de malondialdehido (MDA) (García, 2017; Vásquez-Sánchez et al., 2020). Adicionalmente, la actividad de enzimas citosólicas como lactato deshidrogenasa (LDH) se usa comúnmente como marcador de lisis celular y señal de la activación del metabolismo anaeróbico (Morcillo et al., 2016).
El estrés ocasionado bajo condiciones de anhidrobiosis y las temperaturas ambientales durante el transporte pueden conducir a un deterioro acumulativo de la calidad del chame, lo cual puede provocar cambios en su composición bioquímica y microorganismos asociados. En este sentido, el presente trabajo reporta la tolerancia del chame a condiciones de anhidrobiosis y cómo su frescura puede ser alterada.
MATERIALES Y MÉTODOS
Ejemplares
Un total de 60 ejemplares de Dormitator latifrons adultos, de talla comercial (245±23 g de peso y 24±1 cm de longitud anteroposterior) sin distinción de sexo ni estadio reproductivo, fueron recolectados desde el humedal La Segua, ubicado en el Cantón Chone, provincia de Manabí, Ecuador. Los peces fueron transportados humedecidos en cestas plásticas, durante una hora, hasta el laboratorio.
Exposición a Anhidrobiosis
Se distribuyeron 30 peces en cubetas plásticas (25x35x45 cm), 5 chames por cubeta, mantenidos bajo una condición de anhidrobiosis en dos ambientes climatizados (16 y 24 °C), durante 96 h. Diariamente, se registró el comportamiento, movimiento opercular e irritabilidad de los peces (Cuadro 1). Adicionalmente, se estimó la supervivencia y tiempo letal medio (TL50) de tolerancia a la anhidrobiosis.
Cuadro 1. Criterios para la evaluación del comportamiento de Dormitator latifrons

Fuente Modificado de Sneddon (2012).
Para mantener la humedad corporal, los peces fueron rociados cada 2 h con agua destilada y estéril con ayuda de un aspersor. Para realizar el análisis sensorial, se utilizaron peces sometidos a anhidrobiosis en periodos de 0, 12, 24, 48, 72 y 96 h, los cuales fueron seleccionados al azar. Una vez sacrificados por choque térmico, se les disecó una porción de músculo de la región dorsal y de sus branquias, los cuales fueron almacenados a -25 °C durante 2 días hasta el momento de la estimación de los parámetros bioquímicos. El pH, la concentración de proteínas y malondialdehido (MDA), y los análisis microbiológicos fueron determinados en músculo. La actividad de lactato deshidrogenasa fue determinada en branquias.
Análisis Bioquímicos
pH, proteínas y malondialdehido (MDA)
Los valores de pH se determinaron en un homogenizado de músculo (sin piel) del chame en agua destilada (500 mg/mL) a través del pHmetro Apera Instruments Al311 (ISO 2917:1999). Las proteínas fueron determinadas por el método colorimétrico de Biuret (Gornall et al., 1949). La lectura fue obtenida a una absorbancia a 540 nm frente al blanco, usando como estándar albúmina de suero de bovino (1 mg/mL).
El malondialdehído (MDA) fue determinado colorimétricamente por el método de Ohkawa et al. (1979) como marcador de daño oxidativo de lípidos. Las absorbancias fueron leídas a una longitud de onda de 532 nm, y su concentración fue valorada usando un coeficiente de extinción molar 156.000 M-1 cm-1.
Lactato deshidrogenasa (LDH, EC 1.1.1.27)
Las branquias (200 mg) fueron lavadas previamente con solución salina al 0.9%. Se homogeneizaron en 4 mL de tampón de fosfato sódico (NaH2PO4/Na2HPO4) 100 mmol/L pH 7.6, que contenía ácido etilen-diamino tetra-tetraacetato (EDTA) 1 mmol/L, sacarosa 500 mmol/L y KCl 150 mmol/L. Para la homogeneización se utilizó un homogeneizador IKA T25 Basic a revoluciones de 12 000 min-1, en un sistema frío (4 °C). El extracto se centrifugó a 5000 g durante 20 min para obtener las muestras sobrenadantes como fuente de enzima. La actividad enzimática se estimó en condiciones de temperatura controlada a 25 ± 1 °C en un espectrofotómetro Evolution 2220 UV/VIS. Los ensayos enzimáticos se realizaron en un volumen final de 1 mL.
Las estimaciones de pendiente se realizaron por seguimiento de la oxidación del Nicotinamina Adenina Dinucléotido reducido (NADH) por piruvato a 340 nm (E= 6.22 mM.cm-1) (Livingstone et al., 1990) durante 3 min. La actividad específica se expresó como U mg proteína-1, donde 1 U es la cantidad de enzima necesaria para catalizar 1 µmol de sustrato por minuto. Se determinó a 25 °C. La actividad de la LDH se expresó como actividad específica por microgramo de proteínas.
Análisis Microbiológicos
Se pesaron 10 g de la musculatura (libre de piel y espinas) de cada pez bajo condiciones asépticas en una bolsa de Stomacher para estimar el recuento de bacterias totales viables. Se añadió 90 mL de agua de peptona tamponada (0.1%) y se maceraron durante 4 min. Esta mezcla representó una concentración de 10-1. Otras diluciones decimales fueron completadas hasta llegar a 10-8. Posteriormente 0.1 mL de cada dilución fue pipeteado sobre la superficie de agar e incubadas a 37 °C durante 48 h para recuento en placas por triplicado.
Evaluación Sensorial
De cinco a seis peces fueron usados para el análisis sensorial de cada una de las condiciones de almacenamientos en los tiempos establecidos. La evaluación sensorial se realizó utilizando el método del índice de calidad (QIM), el cual se basa en la observación de los cambios característicos que sufre el pez en ojos, piel, branquias y musculatura, evaluados mediante parámetros sensoriales como olor, color, aspecto y tacto. Las modificaciones que ocurren en cada uno de estos atributos fueron cuantificadas por un mínimo de cinco panelistas previamente entrenados, a través de una escala de puntuación en demérito de 0 a 3 propuesta por Abaroa (2008).
Análisis Estadístico
Los datos se analizaron utilizando el programa Statgraphics 19 para Windows. Se realizó una prueba de análisis de varianza (ANOVA) de dos vías (temperatura de almacenaje y horas de exposición) con el objetivo de conocer si había diferencia significativa entre las variables estudiadas. Previamente, fueron corroboradas las pruebas de normalidad con test de Shapiro-Wilks y pruebas de Homocedasticidad (Levene). La prueba de Tukey fue utilizada como prueba a posteriori.
RESULTADOS
Supervivencia
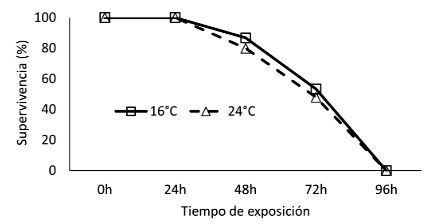
Las curvas de supervivencias fueron similares en los chames expuestos a anhidrobiosis para ambas temperaturas, observándose una tolerancia máxima hasta 96 h. No obstante, su periodo crítico de supervivencia fue evidenciado a partir de las 48 h (Figura 1). El tiempo letal medio (TL50) bajo anhidrobiosis para chames sometidos a un ambiente climatizado a 16 °C alcanzaron un TL50 de 85.2 h (IC 95%= 74.0-98.2 h) y para 24 °C a 71.1 h (IC 95%= 62.7-80.7 h).
Comportamiento
Los peces sometidos a anhidrobiosis, en ambos ambientes climatizados, presentaron un comportamiento considerado «normal» hasta las 48 h. Sin embargo, previo a las 72 más del 50% de los peces estaban aparentemente muertos. Se encontraron diferencias significativas en el comportamiento del chame con respecto al tiempo de exposición (F=4.40; p<0.05) (Figura 2A). Se apreció un movimiento opercular disminuido a 24 °C. Esta respuesta en peces a 16 °C se mostró incrementada y/o sin movimiento (Figura 2B). No hubo diferencia significativa respecto al tiempo de exposición y temperatura (F=0.49; p>0.05). La sensibilidad al tocarlos, en 24 °C fue normal hasta las 24 h, observándose una sensibilidad disminuida hasta las 72 h (Figura 2C). Para todos los casos no hubo diferencias significativas (F=1.50; p>0.05).
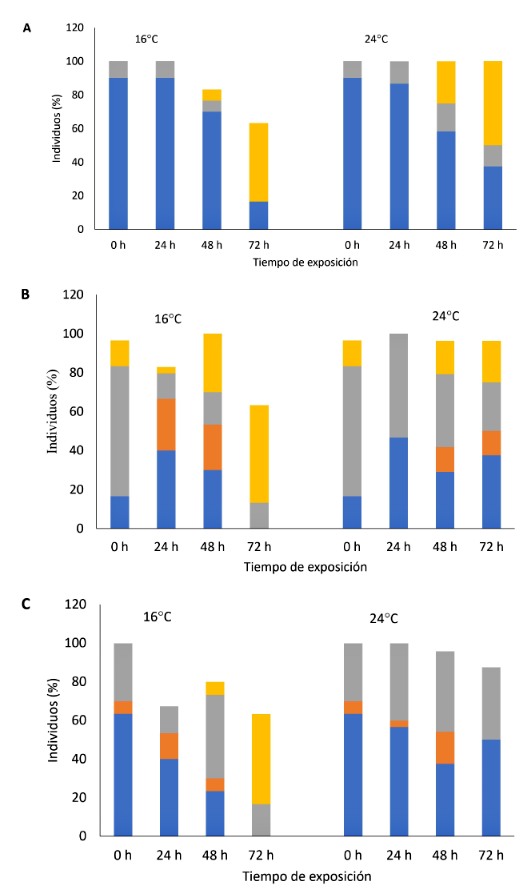
Figura 2. Comportamiento (A), movimiento opercular (B) e irritabilidad (C) de Dormitator latifrons expuesto a anhidrobiosis. Los resultados son expresados en porcentaje de individuos (%). Color azul (normal), gris (agitado/disminuido), amarillo (aparentemente muerto/sin movimiento/sin reacción), naranja (incrementado)
Análisis Bioquímico
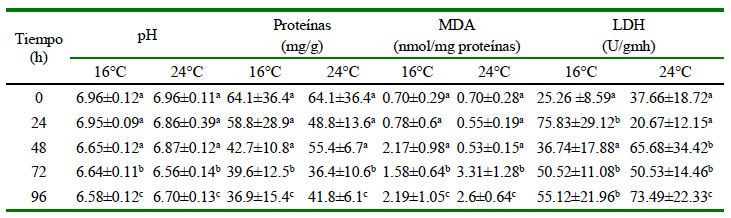
El pH en el músculo descendió a partir de las 24 h para los chames a 24 °C y a las 48 h para los chames sometidos a 16 °C en comparación con el pH inicial (Cuadro 2). Las concentraciones de proteínas no presentaron variaciones entre los tratamientos evaluados (F=1.31; p>0.05). El contenido de MDA en el músculo mostró un incremento significativo relacionado con los periodos de exposición a anhidrobiosis (F=8.78; p<0.05), con promedios que alcanzaron 3.31 nmol MDA/mg proteína a 24 °C en 72 h y 2.19 nmol MDA/mg proteína a 16 °C en 96 h (Cuadro 2). La actividad de LDH incrementó significativamente con relación al periodo de exposición, observándose una mayor actividad durante las 24 h en los peces conservados a 16 C y a las 96 h en peces sometidos a anhidrobiosis a 24 °C (Cuadro 2).
Análisis Microbiológicos
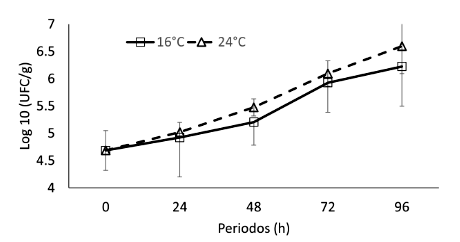
Se observó un incremento en el número de microrganismos en los chames expuestos a anhidrobiosis en los ambientes climatizados durante 96 h, mostrando diferencias significativas entre los días de exposición (F=30.20; p<0.05), más no así entre los tratamientos 16 y24°C(F=2.42;p>0.05).A16 °C se obtuvo una carga microbiana de 4.69 ± 0.36 Log10 UFC/g, que incrementó a 6.23 ± 0.72 Log10 UFC/g luego de 96 h transcurridas. A 24 °C durante 96 h se obtuvo un promedio de 6.60 ± 0.50 Log10 UFC/g, mientras la carga de inicio fue de 4.69 ±0.36 Log10 UFC/g (Figura 3).
Evaluación Sensorial
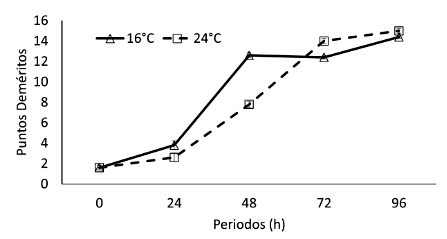
Las puntuaciones de frescura obtenidas de D. latifrons almacenados bajo anhidrobiosis desde las 0 a 96 horas muestran la pérdida progresiva de la frescura en ambas condiciones de almacenamiento, con un incremento mayor, aunque no estadísticamente significativo, en los peces mantenidos a 24 °C (Figura 4). A 16 y 24 °C la evaluación denota una calidad de frescura buena durante 24 h (3 y 4 puntos), mientras que entre 48 y 72 h los peces presentaron una calidad regular de 12 y 8-14 puntos deméritos, respectivamente, siendo considerado el producto de mala calidad a 96 h (14 puntos a 16 °C y 15 puntos a 24 °C). Se obtuvo diferencias significativas en los periodos de exposición (F=49.27; p<0.001).
DISCUSIÓN
Los resultados de los análisis bioquímicos, microbiológicos y sensoriales indican que la frescura del chame D. latifrons bajo exposición a anhidrobiosis puede ser ideal hasta las 48 h. Este periodo crítico para la supervivencia de los chames fuera del agua probablemente se encuentre asociado a una condición de estrés ambiental que provoca el ajuste a la reducida disponibilidad para captar el oxígeno indispensable para los procesos metabólicos. D. latifrons puede sobrevivir fuera del agua por 5 días continuos, habiéndose observado una mortalidad de 50% de los organismos expuestos a hipoxia hasta 18 h (Chang, 1984; Todd, 1973; Vega-Villasante et al., 2021). Se conoce que el consumo de oxígeno es reducido en la mayoría de los organismos tolerante a la anhidrobiosis, lo que conlleva a una condición hipometabólica y comportamiento aletargado (Lefevre et al., 2014). Se presume que la capacidad de respiración aérea facultativa de D. latifrons podría estar relacionada con adaptaciones específicas que le permiten afrontar condiciones extremas como la anhidrobiosis. Estudios más específicos podrían identificar adaptaciones bioquímicas y mecanismos fisiológicos de ajustes durante la anhidrobiosis, particularmente la composición de su piel y su relación con la pérdida de agua excesiva durante esta condición.
El comportamiento de los peces bajo anhidrobiosis fue considerado normal hasta las 48 h, para luego deprimirse a las 72 h, con movimientos operculares disminuidos, movimientos corporales intermitentes y poca sensibilidad, posiblemente destinados a para preservar la energía y activar los mecanismos de respiración aérea para incrementar la captación de oxígeno (Kramer, 1987). Agualsaca (2015) menciona que el chame, al soportar concentraciones bajas de oxígeno desde 0.5 ppm, sus branquias no colapsan cuando están fuera del agua, se mantienen húmedas y el intercambio gaseoso puede ser cutáneo. Esta adaptación le permite al chame vivir fuera del agua en ambiente húmedo de tres a cinco días asociado a una disminución de su tasa metabólica para reducir sus requerimientos de oxígeno y preservar la energía en condiciones de anoxia (Van Waversveld et al., 1989).
La caída del pH en el músculo puede estar relacionado a una alteración ácido-base debido principalmente a la producción metabólica de H+ a través de la síntesis de lactato (Pelster et al., 1988), inclusive ayudado por el posible incremento de bacterias ácido-lácticas favorecidas frente a las aerobias estrictas (Ayala et al., 2010). La musculatura de los peces recién sacrificados tiene un pH cercano a la neutralidad y a partir de este momento, la ausencia de oxígeno origina la glucólisis anaerobia y la acumulación de compuestos ácidos, lo que conlleva a la disminución del pH (Santaella-Pascual, 2015).
El porcentaje de proteína obtuvo un decrecimiento en los dos tratamientos; no obstante, el resultado fue más bajo a los 16 °C, del cual se refleja que a menor temperatura mayor degradación de proteína (Moreira-López, 2022). Adicionalmente, los valores de MDA incrementaron con el tiempo de exposición a anhidrobiosis. Piedrahita et al. (2015) determinaron que la oxidación lipídica en muestras de filetes de pescados de cachama (Piaractus brachypomus), bocachico (Prochilodus magdalenae) y tilapia (Oreochromis niloticus) durante 0, 4, 8, 12, 16 y 20 h expuestos a 30 °C resultó en valores mayores a 1 mg MDA/kg a partir del cuatro día de almacenamiento. No obstante, el pescado de este estudio todavía puede ser consumido ya que los valores de MDA son inferiores a 5 nmol TBARS/mg (Jouki et al., 2014).
La actividad de las enzimas LDH da referencia a la capacidad en el metabolismo anaeróbico que posee D. latifrons para tolerar los cambios ambientales en el ecosistema donde habita. El pez en condiciones fuera del agua es conducido a cambios metabólicos anaeróbicos incrementando la actividad LDH con la generación continua de energía bajo condiciones anaeróbicas provocada por una hipoxia inducida (Farhana y Lappin, 2024). Se ha considerado que la pérdida de la integridad de la membrana celular bajo procesos de apoptosis, necrosis u otras formas de deterioro pueden ser a causa de la liberación del LDH, llevando a consecuencias negativas en la salud del pez (Chan et al., 2013, Kamiloglu et al., 2020).
La carga de aerobios mesófilos al final de bioensayo sugiere que sobrepasa los requisitos de la norma NTE INEN (1896: 2013). Se considera que las temperaturas de 16 y 24 °C ayudan a mantener inhibido el crecimiento microbiano, ya que los aerobios mesófilos se desarrollan en presencia de oxígeno libre y a una temperatura comprendida entre 15 y 45 °C, siendo el rango óptimo entre 30 y 40 °C (Cáceres, 2018; Álvarez, 2021).
Con respecto a la evaluación sensorial, la puntuación de apariencia incrementó con el tiempo de exposición, lo que indica una pérdida progresiva de frescura en las dos temperaturas en estudio. Resultados similares fueron obtenidos por Özogul et al. (2005) en Anguilla anguilla almacenada en dos ambientes (con hielo y sin hielo) y en contraste con Burghi Echeverriarza et al. (2015) donde Oreochromis niloticus alcanzó el mayor nivel de frescura no apto para consumo hasta el día 16, en cámaras de 0-5 °C.
CONCLUSIONES
La frescura del pescado Dormitator latifrons expuesto a anhidrobiosis bajo dos ambientes climatizados (16 y 24 °C) fue conservada hasta las 48 h.
La actividad de lactato deshidrogenasa (LDH) en branquias se incrementó asociada a los periodos de anhidrobiosis y temperaturas, lo cual vincula la activación del metabolismo anaeróbico.
Las bacterias mesófilas incrementaron y el número de microorganismos aerobios se duplicó para ambos ambientes.
El 50% de la supervivencia fue alcanzado a las 48 h en anhidrobiosis para ambas temperaturas y una máxima tolerancia hasta 72 h.
La evaluación sensorial demuestra que a las 48 h se evidencia el deterioro la calidad organoléptica del chame cuando es mantenido «fuera del agua», teniendo una interacción directa con la temperatura ambiental de mantenimiento.












 uBio
uBio