INTRODUCCIÓN
Colossoma macropomum (Cuvier, 1816), denominado «tambaqui» en Brasil y «gamitana» en Perú, puede alcanzar hasta 1 m de longitud total y 30 kg de peso en ecosistemas hídricos amazónicos naturales (Goulding y Carvalho, 1982). Según experiencias de crianza de la especie en estanques de tierra, es capaz de pasar de 164 g a 1.04 kg en un periodo de 5 meses (Hilsdorf et al., 2022). Es una especie que se viene consolidando en la producción acuícola en la Amazonía, siendo una de las especies nativas de mayor producción de aguas continentales en Brasil (Hilsdorf et al., 2022) y en el Perú (PRODUCE, 2022). Entre los factores que han contribuido a este posicionamiento está su capacidad de aceptar raciones balanceadas, manpulación reproductiva y de manejo en ambientes controlados (Izel-Silva et al., 2020; Dos Santos et al., 2021). Es un pez omnívoro con demostrada plasticidad en cuanto a la funcionabilidad de sus enzimas digestivas, que le permiten aprovechar amplitud de ítems alimentarios sean de origen animal (Costa et al., 2024) o vegetal (Araújo-Dairiki et al., 2018; Cortegano et al., 2019; Hilsdorf et al., 2022; Grande-Fernández et al., 2023), sin que esto afecte su desempeño zootécnico.
Diversos estudios indican el buen desempeño corporal de la especie en respuesta a raciones vegetales con inclusión de insumos alternativos procedentes de industrias locales (Dantas et al., 2024), así como en respuesta al uso de insectos como fuente nutricional (Dos Santos et al., 2022; Ordóñez et al., 2022). Asimismo, Grande-Fernández et al. (2023) indicaron que es posible obtener similares condiciones de crecimiento corporal en juveniles de gamitana alimentados tanto con una ración con contenido bajo en harina de pescado como con una ración únicamente vegetal, y que raciones vegetales no alteran el contenido proximal de filetes ni parámetros hematológicos en el pez. Sin embargo, es conocido que raciones vegetales afectan directamente el contenido de ácidos grasos poliinsaturados de cadena larga en el músculo (Melo-Filho et al., 2013).
En ese sentido, un estudio demostró que para la crianza de gamitana con raciones vegetales es recomendable la suplementación con harina de Schizochytrium sp. durante la fase de terminación para garantizar la relación de ácidos grasos n-3:n-6 según valores mínimos recomendados por la Organización Mundial de la Salud - OMS (WHO, 2015) para alimentos de consumo humano. Asimismo, se garantiza mayor deposición de ácido docosahexaenoico (DHA) en la carne, ofreciendo mejor calidad nutricional en términos lipídicos (Cortegano et al., 2019; Hilsdorf et al., 2022). No obstante, estos resultados deben ser validados en condiciones de entorno real en los sistemas de crianza más usualmente aplicados en la Amazonía; es decir, los estanques de tierra excavados (PRODUCE, 2022), para verificar si escenarios de crianza semicontrolada son viables para esta tecnología (Radulovich yKarremans, 1992; Straub, 2015).
El objetivo de este estudio fue validar una tecnología de producción de gamitana rica en DHA en estanques de tierra excavados suministrando una ración vegetal de terminación suplementada con harina de Schizochytrium sp. y evaluar el efecto sobre el crecimiento corporal, contenido proxi-mal, contenido de ácidos grasos, calidad nutricional de la fracción lipíca, pH y características microbiológicas del filete de gamitana.
MATERIALES Y MÉTODOS
Raciones
Se elaboraron dos raciones experimentales vegetales isonitrogénicas (367.5 g de PB kg-1) e isoenergéticas (4401.9 kcal de EB kg-1) (Guimarães y Martins, 2015), difiriendo en la fuente de lípidos y conforme formulación previa establecida por Cortegano et al. (2019) y Grande-Fernández et al. (2023): una ración vegetal (DV) y otra ración vegetal suplementada con 5% de harina de Schizo-chytrium sp. (Allpro/Alltech®) (DS) (Cuadro 1).
Cuadro 1. Contenido proximal y de ácidos grasos de la harina de Schizochytrium sp. y de las raciones experimentales
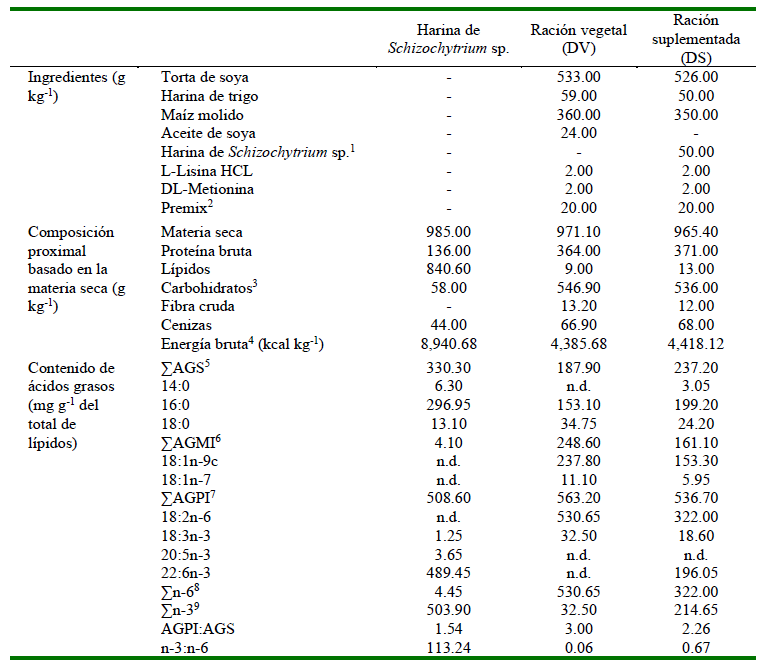
Modificado de Cortegano et al. (2019) y Grande-Fernández et al. (2023). Muestras de la harina de Schizochytrium sp. y de las raciones experimentales (n=3) fueron analizadas por triplicado para determinar el contenido proximal y por duplicado para determinar el contenido de ácidos grasos. n.d. = no detectado.
1 Harina de Schizochytrium sp. (Allpro/Alltech®).
2 Premezcla de minerales y vitaminas (DSM ACUACULTURA) - DSM. Premezcla de BHT y BHA (antioxidantes), vitaminas ROVIMIX®, minerales MICROGRAN® (DSM Nutritional Products Perú). Su contenido (kg) es: Vitaminas: A (9 334 000 UI); D3 (1 866 800 UI); E (93 333 UI); K3 (5.33 g); tiamina (12.00 g); riboflavina (13.32 g); piridoxina (10.00 g); B12 (0.02 g); ácido ascórbico (210 g); niacina (100 g); ácido pantoténico (33.32 g); ácido fólico (2.67 g); biotina (0.53 g). minerales: Cu (1 g); Fe (13.33 g); Mn (26.66 g); Co (0.1 g); I (1 g); Zn (13.33 g); Se (0.2 g). Mezcla de BHT y BHA (26.6 g). Excipientes c.s.p. (2 000 g).
3 Carbohidratos (g kg-1) = 1000 - (fibra cruda + lípidos + cenizas proteína + bruta) (NRC, 2011)
Los insumos se mezclaron por 20 min haciendo uso de una máquina mezcladora de capacidad de 500 kg, extrudizadas a 4 mm de diámetro de pellet (modelo Light M&E ft95 800 a 1000 kg por h) y se secaron usando una máquina secadora de plataforma horizontal a 60 °C por 12 h. Las raciones elaboradas fueron almacenadas en sacos oscuros y conservadas a -18 °C. Durante el periodo experimental, parte de las raciones fueron retiradas y descongeladas en baldes oscuros de plástico para la alimentación de los peces.
Diseño Experimental y Muestreos
El estudio se ejecutó en la Piscrigranja de la Estación Pucallpa del IVITA (8°39’15"S; 74°56’34"W), localizada en el km 58 de la carretera Federico Basadre, Campoverde, Ucayali, Perú. Los procedimientos de manejo con los animales se realizaron garantizando el bienestar animal y el menor dolor para procedimientos de eutanasia (CONCEA, 2013; Jenkins et al., 2014).
El estudio se desarrolló bajo un diseño completamente aleatorizado (DCA) con esquema unifactorial con dos tratamientos: una ración vegetal (DV) y una vegetal suplementada con 5% de harina de Schizochytrium sp., y tres repeticiones por tratamiento (n=3). La determinación de las repeticiones (triplicado) se realizó en base al principio de reducción a las 3Rs en experimentación animal (replace, reduction and refinament), lo que aprueba afirmar que tres repeticiones por tratamiento fueron apropiadas para comprobar diferencia estadística entre los grupos de comparación (NRC, 2011). Las unidades experimentales se constituyeron por tres estanques de tierra de 200 m3 (20 × 10 × 1 m; 1 pez/m3) por tratamiento, previamente preparados (Affonso y Ono, 2016), distribuyendo 1200 juveniles de gamitana (258.9 ± 6.9 g; 22.47 ± 1.67 cm). En las unidades experimentales se garantizó la renovación diaria de 1% de agua para evitar mermas por evaporación.
Todos los animales se alimentaron con la DV durante 120 días. Luego, los peces de tres estanques seleccionados aleatoriamente continuaron su alimentación con DV, mientras que los restantes fueron alimentados con DS por 71 días, tiempo que corresponde al periodo mínimo para maximizar el contenido de DHA en el filete de gamitana (Cortegano et al., 2019). Los peces fueron alimentados 2 veces por día (08:30 y 16:30 h) a una tasa diaria de alimentación de 1.5% en relación a la biomasa (Afonso y Ono, 2016), con ajustes de ración cada 30 días. Las raciones fueron suministradas a ritmo lento que permitió observar rechazo del alimento en algunos días; en estos casos, se anotó el alimento consumido al día y se consideraron estos datos para el cálculo del consumo de alimento. La crianza se ejecutó bajo condiciones de foto periodicidad natural y las condiciones de calidad del agua, oxígeno disuelto (4.20 ± 1.03 mg L-1), temperatura (28.12 ± 2.40 °C) y pH (6.69 ± 1.20), registradas diariamente (HANNAHI98194) fueron constantes a lo largo del experimento y se mantuvieron dentro del rango apropiado para la especie (Ríos, 2021).
Al final del periodo de alimentación, 40 peces por estanque, correspondiente al 20% de la población por unidad experimental, fueron pesados usando una balanza acuática de 4 kg de capacidad (Adam Equipment, ABW 4S, 0.1 g de sensibilidad) y medidos usando ictiómetro de madera graduado en centímetros para evaluaciones de los parámetros de crecimiento corporal. Se optó por no manipular al total de la población debido a que los peces restantes fueron posteriormente utilizados en otra investigación. Para el manejo de los animales, se usó eugenol como anestésico a una proporción de 0.20 ml L-1 para evitar daño en los peces (Dos Santos et al., 2021). Se evaluó el Peso final (PF), Longitud final (LF), Ganancia de peso [GP = PF -peso inicial (PI)], Ganancia de longitud [GL = LF longitud inicial (LI)], Consumo de alimento [CA = alimento consumido], Índice de conversión alimenticia [ICA = CA (GP)-1], Tasa de crecimiento relativo [TCR (% day-1) = (eg-1)×100; donde «e» es el número «nepper» y g = (ln(PF) -ln(PI)) (días)-1], Sobrevivencia [(número final de peces×100)/número inicial de peces], Factor de condición alométrico de Fulton [K = PF (LF3)-1].
Asimismo, 18 peces por cada estanque fueron eutanasiados por punción cerebral. Estos fueron colocados en un envase isotérmico de 200 L, donde se adicionó hielo picado en una proporción 1:1 y se transportaron al Laboratorio de Sanidad Animal del IVITA Pucallpa. Los peces fueron fileteados, molidos y mezclados en un pool por cada tres peces (3 pool por estanque; siendo 3 para análisis de contenido proximal en el Laboratorio de Natura Analítica SAC, Pucallpa, Perú y los otros 3 para análisis de contenido de ácidos grasos en el Laboratorio LABS del Instituto Tecnológico de la Producción (Lima, Perú).
El análisis de contenido proximal, incluyendo de los insumos y la harina de Schizochytrium sp. (n=3), se realizó por triplicado de cada muestra según los procesos indicados por AOAC (2005). Los análisis del contenido de ácidos grasos, incluyendo de los insumos y la harina de Schizochytrium sp. (n=3), se realizaron por duplicado de cada muestra. Para ello, se extrajeron los lípidos conforme Bligh y Dryer (1959). Los ésteres metílicos de ácidos grasos (FAME) fueron preparados (Santos-Júnior et al., 2014) y, luego, separados utilizando un cromatógrafo de gases Perkin-Elmer modelo AutoSystem XL USA, fijado a un detector por ionización de flama (FID) y una columna capilar SUPELCOWAXTM 10 de 30 m de longitud, 0.25 mm de diámetro interno y 0.25 µm de espesor de película. Los parámetros operacionales fueron: temperatura del detector, 270 °C; temperatura del puerto del inyector, 250 °C; presión de 10 psi, volumen de inyección de 2.00 µL, temperatura de la columna, 180 °C por 30 min, programada para incrementar 2 °C min-1.
Para la identificación de los ácidos grasos, los tiempos de retención de los ácidos grasos fueron comparados con los ésteres metílicos padrones (Sigma, EE. UU.). Los tiempos de retención y los porcentajes del área de los picos fueron automáticamente computados con auxilio del Software TotalChrom Workstation v. 6.0. Para su cuantificación, se realizó en comparación al padrón interno de Sigma C23:0 (Joseph y Ackman, 1992). El factor de corrección teórica del detector por ionización en llama se utilizó para calcular la concentración de ácidos grasos (Visentainer, 2012). La calidad nutricional de la fracción lipídica para los filetes de gamitana fue estimada por las relaciones AGPI: AGS (ácidos grasos poliinsaturados: ácidos grasos saturados), n-3:n-6, los índices de aterogenicidad (IA) y trombogenicidad (IT) (Ulbricht y Southgate, 1991), y por la relación de ácidos grasos hipocolesterolémicos e hipercolesterolémicos (H H-1) (Santos-Silva et al., 2002), donde: IA = [12:0 + (4 × 14:0) + 16:0] [ΣAGMI + Σn-6 + Σn-3]1; IT = [14:0 + 16:0 + 18:0] ([0.5 × (ΣMufa + Σn-6)] + [3 × Σn-3] + [Σn-3 Σn-6-1])-1; H H-1 = [18:1n-9 + 18:2n-6 + 18:3n-3 + 20:4n-6 + 20:5n-3 + 22:5n-3 + 22:6n-3] [14:0 + 16:0]-1.
Finalmente, cinco peces por cada unidad experimental se eutanasiaron también por punción cerebral, conforme el número de muestras recomendadas por SANIPES (2016), y colocados en bolsas de plástico al interior de un cajón isotérmico de 60 L de capacidad con hielo a una proporción 1:1. Los peces fueron enviados al Laboratorio de Sanidad Animal del IVITA Pucallpa para el desarrollo de análisis microbiológico del pescado fresco, en términos de cuantificación de Unidades Formadoras de Colonias (UFC) de aerobios mesófilos totales (30 °C), Staphylococcus aureus, Escherichia coli, y estimación de presencia o ausencia de Salmonella sp. en 25 g de carne, y determinación de pH del filete de gamitana (Hinotek, potenciómetro portátil PH-013), con 10 repeticiones por cada muestra. Los procedimientos para los análisis microbiológicos se realizaron según metodología de Da Silva et al. (2013).
Análisis de Datos
La homogeneidad inicial en relación al peso de los animales se corroboró a través del test Q de Cochran, mientras que la verificación de la distribución normal de los datos se comprobó mediante Shapiro-Wilk (p<0.05). Los datos de crecimiento corporal, contenido proximal, contenido de ácidos grasos, calidad nutricional de la fracción lipídica y pH se compararon aplicando el test t-Student para muestras independientes (p<0.05). Los datos de evaluación microbiológica estuvieron en función del límite máximo permisible. Para el análisis de los datos se utilizó el programa Statistica 10.0.
RESULTADOS Y DISCUSIÓN
No se registraron mortalidades durante el periodo de crianza en los estanques de tierra, correspondiendo a la aplicación de adecuadas condiciones de manejo piscícola durante el estudio (Grande-Fernández et al., 2023). La suplementación con harina de Shizochytrium sp. de una ración vegetal suministrada en la fase de terminación establecida por 71 días (Cortegano et al., 2019) no afectó el crecimiento corporal de los peces (Cuadro 2), coincidiendo con diversos estudios que indican que el uso de esta harina en raciones libres de harina y/o aceite de pescado no perjudican el crecimiento de peces (Miller et al., 2007; Sprague et al., 2015; Sarker et al., 2016; Seong et al., 2020; Neylan et al., 2024) y camarones (Allen et al., 2019). Sin embargo, para que esto sea logrado es importante garantizar adecuadas condiciones de manufactura de las raciones considerando el potencial oxidativo de los ácidos grasos poliinsaturados (Trevi et al., 2023), aspecto que fue tomado en cuenta en este experimento.
Cuadro 2. Crecimiento corporal de gamitana, Colossoma macropomum, alimentada con raciones experimentales hasta su fase de terminación

1 Promedio ± desviación estándar. Peso y longitud inicial de los animales = 258.9 ± 6.9 g; 22.5 ± 1.7 cm
2 Ración suplementada con 5% de harina de Schizochytrium sp. (Allpro/Alltech®)
n.s. = no significativo según t-student (p>0.05)
La ración vegetal suplementada con harina de Shizochytrium sp. ofertada en la fase de terminación en una crianza en estanques de tierra no afectó los valores proximales en el filete de gamitana evaluado inmediatamente al finalizar el periodo de alimentación (p>0.05) (Cuadro 3), concordando con datos obtenidos por Cortegano et al. (2019) en experiencia de laboratorio previa. En relación con el contenido de lípidos en el filete, al final del experimento de validación, la gamitana se categorizó como «pescado bajo en grasa»; ya que su contenido de lípidos estuvo en el rango del 2 al 4% de la grasa corporal según la clasificación descrita por Ackman (1989). Si bien esta categorización concuerda con lo reportado para gamitanas criadas en sistema semi-intensivo y en condiciones de laboratorio (Cortegano et al., 2019), es divergente de lo reportado para la misma especie según estudio de Grande-Fernández et al. (2023) para gamitanas provenientes de piscicultura, que tuvieron menor (1.04%) contenido de lípidos; diferencias que pueden estar condicionadas consituaciones de manejo, crianza, edad y formulación de la ración (NRC, 2011).
Cuadro 3. Contenido proximal del filete de gamitana, Colossoma macropomum, alimentada con las raciones experimentales hasta su fase de terminación
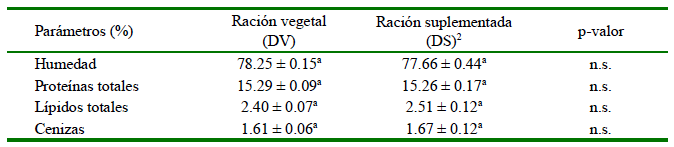
1 Se muestran promedio ± desviación estándar y en base a la materia húmeda
2 Ración suplementada con 5% de harina de Schizochytrium sp. (Allpro/Alltech®)
n.s. = no significativo según t-student (p>0.05)
En relación al contenido de ácidos grasos en el filete de gamitana, 22 ácidos grasos fueron cuantificados con predominancia de los ácidos grasos saturados (AGS), seguido por los monoinsaturados (AGMI) (Cuadro 4). El ácido palmítico (16:0), oleico (18:1n-9c) y esteárico (18:0) fueron los predominantes, aunque sin diferencia estadística para los AGS y AGMI (p>0.05), tal y como fue reportado por Cortegano et al. (2019). Por otro lado, los contenidos de todos los ácidos grasos poliinsaturados presentaron diferencias estadísticas (p<0.05). En ese sentido, el filete de gamitana alimentada únicamente con DV presentó mayor contenido de ácido linoleico (18:2n-6, LN), araquidónico (20:4n-6) y n-6; mientras que, el contenido de ácido linolénico (18:3n-3, LNA), eicosapentaenoico (20:5n-3; EPA), DHA, n-3 y AGPI fue predominante en peces alimentados con DS durante la fase de terminación. Tales tendencias de predominancia de ácidos grasos n-3 sobre ácidos grasos n-6 en peces alimentados con ración vegetal suplementada con harina de Shizochytrium sp. son concordantes con lo determinado por Cortegano et al. (2019).
Cuadro 4. Contenido de ácidos grasos y calidad nutricional de la fracción lipídica del filete de gamitana, Colossoma macropomum, alimentada con las raciones experimentales hasta su fase de terminación
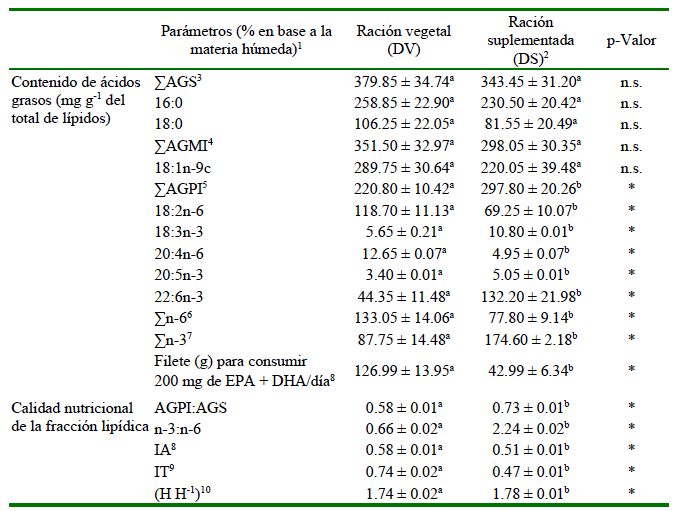
1 Se muestran promedio ± desviación estándar
2 Ración suplementada con 5% de harina de Schizochytrium sp. (Allpro/Alltech®)
3 Ácidos grasos saturados, incluyendo 4:0, 14:0, 15:0, 17:0, 20:0, 22:0
4 Ácidos grasos monoinsaturados, incluyendo 16:1n-7, 18:1n-7, 20:1n-9, 24:1n-9
5 Ácidos grasos poliinsaturados, incluyendo 18:3n-6, 20:3n-6, 20:3n-3, 22:5n-3
6 Total de ácidos grasos de la serie n-6
7 Total de ácidos grasos de la serie n-3
8 Índice de aterogenicidad
9 Índice de trombogenicidad
10 Relación de ácidos grasos hipocolesterolémicos:hipercolesterolémicos
n.s. = no significativo según teste t-student (p>0.05)
* = significativo según t-student (p<0.05)
En cuanto a los peces alimentados con DS, el contenido de DHA fue mayor a lo reportado por Cortegano et al. (2019) a los 71 días de alimentación (39.81 mg g-1 del total de lípidos). De la misma manera, el contenido de LNA, EPA, n-3 y AGPI obtenido al final del período de alimentación fue mayor a lo reportado por dichos investigadores entre los 60 y 75 días de alimentación (5.86 - 6.89 mg de LNA g-1 del total de lípidos; 1.08 - 1.40mg de EPAg-1 del total de lípidos; 43.63 - 51.10 mg de n-3 g-1 del total de lípidos y 164.20 - 174.69 mg de AGPI g-1 del total de lípidos). En ese sentido, es vital precisar que la gamitana es un pez con capacidad de filtración de organismos planctónicos circundantes en el ambiente acuático donde habita (Assis et al., 2020). Asimismo, el fitoplancton en ambientes acuáticos continentales es rico en LA y/o LNA (Tocher, 2010). En así que es probable que la producción primaria existente en los estanques de crianza producto de su preparación haya contribuido adicionalmente en el contenido de LNA de los peces y, subsecuentes reacciones de desaturación y alongamientos típicos en peces de aguas continentales (NRC, 2011), en el contenido de ácidos grasos n-3.
Adicionalmente, con base a los resultados obtenidos sería necesario que una persona solo requiera consumir 42.99 ± 6.34 g de filete de gamitana, inmediatamente cosechado luego del periodo de alimentación con DS, para suministrar los 200 mg de EPA + DHA por día conforme recomendaciones de la OMS para el consumo de esos ácidos grasos (WHO, 2015). No obstante, bajo similares condiciones, 126.99 ± 13.95 g de filete de gamitana alimentada en su crianza únicamente con DV deberían ser consumidos para ingerir la misma cantidad de EPA + DHA. Aun así, los resultados obtenidos en esta validación en campo son alentadores, toda vez que en el experimento en laboratorio realizado previamente (Cortegano et al., 2019) se mencionan que 231.35 g de filete de gamitana alimentada con ración vegetal suplementada con harina de Schizochytrium sp. son necesarios para consumir los 200 mg de EPA + DHA y entre 995.64 g a 1,037.13 g de filete de gamitana alimentada en su crianza únicamente con ración vegetal son necesarios para conseguir similar contenido de EPA + DHA.
Valores más elevados de AGPI:AGS, n3:n-6 y H H-1, así como valores más bajos de IA e IT, indican que la carne del pescado podría ser más beneficioso para la salud humana, garantizando la acción de los ácidos grasos n-3 sobre el organismo humano y previniendo enfermedades en la arteria coronaria (Ulbricht y Southgate, 1991; Cortegano et al., 2017). Los resultados obtenidos con respecto a la calidad nutricional de la fracción lipídica indican que el filete de gamitana que recibió DS en la fase de terminación presentó valores más altos de AGPI:AGS, n-3:n-6e H H-1, así como valores más bajos de IA e IT (p<0.05) en comparación con peces alimentados únicamente con DV.
No hubo diferencias significativas en los valores de pH y microbiológicos del filete de gamitana (Cuadro 5; p>0.05). El valor de pH (6.82 ± 0.15) demuestra un estado fresco del pescado (PAHO, 2020; Ponce et al., 2021); mientras que, la inocuidad microbiológica del pescado cosechado fue garantizada para los dos grupos de filete de gamitana (SANIPES, 2016) por ausencia completa de los microorganismos analizados y por la aplicación de buenas prácticas de manipulación del pescado.
Cuadro 5. pH y evaluación microbiológica del filete de gamitana, Colossoma macropomum, alimentada con las raciones experimentales hasta su fase de terminación

1 Se muestran promedio ± desviación estándar
2 Ración suplementada con 5% de harina de Schizochytrium sp. (Allpro/Alltech®)
3 Límite máximo permisible = >5×105-106 UFC g-1 en 2 muestras o superior
4 Límite máximo permisible = >10-102 UFC g-1 en 3 muestras o superior
5 Límite máximo permisible = >102-103 UFC g-1 en 2 muestras o superior
6 Límite máximo permisible = Ausencia en todas las muestras
n.d. = no detectado
n.s. = no significativo según teste t-student (p>0.05)
CONCLUSIONES
El estudio valida en campo una tecnología de enriquecimiento natural del filete de gamitana (Colossoma macropomum) con DHA, conforme resultados previos obtenidos por Cortegano et al. (2019) en ensayo en condiciones de laboratorio, demostrando que es posible suministrar ración vegetal con harina de Schizochytrium sp. a gamitanas por 71 días antes de su cosecha, sin afectar el crecimiento de los peces, garantizando su inocuidad, sin afectar el contenido proximal del filete e incrementando el valor nutracéutico del pez en términos de incremento del contenido de DHA, n-3, AGPI y mejoramiento nutricional de la fracción lipídica de la carne del pescado y viabilizando la crianza de la especie con raciones vegetales.












 uBio
uBio 


