INTRODUCCIÓN
El empleo de semen criopreservado es cada vez más común en programas de reproducción asistida en equinos (Contreras et al., 2022; Jhamb et al., 2023), principalmente debido a la posibilidad de acceder a semen de alta calidad, conservar material seminal de animales genéticamente superiores por tiempo indefinido, así como facilitar su transporte a largas distancias, entre otros (Salazar et al. 2011; Vasconcelos-Franco et al., 2014). No obstante, la calidad del semen descongelado presenta una gran variabilidad, siendo afectado, entre otros, por los protocolos de congelación y descongelación (Neuhauser et al., 2014; Pereira et al., 2022).
La criopreservación de semen causa daños químicos y físicos en los espermatozoides que tienen como consecuencia una marcada reducción en las tasas de fertilidad (Moraes et al., 2015). El proceso de congelación y descongelación involucra que los espermatozoides sean sometidos cambios extremos de temperatura y osmolaridad (Vasconcelos-Franco et al., 2014). Uno de estos, es el estrés oxidativo, que es generado por la producción excesiva de especies reactivas de oxígeno (ERO), que es uno de los factores más relacionados con las alteraciones asociadas a la pérdida de fertilidad (Restrepo-Betancur et al., 2012). Esto se debe a que la membrana plasmática de los espermatozoides equinos tiene un bajo contenido de colesterol, haciéndolos susceptibles a cambios durante el proceso de enfriamiento, generando daños mecánicos y estructurales en la célula espermática (Hernández-Avilés et al., 2018). Asimismo, los espermatozoides experimentan cambios físicos en sus membranas celulares y cambios de tipo metabólico ocasionados por el estrés térmico, cambios en el volumen celular ocasionado por la adición de crioprotectores en los diluyentes de congelación y cambios de tipo osmótico ocasionados por el uso de diluyentes hipertónicos (Loomis y Graham, 2008).
A fin de disminuir el daño ocasionado por el estrés al que se encuentran sometidos los espermatozoides se han hecho diversos estudios que han evaluado los suplementos en los medios de congelación (Pizarro et al., 2013; Vasconcelos-Franco et al., 2013; Al-Essawe et al., 2018; Hernández-Avilés et al., 2020) y han comparado diluyentes de congelación comerciales (Restrepo-Betancur et al., 2014). Sin embargo, no se ha enfatizado en aspectos relacionados con el proceso de criopreservación de semen, como es el efecto del método y la tasa de congelación, y el tiempo y la temperatura de incubación pos-descongelación (Tomás et al., 2014). Por lo tanto, el objetivo de esta investigación fue evaluar el efecto del método de congelación y el periodo de incubación sobre la calidad pos-descongelación del semen equino.
MATERIALES Y MÉTODOS
Sitio de Estudio
El semen de los equinos fue recolectado en los sitios de crianza de estos animales, en los municipios de Copacabana y Rionegro, Antioquia (Colombia). El semen fue trasladado al Laboratorio de Biotecnología Animal del Centro de Experimentación y a los laboratorios del Politécnico Colombiano Jaime Isaza Cadavid en el municipio de Bello, Antioquia, para su congelamiento y evaluación.
Se trabajó con semen de tres equinos (Equus caballus), raza criollo colombiano con edades entre 2 y 10 años, condición corporal entre 6 y 7 (escala 1-9; Novak et al., 2008) y de fertilidad comprobada por medio de crías nacidas vivas. Los animales se encontraban en condiciones similares de estabulación con alimento disponible y agua a voluntad.
Recolección de Semen
Para la recolección del semen se utilizó una vagina artificial Missouri (Minitube,Alemania), lubricada con gel no espermicida y una yegua para favorecer la estimulación sexual. Se removió la fracción en gel del eyaculado por medio de filtración y el semen fue diluido en una proporción 1:1 en diluyente comercial compuesto por caseinatos, azúcares y antibióticos (EquiPlus®, Minitube, Alemania) precalentado a 32 ºC. Se determinó el volumen, movilidad y concentración de cada eyaculado. El volumen fue medido en una probeta graduada y la concentración espermática (millones de espermatozoides/ml) se determinó mediante fotometría utilizando un Spermacue® (Minitube, Alemania).
El semen fue llevado hacia el laboratorio bajo condiciones de refrigeración (1012 °C) en un dispositivo de transporte Equitainer® (Hamilton Research, EE. UU.). Solo se procesaron eyaculados que cumplieron con los siguientes parámetros mínimos de calidad: movilidad progresiva ≥ 60%, vitalidad ≥ 70%, concentración ≥ 100x106 espermatozoides/ml y espermatozoides morfológicamente normales ≥ 70% (Henry et al., 2002; Pérez Osorio et al., 2018).
Congelación del Semen
El semen diluido fue centrifugado a 850 x g durante 12 min y se descartó el sobrenadante. El pellet resultante fue re suspendido usando el dilutor EquiPlus® (Minitube, Alemania), 5% de N, N-dimetilformamida (DMF) como crioprotector permeable (Sigma-Aldrich, EE. UU.) y 5% yema de huevo. Esta última fue procesada de acuerdo con el protocolo modificado por Nouri et al. (2013), donde la yema fue diluida en una proporción de 3:1 con agua ultrapura y centrifugada a 3400 xg durante 100 min. Posteriormente, el semen diluido se mantuvo en refrigeración a 5 °C por 60 min y se dividió en dos alícuotas en una concentración final de 100x106 espermatozoides/ml, correspondientes a cada experimento. Finalmente, el semen se empacó en pajillas de 0.5 ml (MRS1 Dual V2, IMV Technologies, EE. UU.).
Las pajillas fueron sometidas a dos métodos de congelación (experimentos). En el Exp 1, las pajillas fueron expuestas a vapores de nitrógeno líquido, ubicándose horizontalmente en un contenedor de poliestireno a una distancia de 4 cm de la superficie durante 15 min; luego, las pajillas fueron sumergidas en el termo de nitrógeno líquido a -196 °C.
En el Exp 2, se utilizó un congelador programable (Crysalys®, EE. UU.) con una tasa de descenso de 0.6 °C/min hasta alcanzar una temperatura de -32 °C. Luego, las pajillas se sumergieron en el tanque de nitrógeno líquido. La descongelación de las pajillas se realizó después de una semana a 37.5 °C por 1 min en baño maría. El semen descongelado fue sometido a evaluaciones estructurales y funcionales.
Evaluación Seminal
En el semen fresco y en el tiempo 0 pos-descongelación se evaluó la movilidad y cinética espermática, vitalidad, morfología e integridad de membrana. En el tiempo 1 h posterior a la descongelación se evaluó movilidad y cinética espermática, y en el tiempo 2.5 h se evaluó movilidad, cinética espermática e integridad de la membrana plasmática.
Movilidad y cinética espermática. La movilidad espermática se evaluó mediante un sistema computarizado de análisis de semen (CASA), utilizando un procedimiento modificado del reportado por Montoya et al. (2017). Se determinaron los parámetros: Movilidad Total (MT), Movilidad Progresiva (MP), Velocidad Rectilínea (VSL), Velocidad Curvilínea (VCL) y Velocidad Media (VAP).
Morfología espermática. Se utilizó la tinción eosina-nigrosina modificada por Barth y Oko (1989) y Brito et al. (2011) para determinar anormalidades en las células (MA). Se colocó una gota de semen y una gota del colorante (Sigma-Aldrich, EE. UU.) sobre un portaobjetos a 37 °C, se mezclaron durante 1 min, se realizó el extendido y se realizó una fijación con calor sobre una platina térmica. Los espermatozoides fueron observados al microscopio (100X) y se clasificaron como morfológicamente normales o anormales (Graham y Mocé, 2005).
Vitalidad. Se determinó según Gamboa et al. (2010) con el kit Live/Dead (Molecular Probes). Una suspensión de células (20x106 espermatozoides/mL) en solución Hanks Heppes (HH) con 1% de albúmina sérica bovina (BSA) fue incubada por 5 min a 37 °C con el fluorocromo para ácidos nucleicos SYBR14 y luego con el fluorocromo de ácidos nucleicos yoduro de propidio (fluorescencia roja en células muertas) a 0.48 mM. Se contaron 200 células con un microscopio E200 con fluorescencia HBO (Nikon, Japón), determinándose los porcentajes de espermatozoides vivos (células de color verde) y muertos (de color rojo)
Integridad funcional de la membrana plasmática. Se determinó mediante la prueba hipoosmótica (HOS) reportada por Neild et al. (1999). Se evaluó el hinchamiento espermático de 200 células en un mínimo de cinco campos (400X) utilizando un microscopio de contraste de fase Eclipse E200 (Nikon, Japón).
Análisis Estadístico
Se diseñó un modelo completamente aleatorizado donde las fuentes de variación se ajustaron a un modelo lineal generalizado para cada variable dependiente. Se realizó la prueba de Shapiro-Wilk para verificar la distribución normal de los datos. El método de congelación, método de incubación y el tiempo fueron considerados como variables independientes, mientras que las interacciones entre las variables MP, MT, VCL, VSL, VAP, VE, MA e IM, se incluyeron como variables independientes. Se realizó la prueba de Tukey para comparar las medias de los tratamientos y sus posibles diferencias estadísticas (p<0.05). En todos los análisis se empleó el software estadístico SAS 9.2.
RESULTADOS
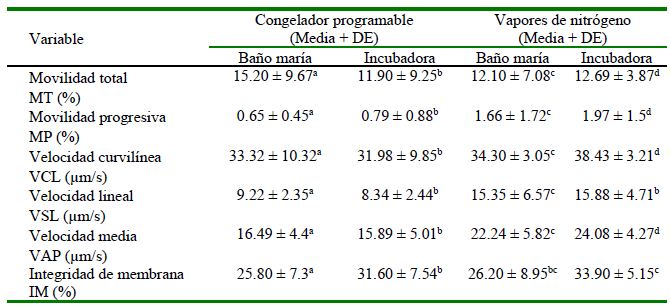
En el Cuadro 1 se muestran los resultados correspondientes a las evaluaciones en el tiempo 0. Las pajillas congeladas mediante el congelador programable presentaron una mayor MT que las pajillas congeladas en vapores de nitrógeno. No obstante, los valores de MP, VCL, VSL y VAP fueron mayores en pajillas sometidas a los vapores de nitrógeno líquido, mientras que los valores de VE, MA e IM fueron similares para ambos experimentos.
Cuadro 1. Medias generales en el tiempo 0 (descongelación) de parámetros de semen equino pos-descongelación
Los resultados se expresan como media ± desviación estándar
a,b Letras diferentes dentro de filas indican diferencia estadística significativa (p<0.05) entre tratamientos
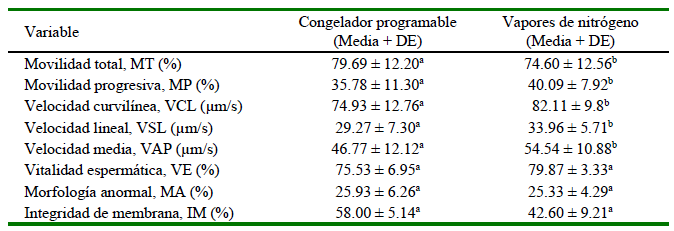
Los resultados correspondientes a las evaluaciones en el tiempo de 1 hora se presentan en el Cuadro 2. Las pajillas congeladas que emplearon vapores de nitrógeno presentaron valores más altos para los parámetros de MT, MP, VCL, VSL y VAP en comparación con aquellas congeladas con el congelador programable. Asimismo, las pajillas mantenidas en incubadora presentaron valores más altos en todos estos parámetros, independientemente del método de congelación empleado.
Cuadro 2. Medias generales en el tiempo 1 hora pos-descongelación de parámetros de semen equino
Los resultados se expresan como media ± desviación estándar
a,b,c Letras diferentes dentro de filas indican diferencia estadística significativa (p<0.05) entre tratamientos
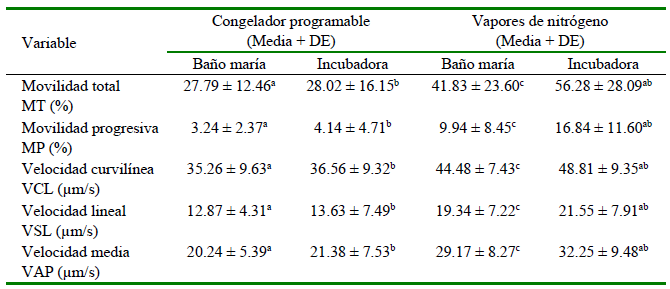
En el Cuadro 3 se presentan los resultados correspondientes a las evaluaciones en el tiempo de 2.5 horas. Las pajillas congeladas mediante el congelador programable presentaron valores más altos de MT cuando se mantuvieron en baño maría, mientras que las pajillas congeladas empleando vapores de nitrógeno presentaron valores más altos de MP, VCL, VSL y VAP, independientemente del método de incubación al que fueron sometidos. Por otro lado, las pajillas mantenidas en incubadora presentaron valores más altos para la mayoría de las variables evaluadas, en comparación con aquellos mantenidos en baño maría.
DISCUSIÓN
Las técnicas de almacenamiento y las metodologías para la conservación de semen pueden presentar variaciones que derivan en una disminución de la calidad en comparación con el semen fresco (Consuegra et al., 2019; Restrepo et al., 2019), trayendo como consecuencia una disminución en las tasas de preñez (Metcalf. 2007; Catalán et al., 2020).
El presente estudio demostró que el semen de equino congelado mediante vapores de nitrógeno tiende a tener valores significativamente más altos para la mayoría de las variables evaluadas, con excepción de la MT. Esto se debe a que los protocolos de congelación rápida y ultrarrápida pueden prevenir la formación de cristales de hielo intra-celulares, gracias a la deshidratación acelerada a la que se expone la célula (Restrepo-Betancur et al., 2012), mientras que con una tasa de congelación lenta los espermatozoides corren el riesgo de sufrir una deshidratación extrema que puede ser perjudicial (Vasconcelos-Franco et al., 2014). No obstante, se reportan resultados contradictorios, donde se plantea que curvas lentas de congelación lenta proporcionan mejores valores en la movilidad pos-descongelación que las curvas rápidas de congelación (Hernández-Avilés et al., 2023).
Neuhauser et al. (2014) evaluaron semen de equino colectado del epidídimo que fue sometido a dos protocolos de congelación (Congelador Programable y Vapores de Nitrógeno) y dos velocidades de congelación (lenta y rápida), encontrando valores más altos para MT, MP, VCL, VSL y VAP al utilizar el congelador programable. Asimismo, estos autores en otro estudio, también con semen de epidídimo, encontraron valores más altos MT y MP ((Neuhauser et al., 2019), concluyendo que el empleo de un congelador programable sumado a una velocidad de congelación lenta permite obtener una mejor calidad del semen descongelado.
Salazar et al. (2011) en su estudio con 24 eyaculados de 8 equinos sometidos a dos protocolos de congelación (lento y rápido) empleando congelador programable y vapores de nitrógeno encontraron valores más altos para MT, MP, VCL, VAP, integridad de la membrana plasmática y del acrosoma, e IM cal utilizar un enfriamiento lento. Sin embargo, Hernández-Avilés et al. (2018), empleando los mismos métodos de congelación empleados en esta investigación, no encontraron un efecto significativo del método de congelación sobre MT, MA, función de la membrana plasmática e IM posterior a la descongelación, de allí que recomendaron el método de vapores de nitrógeno para congelar esperma de equino, por ser más económico y poderse emplear en condiciones de campo. La variabilidad entre los resultados reportados en este estudio y los resultados reportados en la literatura puede deberse a factores individuales, de raza, y del proceso de congelación, entre otros.
Durante la congelación, los espermatozoides pueden sufrir daño oxidativo en los lípidos, las proteínas y la cromatina de la membrana debido al choque térmico; estrés por cambios en el pH, agotamiento de las reservas de ATP y contaminación por microorganismos (Peña et al.,2019; Al-Kass y Morrel, 2024). Además, la congelación desencadena procesos apoptóticos en la célula (Ball, 2008; Peña et al., 2012), así como daños en el ADN espermático (Espinosa-Cervantes y Córdova-Izquierdo, 2018).
Los resultados obtenidos pudieron determinar que la calidad espermática disminuye considerablemente a medida que aumenta el tiempo en el que el semen se encuentra incubado a 37 °C, similar a la temperatura del tracto reproductivo de la yegua. Esto fue confirmado por Neuhauser et al. (2019), que pudieron observar que el esperma evaluado después de 1 h pos-descongelación presentó una disminución en la calidad en comparación con el esperma evaluado a las 0 h. Asimismo, Hidalgo et al. (2017) utilizando semen descongelado y mantenido en incubación a 37 °C, evaluaron el ADN espermático a las 0, 3, 6 y 24 h encontraron que, a medida que aumentó el tiempo de incubación, también aumentaron los niveles de fragmentación del ADN espermático. Resultados similares han sido reportados en estudios en cerdos (Pérez-Llano et al., 2010; Tomás et al., 2014) y en bovinos (Underwood et al., 2009).
Vasconcelos-Franco et al. (2013) evaluaron semen descongelado y mantenido a 37 °C por 0, 60 y 120 minutos, encontrando diferencias diversas pero pequeñas en el número de células vivas y muertas con acrosoma intacto, número de células vivas con acrosoma dañado y número de células muertas con acrosoma dañado, entre los tiempos estudiados.
Los espermatozoides envejecen como consecuencia de una acumulación de macromoléculas dañadas que han sido modificadas químicamente por moléculas reactivas producidas durante el metabolismo de las células. Además, los espermatozoides equinos tienden a perder rápidamente su capacidad fecundante, debido al choque térmico ocasionado por el proceso de congelación, que finalmente conduce al daño celular y la muerte (Peña et al., 2012). Los radicales libres y las especies reactivas de oxígeno (ERO) son fundamentales para la actividad normal de la célula espermática, pero cuando se producen en exceso pueden dañar las membranas, las proteínas y la cromatina espermática (Restrepo-Betancur et al., 2012; Maitan et al., 2021). La oxidación de las proteínas de los espermatozoides puede tener efectos significativos sobre parámetros como MT, MP, VSL, VCL y VAP y estar correlacionada con la morfología normal de los espermatozoides (Úsuga et al., 2016).
La producción elevada de ERO se debe principalmente a la fuga de la cadena de transporte de electrones a nivel mitocondrial sumado a una subsiguiente reducción del oxígeno molecular que forman el anión superóxido, el cual, se dismuta y forma el peróxido de hidrogeno, la principal ERO involucrada en el daño oxidativo. En condiciones hipoosmóticas o hiperosmóticas también se produce una mayor producción de anión superóxido (Ball, 2008; Restrepo-Betancur et al., 2012). Además, Los espermatozoides equinos tienen un metabolismo muy rápido, lo que resulta en una mayor fosforilación oxidativa y una mayor producción de EROS, lo que genera una tasa de peroxidación lipídica más alta (Maitan et al., 2021). Un problema adicional es que los espermatozoides anormales y muertos producen más EROS que los espermatozoides vivos, debido, precisamente, a dicha fuga de electrones. Igualmente, el estrés osmótico ocasionado por el proceso de congelación y descongelación disminuye la capacidad de los espermatozoides de regular su propio volumen celular y genera un proceso de necrosis aguda (Peña et al., 2012).
Se reconoce que las diferencias morfológicas, la composición de la membrana plasmática, las características biofísicas y el metabolismo espermático entre especies y entre individuos, impide la estandarización y el éxito de los protocolos de criopreservación. Asimismo, el éxito del almacenamiento del semen congelado depende de que el espermatozoide tenga la capacidad de resistir diversos tipos de estrés (Darr et al., 2016). Esto llama necesariamente a aceptar que la predicción de la capacidad fecundante de los espermatozoides puede contribuir significativamente al mejoramiento de las biotecnologías de reproducción asistida (Restrepo-Betancur et al., 2013). Por lo tanto, es necesario ampliar la investigación relacionada con la criopreservación de semen equino con el objetivo de mejorar los resultados en los programas de reproducción asistida en esta especie.
CONCLUSIONES
El empleo de vapores de nitrógeno resulta ser el más adecuado para criopreservar semen equino.
El mantenimiento del semen descongelado en incubadora resulta ser más adecuado en comparación con la incubación en baño de agua.
El semen equino descongelado presenta una clara tendencia a perder calidad a medida que aumenta el tiempo de incubación a37 °C en condiciones in vitro.












 uBio
uBio