INTRODUCCIÓN
La riqueza de la biodiversidad de la selva peruana es amplia. El Perú es líder mundial de la mayor diversidad de aves de acuerdo con el Comité de Registros de Aves Peruanas (CRAP) en acorde con los criterios del Comité de Clasificación de América del Sur en 2024 (eBird, 2023). Sin embargo, esta gran biodiversidad conlleva a la existencia de centros de custodia y cautiverio con componentes de rehabilitación y reincorporación a fin de apoyar a la conservación de la riqueza de estas especies de aves silvestres en su medio natural, que en muchos casos se registran situaciones amenazadoras como la caza indiscriminada y el tráfico ilegal.
El estrés causado por el cautiverio genera problemas sanitarios como las enfermedades parasitarias, las cuales son relevantes, no solo por la frecuencia con la que ocurren, sino también por la potencialidad de estar relacionadas con infecciones graves o causar la muerte en una gran parte de la población de aves altamente parasitadas (Barrenechea et al., 2008), sobre todo por especies parasitarias del tracto gastrointestinal (García et al., 2013). Además, cabe considerar que los helmintos son los parasitos que conforman el grupo más común en las aves psitácidas (Hofstatter y Guaraldo, 2015).
Los endoparásitos que afectan las aves psitácidas podrían constituir un riesgo latente o activo en salud pública para la población que constantemente se encuentran en contacto con aves en cautiverio (trabajadores y médicos veterinarios); así mismo, podrían constituir un peligro para los pobladores que indiscriminadamente mantienen a estas aves como mascotas, situación que genera problemas sociales, económicos, médicos y ambientales. Si bien se han reportado parásitos gastrointestinales que evidencian un potencial peligro para los seres humanos, considerándoseles zoonóticos como es el caso de Raillietina que afecta roedores (Chaisiri et al., 2015; Sapp y Bradbury, 2020), existen especies de Raillietina que afectan a las aves, que aún no han sido reportados como zoonóticos, pero existe riesgo de infección parasitaria (Sciabarrasi et al., 2020).
Respecto a las especies parasitarias, en el Perú se ha reportado la presencia de Ascaridia hermaphrodita y Raillietina spp. en un loro harinoso (Amazona farinosa) en la región peruana de San Martín (Matsuno et al., 2016). Asimismo, han sido reportados en su forma adulta en el loro huaro (Amazona amazonica) de vida libre en la región noreste de Brasil (Gomes-dos Santos et al., 2015). Otros estudios realizados con un mayor número de animales como el reportado por Hofstatter y Guaraldo (2015) en una evaluación parasitológica con 170 muestras fecales en aves psitácidas de cautiverio en zoológicos en Brasil evidenciaron que un tercio de las muestras fueron positivas a Eimeria spp., Capillaria sp., Ascaridia sp. y Heterakis sp.
En otros países sudamericanos como Colombia, García et al. (2013) analizaron 100 muestras coprológicas de 16 especies de aves silvestres encontrando monoparasitismo (Cocccidia 75%, Tetrameres 1% y Toxocara 1%), biparasitismo (Coccidia-Ascaridia 9%, Coccidia-Trichuris 4%, Coccidia-Heterakis 2%, Coccidia-Tetrameres 1%) y triparasitismo (Coccidia-Ascaridia-Trichuris 1%, Coccidia-Ascaridia-Heterakis 1%, Ascaridia-Amidostomum-Raillietina 1%). Figueiroa et al. (2002) determinaron diversos géneros parasitarios gastrointestinales en 685 aves Ara macao, obteniendo una prevalencia global de 46.7% de los géneros Capillaria sp., Strongyloides sp., Ascaridia sp., Heterakis sp., Strongyloidea, Spiruroidea, cestodos, trematodos, coccidios, y otros protozoarios como Entamoeba coli, E. histolytica o Balantidium coli. Otras especies menos reportadas fueron Pelecitus circularis, Pelecitus helecinus, Pelecitus andersoni y Pelecitus tercostatus (Allen et al., 1985; Greiner y Ritchie, 1994). Estos hallazgos indican la gran diversidad de géneros parasitarios en aves psitácidas de cautiverio, por lo cual, el objetivo del presente estudio fue determinar la prevalencia coprológica de géneros parasitarios gastrointestinales en aves psitácidas en centros de custodia de fauna silvestre de la región San Martín, Perú.
MATERIALES Y MÉTODOS
Área de Estudio
San Martín es una zona de clima tropical, húmedo y con precipitaciones frecuentes durante todo el año. La temperatura promedio anual se encuentra entre 27 y 29 °C, precipitación media anual de 760 mm y humedad media de 79%. Se seleccionaron tres centros de custodia denominados Centro 1 (75°33’07’’), Centro 2 (76° 17’15’’), Centro 3 (76° 12’ 15’’), ubicados en los distritos de Rumisapa, Lamas (Centro 1); Sector Ahuashiyacu Alto, Banda de Shilcayo, San Martín (Centro 2) y Sector Bocatoma, Tarapoto, San Martín (Centro 3).
Autorizaciones
Se tuvo la autorización de Servicio Nacional Forestal y Fauna Silvestre (SERFOR) con RD N.º D000031-2021-MIDAGRISERFOR-DGGSPFFS-DGSPFS y Código de Autorización N.º AUT-IFS-2021-076 y con la aprobación de la Comisión Institucional Ética de Investigación, Manejo de la Biodiversidad y Bienestar Animal (Aprobado con Resolución N.° 394-2021-UNSM/CU-R).
Muestras de Heces
Las muestras coprológicas fueron colectadas en un periodo de cinco meses (mayo a octubre de 2021). Las muestras fueron colectadas en las primeras horas de la mañana (06:00 h). Para esto, se colocaron láminas de hule extendidas en los pisos de las jaulas para colectar directamente las heces (mínimo 5 g). Las muestras fueron llevadas bajo condiciones de refrigeración con geles refrigerantes y dentro de las 12 horas al Laboratorio de Sanidad Animal de la Facultad de Medicina Veterinaria de la Universidad Nacional de San Martín.
Población y Muestras Colectadas
El número de la población de aves psitácidas en los tres centros de custodia fue de 44 especímenes (Cuadro 1). La muestra se estimó con un nivel de confianza de 95%, con una proporción absoluta esperada de 0.5 y un error de 0.5 mediante la fórmula de poblaciones finitas, resultando en una muestra de 40 muestras. Sin embargo, al no realizar-se un muestreo selectivo por especie, sino que la colecta fue en función a las jaulas como unidad experimental, se procedió a tomar 40 muestras por cada centro de custodia en 11 repeticiones con el fin de aumentar la probabilidad de que todas las aves dentro de cada jaula hayan sido incluidas. Para esto, se tuvo en cuenta factores como la altitud de caída de las heces al suelo, las cantidades de heces liquidas en pequeña proporción por cada ave, y la dificultad de realizar un muestre coprológico selectivo, ya que las aves tienden a estar en grupos. Además, los centros de custodia solo permitieron la toma fecal que caía en las jaulas. Por otro lado, no existió uniformidad proporcional en la cantidad de aves de acuerdo con el número de especies, por lo que no se podría realizar inferencias estadísticas válidas.
Análisis Parasitológico
Los procedimientos de laboratorio coprológicos cualitativos correspondieron a técnicas cuantitativas: frotis directo, técnica de flotación con solución sobresaturada de sal y técnica de sedimentación espontánea (Figueroa y Rodríguez, 2007, Parsa et al., 2023) considerando que estas dos últimas técnicas cualitativas se consideran las más apropiadas para la evaluación de helmintos (Thawait et al., 2014). Los géneros parasitarios fueron identificados de acuerdo con la morfología de los huevos encontrados en los análisis microscópicos (Soulsby, 1982).
El grado de infección parasitaria se clasificó como leve (+) (2-5 formas parasitarias por campo/40X), moderado (++) (6-10 formas parasitarias por campo/40X) y severo (+++) (>10 formas parasitarias por campo/ 40X). Se consideró como muestra positiva aquella con huevos parasitarios en al menos una de las tres técnicas realizadas (Ash y Orihel, 1987).
Análisis Estadístico
Se determinó la prevalencia global y por lugar de procedencia (Centros de custodia). Asimismo, se determinó la relación entre prevalencia parasitaria y procedencia mediante la prueba de Chi cuadrado (p<0.05) aplicando el programa estadístico R studio (2020). Adicionalmente, se determinó las coinfecciones parasitarias (mono, bi y triparasitismo).
RESULTADOS Y DISCUSIÓN
Prevalencia coprológica de géneros parasitarios
La prevalencia coprológica global de parasitos gastrointestinales de aves psitácidas fue de 27.50% (33/120) Los agentes parasitarios identificados fueron Ascaridia sp. (10.83%) (13/120), huevos tipo Strongylus (10.0%) (12/120) y Capillaria sp. (8.33%) (10/120) (Cuadro 2). Todos los animales positivos evidenciaron un grado de infección leve (100%).
Cuadro 2. Parásitos gastrointestinales hallados en 120 muestras coprológicas de aves psitácidas en tres Centros de Custodia en la región San Martín (Perú)
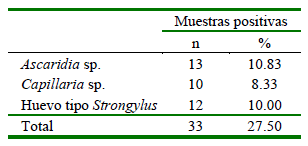
Se evidencia una prevalencia mayor por Ascaridia sp. En este sentido, Gomes-dos Santos et al. (2015) y Hofstatter y Guaraldo (2015) encontraron una mayor prevalencia de Ascaridia sp. (58%) en aves psitácidas, donde nematodos Ascaridia sp. y Capillaria sp. fueron los de mayor frecuencia en loros en cautiverio. Así mismo, en Tarapoto, Matsuno et al. (2016) hallaron Ascaridia hermaphrodita y Raillietina spp. adultos en un animal rescatado de un decomiso.
Estos resultados se diferencias con respecto a García et al. (2013), donde el tipo de parásito más frecuente fueron coccidias, seguido de Ascaridia sp., Trichuris sp., Heterakis sp., Tetrameres sp., Amidostonum sp., Raillietina sp. y Toxocara sp.; diferencias que podrían atribuirse a la mayor diversidad de familias de aves, parte de las Psitácidas del presente estudio, así como de la ubicación (altitud de 2550 m vs 550 m en el presente estudio). Por otro lado, se dispone de reportes de prevalencias bajas como en el estudio de Abbaszadeh et al. (2024) en Irán con 0.13% (1/751) de parásitos a nivel coprológico tanto para Eimeria spp. y una especie parasitaria Heterakoidea y ningún protozoario como Giardia sp. o Cryptosporidium sp. en dos años de muestreos coprológicos.
El 100% de los casos positivos correspondieron a un grado leve de infección, compatible con lo indicado por Hofstatter y Guaraldo(2015) y Figueiroa et al.(2002), quienes afirman que existe una tendencia entre las aves cautivas a presentar cargas parasitarias en mayor grado que aves en libertad, lo que sería un indicativo de amenaza de la salud de aves mantenidas en cautiverio.
Coinfecciones parasitarias
Si se consideran únicamente las muestras positivas (33/120), se evidenció un monoparasitismo de 94% (31/33) y biparasitismo de 6% (2/33). El alto nivel de monoparasitismo es compatible con el estudio de García et al. (2013), quienes reportaron 77% de monoparasitismo, evidenciando infecciones con parásitos de ciclos directos. No obstante, Figueiroa et al. (2002) obtuvieron un mayor porcentaje de poliparasitismo, debido, probablemente a que, en las zonas de estudio, las aves tuvieron contacto directo con otras fuentes externas de infección como roedores e insectos.
Relación entre la procedencia de las aves y la prevalencia
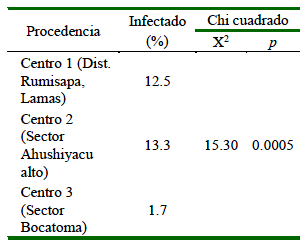
Los resultados evidencian una relación de dependencia entre la prevalencia parasitaria y la procedencia (centros de custodia) de las aves (p=0.00; Cuadro 3), donde la mayor prevalencia fue hallada en el Centro 2 (13.3%).
Cuadro 3. Asociación entre la procedencia (Centro de Custodia) y la prevalencia de parásitos gastrointestinales en aves psitácidas (San Martín, Perú)
La evaluación de las variables mediante el análisis de correspondencia (multivariado) explicó a través de eje 1 el 36.87% de la información contenida y mediante el eje 2 el 24.50% (Cuadro 4). Es decir, el análisis permite explicar el 62 % de la variabilidad del estudio.
Cuadro 4. Coeficiente de correlación multivariada de los factores analizados y variabilidad y variabilidad acumulada de cada eje
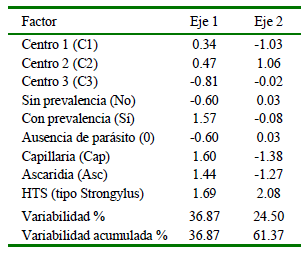
Cabe considerar que el Centro de Custodia 2 (sector Ahushiyacu alto) posee un medio ambiente (altitud de 990 msnm) que difiere de los otros que se encuentran por debajo de los 350 msnm. Además, la localización de ese centro es de libre acceso ya que por su relieve geográfico no es posible limitarlo, de allí que podría haber acceso de otras aves de vida libre u otros animales reservorios como animales vertebrados o invertebrados a las jaulas de estos animales pudiendo transmitir los agentes parasitarios reportados. Por otro lado, el clima de esta zona es más frío que en los otros dos centros, ya que podría llegar hasta 12 °C, siendo un factor que podría mantener a los huevos parasitarios por largos periodos de tiempo.
CONCLUSIONES
Ascaridia sp. presentó mayor prevalencia (10.83%) (13/120) seguido por huevo tipo Strongylus (10.0%) (12/120) y Capillaria sp. (8.33%) (10/120) en aves Psitácidas de tres Centros de Custodia en la Región San Martín, Perú.
El Centro de Custodia 2 tuvo mayor porcentaje de prevalencia (13.3%) (16/40) con respecto a los otros centros, lo cual determinó asociación estadística significativa entre prevalencia de parasitismo y procedencia de los centros de custodia (p<0.005).
El monoparasitismo fue mayor (94%) sobre el biparasitismo (6%) en las aves psitácidas de los tres centros de custodia.












 uBio
uBio 



