INTRODUCCIÓN
El Virus Distemper Canino (VDC), perteneciente al género Morbillivirus, posee un genoma con un ARN monocatenario de sentido negativo no segmentado, con 15 960 nucleótidos, codificando seis proteínas estructurales: nucleocápside (N), fosfoproteína (P), de matriz (M), proteína grande (L), de fusión (F), y hemaglutinina (H) (Karki et al., 2022). Las proteínas H y F son glicoproteínas específicas de la envoltura viral, participando en el reconocimiento de los receptores celulares para VDC y en la entrada hacia las células del huésped. La molécula de activación linfocitaria de señalización (SLAM o CD150), es un receptor propio de células B, T activadas, de memoria, monocitos activados y células dendríticas (Tatsuo et al., 2000). Asimismo, la proteína de unión adherente nectina-4 (PVRL4), corresponde a un receptor expresado en el epitelio traqueobronquial de células linfáticas y epiteliales (Pratakpiriya et al., 2017). Para el caso de las células gliales del Sistema Nervioso Central, se ha descrito que el receptor denominado GliaR estaría presente en la transmisión del VDC y astrocitos (Zhao y Ren, 2022). Adicionalmente, la nucleoproteína viral se une como factor soluble al receptor CD32 de los linfocitos B y el sulfato de heparina presente en la superficie de las células epiteliales actúa como receptor para la hemaglutinina (Céspedes et al., 2010).
Esta virosis, a pesar de ser específica de caninos, ha sido asociada con brotes severos en macacos, mostrando un alto potencial para atravesar barreras interespecíficas. Así, Rohowsky-Kochan et al. (1995) demostrarían que la Esclerosis Múltiple (EM) podría deberse a una infección zoonótica y por tanto VDC sería un candidato probable en la causa de este trastorno. Entonces, la evidencia de que el humano podría infectarse con este virus neurotrópico no es utópico. Sumado a estas consideraciones, hoy se conocen cepas de VDC que crecen eficientemente en células de varias especies, característica que mantienen los virus recombinantes (Zhao y Ren, 2022). Entonces, proteína H como determinante del tropismo viral, sugiere reconocimiento-adhesión a un componente de la superficie celular conservado/ubicuo o proteínas diferentes.
La proteína cinasa II (CaMKII) es una holoenzima compuesta por 12 subunidades, las cuales poseen un dominio catalítico y regulador, que incluye una región autoinhibitoria y un sitio de unión al Ca2+/CaM. Las subunidades se ensamblan a través de un dominio asociativo en el extremo carboxiterminal (Gaertner et al., 2004; Myers et al., 2017; Zalcman et al., 2018; Bhattacharyya et al., 2020). La CaMKII se activa dependiente de Ca2+ mediante su incremento a nivel intracelular a través de receptores de N-metil-Daspartato (NMDA) tras interactuar con el glutamato y CaMKII se fosforila en serina o treonina (Strack et al., 2000; Mao et al., 2014). Esta fosforilación le permite mantenerse activa en una subunidad después de autofosforilarse en T286 (en la subunidad α en T286 o en β en T287) independiente del aumento de calcio (Lisman et al., 2012). Por lo tanto, actúa como memoria sináptica a largo plazo en la densidad postsináptica (Thalhammer et al., 2006).
La autofosforilación de CamKIIen T253 está implicada en la muerte celular neuronal inducida por isquemia (Rostas et al., 2017; Rumian et al., 2021). CaMKII también puede causar la muerte celular programada al sensibilizar a poblaciones neuronales vulnerables a la señalización de glutamato excito-tóxico (Rostas et al., 2017). La disminución de CaMKII en diversas circunstancias patológicas de la corteza cerebral puede impedir el funcionamiento sináptico en las fases iniciales de los mecanismos neurodegenerativos crónicos, provocando una muerte celular programada al aumentar la vulnerabilidad de las neuronas susceptibles a la señalización del glutamato y fomentar la agresión excitotóxica (Gupta et al., 2010; Ashpole et al., 2012). La CaMKII es una proteína quinasa que tiene cuatro isoformas (α, β, γ, δ). Las formas alfa y beta se encuentran principalmente en el cerebro (Zalcman et al., 2018). Saha et al. (2006) estudiaron la regulación de CaMKIINá/â en el sistema nervioso central (SNC),mostrando que el gen CaMKIINa de ratón codifica a una transcripción específica de cerebro de 2.9 kb cuya expresión está regulada negativamente durante la infección por el virus de la encefalitis japonesa (JEV) y el virus de la rabia, observándose cambios en la fosforilación, así como en la localización subcelular de CaMKIIa que conducen a un aumento de la actividad citosólica de CaMKII en el cerebro del ratón infectado.
La regulación diferencial de CaMKIIa y CaMKIINa durante la infección por JEV sugiere un posible papel de estas proteínas en la infección viral y/o en la neuropatogenia inducida por virus en el SNC. Es así que se considera relevante investigar sobre la regulación de la CaMKII citoplasmática en la comprensión de la neurovirulencia del Virus Distemper Canino y en la posible producción de antivirales exitosos.
MATERIALES Y MÉTODOS
Reactivos e Insumos
Glicina (SC-29096A), Azul de Bromo-fenol (SC-24971), DAPI (4',6-Diamidino-2fenilindol) (SC-3598) de Santa Cruz Biotechnology USA., Suero fetal bovino de Life Technologies (USA), Penicilina y Estreptomicina (Sima-Aldrich, USA). MTT (3-(4,5-dimetiltiazol-2-yl)-2,5-difeniltetrazolio), Tritón X-100, BSA (Albúmina Sérica Bovina), Amersham ECL Rainbow Marker (GERPN800E), DMEM de alta glucosa (D6429) (Sigma Aldrich, USA), Anticuerpo primario P-CamKII (Thr 286) anticonejo mAb Anti-Chicken IgG (H+L), F(ab) fragment -Texas Red®, Anti-Chicken IgG (H+L), F(ab#)2 de Cell Signaling.
Muestra Nasal de VDC y Homogenizados
Se recolectaron muestras de secreción nasal de perros con sintomatología de infección por el VDC siguiendo las pautas de bioseguridad que incluyeron el uso de equipo de protección personal, desinfección adecuada de las manos y uso de hisopos nasales estériles conteniendo suero fisiológico helado. Las muestras fueron transportadas bajo congelamiento y almacenadas a -80 °C.
La preparación de homogenizados positivos (Inmunocromatografía VDC) para el VDC se hizo a partir de muestras de secreción nasal de perros infectados. Para ello, las muestras fueron sometidas a un lavado inicial con DMEM de alta glucosa (D6429) (Sigma Aldrich), centrifugadas por 15 min a 3500 rpm. Se separó el sobrenadante, el cual contiene las partículas virales. Se adicionó penicilina U/mL y estreptomicina 1 µg/mL (Sigma-Aldrich) para evitar contaminaciones indeseadas. El sobrenadante se utilizó para preparar un stock viral de 1:100 en DMEM, mantenido a una temperatura de 4 °C durante 20 min para estabilizar las partículas virales antes de su almacenamiento. Finalmente, los homogenizados de VDC resultantes fueron almacenados a -80 °C para su conservación a largo plazo.
Cultivo in vitro de Células Neuronales de Retina
El desarrollo de los cultivos primarios embrionarios se llevó a cabo utilizando huevos fertilizados de gallina White Leghorn, obtenidos de una granja avícola de la región de Arequipa, Perú. Los huevos se incubaron a una temperatura constante de 37 °C en una atmósfera humidificada (5%) adecuada para su viabilidad. A los 8 días de incubación (E8), los embriones fueron extraídos en condiciones estériles. Se realizó la remoción de los ojos mediante enucleación y se transfirieron a una solución salina sin Ca+2 y Mg+2 (CMF), suplementada con antibióticos como penicilina (100 U/mL) y estreptomicina (100 ìg/mL). Las retinas fueron aisladas de los globos oculares y transferidas a un tubo de ensayo estéril con CMF y Tripsina 0.2% en 1:1.
Las retinas se incubaron a 37 °C durante 20 min. Luego se procedió a inactivar la enzima y lavar tres veces con medio de cultivo DMEM. Se procedió a la disociación mecánica con DMEM en golpeteos contra la pared del tubo. La suspensión celular fue diluida en DMEM 1:10, para luego realizar el conteo en placa de Neubauer. Para el plaqueo se aplicó una densidad de 4x106 y 107 células. Las placas fueron incubadas a 37 °C en una atmósfera de 95% de oxígeno y 5% de CO2. Todo el proceso de disección, disociación y cultivo de células se llevó a cabo siguiendo estrictas medidas de bioseguridad y esterilidad para garantizar la integridad de los cultivos primarios embrionarios.
Viabilidad Celular por Ensayo de MTT
La viabilidad celular de las células de retina expuestas al Virus Distemper Canino se evaluó a través del ensayo de MTT (3(4,5-dimetiltiazol-2-yl)-2,5-difeniltetrazolio), ensayo colorimétrico para evaluar la actividad metabólica celular. Las células fueron incubadas con VDC con TCID50 de 104 durante 48 h. El reactivo MTT fue añadido a una concentración de 1.5 mg/mL incubado por 4 h. Después de la incubación, los cultivos fueron lavados con una solución salina de Hank (NaCl 128 mM, KCl 4 mM, Na2HPO4 1 mM, KH2PO4 0.5 mM, MgCl2 1 mM, CaCl2 3 mM, HEPES 20 mM y glucosa 12 mM, con un pH de 7.4). Para la lisis celular, se utilizó la solución de Isopropanol y HCl (0.6:1). Para cuantificar la viabilidad celular se midieron las absorbancias de las muestras utilizando un espectrofotómetro (Ultrospec 1000) a una longitud de onda de 570 nm. La absorbancia a esta longitud de onda se correlaciona directamente con la cantidad de formazan producida por las células viables expresada en porcentaje con respecto al control.
Las proteínas solubilizadas se separaron en geles de poliacrilamida SDS al 10%, lo que permitió su separación según tamaño y peso molecular. Estos geles fueron utilizados para la electrotransferencia de las proteínas a membranas de fluoruro de polivinilideno (PVDF), asegurando una transferencia eficiente para la detección de proteínas específicas. Para evitar la unión de anticuerpos a regiones inespecíficas en las membranas, se bloquearon con una solución de leche en polvo desnatado al 5% durante 1 h a temperatura ambiente, utilizando TBS más 0.1% de Tween-20 (TBST) como disolvente. Luego, se incubaron las membranas en TBST con leche desnatada al 5% y el anticuerpo primario específico, en este caso, el anticuerpo anti-P-CaMKII (1:1000) Thr 286. Posteriormente, las membranas se incubaron con el anticuerpo secundario Anti-Chicken IgG (H+L) durante 1 h diluido a 1:1500 en el tampón adecuado. Las bandas de proteínas inmunorreactivas se detectaron mediante quimioluminiscencia con el sistema de sustrato Super Signal ECL-HRP, permitiendo la detección de proteínas específicas en las membranas. Finalmente, se utilizó el anticuerpo anti-ERK como control de carga de proteínas para asegurar cantidades similares de esta proteína en todas las muestras del gel.
Marcación por DAPI para la Detección de Núcleos Apoptóticos
Para la marcación nuclear de los cultivos neuronales, se procedió a utilizar el marcador fluorescente DAPI (4´,6-diamidino-2fenilindol) en cultivos tratados o no con VDC 104 por 1 h, fijados con paraformaldehído 4% por 24 h. Posteriormente, se realizó lavados con PBS 1x por 3 veces por 5 min. Los núcleos de los cultivos neuronales fueron marcados con DAPI 0.5 µg/ml durante 1 min en una cámara húmeda, protegido de la luz y lavado (2x) con PBS 1x durante 2 veces de 5 min cada vez. Finalmente, se montaron las lamínulas redondas invertidas con aceite de inmersión en láminas portaobjetos, se sellaron y se llevaron al microscopio de fluorescencia.
Análisis Estadístico
Se realizó un análisis estadístico para evaluar la significancia de las diferencias observadas entre los grupos de tratamiento y control en los experimentos de viabilidad celular por MTT, utilizando pruebas estadísticas de Análisis de Varianza (ANOVA) con Test de Comparación Múltiple de Bonferroni (p<0.05; p<0.01). Los datos obtenidos se sometieron a un análisis estadístico detallado utilizando el programa GraphPad Prism 9.0.
RESULTADOS
Efecto citotóxico del VDC TCID50 10 4 sobre cultivo de células neuronales de retina embrionaria de gallina
El neurotropismo del VDC se caracteriza por la interacción proteica de las glicoproteínas monoméricas H y F del virión con el receptor celular del hospedero neuronal (no definido). Esta interacción dispara una respuesta celular que fue evaluada a través de la incubación de homogenizados de VDC a partir de una dilución de 104 (TCID50) por 48 h aplicadas sobre cultivos neuronales de retina con una densidad de 5x106 células/placa por el ensayo de MTT. El análisis de la determinación del porcentaje de actividad metabólica del succinato dehidrogenasa mitocondrial por la técnica de MTT mostró el efecto citotóxico del VDC con 49.16% de viabilidad celular comparado con el control (p<0.01) (Figura 1).
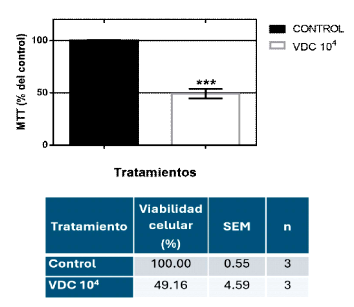
Figura 1. Efecto citotóxico del Virus Distemper Canino 104 incubado por 48 h sobre cultivos neuronales de retina de gallina E8C2. En la parte superior de la tabla se muestra el porcentaje promedio de los tratamientos. En el gráfico de barras se observa que el VDC a las 48 h provoca una pérdida de la viabilidad celular (p<0.01). SE (Error Standard). Resultado de tres experimentos
La morfología de las células neuronales cultivadas in vitro a partir de retina embrionaria de gallina E8C2, infectadas o no infectadas con homogenizados de VDC con un TCID50 104 fueron observados por microscopía de contraste de fase. A las 48 h de exposición se observó una diferencia importante en cuanto a la alteración morfológica neuronal y glial de la retina de gallina, donde aquellas tratadas con VDC evidenciaron un disgregamiento celular, pérdida de procesos de axones y dendritas, así como un aparente proceso de muerte celular (Figura 2).
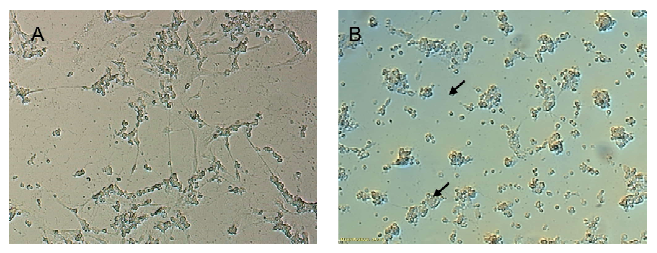
Figura 2. Microfotografías de cultivos de células neuronales retina embrionaria de gallina 4x106 células/placa (E8C2) incubados con homogenizados de Virus Distemper Canino -VDC (stock 1:300 MEM) con TCID50 104. (A) Cultivos no infectados (B) Cultivos infectados con VDC, 104 por 48 h. Flecha negra: Células aisladas sin dendritas y axones, entrando en un proceso de muerte celular. 10X
Asimismo, para confirmar el efecto neurotóxico del VDC y tipo de muerte celular sobre cultivos neuronales de retinas de embrión de gallina se realizó la detección con el marcador nuclear DAPI. En la Figura 3 se observan microfotografías comparadas de cultivos tratados y no tratados con VDC. Se señalan los núcleos picnóticos caracterizados como evento tardío de un proceso apoptótico.
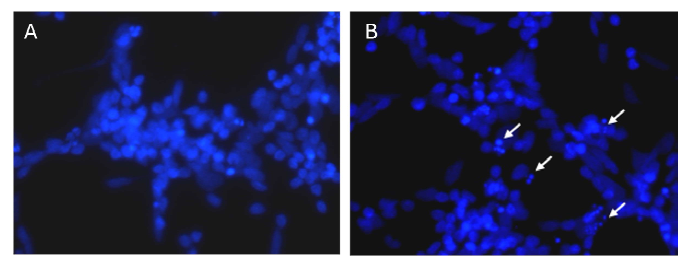
Figura 3. Microfotografías de cultivos de células neuronales de retina de embrión de gallina marcadas con DAPI detectadas por microscopia de fluorescencia. Se observan núcleos contra teñidos con DAPI (1:1000) por 30 s. (A) Cultivos retinales de embrión de gallina E8C2 sin tratamiento (B) Cultivos tratados con Virus Distemper Canino 104 por 1 h. Flechas blancas: Núcleos picnóticos de células en apoptosis. 37.8X
Respuesta inflamatoria glial y excitoxicidad en cultivos de células neuronales de retina embrionario de gallina E8C2 infectados con VDC 10 4
La infectividad viral se caracteriza por una respuesta inflamatoria inmediata del hospedero, siendo que en un modelo del SNC, la glía sería una de las principales células activadas. En la Figura 4 se muestran los cambios morfológicos observables por microscopía de contraste de fase, tal como hiperplasia e hipertrofia glial inducidos por tratamiento con VDC en 1 h de incubación.
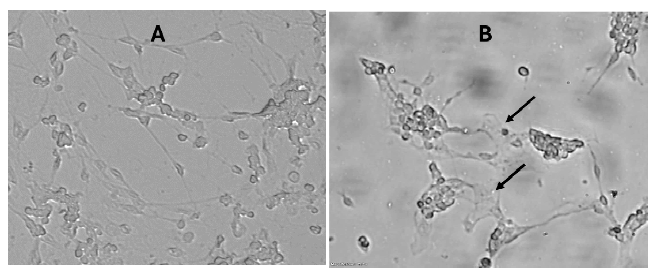
Figura 4. Reacción inflamatoria glial por Virus Distemper Canino - VDC en cultivos de células neuronales de retina embrionaria de gallina 4x106 células/placa E8C2. (A) Cultivos no infectados. (B) Cultivos tratados con VDC 104 por 1 h. Flecha: Glía activada por proceso inflamatorio con hiperplasia e hipertrofia. 37.8X
A través de estos datos y sabiendo que una reacción inflamatoria glial podría ser relacionada a eventos excitotóxicos la pregunta sería si el modelo neuronal con estímulo de Glutamato tendría una respuesta de pérdida celular similar al VDC 104 en 48 h. De este modo, en la Figura 5 se muestra que Glutamato 1 mM induce una pérdida de alrededor de 51% similar al homogenizado de VDC 104, lo cual indicaría la posibilidad de una muerte neuronal a través de un proceso excitotóxico.
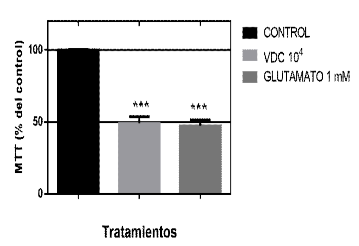
Figura 5. Virus Distemper Canino - VDC TCID50 104 induce efecto excitotóxico sobre cultivos retinales de embrión de gallina E8C2. Gráfico de barras mostrando el porcentaje de viabilidad celular con respecto al control. Se observa comparativamente el efecto de pérdida celular por VDC y glutamato 1 mM. Medias± SEM, n=3.***p<0.001 en comparación con el grupo control. ANOVA con prueba de comparación múltiple de Bonferroni
VDC induce fosforilación de CamKII (PCamKII Thr286 ) en cultivos neuronales de retina
De acuerdo con los resultados anteriores y considerando que todo proceso inflamatorio conlleva a la demanda de calcio intracelular ([Ca2+]i) se sugiere que existe dependencia de este catión intracelular para los efectos de infectividad del VDC en las células neuronales. Ante ello, se evaluó la regulación de una proteína dependiente de Ca2+ tal como la P-CamKII. La Figura 6 muestra el análisis densitométrico de las bandas de cultivos neuronales de retina tratados o no con VDC marcados con el anticuerpo primario P-CamKII Thr286 (1:1000). Los resultados indican un incremento de la fosforilación de CamKII en los cultivos neuronales tratados con VDC 104 con una diferencia significativa con respecto al control (p<0.05), confirmando su activación con el con rol positivo de KCl 1.5 mM en el modelo biológico empleado.
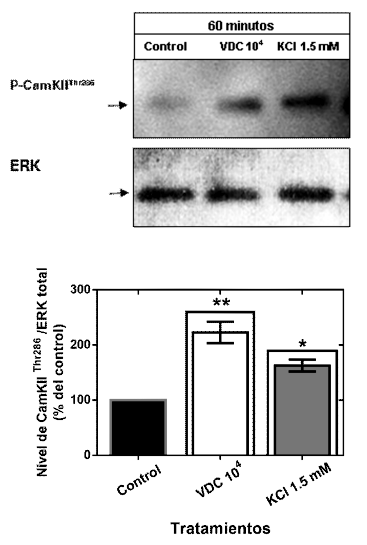
Figura 6. P-CamKII es regulada por el Virus Distemper Canino - VDC en cultivos neuronales de retina de gallina. Los cultivos mantenidos por 1 h con solución salina de Hank fueron tratados con VDC 104 y KCl 1.5 mM. y procesadas por la técnica de Western Blot. En la parte superior se observa una imagen representativa de los Blots que muestra la fosforilación de la Treonina 286 de la proteína P-CamKII como sitio específico. En el gráfico de barras se observa el análisis densitométrico de las bandas. Los datos representan la media de dos experimentos realizados por separado (n=3). El asterisco representa **, *p<0.05 con respecto al control
DISCUSIÓN
La presente investigación se centra en el estudio del neurotropismo molecular del VDC en la infectividad de células neuronales y gliales del SNC a través de la regulación de proteínas intracelulares como la CamKII. La infección de VDC como todo virus, depende de una interacción proteica inicial con un receptor específico, siendo que para este modelo de cultivo de células neuronales de retina embrionaria existe una definición inexacta del tipo de receptor que se encuentra en estas células. Se sabe que VDC reconoce al receptor SLAM (CD105) importante en células B, T activadas, macrófagos, células dendríticas y una vía independiente o dependiente de Nectina-4 (PVRL4) para células de epitelio traqueobronquial, linfáticas y epiteliales (Pratakpiriya et al., 2017).
Investigaciones recientes de Zhao y Ren (2022) mostraron que el receptor GliaR estaría presente en células gliales, permitiendo la infectividad y transmisión del virus y astrocitos. Por tanto, al incubar cultivos neuronales de retina con homogenizados de VDC con un TCID50 de 104 en 48 h alcanzando una citotoxicidad de 54% (con respecto al control) permitió establecer que existe un efecto de pérdida celular, siendo además confirmada a través de microfotografías por microscopía de contraste de fase, donde se visualiza un claro efecto del deterioro morfológico de células neuronales y gliales con VDC. Asimismo la marcación con DAPI evidenció un efecto importante del tipo de muerte celular caracterizado por núcleos apoptóticos con cromatina condensada y picnosis.
El efecto neurotóxico registrado por VDC en cultivos de células neuronales de retina embrionaria podría ser asociado a reactividad glial inflamatoria caracterizada por el cambio morfológico, tal y como se observa en microfotografías de contraste de fase donde se detecta glía con citoplasma agrandado comparado con el control. El glutamato es una molécula endógena crucial que desencadena excitoneurotoxicidad (Choi, 1994; Jiang et al., 2001). La toxicidad del glutamato es una causa importante de pérdida neuronal, asimismo del mal funcionamiento y/o la regulación negativa de los transportadores de glutamato glial contribuyendo al aumento de la actividad extracelular del glutamato hacia niveles excitotóxicos.
Chen et al. (2012) investigaron la asociación entre la excitoneurotoxicidad y el JEV encontrando una significativa acumulación de glutamato en los sobrenadantes de cultivos de microglia infectados con JEV. Asimismo, Brunner et al. (2007) muestran que cultivos en monocapa de células hipocampales de rata tratados con VDC desencadenan un contundente incremento de «glutamato», así como la expresión del transportador de glutamato - EAAT3 - facilitando de esta forma una mayor liberación de este aminoácido al medio extracelular. Con esta información, en el presente estudio se evaluó el porcentaje de pérdida celular en cultivos de retina incubada con glutamato 1 mM, encontrando un efecto similar al VDC 104 en 48 h. Es así que existe una posibilidad que la muerte neuronal por VDC sería a través de una vía excitotóxica.
Nie et al. (2020), utilizando el modelo de cardiomiocitos H9c2 infectado con el virus coxsackie B3 (CVB3) muestra que la apoptosis de los cardiomiocitos contribuye al desarrollo de miocarditis inducida a través de la sobrecarga de Ca2+ intracelular dependiente del estrés del Retículo Endoplásmico (RE) activando a la quinasa dependiente de Calcio y Calmodulina II (CaMKII). A pesar de que este modelo difiere completamente del SNC, se sabe que la mayoría de las infecciones virales producen cambios en la concentración de Ca2+ intracelular. Sumado a ello, el Ca2+ juega un papel vital en el proceso de formación de la estructura del virión, entrada del virus, expresión, traducción de proteínas virales, maduración y liberación de partículas virales (Zhou et al., 2009). Los mecanismos más conocidos indican que los virus interfieren con la estabilidad del Ca2+ y facilitan la replicación del virus al interferir con el Ca2+ y las proteínas de unión a Ca2+ (van Kuppeveld et al., 2005).
Para vivir en la célula hospedera, el virus secuestra Ca2+ importante en las vías de señalización, y también acelera o induce apoptosis celular al interferir con la vía del Ca2+, por lo que promueve la liberación de partículas virales y propaga el virus en mayor medida (Wenzhong y Hualan, 2021). Investigaciones adicionales in vivo de cardiomiocitos revelaron que el bloqueo de CaMKII con KN-93 evitó la apoptosis de los cardiomiocitos y mejoró la función contráctil cardíaca en el corazón de un ratón infectado con CVB3. Estos hallazgos proporcionan una nueva evidencia de que CaMKII desempeña un papel vital en la promoción de cardiomiocitos inducidos por CVB3 en la apoptosis, que vincula el estrés del RE y la absorción de Ca2+ mitocondrial (Nie et al., 2020).
La CaMKII (cinasa II dependiente de calcio/calmodulina), es una proteína serina treonina proteasa que posee funciones en la potenciación sináptica y el almacenamiento de memoria en neuronas; sin embargo, también se le atribuye funciones inmuno moduladoras. En este sentido, Gupta et al. (2010) muestran cultivos neuronales de hipocampo de rata tratados con sobrenadantes de cultivos de macrófagos derivados de monocitos humanos infectados con VIH-1 (VIH/MDM) presentaron inhibición de la fosforilación de CaMKII. Asimismo, cultivos de hipocampo y de corteza frontal de macacos infectados por el Virus de Inmunodeficiencia de Simio (SIV) en comparación con los animales no infectados, mostraron una disminución significativa en la activación de CaMKII.
La proteína S del SARS-CoV-2 posee actividad CaMKII que media la fusión del virus con la membrana celular (Wenzhong y Hualan, 2021). La infección por el virus de la peste porcina africana (PPA) provoca la reorganización de la vimentina en una jaula «cage» que rodea al virus. El reordenamiento de vimentina en las células generalmente implica la fosforilación del dominio N-terminal quinasas celulares para facilitar el desmontaje y transporte de los filamentos de vimen-tina en los microtúbulos. Curiosamente, la replicación del ADN viral también resultó en la activación de la proteína quinasa II dependiente de calmodulina cálcica (CaM quinasa II) y fosforilación del dominio N-terminal de vimentina en serina 82. Asimismo, la fosforilación fue bloqueada por KN93, un inhibidor de la CaM quinasa II, lo que sugiere un vínculo entre la CamKII, la replicación del ADN y expresión genética tardía. La vimentina también se redistribuye en células que expresan proteínas mal plegadas y durante infecciones virales. Una jaula viral «cage» también puede facilitar la replicación del virus y ensamblaje evitando la difusión de componentes virales en el citoplasma (Stefanovic et al., 2005).
Finalmente, se ha demostrado in vitro que la sobreactivación del receptor NMDA inhibe la actividad CaMKII en neuronas; por tanto, la activación de CaMKII podría surgir de una acción glutamatérgica excitotóxica (Churn et al. 1995; Zhou et al. 2007). Estos resultados son consistentes con estudios previos que han destacado un papel emergente para CaMKII en enfermedades neurodegenerativas. Los estudios han demostrado in vivo que una pérdida de actividad CaMKII se correlaciona con el daño neuronal durante la isquemia. Otros experimentos han utilizado ratones con genes knockout que carecen de CaMKII para proporcionar evidencia de que la alteración de esta única proteína quinasa produce daño a las dendritas neuronales después de la isquemia (Shackelford et al., 1995; Hudmon et al., 1996).












 uBio
uBio 


