Introducción
Los moluscos gasterópodos estilommatóforos, representados por caracoles terrestres y babosas, son hermafroditas que almacenan el exoesperma en túbulos relacionados a la cámara de fertilización (Barker 2001; Ponder et al. 2020). Van Mol (1971) llamó carrefour a la región a donde llega el conducto hermafrodita y encuentra al talón (cámara de fertilización y túbulos de la espermateca) de donde sale el canal colector de la glándula de la albúmina. El talón también es denominado FPSC (bolsa de fertilización + complejo de la espermateca) (Schileyko & Schileyko 1992). Beese (2007) encontró en una filogenia de los estilommatophora con el 28S rDNA parcial de que el carrefour con espermateca subdividida se encuentra principalmente en los helicoidea, seguido de Bulimulidae. Sin embargo, en esa filogenia no está Megalobulimus. En las filogenias propuestas por Wade et al. (2006) y Ramírez et al. (2012), Megalobulimus se encuentra entre los Helicoidea y Orthalicoidea, dos clados con espermatecas complejas (Beese et al. 2009).
Hylton-Scott (1939) describió la porción terminal del conducto hermafrodita de M. lorentzianus (Doering, 1876), denominando talón a la porción donde llega el conducto hermafrodita, así como al saco glandular anexo, mencionado también por Leme (1973) y Simone y Leme (1998) para especies brasileñas de Megalobulimus, y por Borda y Ramírez (2013, 2016) para especies peruanas, pero en ningún caso se realizó una descripción a nivel histológico. Aquí presentamos el primer análisis histológico del talón y del saco glandular anexo para el género Megalobulimus, en especies nativas peruanas.
Material y métodos
La presente investigación fue desarrollada en los laboratorios de Sistemática Molecular y Filogeografía y Reproducción y Biología del Desarrollo de la Facultad de Ciencias Biológicas, y el Departamento de Malacología del Museo de Historia Natural, todos de la Universidad Nacional Mayor de San Marcos.
Para el análisis histológico del talón y saco glandular anexo en el género Megalobulimus, se utilizaron en total 7 individuos, uno de M. popelairianus (Nyst, 1845), M. maximus (Tschudi, 1852) y M. leucostoma (G. B. Sowerby I, 1835), y dos de M. carrikeri (Pilsbry, 1930) y M. capillaceus (L. Pfeiffer, 1855) (Bequaert 1948, Ramírez et al. 2012).
Los especímenes fueron obtenidos de los pobladores locales, ya que son especies consumidas comúnmente. Los especímenes de M. carrikeri, fueron colectados en marzo del 2012, en el CP Yanango (Dist. San Ramón, Prov. Chanchamayo, Depto. Junín, 11°12’32.36”S, 75°29’6.23”W); M. capillaceus, conocidos con el nombre común de “pucashimi”, fueron colectados en octubre del 2017, en el CP Huinguyacu (Prov. Bellavista, Depto. San Martín, 6°51’43.2”S, 76°39’58.2”W); M. leucostoma, colectado en enero de 2018, en el CP Potrero (Dist. Santa Ana, Prov. La Convención, Depto. Cusco, 12°53’21.5”S, 72°43’28.4”W); M. maximus colectado en diciembre de 2017, en ITA-INKATERRA (Depto. Madre de Dios, 12°31’58.2”S 69°03’01.3”W) y M. popelairianus, conocido como “congompe”, colectado en octubre de 2017 en el CP Puerto Rico (Prov. Picota, Depto. San Martín, 6°59’33.1”S, 76°25’6.1”W).
Los moluscos fueron sacrificados por ahogamiento en agua potable. Luego se extrajo la parte blanda de la concha y se colocó en solución Bouin alcohólico, para fijarlos, por 24 horas. Una vez culminada la fijación, se lavaron las muestras con alcohol al 70% hasta desaparecer los restos del fijador (color amarillo). De cada ejemplar se extrajo el sistema reproductor completo, y se realizó una disección para aislar la bolsa de fertilización y talón, y estructuras relacionadas.
Estas estructuras se deshidrataron en una batería de alcoholes al 70, 80, 90, 95 y 100%, se aclararon con xilol y finalmente se sumergieron en Paraplast Plus a 56 °C por 15 minutos. Luego de solidificado, estas muestras fueron seccionadas (longitudinal y transversalmente) a 7 μm de espesor, y en láminas seriadas. Los cortes obtenidos se colorearon con hematoxilina-eosina (Martoja & Martoja-Pierson 1970), y se observaron en un microscopio Leica y se fotografiaron con una cámara Leica ICC50HD.
Resultados
El talón y el saco glandular anexo (SGA) en las cinco especies estudiadas (M. popelairianus, M. maximus, M. carrikeri, M. leucostoma y M. capillaceus) presentan una estructura uniforme, ambos están juntos y envueltos por una delgada capa de tejido conjuntivo.
El talón es bastante pequeño, en relación con el SGA, y se sitúa junto a su base; es una estructura muscular. La bolsa de fertilización (BF) no es ciega, más bien tubular, y corre cerca de la periferia del talón. El conducto hermafrodita ingresa a la BF en su extremo proximal, el que sobrepasa ligeramente a los túbulos de la espermateca, excepto en M. leucostoma que es muy alargada. Tanto a nivel de corte longitudinal como transversal se distingue claramente la diferencia entre la bolsa de fertilización y el complejo de la espermateca, en donde esta última tiene túbulos de lumen muy reducido, y se puede ramificar varias veces. Sin embargo, en M. capillaceus hay menor número de túbulos, muy poco ramificados, y tienen amplio lumen.
El saco glandular anexo presenta la misma estructura general entre las cinco especies de Megalobulimus estudiadas, variando en la cantidad de plegamiento de sus paredes, el revestimiento muscular, así como en la presencia de tejido muscular liso delimitando porciones de plegamientos. El conducto del SGA desemboca justo por debajo del talón, en el conducto colector que va a la glándula de la albúmina (Fig. 1A).
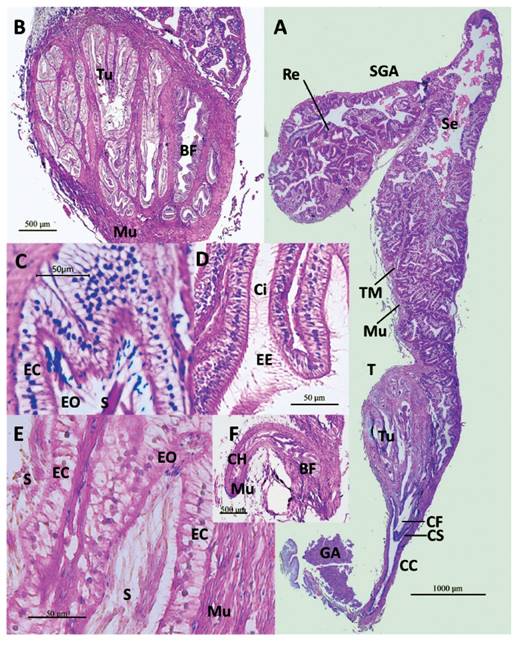
Figura 1 Secciones histológicas longitudinales del talón y saco glandular anexo (SGA) de M. popelairianus. A- Talón donde se observa túbulos de la espermateca (Tu) y la cámara de fertilización (CF) con abertura al conducto colector (CC). SGA plegado en su extremo ciego; capa externa de tejido muscular liso (Mu), que hace proyecciones a manera de tabiques (TM) como soporte en repliegues grandes de los tejidos epitelial y subepitelial (Re); lumen con secreción (Se). Conducto del SGA (CS), glándula de la albúmina (GA). Aumento 40X. B - Talón embebido en tejido muscular liso (Mu): Bolsa de fertilización (BF) y túbulos de la espermateca (Tu). Aumento 40X. C- Túbulo de la espermateca con espermatozoides orientados (EO) en su epitelio ciliado (EC) y sustancia (S) proveniente del saco glandular anexo (SGA). Aumento 400X. D- Repliegues del epitelio de la bolsa de fertilización con cilios (Ci) más largos que los de los túbulos de la espermateca; con presencia de espermatozoides endógenos (EE). Aumento 400X. E- Túbulo con espermatozoides orientados (EO) y sustancia (S) proveniente del SGA, a manera de hilos. Epitelio ciliado (EC), tejido muscular liso (Mu). Aumento 400X. F- Conducto hermafrodita (CH) ingresando al talón, previa flexión, por la bolsa de fertilización, con una capa gruesa de tejido muscular liso (Mu). Aumento 40X.
Histología del Talón en M. popeilarianus (Figs. 1-2). El talón en M. popelairianus es pequeño, piriforme, con su extremo proximal más angosto junto al extremo basal del saco glandular anexo (SGA), que a su vez se encuentra adosado al borde cóncavo de la glándula de la albúmina. Es de consistencia compacta debido al tejido muscular liso en el que están embebidos la bolsa de fertilización y los túbulos de la espermateca (Fig. 1A-B).
El conducto hermafrodita (CH), luego de la flexión de su extremo distal, ingresa al talón por su extremo libre, en donde se continúa con la bolsa de fertilización (BF), tiene una gruesa capa de tejido muscular liso en disposición circular (Fig. 1B, F). Internamente está revestido con tejido epitelial de células cilíndricas ciliadas, replegado. De esta manera continua en su entrada a la BF (Fig. 1B), que es un conducto que corre longitudinalmente más pegado hacia la periferia de la estructura muscular, es ligeramente curvado en su extremo proximal donde se encuentra con el conducto hermafrodita (Fig. 1F). Está envuelto por tejido muscular liso. Es de amplio lumen, revestido de células epiteliales cilíndricas con núcleo central y cilios largos, capa que presenta repliegues (Fig. 1B, D); tiene algunas ramificaciones. Tanto en el conducto hermafrodita como en la bolsa de fertilización se observaron espermatozoides endógenos (Fig. 1D). La bolsa de fertilización termina en un espacio amplio, que llamaremos cámara de fertilización (CF), con una abertura subterminal en la base del talón (Fig. 1A), cuyo borde de tejido muscular liso termina en una proyección dentro del conducto colector (Fig. 1A). Éste, a su vez, contiene células mucosas que se prolongan desde el SGA (Fig. 2A-C).
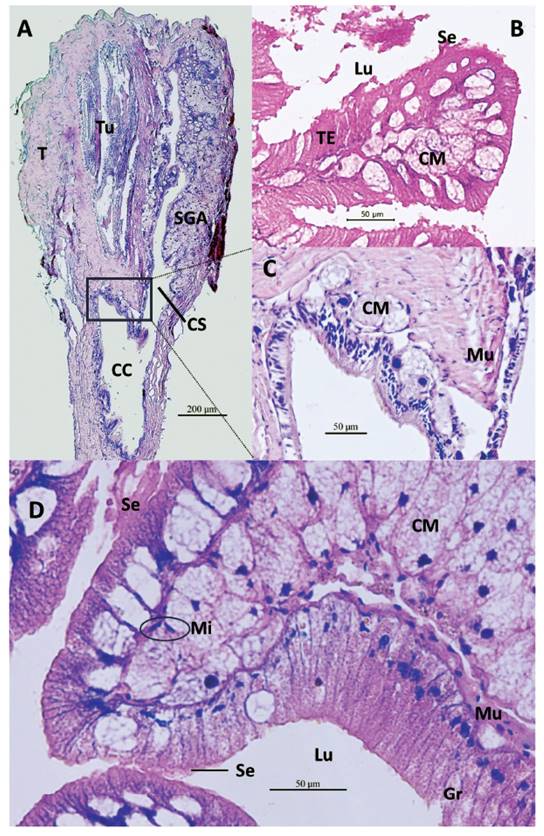
Figura 2 Secciones histológicas longitudinales del talón y saco glandular anexo (SGA) de M. popelairianus. A- Talón con túbulos de la espermateca (Tu); SGA en su salida (CS) al conducto colector (CC). Aumento 10X. B- SGA: Repliegue del tejido epitelial (TE) con células glandulares y secreción (Se); células mucosas (CM) subepiteliales y su salida al lumen (Lu) entre las células epiteliales. Aumento 400X. C- Recuadro de A. Base del talón con revestimiento con células mucosas (CM) subepiteliales del SGA. Aumento 400X. D- Repliegue interno SGA. Se observan las células glandulares epiteliales con granulaciones (Gr), y sus secreciones (Se) en el lumen (Lu). Células mioepiteliales (Mi) en la base del tejido epitelial y entre células mucosas subepiteliales, y tejido muscular liso (Mu) entre el tejido epitelial y las glándulas subepiteliales. Aumento 400X.
La espermateca comienza por la cámara de fertilización con unos pocos túbulos que se ramifican grandemente y terminan ciegos, algo más cortos y lumen más reducido que el de la bolsa de fertilización (BF) (Fig. 1A-B, 2A). Hay tejido muscular liso separando bloques de ellos. Su revestimiento interno es de tejido epitelial cilíndrico, con cilios más cortos que los de la BF; no es replegado (Fig. 1B-C, 1E). En los túbulos se observa espermatozoides con sus cabezas adheridas a las células epiteliales y la cola en el lumen a lo largo del túbulo (Fig. 1C, E). En estos túbulos con espermatozoides, llama la atención la presencia de una sustancia en el lumen (Fig. 1C, E), que en algunos túbulos quedan como unos hilos colgando de los espermatozoides (Fig. 1E). Se sugiere que pueda corresponder a la secreción del SGA, en la que los espermatozoides quedan inmersos justo antes de ingresar al talón, en su camino hacia los túbulos de la espermateca.
Histología del Talón en M. carrikeri (Figs. 3-5). El talón de M. carrikeri es muy semejante al de M. popelairianus. En cortes transversales se observa la bolsa de fertilización (BF) hacia la periferia, y túbulos de la espermateca ramificados, ambos embebidos en tejido muscular liso (Fig. 3A-B).
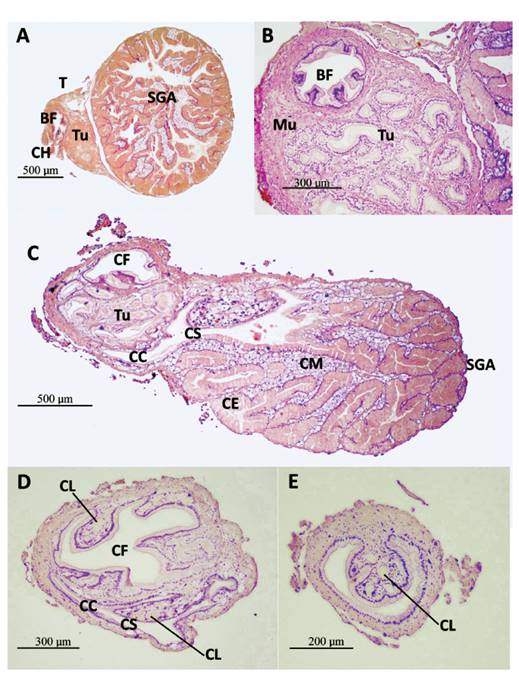
Figura 3 Secciones histológicas transversales del talón y saco glandular anexo (SGA) de M. carrikeri. A- Sección en la región apical del talón. Saco glandular anexo (SGA) y talón (T), con bolsa de fertilización (BF) y túbulos de la espermateca (Tu). Un segmento del conducto hermafrodita (CH) entrando a la BF. Aumento 40X. B- Sección en la región media del talón. Bolsa de fertilización (BF) y túbulos de la espermateca (Tu), embebidos en tejido muscular liso (Mu). Aumento 100X. C- Por la zona basal del talón: cámara de fecundación (CF), hacia el inicio de los túbulos de la espermateca (Tu), y la llegada del conducto (CS) del SGA al conducto colector (CC). En el SGA repliegues de células epiteliales glandulares (CE) y mucosas subepiteliales (CM). Aumento 40X. D- Base del talón. Cámara de fecundación (CF) con repliegues de epitelio y células de Leydig (CL) del tejido conjuntivo. Conducto colector (CC). Conducto del SGA (CS). Aumento 100X. E- Conducto colector cerca a la glándula de la albúmina, con proyección del epitelio, a lo largo del conducto, presenta células de Leydig (CL) del tejido conjuntivo. Aumento 100X.
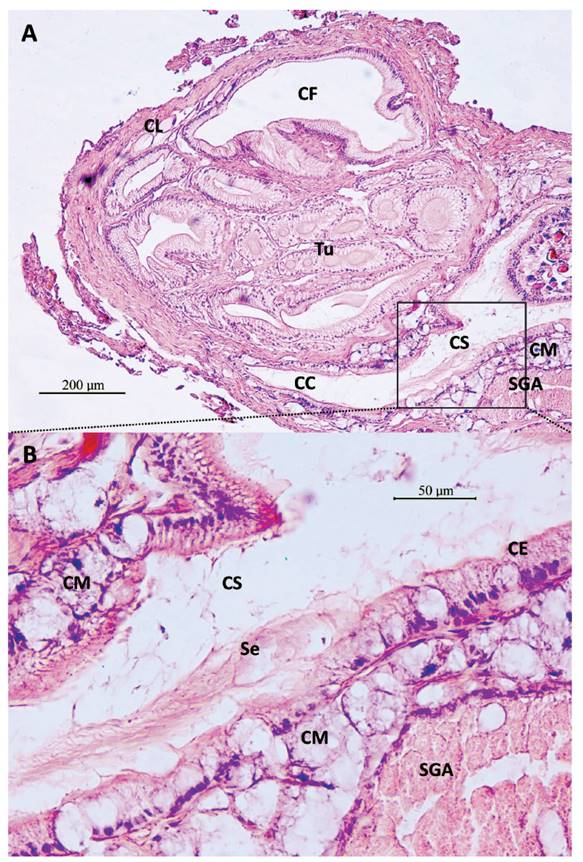
Figura 4 Secciones histológicas transversales del talón y saco glandular anexo (SGA) de M. carrikeri. A- Células mucosas (CM) subepiteliales del SGA en el borde del talón (recuadro) y células de Leydig (CL) del tejido conectivo. Cámara de fecundación (CF), túbulos de la espermateca (Tu). Aumento 100X. B- Células mucosas (CM) subepiteliales del saco SGA en el borde del talón, por el conducto (CS) del SGA, zona donde se aprecia secreción apocrina de las células glandulares epiteliales. Aumento 400X.
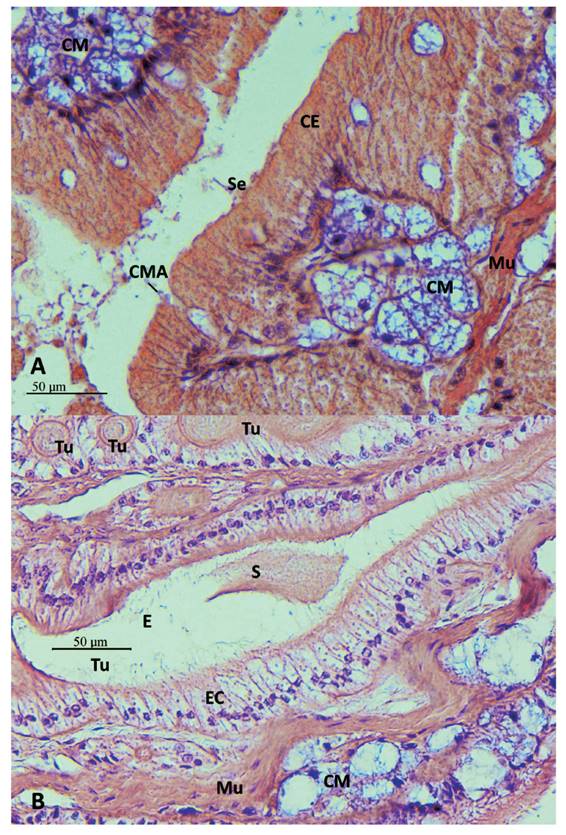
Figura 5 Secciones histológicas transversales del talón y saco glandular anexo (SGA) de M. carrikeri. A- Repliegues internos del SGA, con células epiteliales glandulares (CE), con secreción (Se), tejido muscular liso (Mu), glándula mucosa subepitelial (CM) en secreción apocrina (CMA) entre células epiteliales. Aumento 400X. B- Túbulos de la espermateca (Tu) con epitelio ciliado (EC), conteniendo sustancia (S) como el de secreción del SGA. En el de sección alargada se observa espermatozoides (E). Tejido muscular liso (Mu), Células mucosas subepiteliales (CM). Aumento 400X.
La bolsa de fertilización tiene revestimiento de epitelio replegado (Fig. 3B), de células cilíndricas con cilios largos, muy semejante al conducto hermafrodita que ingresa en su extremo proximal (Fig. 3A), en el extremo apical del talón. Tiene algo de ramificaciones. Llega a un espacio amplio en la base del talón, la cámara de fertilización (CF) (Fig. 3C-D, 4A). Se observaron espermatozoides entre los cilios. Túbulos de la espermateca conteniendo espermatozoides (Fig. 5B), con cabezas relacionadas a las células epiteliales que tienen cilios más cortos que los observados en la bolsa de fertilización. Se observaron túbulos conteniendo una sustancia (Fig. 5B) semejante a las secreciones del SGA (Fig. 4A-B, 5B).
El borde externo de la base del talón que va al conducto colector presenta células mucosas subepiteliales (Fig. 4A), que vienen de la pared del SGA (Fig. 4A-B). También presenta células de Leydig, parte del tejido conjuntivo, observadas entre la pared de la cámara de fertilización y la capa muscular externa (Fig. 4A), así como en los repliegues de la cámara de fertilización y del conducto del SGA (Fig. 3D), así como en el del conducto colector (Fig. 3E).
Histología del Talón en M. maximus (Figs. 6-7). La estructura muscular lisa que compone el talón de M. maximus tiene forma más bien tubular. La bolsa de fertilización (BF) tiene su extremo proximal curvado, por encima de los túbulos de la espermateca, por donde ingresa el conducto hermafrodita luego de una flexión (Fig. 6A). Su lumen está revestido por una capa replegada de tejido epitelial cilíndrico con cilios largos. Se observaron espermatozoides endógenos tanto en la BF como en el conducto hermafrodita. En la base del talón, la BF se expande formando la cámara de fertilización, de donde nacen los túbulos de la espermateca (Fig. 6B).
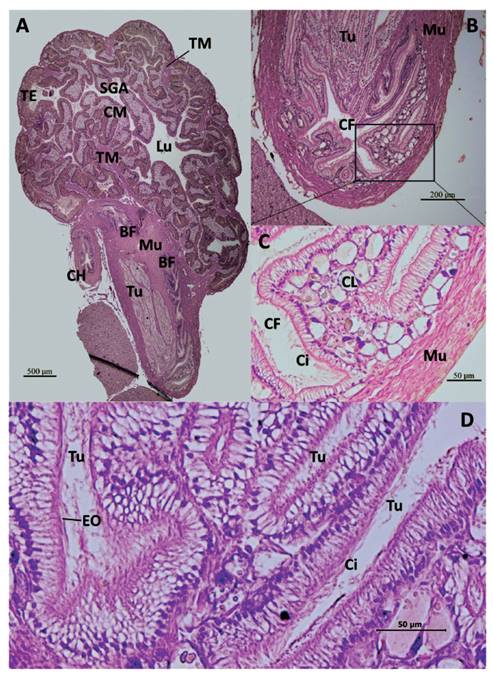
Figura 6 Secciones histológicas longitudinales del talón y saco glandular anexo (SGA) de M. maximus. A- Talón con bolsa de fertilización (BF) y túbulos (Tu) de la espermateca embebidos en tejido muscular liso (Mu). Conducto hermafrodita (CH) a su entrada al talón por la BF. SGA con repliegues internos del tejido epitelial (TE) y glándulas mucosas subepiteliales (CM), hacia el lumen (Lu), soportados por tabiques de tejido muscular liso (TM). Aumento 40X. B- Base del talón, donde se observa la cámara de fertilización (CF) y túbulos de la espermateca (Tu), embebidos en tejido muscular liso (Mu). Aumento 100X. C- Repliegue del epitelio y tejido conectivo de la CF. Epitelio cilíndrico con cilios largos (Ci). Células de Leydig (CL) del tejido conectivo. Tejido muscular liso (Mu). Aumento 400X. D- Túbulos de la espermateca (Tu) con epitelio ciliado (Ci) conteniendo espermatozoides orientados (EO). Aumento 400X.
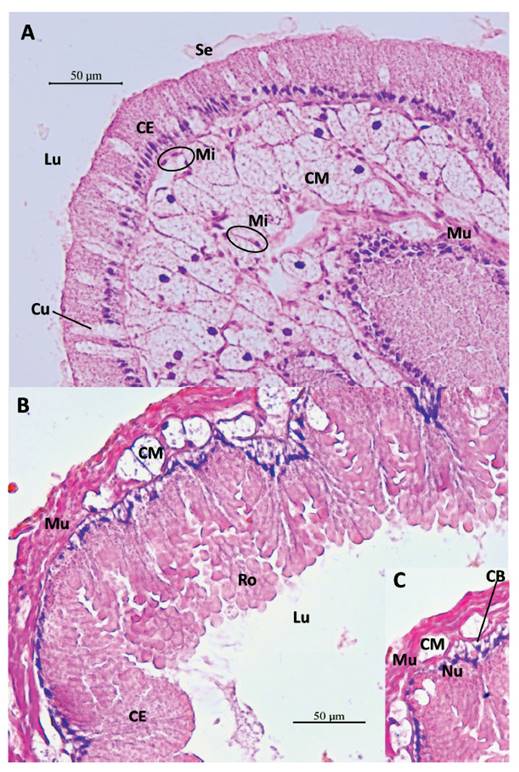
Figura 7 Secciones histológicas longitudinales del saco glandular anexo (SGA) de M. maximus. A- Repliegue hacia el lumen (Lu) del SGA. Células glandulares (CE) del tejido epitelial con secreción (Se). Células glandulares mucosas subepiteliales (CM), con extensión de su cuello (Cu) entre las células epiteliales para secretar su contenido en el lumen (Lu). Tejido muscular liso (Mu). Células mioepiteliales (Mi). Aumento 400X. B- Pared del SGA. Capa muscular de tejido liso (Mu), glándulas mucosas subepiteliales (CM). Células glandulares epiteliales con granulaciones (CE) proyectadas en el lumen (Lu), en proceso de secreción apocrina, con agrupamientos en forma de roseta (Ro). Aumento 400X. C- Célula basal totipotente (CB), forma triangular, entre las bases de las células epiteliales, cuyo núcleo (Nu) de una de ellas se indica. Aumento 400X.
A diferencia de lo observado en los otros Megalobuliminus, se mantienen más bien verticales, sin mayor expansión hacia los lados, de modo que el talón se ve como tubular (Fig. 6A). El lumen está revestido de tejido epitelial cilíndrico con cilios cortos (Fig. 6D). Se observaron espermatozoides exógenos con sus cabezas adheridas a estas células y sus flagelos a lo largo del lumen de los túbulos (Fig. 6D).
En el extremo basal del talón y los repliegues de la cámara de fertilización se observan células del tejido conjuntivo, células de Leydig (Fig. 6B-C).
Histología del Talón en M. leucostoma (Figs. 8-10). En el talón de M. leucostoma se ve una diferencia saltante en relación con los otros Megalobulimus estudiados, en que el saco de fertilización es tremendamente alargado, y los túbulos de la espermateca se quedan en la base, dentro de la estructura musculosa, que es más bien esférica (Fig. 8). En un corte longitudinal se observa que la bolsa de fertilización sobresale como tres cuartos más del complejo de la espermateca, y está recubierta de una gruesa capa de tejido muscular liso (Fig. 8). El conducto hermafrodita ingresa a la bolsa de fertilización en su extremo proximal, se observan espermatozoides endógenos (Fig. 8).
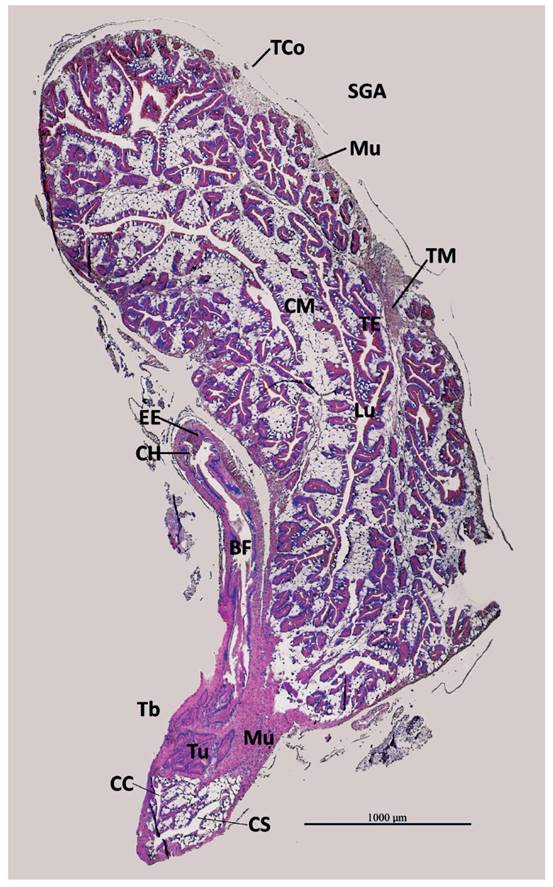
Figura 8 Sección histológica longitudinal del talón y saco glandular anexo (SGA) de M. leucostoma. Talón con porción basal (Tb) a manera de nódulo, donde se observa túbulos (Tu) de la espermateca embebidos en tejido muscular liso (Mu), y bolsa de fecundación (BF) que se extiende por fuera hasta su conexión con el conducto hermafrodita (CH). Espermatozoides endógenos (EE) en CH y BF. SGA: capa externa de tejido muscular liso (Mu), tabiques de músculo liso (TM) soportando repliegue de tejido epitelial (TE) y células glandulares subepiteliales (CM), que se proyectan al lumen (Lu). Conducto colector (CC) y conducto de salida (CS) del SGA. Tejido conjuntivo (TCo) que envuelve al SGA y talón. Aumento 40X.
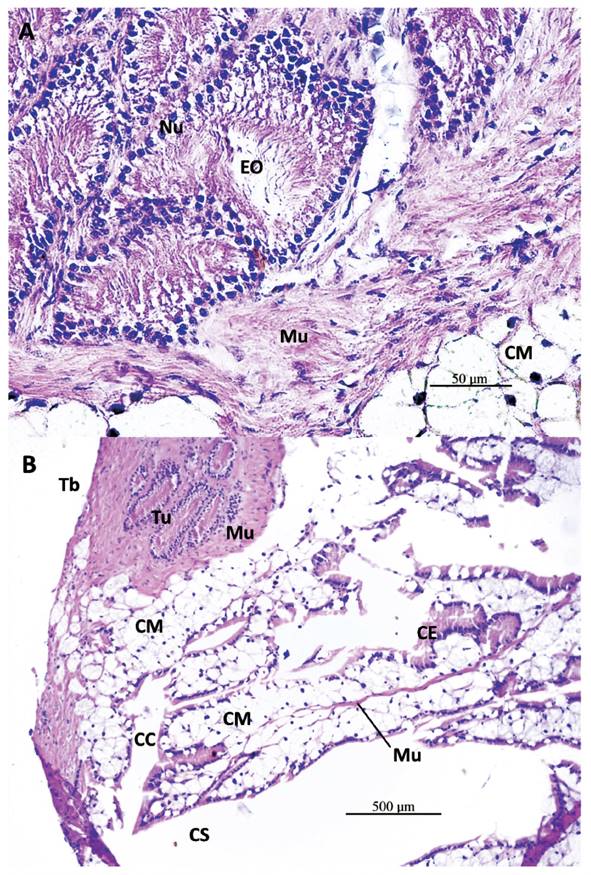
Figura 9 Sección histológica longitudinal del talón y saco glandular anexo (SGA) de M. leucostoma. A- Núcleos (Nu) de las células epiteliales de túbulos de la espermateca, con cabezas de espermatozoides relacionados a estas células (Espermatozoides orientados: EO) y colas en el lumen. Tejido muscular liso (Mu), células mucosas (CM). Aumento 400X. B- Porción basal del talón (Tb), con túbulos de la espermateca (Tu) embebidos en tejido muscular liso (Mu), con borde hacia el conducto colector (CC) con células mucosas (CM) del SGA. SGA: conducto de salida (CS), células epiteliales (CE) y mucosas subepiteliales (CM), tejido muscular liso (Mu). Aumento 100X.
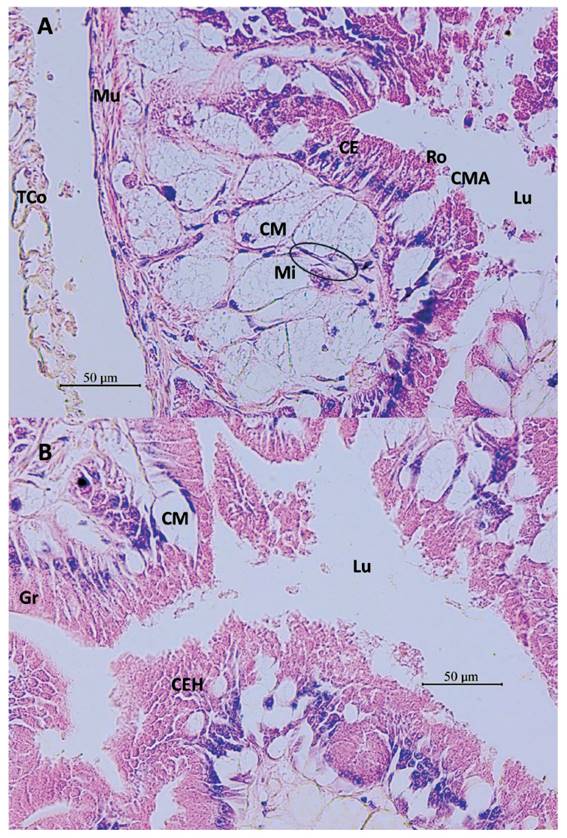
Figura 10 Sección histológica longitudinal del saco glandular anexo (SGA) de M. leucostoma. A- Pared del saco glandular anexo: capa externa del tejido muscular liso (Mu), células epiteliales glandulares con gránulos (CE), en secreción apocrina con células agrupadas en roseta (Ro). Células glandulares mucosas subepiteliales (CM), liberando su contenido apocrino (CMA) al lumen (Lu) entre células epiteliales. Células mioepiteliales (Mi) entre las CM. Tejido conjuntivo (TCo) que envuelve al SGA y talón. Aumento 400X. B- Proyecciones del tejido epitelial y subepitelial al lumen (Lu) del SGA. Células epiteliales glandulares con granulaciones (Gr), células mucosas subepiteliales (CM) abriéndose paso entre las células epiteliales para alcanzar el lumen y liberar su contenido. Se aprecian células epiteliales glandulares liberando su contenido por secreción holocrina (CEH). Aumento 400X.
La espermateca está conformada por túbulos más bien cortos, como retorcidos, y menos ramificados que en las otras especies estudiadas (Fig. 8, 9B). El epitelio que reviste el lumen está constituido por células cilíndricas de núcleo muy grande, basal, citoplasma más bien acidófilo, en la mayor parte cada célula no claramente definida (Fig. 9A). Se observaron espermatozoides cuyas cabezas estaban relacionadas al epitelio y las colas en el lumen (Fig. 9A).
Histología del Talón en M. capillaceus (Fig. 11-13). La estructura muscular del talón en M. capillaceus es de ¼ de la longitud del saco glandular anexo (Fig. 11A). Su parte basal es ligeramente más angosta. Conducto hermafrodita con gruesa capa de tejido muscular liso, y capa interna de tejido epitelial ciliado, replegado (Fig. 11B, 12A-B). Por la porción apical del talón, ingresa a la bolsa de fertilización (Fig. 11B), que es de amplio lumen revestido de tejido epitelial con cilios largos, replegado (Fig. 12C). Aquí y en el conducto hermafrodita se observaron espermatozoides endógenos (Fig. 12B-C). La bolsa de fertilización llega a la cámara de fertilización, en la base del talón, que tiene abundantes repliegues largos (Fig. 11A, 13A-B), de donde también comienzan los túbulos de la espermateca (Fig. 11C).
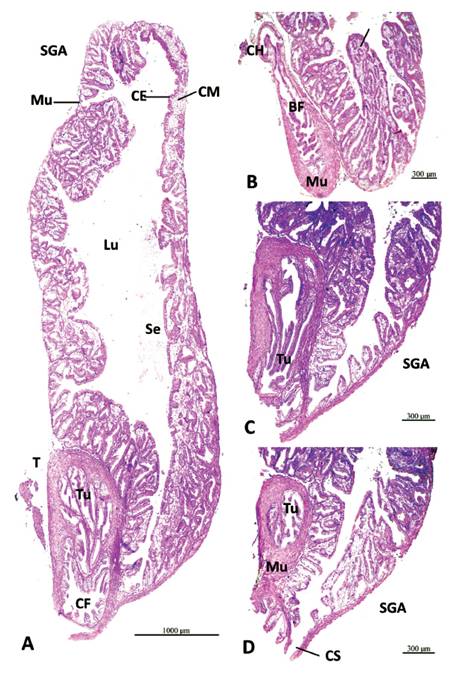
Figura 11 Sección histológica longitudinal del talón y saco glandular anexo (SGA) de M. capillaceus. A- SGA con delgada capa externa de tejido muscular liso (Mu), con repliegues de la capa de células epiteliales glandulares (CE) y células mucosas subepitelales (CM) que se proyectan hacia el lumen (Lu). Talón (T) con túbulos (Tu) de la espermateca y cámara de fertilización (CF). Aumento 40X. B- SGA con repliegues de capas epitelial y subepitelial de células mucosas (CM). Talón con la bolsa de fertilización (BF) embebida en tejido muscular liso (Mu), con el conducto hermafrodita (CH) entrando por su extremo proximal. Aumento 40X. C- Talón, con los túbulos de la espermateca (Tu) vistos desde su origen. SGA cerca de su conducto de salida (CS). Aumento 40X. D- Talón con ramificaciones de los túbulos de la espermateca (Tu), embebidos en tejido muscular liso (Mu). SGA con conducto de salida (CS). Aumento 40X.
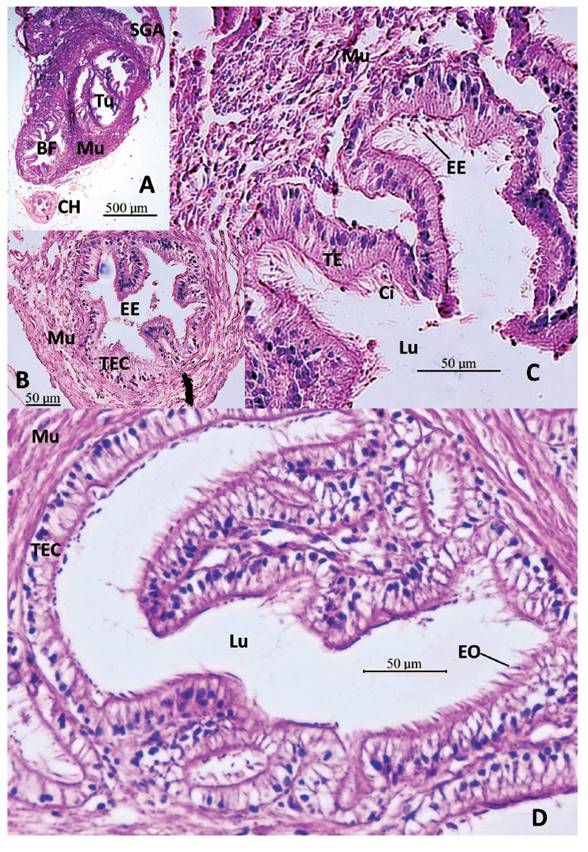
Figura 12 Sección histológica transversal del talón y saco glandular anexo (SGA) de M. capillaceus. A- Talón con bolsa de fertilización (BF) y 3 amplios túbulos de la espermateca (Tu) con epitelio de revestimiento replegado, ambos embebidos en tejido muscular liso (Mu). Conducto hermafrodita (CH). Saco glandular anexo (SGA). Aumento 40X. B- Conducto hermafrodita (CH) con epitelio ciliado replegado (TEC), y pared gruesa de tejido muscular liso (Mu), lumen con espermatozoides endógenos (EE). Aumento 400X. C- Bolsa de fecundación (BF) embebido en tejido muscular liso (Mu): revestimiento de tejido epitelial (TE) con cilios largos (Ci), replegado, presencia de espermatozoides endógenos (EE) en el lumen (Lu). Aumento 400X. D- Túbulo de la espermateca, con revestimiento epitelial ciliado replegado (TEC), con presencia de espermatozoides exógenos con sus cabezas en relación con las células epiteliales y colas en el lumen (Lu) (espermatozoides orientados: EO). Tejido muscular liso (Mu). Aumento 400X.
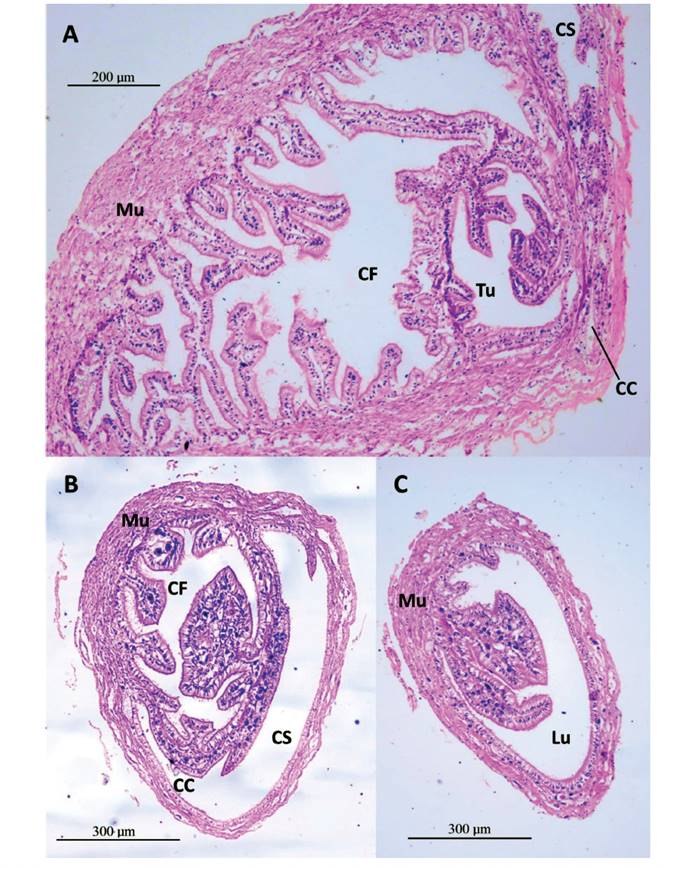
Figura 13 Sección histológica transversal del talón y conducto colector de M. capillaceus. A- Hacia la base del talón. Cámara de Fertilización (CF) y túbulo de la espermateca (Tu) embebidos en tejido muscular liso (Mu). Conducto colector (CC) y conducto de salida (CS) del saco glandular anexo. Aumento 100X. B- Cámara de fertilización (CF) con repliegues grandes cerca a la salida al conducto colector (CC) y conducto de salida (CS) del saco glandular anexo, con capa externa de tejido muscular liso (Mu). Aumento 100X. C- Conducto colector que va de la base del talón a la glándula de la albúmina. Con repliegues de tejido epitelial y conjuntivo que se extienden al lumen, con capa externa de tejido muscular liso (Mu). Aumento 100X.
A diferencia de las otras especies de Megalobulimus, algunos túbulos con que se origina la espermateca, luego de un corto trecho, terminan dando paso a tan solo tres tubos de amplio lumen (11C, 12A), los que luego se ramifican levemente (Fig. 11A, D). Su revestimiento interno está constituido por tejido epitelial cúbico, con cilios menos largos que los de la bolsa de fertilización (Fig. 12D). El revestimiento es casi tan plegado como el de la bolsa de fertilización (Fig. 12A), que no son discernibles a primera vista (Fig. 13A). En los túbulos de la espermateca se observaron espermatozoides con sus cabezas adheridas a células epiteliales (espermatozoides orientados) (Fig. 12D).
Histología del Saco Glandular Anexo (SGA) de M. popelairianus (Figs. 1-2). El SGA de M. popelairianus es un saco ciego largo, con su extremo basal reduciendo su diámetro progresivamente hacia el talón (Fig. 1A). Su extremo ciego se dobla, lo que da una apariencia de menor longitud. La pared es de una capa delgada de tejido muscular liso. Su lumen está revestido por una capa de tejido epitelial con células cilíndricas no ciliadas, y células mucosas subepiteliales (Fig. 2B, D), las que se repliegan en diversos tamaños y complejidad (Fig. 1A, 2B, D). Hay otros repliegues más complejos que hacen unas proyecciones grandes hacia el lumen, que pueden llegar a expandirse a tal punto que obliteran parte del lumen, están soportados por tabiques de tejido muscular liso que vienen desde la capa muscular externa (Fig. 1A).
Las células del tejido epitelial cilíndrico no ciliado son muy angostas, con núcleo basal, citoplasma con granulaciones y acidófilo. Abundantes células glandulares mucosas subepiteliales, globosas con núcleo picnótico excéntrico, con vesículas amorfas en su citoplasma. Son de tamaño relativamente parecidos al de las células epiteliales (Fig. 2B, D).
Entre el tejido epitelial se encuentran células basales, distribuidas ralamente en la base, entre las células epiteliales, sobre la membrana basal. Se puede observar células mioepiteliales dispersas, en la base del tejido epitelial y entre las glándulas subepiteliales. En la porción subepitelial se puede observar manojos de tejido muscular liso, de diversos tamaños (Fig. 2D).
Las células epiteliales se observaron mayormente con secreción apocrina, que al secretar se rompe y libera la porción apical de la célula, siendo la sustancia de naturaleza acidófila (Fig. 2B, D). Las células glandulares subepiteliales liberan su contenido apocrino al lumen del SGA, previamente extendiéndose entre las células epiteliales.
El conducto del SGA desemboca en el conducto colector, en relación a la base del talón (Fig. 1A, 2A).
Histología del Saco Glandular Anexo (SGA) de M. carrikeri (Figs. 3-5). El saco glandular anexo de M. carrikeri es histológicamente parecido al de M. popelairianus, diferenciándolo un menor número de repliegues complejos del tejido epitelial. Resalta la capa de células epiteliales glandulares, de casi el doble del tamaño de las células glandulares subepiteliales, que además están en menor proporción (Fig. 3A, C). Se observó secreción apocrina en ambos tipos celulares. Las células mucosas subepiteliales liberan su secreción extendiéndose entre las células epiteliales (Fig. 5A). Se observó una dramática secreción apocrina en células epiteliales glandulares hacia la salida al tubo colector, dejando como la mitad basal de la célula (Fig. 4A-B). La secreción tiene la misma apariencia de la que se encontró en los túbulos de la espermateca (Fig. 4B, 5B).
Histología del Saco Glandular Anexo (SGA) de M. maximus (Figs. 6-7). Cubierta de tejido muscular liso de un espesor mayor al de M. popelairianus. El tejido epitelial cilíndrico no ciliado, con repliegues amplios, soportados por tabiques de tejido muscular liso que vienen de la musculatura de la pared externa, pero que se encuentran a tramos relativamente constantes (Fig. 6A); ello le da una característica mamelonada a la superficie externa del SGA. Las células glandulares subepiteliales se encuentran en los repliegues del tejido epitelial (6A, 7A), y, a diferencia de las otras especies de Megalobulimus aquí estudiadas, también se encuentran en las zonas no replegadas del epitelio, entre éste y la capa muscular externa (Fig. 7B-C).
Las células epiteliales glandulares tienen secreción apocrina, observándose porciones de células agrupadas en roseta (Fig. 7B). Las células glandulares subepiteliales son apocrinas, prolongando su cuello entre las células epiteliales (Fig. 7A). En la Figura 7A se observa células mioepiteliales y en la 7C una célula basal de forma triangular, entre la porción basal de células epiteliales (Fig. 7C).
Histología del Saco Glandular Anexo (SGA) de M. leucostoma (Figs. 8-10). La cubierta del saco glandular anexo de M. leucostoma, de tejido muscular liso, de tramo en tramo se presenta más engrosada (Fig. 8). Revestimiento del lumen de tejidos epitelial y subepitelial, a diferenciaba de lo encontrado en otros Megalobulimus, se ve como un parénquima grueso, sobresaliendo la gran cantidad de células glandulares subepiteliales, que son más grandes que las células epiteliales glandulares (Fig. 8, 10A). Estas células glandulares subepiteliales se encuentran presentes en gran cantidad por el conducto del SGA, y del borde externo del talón que da al conducto colector (Fig. 9B). Se presentan algunos tabiques musculares delgados, que vienen de la musculatura de la capa externa, soportando a repliegues grandes (Fig. 8).
Se observa secreción apocrina en ambos tipos celulares, las epiteliales glandulares agrupadas en forma de roseta, y células mucosas subepiteliales con el cuello extendido entre células epiteliales para alcanzar el lumen y liberar su secreción (Fig. 10A). En las células epiteliales glandulares se observó secreción holocrina (Fig. 10B), en donde se destruye toda la célula.
Histología del Saco Glandular Anexo (SGA) de M. capillaceus (Figs. 11A, D, 13, 14). Revestimiento externo con delgada capa de tejido muscular liso. Lumen revestido como en las otras especies, con tejido epitelial cilíndrico glandular no ciliado, las células glandulares globosas subepiteliales en los repliegues, ambas se ven pequeñas (Fig. 11A). Hay algunos soportes de tejido muscular liso, bastante delgados (Fig. 14B). Se observa secreción apocrina en las células epiteliales glandulares, con agrupamiento arrosetado de células (Fig. 14A). También presenta secreción holocrina, con el rompimiento total de la célula (Fig. 14B). Las células glandulares subepiteliales son apocrinas.
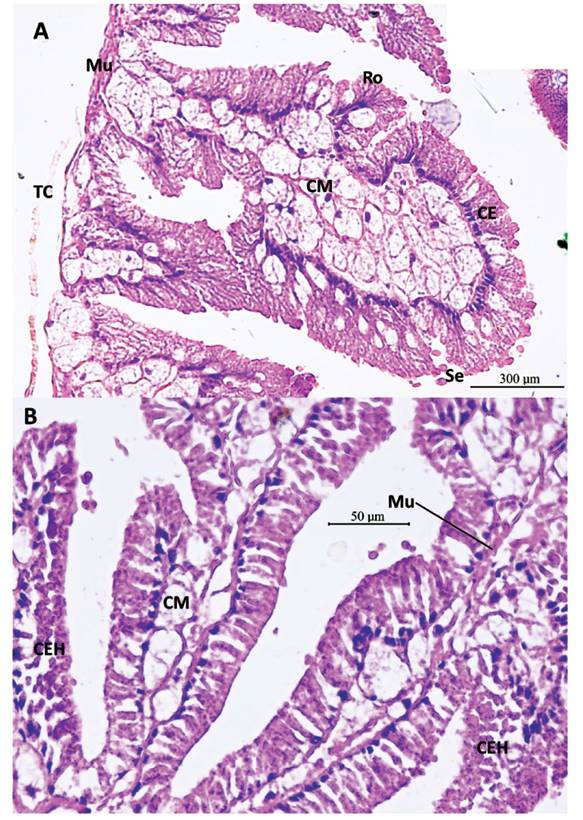
Figura 14 Sección histológica longitudinal del saco glandular anexo (SGA) de M. capillaceus. A- Pared del SGA con proyecciones hacia el lumen de los tejidos epitelial y subepitelial: Tejido muscular liso (Mu), tejido epitelial de células glandulares agrupadas en roseta (Ro) en su proceso de secreción apocrina. Secreción (Se). Células mucosas subepiteliales (Mu). Tejido conjuntivo (TC) que envuelve al SGA y talón. Aumento 400X. B- Repliegues del SGA con tejido muscular liso (Mu). Células epiteliales glandulares, con granulaciones, en proceso de secreción holocrina (CEH). Aumento 400X.
Conducto del SGA desemboca en el conducto colector poco antes de la salida del talón (Fig. 11D). El conducto colector presenta un par de proyecciones del epitelio de revestimiento, con tejido conectivo (Fig. 13C).
Discusión
El talón en las cinco especies de Megalobulimus estudiadas está compuesta por la bolsa de fertilización y túbulos de la espermateca, en ambos casos con células ciliadas tal como lo reportado para los gasterópodos terrestres, Stylommatophora (e.g., Schileyko & Schileyko 1992, Haase & Baur 1995, Zając & Kramarz 2017). Sin embargo, es diferente al talón de otras especies en que ambas están “embebidas” en una estructura de tejido muscular liso; es decir que la bolsa de fecundación no está adherida a la espermateca por tejido conjuntivo que permitiera verlos externamente y separarlos fácilmente, así como tampoco se puede identificar fácilmente el número de túbulos de la espermateca (van Mol 1971, Schileyko & Schileyko 1992, Beese, 2007).
La bolsa de fertilización es más bien tubular, por cuyo extremo proximal ingresa el conducto hermafrodita, a diferencia de lo reportado para la mayoría de estilonmatóforos, en donde es ciego (Rigby 1963, van Mol 1971, Lind 1973, Haase & Baur 1995, Beese 2007).
En cuatro de las cinco especies de Megalobulimus estudiadas, el talón es una pequeña estructura, en relación con el saco grandular anexo, de consistencia sólida, por la gruesa capa de tejido muscular liso que envuelve a los tubos de la espermateca y a la bolsa de fertilización. Ésta suele ser algo más larga que los túbulos ciegos de la primera. En el caso de M. leucostoma, Borda (2014, p: 49) describe la morfología externa del talón como “una estructura esférica, adosada a la base del saco glandular anexo”. Pero, a nivel histológico se puede apreciar que esa parte esférica es tan solo 1/4 del talón, con gruesa capa de tejido muscular liso, que contiene a los túbulos de la espermateca, y tan solo parte de la bolsa de fertilización, pues ésta es como 3/4 más larga, y tubular, por lo que habría sido confundida con el conducto hermafrodita.
Tanto en el conducto hermafrodita como en la bolsa de fertilización fueron observados espermatozoides endógenos (Ponder et al. 2020). En túbulos de la espermateca se observaron espermatozoides exógenos en conexión con las células epiteliales ciliadas, conocidos como espermatozoides orientados, tal cual lo describió Rigby (1963) en Oxychilus cellarius (O. F. Müller, 1774), van Mol (1971) en Bulimulidae, Lind (1973) en Helix pomatia Linnaeus, 1758, Haase y Baur (1995) en Arianta arbustorum (Linnaeus, 1758); Bojat et al. (2001) lo estudiaron a microscopía electrónica. Bojat et al. (2002) indican que esta condición se da probablemente en la mayoría de los gastrópodos. Schileyko y Schileyko (1992) hipotetizaron que, de esta manera, las espermátides exógenas pasan un periodo de maduración, por lo que los túbulos de la espermateca no serían tan solo un contenedor de exoesperma, lo que demostraron investigadores posteriores (ver Bojat et al. 2001, 2002).
En los Megalobulimus estudiados se ha observado la cámara de fertilización como una recámara en posición basal del talón, adonde llega la bolsa de fertilización y salen los túbulos de la espermateca. Algo semejante describe Rigby (1963) en Oxychilus cellarius (Müller), que llama a la primera “ciliated hood”, a la segunda “receptáculo seminal”, y a la región de confluencia de éstas como “pequeña cámara de fertilización”, con lo que se concuerda en el presente trabajo, y hemos llamado cámara de fertilización.
El saco glandular anexo (SGA) ha sido observado en especies del género Megalobulimus (Hylton-Scott 1939, Leme 1973, Simone & Leme 1998, Borda & Ramírez 2013, 2016, Beltramino 2016), aunque recientemente nominado como receptáculo seminal (Silva & Simone 2022), y este es el primer estudio que lo muestra a nivel histológico. En el presente estudio se evidencia que desemboca en el conducto colector, justo antes de la entrada al talón, que posteriormente recibe al de la glándula de la albúmina y termina en el ovoespermiducto. Las secreciones del SGA parecieran facilitar el viaje de los espermatozoides a los túbulos de la espermateca, pues se ha observado toda una estela dejada seguramente por alguna sustancia, que aquí asumimos proviene del SGA.
El SGA de las cinco especies de Megalobulimus aquí estudiadas presenta dos tipos de células glandulares, la epitelial cilíndrica con citoplasma granular acidófilo, y la globosa subepitelial de naturaleza ligeramente básica. Maltz et al. (2017) encontraron en el oviducto y partes del espermoviducto de especies de Clausiliidae, células subepiteliales indicadas como típicas células mucosas, liberan sus productos directamente al lumen del oviducto, previamente sus membranas apicales penetran entre las células epiteliales hasta alcanzar el lumen, tal cual lo observado aquí en el SGA de Megalobulimus spp. Kugler (1965) menciona a unas células mucosas subepiteliales que descargan su secreción en el lumen, extendiendo un cuello a través de las células ciliadas que tapizan el lumen del talón (saco de fertilización), cerca de la glándula de la albúmina, en la babosa Philomycus carolinus (Bosc, 1802), y encontró que estas células contienen mucopolisacáridos ácidos y neutros. Gómez (1991) observó lo mismo en el caracol Cryptazeca monodonta (Folin & Bérillon, 1877), que tampoco tiene alguna estructura sacular en el talón, donde las células glandulares subepiteliales secretan su contenido directamente en la cámara de fertilización. A juzgar por la posición de estas células subepiteliales glandulares voluminosas, que corresponden a la posición del SGA de Megalobulimus spp., entre el talón y la glándula de la albúmina, concluimos que corresponderían a las indicadas por Kugler (1965) y Gómez (1991). Este último indica también que las células glandulares de la cámara de fertilización se extienden por la pared del tubo espermático. Nicholas (1984) también encontró células glandulares subepiteliales extiéndase a lo largo de todo el conducto colector (desde la unión del talón a la región proximal del surco espermático), que denominó “glándula del Carrefour”, discrepando con Kugler (1965) en que las células glandulares subepiteliales encontradas no eran mucosas, por el contrario, eran de naturaleza proteínica. En el caso del SGA de Megalobulimus encontramos dos tipos de células glandulares, mucosa subepitelial, y serosa epitelial no ciliada. Ambas secretan su contenido al lumen del SGA, que luego lo libera en el conducto colector, próximo al talón. Las células glandulares subepiteliales de apariencia mucosa descargan su contenido al lumen de la misma manera descrita por los autores antes mencionados; así como también se extienden parcialmente por el conducto colector hacia la glándula de la albúmina, y hacia el borde externo basal del talón. Por otro lado, las células glandulares epiteliales tienen granulaciones acidófilas. Entonces, el SGA correspondería a la “glándula del Carrefour” de Nicholas (1984) modificada, con células mucosas subepiteliales, y con el agregado de que la capa epitelial es de células no ciliadas glandulares, y de posible naturaleza proteica. Gómez (2001) sugiere que las secreciones de tales células glandulares subepiteliales proveerían de un medio para la fusión de los gametos. En el caso de Megalobulimus, el contenido proveniente de las células glandulares del SGA se pudo apreciar en los túbulos de la espermateca de tres de las cinco especies estudiadas, junto con espermatozoides exógenos orientados, lo que podría estar indicando que la secreción de las células glandulares epiteliales y subepiteliales estarían coadyuvando a la “capacitación” de los espermatozoides, y, posiblemente, en alguna medida a la unión de óvulo y espermatozoide, en la cámara de fertilización, en la base del talón.
En cuanto a la forma de secretar de las células glandulares epiteliales, es muy semejante a lo encontrado en la glándula accesoria mucosa del caracol pulmonado estilommmatóforo Eremina ehrenbergi Roth, 1839 (Bawab 2020), sobre todo el característico agrupamiento en forma de roseta de estas células epiteliales secretoras. Gómez et al. (1996) demostraron en otros Helicidos que la glándula digitiforme presenta células epiteliales alargadas y no ciliadas, como lo encontrado en el SGA de Megalobulimus.
En el SGA se observaron células con los tres distintos tipos de secreción en el mismo individuo, merocrina, apocrina y holocrina, siendo más evidentes estas dos últimas. Moura et al. (2004) encontraron en sus estudios de epitelio de glándulas salivales de Biomphalaria straminea (Dunker, 1848), que la actividad de secreción apocrina y holocrina son fases de la diferenciación de tales células. En todos los individuos de Megalobulimus spp. analizados, la actividad de las células glandulares epilteliales y subepiteliales responde a su plena actividad reproductiva, lo que también es corroborado por la presencia de espermatozoides exógenos en la espermateca, así como acontece en el epitelio de la glándula mucosa accesoria de la vagina en Eremina ehrenbergi (Bawab 2020).
Esta gran actividad celular en el SGA conlleva también a la destrucción de las células. La regeneración de las células glandulares epiteliales en diversos grupos animales es conocido que se da por las células basales (Moura et al. 2004, Lynch et al. 2018, Dennis et al. 2021). Se ha observado células mioepiteliales entre las células glandulares subepiteliales de Megalobuilimus; igualmente se presentan relacionadas a glándulas submucosas de diversos animales (Dennis et al. 2021). Con estudios experimentales en el epitelio traqueal del ratón, Lynch et al. (2018) encontraron que entre las células mioepiteliales relacionadas a la glándula submucosa existen unas que funcionan como células madre de reserva, con capacidad regenerativa de células epiteliales y glándulas submucosas. Ello puede suceder también con las células mioepiteliales encontradas relacionadas a las células mucosas subepiteliales en el SGA de Megalobulimus.
Entre otras células observadas están las células de Leydig. Fueron encontradas principalmente en la región basal del talón, en proyecciones del epitelio del conducto colector, y conducto del saco glandular anexo. Son células del tejido conectivo en moluscos que frecuentemente producen mucus y almacenan glicógeno (Dennis et al. 2021). Jong-Brink (1969) la encontró en el tejido conectivo del talón, útero y vagina del caracol acuático Biomphalaria glabrata. Otros autores indican que las células de Leydig son un tipo de rogocito (Haszprunar 1996, Kokkinopoulou et al. 2015).
El género Megalobulimus, endémino del Neotrópico, agrupa especies de caracoles terrestres de gran tamaño, así como de huevos grandes y bien calcificados, similar a los huevos de ave (Tompa 1976, Zając & Kramarz 2017), aunque depositan pocos huevos (10 a 18 al año) (Beltramino 2016). Las mayores dimensiones las tiene M. popelairianus, de 230 mm de altura de la concha y huevo de 21x25 mm (Stanlen 1917, Heller 2001). Se hipotetiza aquí que estas características del huevo hayan evolucionado junto con cambios hacia el talón bulboso que encontramos en las especies de Megalobulimus, con fuerte musculatura lisa envolviendo tanto a la bolsa y cámara de fertilización, como a los túbulos de la espermateca, produciendo un pasaje más efectivo de los espermatozoides exógenos contenidos en los túbulos de la espermateca con sustancia producida en el SGA. Hay toda una variación en la estructura del talón en caracoles terrestres pulmonados, desde 1) un simple tubo plegado, 2) con bolsa de fertilización, 3) bolsa de fertilización y un solo túbulo de la espermateca, hasta 4) bolsa de fertilización y espermateca subdividida (Beese 2007). En Megalobulimus encontramos una forma muy compleja de esta cuarta condición en la cual se agrega también el saco glandular anexo.
Si bien existen características comunes en la bolsa de fertilización y saco glandular anexo de las cinco especies de Megalobulimus aquí estudiadas, con respecto al tipo de células y la organización general, se observaron diferencias en relación a la forma del saco glandular anexo y el de la espermateca. Sin embargo, se pudo apreciar una uniformidad conformando dos grupos. Por un lado, el de M. popelairianus, carrikeri, leucostoma y maximus en donde lo más resaltante corresponde a los múltiples túbulos ramificados de la espermateca, con lumen reducido. Por el otro está M. capillaceus, en que tales detalles son absolutamente contrastantes, pocos tubos, pero con lumen amplio y revestimiento festoneado. En filogenias moleculares de especies peruanas de Megalobulimus (Ramírez et al. 2012) y de M. oblongus de Colombia (Jaramillo et al. 2014), se encontró que M. capillaceus junto con M. oblongus conforman uno de los dos clados en que se agrupan las especies de Megalobulimus. Shiga (2023) también observó este ordenamiento en su estudio de la histología de la glándula de la baba de M. capillaceus con respecto a M. huascari, lichtensteini y M. carrikeri. Por lo que las características histológicas del talón también constituirían otra sinapomorfía para cada uno de los dos clados de Megalobulimus encontrados en filogenias moleculares. En su estudio de la organización del talón en la familia Bulimulidae, van Mol (1971) ya sugería que podría proporcionar criterios en la búsqueda de afinidades a nivel sistemático. Igualmente lo encontraron Schileyko y Schileyko (1992), aunque indicando que solo con investigación en la mayoría de las especies de cada familia de los Stylommatophora se podrá determinar qué caracteres pueden ser usados y a qué nivel, lo que se demostró en la presente investigación, con especies del género Megalobulimus de la familia Strophocheilidae.












 uBio
uBio 


