INTRODUCCIÓN
La papaya (Carica papaya L.) pertenece a la familia de las Caricaceae, es un árbol frutal tropical americano (Koul et al., 2022) posee un valor nutricional rico en vitaminas y minerales bajo en calorías (Alara et al.,2020). La propagación de este cultivo se realiza solo a través de semillas (Chandni et al., 2022). En condiciones ambientales, la germinación de las semillas se dificulta debido a los inhibidores presentes en la sarcotesta membrana que contiene compuestos fenólicos inductores de latencia (Romero Rodríguez et al., 2013), misma que se convierte en una barrera física que limita el paso de agua y gases lo que provoca una germinación baja (Rodríguez et al., 2019) y facilita la colonización de fitopatógenos (Benítez et al., 2013). Los bioformulados de PGPR´s que contienen células microbianas vivas que son incorporadas en la rizosfera (Mitra et al., 2021) son propicios a la hidratación de las semillas y mejoran el proceso de movilización de nutrientes (Chaudhary et al., 2020; Raj et al., 2021). Se ha convertido en una solución eficiente a los fertilizantes y pesticidas químicos (Vassileva et al.,2021). Muchas bacterias, incluidas Acinobacter, Azospirillum, Azotobacter, Bacillus, Pseudomonas, se han explorado de manera efectiva (Qessaoui et al., 2021; Widawati, 2018). Capaces de estimular el crecimiento de las plantas a través de una variedad de mecanismos que mejoran la nutrición de las plantas, producción y regulación de fitohormonas (Martínez-Viveros et al., 2010) por la síntesis de ácido indol acético (AIA) controla diversos procesos fisiológicos como la elongación y división celular (Vega-Celedón et al., 2016) y ácido giberelico que controlar procesos de crecimiento como la latencia de semilla, elongación y desarrollo de flores (Saidi y Hajibarat, 2021). En una etapa temprana de desarrollo mejora la producción de biomasa a través de efectos directos sobre tasa germinativa, aumento del crecimiento de raíces y brotes (Katiyar et al., 2016) por tratamientos de recubrimiento o imprimación (Carrasco-Fernández et al., 2020; Cardarelli et al., 2022) las plantas pueden seleccionar bacterias con características beneficiosas y transferirlas a través de la semilla para beneficiar a la siguiente generación (Truyens et al., 2015). El crecimiento de la población microbiana a partir de un bioformulado (Bharathi et al., 2004) depende en gran medida la pureza de la melaza que proporciona azucares para su división celular (Ganeshamoorthi et al., 2008), las fuentes de nitrógeno y harina de trigo como principal vehículo de carbono Mishra et al., (2020) para mejorar la tasa de supervivencia y mantener la población microbiana activa Wong et al., 2019. Además, estos elementos protegen a las células microbianas del estrés biótico Kalita et al., (2015) y mejoran el control de enfermedades al aumentar la producción de metabolitos antimicrobianos Adoko et al., (2021).
La latencia es un bloqueo para la germinación, que persiste en el estado embebido y representa un mecanismo adaptativo que permite que una semilla retrase la germinación. Las técnicas utilizadas en el beneficio de semilla de papaya para eliminar la sarcotesta son limitadas lo que provoca una tasa germinación lenta generando perdidas economicas. En este estudio, se probaron tres bioformulaciones bacteriana ampliamente utilizadas (Bioimpulse, BioBacter Plus, Rizobacterias), en consrcios Pseudomonas protegens (CHA0) y Pseudomas putida (BMR 2-4) para evaluar su efecto estimulante roptura de la latencia semilla, incremento radicular y morfología vegetal sobre plántulas de papaya.
MATERIAL Y MÉTODOS
Ubicación
La investigación se ejecutó en el Laboratorio de Microbiologia y Biología molecular de la Universidad Técnica Estatal de Quevedo (UTEQ), ubicado en la Finca Experimental “La María” situado en el km 7 1/2 de la Vía Quevedo - El Empalme, canton Mocache, sus coordenadas geográficas 01° 06’ de latitud Sur y 79° 29’ de latitud Oeste, a 75 msnm.
Multiplicación masiva de bacterias fluorescentes
Del banco de germoplasma del laboratorio microbiología de la UTEQ, se escogieron 2 cepa bacterianas Pseudomonas protegens (CHA0) y Pseudomona putida (BMR 2-4). Las bacterias fluorescentes se incubaron a 150 rpm / 48 h a temperatura ambiente 27 °C en un agitador (Marca) en 50 mL de caldo King B [(g/L): peptona, 20.0; glicerol, 15 mL; K2HPO4, 1.5 g; MgSO4 x 7H2O, 1,5 g; agua destilada)] (King et al., 1954). Después de 48 h, se recuperó 5 mL de suspensión de caldo y de consorcio bacteriano que contiene 9x109 UFC/mL, incorporadas en 3 bioformulados con capacidad de 1 Litro para la reproducción masiva, Bioimpulse (Melaza 30%, Harina de maíz 50%, Sal en grano 0,25%, glicerina 10%, fijador biológico 0,35%), BioBacter PLUS (Melaza 25%, Harina de maíz 50%, urea 2.5%, glicerina 10%, roca fosfórica 1,5%), RizoBacterias (Melaza 30%, Harina de maíz 50%, Sal en grano 0,25%, glicerina 10%, roca fosfórica 1,5%), se mezclaron en condiciones estériles siguiendo el método descrito por (Vidhyasekaran & Muthamilan, 1995).
Evaluación in vitro de semillas inoculadas con bioformulados
Las semillas de papaya se desinfectaron con hipoclorito de sodio (NaCIO) al 1% por 5 min y sumergidas en agua destilada estéril para retirar restos NaCIO, finalmente secadas en papel toalla estéril. Las semillas tratadas se empaparon sobre suspensión de 50 mL de bioformulado con inoculados bacterianos combinados 1x107 UFC/mL por 30 min. Se colocaron aproximadamente ± 20 semillas ubicadas en papeles de germinación de semillas con agua destilada estéril colocadas en placa Petri y puestas bajo incubación (memmert) modelo TwinDISPLAY a 27 °C por un fotoperiodo de 16 h luz/8 h oscuridad por 20 días.
Estudio de rizotrones y análisis de parámetro radicular
Se analizó el desarrollo de raíces seminales en etapa temprana, las semillas de papaya se cultivaron en cajas Perspex (rizotrones) de 2 cm de espesor, 18 cm de ancho y 36 cm de profundidad que contenían una mezcla estéril de turba - tierra en relación 1:2. Los rizotrones se colocaron en una cámara de crecimiento con una humedad relativa del 60% con un fotoperíodo de 12 h de ciclo de iluminación y temperaturas de 24 °C día/noche. Se envolvieron con cartulina negra para evitar la fotooxidación. Se inocularon 50 ul de bioformulado BIOIMPULSE de bacterias en consorcio 1x108 UFC/mL, 25 mg L-1 de AIA y el control con agua destilada estéril. Se realizaron 3 inoculaciones a los 2, 8 y 16 días. Los rizotrones se retiraron al final del día 22 y se tomaron imágenes con una resolución de 300 DPI con un escáner de documentos portátil (ISCAN Portable Handheld Scanner). Las imágenes se analizaron con ImageJ (imagej.nih.gov, Rueden et al., 2017). Como resultado del análisis, se midieron la longitud y área de pelos absorbentes.
Aplicación de bioformulados en plántulas
Se examinó la influencia del bioformulado BIOIMPULSE (BMR 2-4 + CHA0) suplementado con 5 gr/L roca fosfórica (RF) y superfosfato triple (SFT) por separado. Las semillas pregerminadas de papayas fueron trasladas a fundas de polietileno 10x20 con 4500 gr del sustrato antes mencionado que se mantuvieron bajo condiciones de invernadero. Se realizaron 2 inoculaciones 5 mL/plántula 1x108 UFC/mL a los 10 y 20 días. Las plántulas fueron sacrificadas a los 40 días después de la inoculación y se tomaron las siguientes medidas. Se determinaron las características morfológicas porcentaje de germinación, número y longitud radicular, longitud y diámetro del hipocótilo y peso fresco.
Análisis estadístico
Se utilizó un DCA, cada experimento con 3 réplicas y con 4 unidades experimentales. Los valores a cada condición están representados con la desviación estándar promedio individual (±), los tratamientos fueron sujetos al análisis de varianza por ANOVA, y separados por procedimiento de comparación múltiple de Tukey SD, al nivel de significancia de (p ≤ 0,05), empleando Statgraphics.
RESULTADOS Y DISCUSIÓN
Efecto de los bioformulados en la germinación de semillas y el crecimiento radicular
No se encontró diferencia estadística sobre el porcentaje de germinación de papaya bajo aplicación de bioformulados en estudios. El empleo de BIOIMPULSE: (BMR 2-4 y CHA0) obtuvieron mayores promedios del 80% sobre la tasa germinativa (Figura 1A).
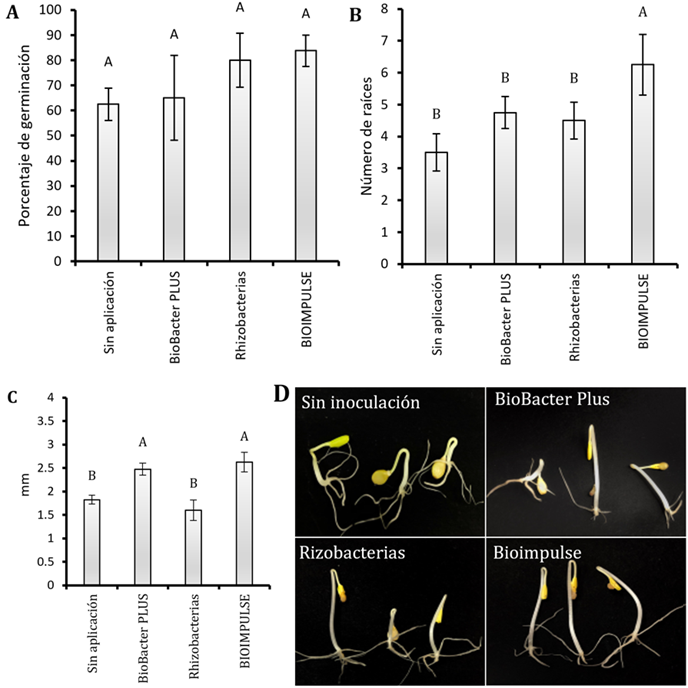
Figura 1 Resultados de la aplicación de bioformulados (P. protegens CHA0 + P. putida BMR 2-4) en semillas de papaya Hawaina. A) Porcentaje de germinación. B) Número de raíces. C) Longitud de raíces en cm. Las barras indican el DE individual para tratamiento (±). Con diferencias significativas al nivel de (p ≤ 0,05), por el procedimiento de comparación múltiple de Tukey D) Efecto de los bioformulados en la germinación de la semilla.
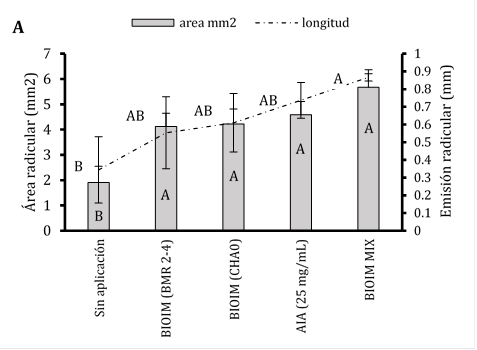
Medición de área y pelos radicales
Al estar expuestas las semillas papayas bajo la co-inoculación con BIOIMPULSE mezclando rizo-bacterias promovieron el incremento temprano de pelos radiculares de 4,12 a 5,67 mm demostrando que este tratamiento ocupo un espacio sobre el área de la radícula a 0,86 mm2 y sin inoculante se aprecia la disminución de zona de crecimiento pilosa (Figura 2A). Sugiriendo que las interacciones subterráneas entre las raíces de las plantas dan una mejor adquisición de nutrientes (Figura 2B). La preparación del sistema inmunológico de las plantas conduce a una mayor ramificación lateral de la raíz y al desarrollo de pelos radiculares (Figura 2C). En aplicaciones edáficas con B. subtilis (B77 y B8) incrementaron biomasa seca radical a 48% controlando la infección de R. solani en maíz (Ugoji & Laing, 2008). La colonización por PGPR está asociada con cambios en el metabolismo de las plantas, la señalización y la homeostasis hormonal (Tsukanova et al., 2017). La modificación de la arquitectura del sistema radicular por PGPR implica la producción de fitohormonas y otras señales (Adebayo et al., 2022).
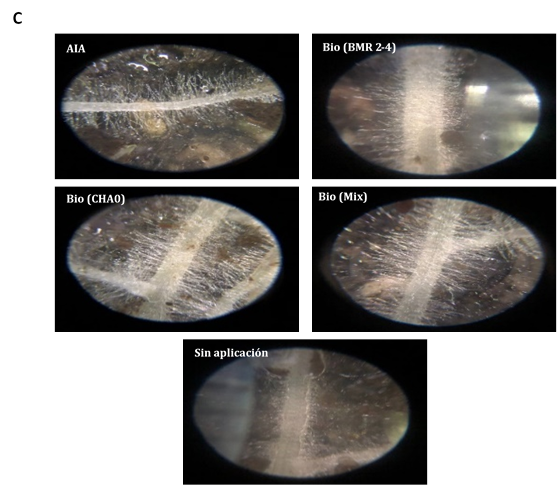
Figura 2 Estimación del consorcio sobre el Fenotipado de Carica papaya y análisis de imagen de pelos radicales. A) Presencia del área y longitud de pelos absorbentes. Las barras indican el DE individual para tratamiento (±). Con diferencias significativas al nivel de (p ≤ 0,05), por el procedimiento de comparación múltiple de Tukey. B) Incremento radicular cultivados en rizotrones. C) Análisis de la distribución radicular en software Imagen J® versión 1.8.0.
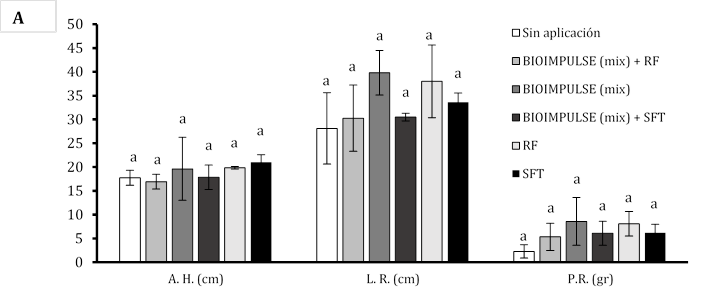
Combinación bacteriana con fertilizante fosforado sobre el crecimiento de papaya
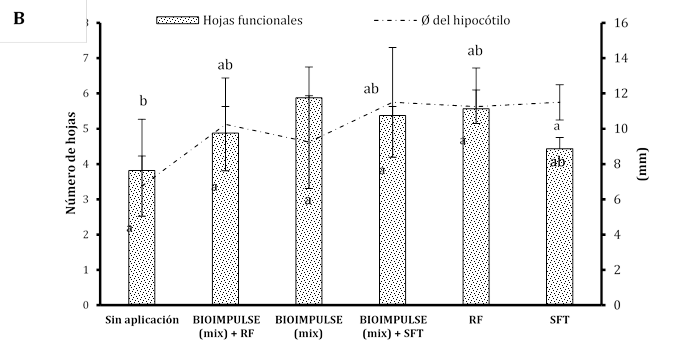
El empleo de consorcios microbianos (CHA0 + BMR 2-4) bajo la adición de fertilizantes fosforados sobre las variables morfométricas alcanzado por los tratamientos no mostró diferencia significativa. Se manifiesta un mayor aumento celular de BIOIMPULSE sin la incorporación de fosforo inorgánico (Super Fosfato Triple SPT y Roca Fosfórica RC) promovieron el desarrollo en la altura del hipocótilo de (19,62 a 17,85 cm), con un hinchamiento en el crecimiento radicular de (30,5 a 39,81 cm), con un engrosamiento sobre el peso de la raíz de (5,33 a 8,57 g) (Figura 3A). Donde la altura de la planta en la etapa de madurez de arroz sobre la interacción entre la tasa de P y la inoculación de P. fluorescens no fue afectada (Hasani & Aminpanah, 2015). Tras incorporar suministros de fósforo, las bacterias mostraron baja actividad metabólica para solubilizar el P y es posible que se hayan visto perjudicadas por altas dosis de P (Rosa et al., 2020). La rizobacterias ejercen mayores beneficios en presencia del aminoácido L-triptófano (Trp) estimulando eficazmente sobre el incremento el peso radicular (Marquina et al., 2018). La co-inoculación de los consorcios rizobacterianos (PGPR) generan mayor formación de hojas funcionales dentro de la zona aérea de plántulas de papayas con valores promedios de 4,62 mm a diferencia de co-incolacion sin consorcios que hay un formación baja de hojas funcionales de 3,37 mm presentando diferencia significativa, donde la variable del Ø de hipocótilo no demuestra diferencia significativa este efecto se ve influenciado por la utilización de comunidad microbiana mezclando fertilizante fosforado o sin fertilizante fosforado y con aplicaciones individuales fosforado (Figura 3B). El número de vainas por planta de haba estuvo significativamente influenciado la aplicación de P, la cepa de P. fluorescens. En ausencia de P, Pseudomonas (136) produjo el mayor número de vainas por planta (Nikfarjam & Aminpanah, 2015). Esto podría se debe a la combinación de bacterias y fósforo se correlacionaron con el mayor incremento de raíces (Figura 3C).

Figura 3 Estimulación del bioformulado microbiano mezclando fósforo inorgánico sobre sistemas radicular. A) Incremento morfométrico de la planta. B) Número de hojas y diámetro del hipotécalo. Las barras indican el DE individual para tratamiento (±). Con diferencias significativas al nivel de (p ≤ 0,05), por el procedimiento de comparación múltiple de Tukey. C) Variación morfológica sobre la arquitectura radicular bajo fertilizantes fosforados.
CONCLUSIONES
Las formulaciones con mayor efecto bioestimu-lador sobre el proceso germinativo de semillas de papaya BIOIMPULSE fueron CHA0 y BMR 2-4, lo que favoreció la evaluación temprana al desarrollo radicular y un aumento de pelos radicales con rizotrones. El efecto de estimulación impartido por la bacteria puede ser más fuerte en las primeras etapas del crecimiento de la planta y luego puede estabilizarse hacia el final del desarrollo de la planta. La combinación de bacterias y un contenido bajo de fósforo se correlacionaron con el mayor incremento de raíces. Los resultados obtenidos del presente estudio proponen CHA0 y BMR 2-4 con propiedades bioestimulante que podría ser una herramienta prometedora para mejorar el sustento de los agricultores a través de la agricultura orgánica de varias especies frutícolas. De hecho, nuestros resultados ayudan a ampliar el conocimiento sobre cómo los consorcios microbianos interactúan por efecto sinérgico con las plantas y las comunidades microbianas nativas del suelo.












 uBio
uBio