INTRODUCCIÓN
La lechuga (Lactuca sativa L.) es una planta anual, herbácea perteneciente a la familia Asteraceae y es el único miembro del género Lactuca. Es una de las hortalizas de hoja más importantes cultivada ampliamente en todo el mundo (Jeong et al., 2015; Sapkota et al., 2019; Shatilov et al., 2019; Yazdi et al., 2019; Shi et al., 2022), llegando a alcanzar una producción de 27 millones de toneladas el 2021 (FAO, 2021).
Es la hortaliza más consumida en fresco a nivel mundial, por su gran producción y valor económico, y también, por ser un alimento nutrafuncional y fuente importante de un alto contenido de agua (95%), vitaminas (B9, C y E), β-caroteno, luteínas, antioxidantes dietéticos, potasio, folato, minerales, fitoquímicos como los flavonoides que son beneficiosos para la salud humana (Kim et al., 2016; Wardhana et al., 2016; Ahmed et al., 2019; Shatilov et al., 2019; Camejo et al., 2020; Medina-Lozano et al., 2021; Shams et al., 2019; Shi et al., 2022; Sularz et al., 2020; Teng et al., 2021; Yang et al., 2022). Contiene metabolitos implicados en los efectos protectores contra una serie de enfermedades crónicas, incluidos el cáncer, la diabetes y las enfermedades cardiovas-culares (Ismail et al., 2019). También podría ayudar a la generación de glóbulos blancos y rojos en la estructura de la médula ósea y mejorar el sistema digestivo (Wardhana et al., 2016). Además, a pesar de su bajo contenido en lípidos, la lechuga contiene ácidos grasos poliinsaturados, como los ácidos linoleico y linolénico, que debemos obtener de la dieta (Kim et al., 2016). Las lechugas son ricas en carbohidratos de baja digestibilidad como la fibra, el almidón resistente y los alcoholes de azúcar, que no se absorben en el intestino delgado, pero que son necesarios para el adecuado funcionamiento gastrointestinal (Grabitske & Slavin, 2009). Las partes más utilizadas son las hojas, seguida de los tallos y las semillas (Diaz, 2021).
La lechuga es un cultivo de crecimiento relativa-mente rápido, con ciclo de crecimiento corto, con alta densidad de siembra, baja demanda de energía (Bantis et al., 2018; Zhang et al., 2018), raíces poco profundas y con altos requerimientos de agua, que lo hacen ideal para la producción hidropónica en sistemas controlados (Boros et al., 2023; Bre´s et al., 2022). Constituyéndose, así como una de las hortalizas hidropónicas más cultivadas, con un alto rendimiento y buena calidad (Kaiser & Ernst, 2012; Qadeer et al., 2020).
Recientemente, los invernaderos han comenzado a expandir sus técnicas de cultivo para incluir tecnologías de cultivo sin suelo como hidroponía y aeroponía (Koukounaras, 2021; Singh et al., 2020). El sistema hidropónico es una solución útil para superar los problemas causados por los cambios climáticos y las condiciones de sequía (Jois 2021). En los últimos años el sistema hidropónico se ha utilizado como un sistema de cultivo de lechuga debido a los beneficios que aporta, incluida la eliminación de riesgos de enfermedades transmitidas por el suelo, el uso eficiente de los recursos naturales. En este sistema, los sustratos hidropónicos se utilizan como sustituto de la tierra. Los sustratos comúnmente utilizados incluyen perlita, vermiculita y turba (Kumar y Saini 2020). Tradicionalmente, se han usado estos sustratos para dar soporte a las raíces y mejorar su crecimiento (El-Kazzaz & El-Kazzaz 2017). Las principales diferencias entre el cultivo convencional en suelo y los sistemas de cultivo hidropónico son la disponibilidad de agua y suministro de nutrientes (De Souza et al., 2019). La combinación de todos estos factores determinará tanto la cantidad como la calidad del producto fresco (Kameoka & Hashimoto, 2019). Estas diferencias influyen en el desarrollo fisiológico y la bioquímica de las plantas (De Souza et al., 2019).
En Piura, en el caserío Mocará de Catacaos, se cultiva lechuga en condiciones hidropónicas que abastecen a los supermercados de la región, la zona tiene un clima prometedor para satisfacer la demanda en las circunstancias actuales de crisis alimentaria. Sin embargo, su cultivo viene siendo afectado por diferentes enfermedades fungosas, como la pudrición de raíces, pudrición del cuello y manchas foliares que ocasionan muerte de plántulas y que generan pérdidas económicas significativas al productor y una fluctuación negativa en su comercialización. Por lo tanto, se requiere una comprensión profunda sobre la caracterización de los agentes causales para clasificarlos y desarrollar adecuadas prácticas de manejo de las enfermedades. El objetivo del presente trabajo fue identificar el agente causal, describir la sintomatología e implementar alternativas de manejo.
METODOLOGÍA
Aislamiento y caracterización de hongos fitopatógenos
Se colectaron muestras de plantas de lechuga con síntomas típicos de pudrición. Los tejidos enfermos fueron lavados con abundante agua, luego, con agua destilada estéril, se desinfestaron con una solución de hipoclorito de sodio al 1% durante 2 minutos y se enjuagaron dos veces con agua destilada estéril (French & Hebert, 1980). Estas muestras fueron cortadas en pequeñas secciones de 0,5 a 1,0 cm de longitud, seleccionando áreas correspondientes a los márgenes de avance del síntoma necrótico, para ser sembrados en placas de Petri que contenían medio de cultivo papa dextrosa agar (PDA). Las placas fueron selladas y puestas en cajas de tecknoport a temperatura ambiente hasta obtener el crecimiento del hongo (French & Hebert, 1980).
Los asilamientos obtenidos fueron purificados en tubos de prueba que contenían medio papa dextrosa agar (PDA) y almacenados a 5°C con la finalidad de mantener la viabilidad y patogenicidad de los hongos aislados (French & Hebert, 1980). A partir de los cultivos puros, se prepararon montajes en lámina para observar a través del microscopio compuesto con aumento de 40X (Carl Zeiss Mod. KF 2, Oberkochen, Germany) las características morfométricas de las estructuras asexuales de los aislamientos fúngicos para su caracterización morfológica e identificación usando las claves propuestas por Barnett & Hunter (1998), Sneb et al. (1991). El aislamiento y caracterización del agente causal se realizaron en el Laboratorio de Fitopatología del Departamento de Sanidad Vegetal de la Facultad de Agronomía de la Universidad Nacional de Piura. Las muestras fueron colectadas de un cultivo hidropónico de lechuga ubicado en el caserío de Mocará del distrito de Catacaos, departamento de Piura, cuya ubicación geográfica se encuentra entre las coordenadas 5°18'05"S y 80°42' 18"W, 22m
Descripción sintomatológica
Se hizo la descripción sintomatológica de cada una de las enfermedades fungosas observadas en el cultivo de lechuga bajo condiciones hidropónicas.
Prueba de patogenicidad
Se utilizó plántulas de lechuga con 4 hojas que fueron trasplantadas en bandejas de plástico que contenían solución nutritiva. La inoculación de los patógenos aislados (discos de 1,0 mm de diámetro de medio de cultivo papa dextrosa agar con crecimiento activo de micelio) se realizó en la raíz, corona y hojas. Posteriormente, a fin de crear condiciones adecuadas de humedad para el desarrollo de la enfermedad y reproducción de los síntomas (French & Hebert, 1980), las plántulas inoculadas fueron cubiertas con bolsas de plástico. Después de la aparición de los síntomas, se aisló nuevamente el agente causal para cumplir con los postulados de Koch (Khakimov et al., 2022).
Prueba in vitro de fungicidas químicos
La eficacia de control de los productos químicos se determinó mediante el método del cultivo enve-nenado, que consistió en inocular trozos de 0.6 cm diámetro de medio de cultivo papa dextrosa agar con crecimiento activo del patógeno de 7 días de edad en el centro de las placas de Petri conte-niendo medio papa dextrosa agar con fungicidas según las dosis que se indican en la Tabla 1.
El tratamiento control únicamente contenía medio papa dextrosa agar. Las placas inoculadas fueron puestas en cajas de tecknoport a temperatura ambiente durante el tiempo que duró la evaluación. La evaluación se realizó cada 24 horas midiendo el diámetro de crecimiento de la colonia y terminó cuando el hongo cubrió toda la placa de 9 cm de diámetro. La eficacia de control se determinó calculando el porcentaje de inhibición del crecimiento de la colonia del patógeno mediante la fórmula propuesta por Abbott (1925).
(%) de inhibición=((a-b)/a)100%
Donde a: Crecimiento radial del micelio del trata-miento testigo; b: Crecimiento radial del micelio en cada tratamiento.
Tabla 1 Fungicidas evaluados in vitro contra hongos fitopató-genos del cultivo de lechuga
| Trat. | Nombre comercial | Ingrediente activo | Concentra-ción (%) |
|---|---|---|---|
| 1 | Testigo | - | 0,00 |
| 2 | Genuino | Sulfato de Cu pentahidratado | 0,25 |
| 3 | Licthor | Extracto de Saccharum officinarum | 0,50 |
| 4 | Action | Fosfito de Potasio | 0,35 |
| 5 | Scudo | (Cu) hidrosoluble, (N) orgánico, (C) orgánico, M.O | 0,10 |
| 6 | Fertil Copper | Sulfato de cobre pentahidratado | 0,10 |
| 7 | Para-Chupadera | Flutolanil y Captan | 0,20 |
| 8 | Aliette | Fosetyl Aluminio | 0,25 |
Prueba de fungicidas químicos en condiciones hidropónicas
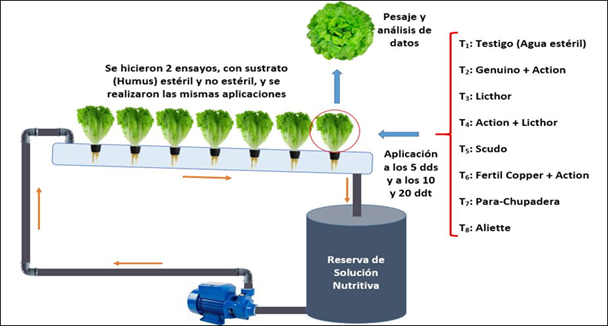
Se utilizaron los productos comerciales empleados en la prueba in vitro. Los productos según la dosis recomendada se vertieron en 200 ml de agua y luego, fueron mezclados y homogenizados para su aplicación. Se realizaron ensayos en sustrato (humus de lombriz) estéril y no estéril, en la que se sembraron semillas de lechuga variedad Bohemia. Los tratamientos T3, T5, T7 y T8 contenían un solo producto y fueron aplicado a los cinco días después de la siembra y a los 10 y 20 días después del trasplante. Los tratamientos T2, T4 y T6 contenían dos productos, uno aplicado a los 5 días después de la siembra y el otro a los 10 y 20 días después del trasplante (Tabla 2). El tratamiento control en ambos ensayos no recibió productos (Figura 1)
Tabla 2 Fungicidas evaluados en condiciones hidropónicas contra hongos fitopatógenos del cultivo de lechuga en sustrato estéril y no estéril
| Trat. | Almácigo | Trasplante | ||
|---|---|---|---|---|
| Producto comercial | Concentración (%) 5 dds | Producto comercial | Concentración (%) 10 y 20 ddt | |
| 1 | Testigo | Agua estéril | Testigo | Agua estéril |
| 2 | Genuino | 0,25 | Action | 0,35 |
| 3 | Licthor | 0,5 | Licthor | 0,5* |
| 4 | Action | 0,35 | Licthor | 0,5 |
| 5 | Scudo | 0,1 | Scudo | 0,1* |
| 6 | Fertil Copper | 0,1 | Action | 0,35 |
| 7 | Para-chupadera | 0,2 | Para-chupadera | 0,2* |
| 8 | Aliette | 0, 25 | Aliette | 0,25* |
*Aplicación de un solo producto. dds: días después de la siembra, ddt: días después del trasplante.
Análisis estadístico
En la prueba in vitro se estableció siete trata-mientos, un testigo, con cuatro repeticiones; en condiciones hidropónicas se utilizó ocho trata-mientos incluido el testigo y diez repeticiones. Antes de realizar el análisis de varianza (ANOVA) mediante el diseño completamente al azar (DCA), los datos se sometieron a la prueba de distribución normal de Shapiro Wilk. Los datos fueron analizados mediante el software de análisis estadístico Statistical Analysis Systems 5,0 (SAS) y para determinar la diferencia de medias se utilizó la prueba post hoc de Duncan con el mismo software con un p valor de α ≤ 0,05.
RESULTADOS Y DISCUSIÓN
Aislamiento, caracterización y descripción sintomatológica
Alternaria solani
Características culturales y morfológicas. Se obser-vó micelio de color beige oscuro (Figura 2), con conidióforos cortos, simples y erectos que dan origen a cadenas simples o ramificadas de conidios. Los conidios fueron alargados, grandes, oscuros en forma de pera. Los conidios fueron septados trans-versales y longitudinales, con células multinu-cleadas de color oscuro, los que concuerdan con Simmons (2007) para Alternaria sp. y Rotem (1994) para Alternaria solani.
Sintomatología. Se caracteriza por afectar al follaje, que se intensifica con la humedad y altas temperaturas, en las hojas se forman manchas necróticas, con anillos concéntricos, las lesiones van aumentando a medida que va envejeciendo la planta, las manchas necróticas estaban rodeadas de un halo amarillo. En los bordes de las hojas del tercio inferior, se observó manchas necróticas de coloración marrón oscura de forma regular e irregular (Figura 3). Estos resultados concuerdan con Sherf & MacNab (1986), quienes mencionaron que los primeros síntomas son pequeñas lesiones necróticas, oscuras que generalmente aparecen en las hojas de mayor edad y se extienden hacia arriba a medida que la planta envejece.
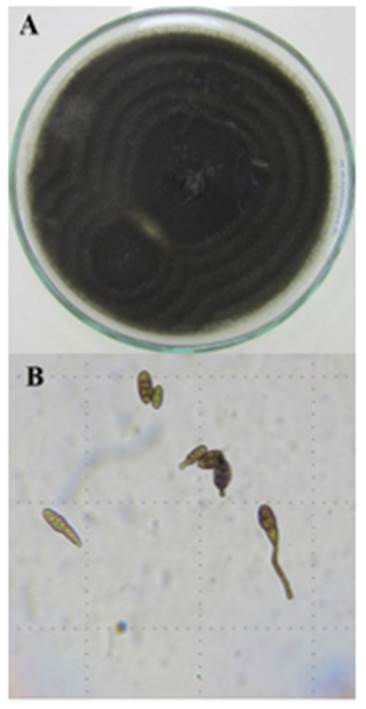
Figura 2 Hongo Alternaria solani. A) Colonia oscura en placas de Petri con medio papa dextrosa agar, B) conidias pigmentadas sobre conidióforos de forma periforme y pluricelulares, con septas transversales, longitudinales y oblicuas.
Cuando las lesiones crecen, comúnmente muestran anillos concéntricos que están rodeados por una zona amarillenta. Sobre estas manchas se observó al microscopio esporulación de conidias de Alternaria solani (Figura 4).
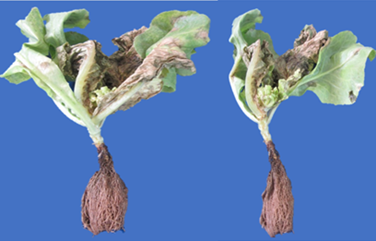
Figura 3 Manchas necróticas marrón oscuras e irregulares en el borde de las hojas ocasionadas por A. solani.
Rhizoctonia solani
Características culturales y morfológicas. Inicial-mente en medio de cultivo papa dextrosa agar, se desarrolló colonias blancas, con micelio elevado algodonoso, poco frondoso, hialino a inicios del crecimiento y luego color cremoso. A los diez días, el micelio fue aéreo, superficial y de coloración marrón. En observaciones al microscopio com-puesto, las hifas fueron septadas, con ramifi-caciones en ángulo recto (90º) y con una cons-tricción en la base de la ramificación (Figura 5). El diámetro de las hifas midió de 6-8 µ y no se observó la formación de esclerotes. Estás características descritas corresponden a R. solani y concuerdan con lo descrito por Sneb et al., (1991) y Barnett & Hunter (1998).
Sintomatología, en los primeros estadios de la planta, en las hojas basales se observó flacidez y pérdida de turgencia. Se observaron síntomas de decaimiento avanzado, marchitez general y muerte de la planta. Externamente las plantas presentaron lesiones ligeramente hundidas e internamente a la altura del cuello decoloración marrón clara.
En el cuello de las plantas con síntomas más avanzados se presentó pudrición de color marrón oscuro (Figura 6) que abarcó todo el diámetro del tallo, originando colapso y muerte de la planta. Esta sintomatología descrita concuerda con Anderson (1982) para Rhizoctonia solani, que es un patógeno necrotrófico transmitido por el suelo. Es uno de los patógenos más importantes que afectan la producción de lechuga en la mayoría de los países donde se cultiva, es mejor conocido por la pudrición del fondo o cuello de la lechuga (Grosch et al., 2011; Gullino et al., 2019).
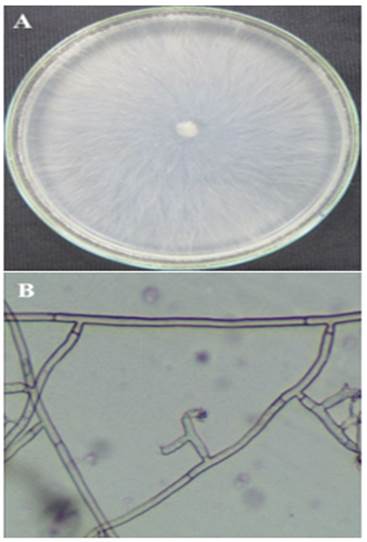
Figura 5 Hongo Rhizoctonia solani. A) Colonia blanca cremoso en placas de Petri con medio papa dextrosa agar, B) hifas septadas, con ramificaciones en ángulo recto (90º) y con una constricción en la base de la ramificación.
Fusarium sp.
Características culturales y morfológicas. Inicial-mente en medio de cultivo papa dextrosa agar desarrolló micelio algodonoso de color blanco, luego, cambió a ligeramente amarillo cremoso (Figura 7). Al microscopio se observó fiálides en forma de botella simples y ramificadas, macroconidias hialinas, septadas, fusoides en media luna en agrupaciones mucoides y microconidias con una a dos células ligeramente curvadas, de oblonga a ovoide, formando agrupaciones mucoides. En plantas de lechuga senescentes se observó clamidosporas terminales e intercalares, solitarias y en pares. Las características observadas corresponden a Fusarium sp., el cual coincide con las claves de Barnett & Hunter (1998) y Booth (1971).
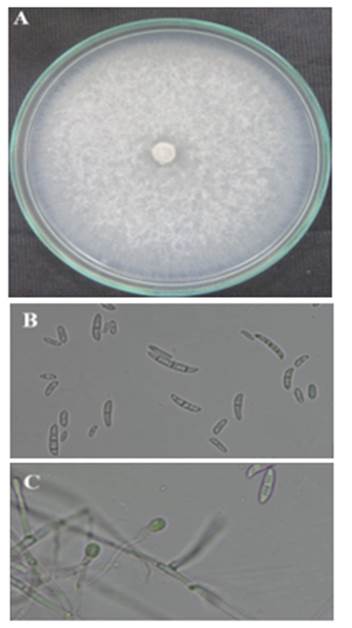
Figura 7 Hongo Fusarium sp. A) Colonia algodonoso blanquecino, B) macroconidias son de forma falcada con 3 a 4 septas y microconidias son uni y bicelulares, C) clamidosporas solitarias y terminales.
Sintomatología. Se observó marchitez (Figura 8) y muerte de plántulas, pudrición de la semilla o muerte antes de la emergencia, en la base del talluelo desarrolló necrosis húmeda y arrugada. La producción de estos síntomas, según los estudios de Matheron (2008) y Scott et al. (2012), se da cuando Fusarium spp. penetran a la planta mediante heridas provocadas por la emisión de las raíces secundarias llegando hasta el xilema y obstruyendo el transporte de agua y nutrientes, ocasionando la marchitez, manifestándose poco desarrollo de las hojas sobre todo basales. Al realizar el corte transversal del tallo, se observó áreas necróticas en el sistema vascular de la raíz, lo que coincide con lo indicado por Matheron (2008) y Scott et al. (2012). Fusariosis es una enfermedad importante del cultivo de lechuga en todo el mundo. Causa pérdidas de rendimiento que van desde el 20% al 70% dependiendo de la susceptibilidad del cultivar, prácticas de manejo y condiciones ambientales prevalecientes (Pasquali et al., 2007).
Pythium sp.
Las características culturales y morfológicas revela-ron que las colonias no tuvieron patrón de crecimiento definido, presentaron hifas conocí-ticas, hialinas, ramificadas, apresorios simples y curvos. Los zoosporangios fueron redondos, no inflados, zoosporas enquistadas, oogonios esfé-ricos, lisas, terminales o intercalares. Se obser-varon anteridios con ramas anteridiales mono-clinas y diclinosas, 1-3 por oogonio, generalmente cortas o sésiles, con células anteridiales tubulares, apicales acopladas y oosporas esféricas y lisas.
Sintomatología. Además del síntoma clásico de pudrición de la raíz (Figura 9), las plantas afectadas por Pythium presentaron marchitez, clorosis, oscurecimiento vascular, subdesarrollo y disminu-ción de la producción (Owen-Going et al., 2003; Sutton et al., 2006, Zheng et al., 2000). Las lechugas hidropónicas afectadas por Pythium sp. también, fueron estudiadas por Corrêa & Bettiol (2009) y Utkhede et al. (2000). A pesar de las ventajas del cultivo hidropónico de la lechuga, este ambiente es favorable para el desarrollo de pudriciones radicu-lares, especialmente ocasionadas por Pythium spp. (Chaudhary et al., 2023). En estas condiciones se pueden presentar pérdidas de hasta el 70% en variedades de lechuga susceptibles ocasionadas por Pythium spp (Paugh & Gordon, 2021; Scott et al., 2012).
Pruebas de patogenicidad
La prueba de patogenicidad de los patógenos aislados e inoculados en lechuga hidropónica reveló la aparición de síntomas típicos. Esta sintomatología correspondiente a cada fitopa-tógeno inoculado se puede apreciar en la Figura 10.

Figura 10 Plantas de lechuga inoculadas con (A) Pythium sp., (B) Fusarium sp. y (C) Rhizoctonia solani.
Las plantas que fueron inoculadas con el aislado de Pythium sp. (Figura 10A) presentaron pudrición de la raíz, marchitez, clorosis, oscurecimiento vascular, subdesarrollo y una disminución en la producción. Estos signos coinciden con los reportes de Owen Going et al. (2003), Sutton et al. (2006), Zheng et al. (2000), Corrêa & Bettiol (2009) y Utkhede et al. (2000). Las plántulas inoculadas con el aislamiento de Fusarium sp. (Figura 10B) se observó marchitez de plántulas. En la base del tallo se desarrolló una necrosis húmeda y arrugada, además de áreas necróticas en el sistema vascular de la raíz. Estos síntomas concuerdan con las observaciones de Matheron (2008) y Scott et al. (2012). Por último, las que fueron inoculadas con Rhizoctonia solani (Figura 10C) presentaron en las hojas basales mostraron flacidez, pérdida de turgencia, marchitez general y subdesarrollo. También se observaron lesiones ligeramente hundidas. A nivel del cuello, hubo decoloración marrón clara que derivó en una pudrición marrón oscuro afectando todo el diámetro del tallo, causando finalmente la muerte. Esta síntoma-tología coincide con lo descrito por Anderson (1982), Grosch et al. (2011) y Gullino et al. (2019), quienes documentaron pudrición en el cuello de la lechuga.
Evaluación in vitro de los fungicidas
Los resultados muestran que los fungicidas evaluados tuvieron efecto inhibitorio contra A. solani, R. solani y Fusarium sp.
En las tablas 3, 4 y 5 y en las figuras 11, 12 y 13 se observa que los tratamientos T7: Parachupadera (0,2%) y T8: Aliette (0,25%) lograron el 100% de inhibición del crecimiento micelial de los hongos Alternaria solani, Fusarium solani y Rhizoctonia solani, superando significativamente (p ≤ 0,05) al testigo y a los tratamientos Genuino (0,25%), Scudo (0,1%).
Estos resultados obtenidos con el fungicida Parachupadera, compuesto por Captan y Flutolanil, concuerdan con el estudio realizado por Aguilar, (2020) quien usando Parachupadera como tratamiento, logró inhibir completamente el crecimiento micelial del hongo Rhizoctonia solani y afirmó que este efecto se atribuye a la presencia de dos ingredientes activos en su formulación, uno de acción curativa y otro sistémica, que afectan distintos procesos metabólicos del patógeno, ampliando su rango de acción tóxica. Los resultados también coinciden con lo obtenido por Khabbaz-Jolfaee et al (2023) quien reporta que el ingrediente Captan tuvo una eficacia aceptable en el control contra Alternaria.
Tabla 3 Promedio de los tratamientos en el control de Alternaria solani en condiciones hidropónicas
| Trata- miento | Dosis (ml/100 ml de PDA) | Media | Inhibi-ción (%) | Sig. (p ≤ 0,05) |
|---|---|---|---|---|
| T3 (Licthor) | 0,50 | 0 | 100 | a |
| T4 (Action) | 0,35 | 0 | 100 | a |
| T8 (Aliette) | 0,25 | 0 | 100 | a |
| T7 (Para-chupader) | 0,20 | 0 | 100 | a |
| T2 (Genuino) | 0,25 | 0,73 | 83,78 | b |
| T5 (Scudo) | 0,10 | 0,76 | 83,11 | b |
| T6 (Fertil Copper) | 0,10 | 1,07 | 76,22 | c |
| T1 (Testigo) | 0,00 | 4,5 | 0 | d |
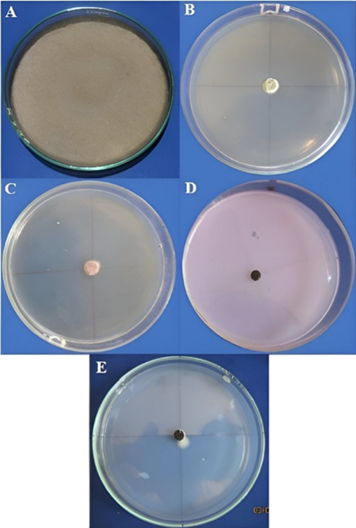
Figura 11 Inhibición del crecimiento micelial al 100% de Alternaria solani. A) Testigo B) Aliette (0,25%), C) Licthor (0,5%) y D) Parachupadera (0,2%) E) Action (0,35%).
El estudio también armoniza con Soraluz (2022) quien usó Captan y Flutolanil para prevenir el ataque de hongos Rhizoctonia solani (pudrición de la raíz) y Fusarium. Los resultados obtenidos con el fungicida Aliette, compuesto por Fosetyl-Aluminio armonizan con lo reportado por Bañuls (1990) quien menciona que este fungicida combina propiedades protectoras y curativas, desplazan-dose de manera progresiva dentro de la planta. Aunque no ejerce acción directa sobre A. solani, R. solani y Fusarium sp. Si ejerce un efecto indirecto al estimular los mecanismos de defensa naturales de la planta.
Tabla 4 Promedio de los tratamientos en el control de Rhizoctonia solani en condiciones hidropónicas
| Trata-miento | Dosis (ml/100 ml de PDA) | Media | Inhibición (%) | Sig. (p ≤ 0,05) |
|---|---|---|---|---|
| T8 (Aliette) | 0,25 | 0 | 100 | a |
| T7 (Para-chupadera) | 0,2 | 0 | 100 | a |
| T6 (Fertil Copper) | 0,1 | 0 | 100 | a |
| T2 (Geniuno) | 0,25 | 2,62 | 41,78 | b |
| T5 (Scudo) | 0,1 | 2,89 | 35,78 | bc |
| T4 (Action) | 0,35 | 3,46 | 23,11 | c |
| T3 (Licthor) | 0,5 | 3,5 | 22,22 | c |
| T1 (Testigo) | 0 | 4,5 | 0 | d |
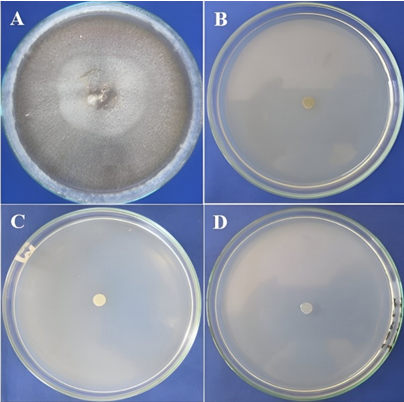
Figura 12 Inhibición al 100 % del crecimiento micelial de Rhizoctonia solani. A) Testigo B) Aliette (0,25%), C) Parachupadera (0,2%) y D) Fertil Copper (0,1%)
Los tratamientos T3: Licthor (0,5 %) y T4: Action (0,35 %) lograron inhibir completamente el crecimiento micelial de los hongos Alternaria solani y Fusarium solani superando significativamente (p ≤ 0,05) al testigo y a los tratamientos Genuino (0,25%), Scudo (0,1%). El fungicida biológico Licthor, elaborado a partir de extracto de caña de azúcar (Saccharum officinarum) contiene un 6,61% de extracto vegetal y un 1,41% de ácidos urónicos. Estos ácidos, generados mediante fermentación microbiana, penetran las membranas celulares de los hongos fitopatógenos. Una vez en el citoplasma, activan enzimas endógenas como poligalactu-ronasas y enzimas pécticas, que contribuyen a descomponer las paredes celulares y membranas, desencadenando así la autolisis del hongo y su muerte celular (Biogen, 2021). Por lo que este tratamiento inhibió al 100% el hongo Alternaria solani. El tratamiento T4, Action (fosfito de potasio) aunque no tiene acción directa sobre el hongo Alternaria solani si tiene acción indirecta como inductor de la Resistencia Sistémica Adquirida, tal como reporta Daniel & Guest (2005). En la planta el fosfito de potasio es disociado en las formas de ácido fosforoso (H3PO3) y K; el ácido fosforoso al ser reconocido por la planta como un metabolito del patógeno, activa los mecanismos de defensa estimulando la producción de fitoalexinas, las cuales son reconocidas por sus propiedades biocidas contra diferentes grupos de fitopatógenos (Kofoet et al., 2007).
Tabla 5 Medias de Duncan a (p = 0,05) de los fungicidas en el control de Fusarium solani en condiciones de in vitro
| Trata- miento | Dosis (ml/100 ml de PDA) | Media | Inhibición (%) | Sig. (p ≤ 0,05) |
|---|---|---|---|---|
| T3 (Licthor) | 0,5 | 0 | 100 | a |
| T4 (Action) | 0,35 | 0 | 100 | a |
| T8 (Aliette) | 0,25 | 0 | 100 | a |
| T7 (Para-chupadera) | 0,2 | 0 | 100 | a |
| T6 (Fertil Copper) | 0,1 | 0 | 100 | a |
| T5 (Scudo) | 0,1 | 0,63 | 86 | b |
| T2 (Geniuno) | 0,25 | 2,53 | 43,78 | c |
| T1 (Testigo) | 0 | 4,5 | 0 | d |
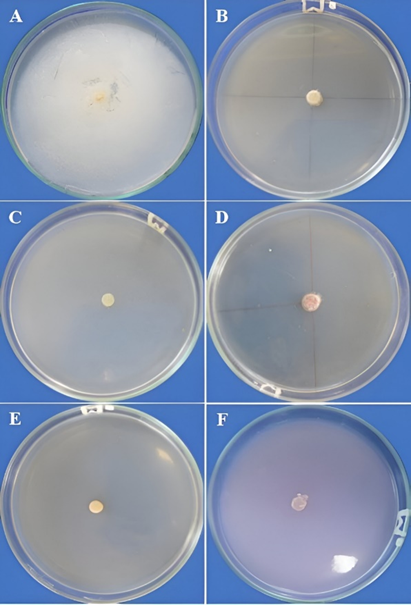
Figura 13 Inhibición del crecimiento micelial de Fusarium sp. A) Testigo B) Action (0,35%), C) Aliette (0,25%), D) Fertil Copper (0,1%), E) Licthor (0,5%) y F) Parachupadera (0,2%).
El tratamiento T6: Fertil Copper (0,1 %) logró una inhibición total del crecimiento micelial de los hongos Rhizoctonia solani y Fusarium solani, superando significativamente (p ≤ 0,05) al testigo y a los tratamientos Genuino (0,25%), Scudo (0,1%). El fungicida Fertil Cooper, compuesto por Sulfato de Cobre Pentahidratado pertenece al grupo químico inorgánico y actúa por contacto en varios sitios (FRAC, 2017). Inhibiendo la germinación de esporas, intoxicación y bloqueo de procesos respitarios, disminuye la biosíntesis de proteínas de los hongos (Herrero, 2005). Los fungicidas a base de cobre son considerados como multisitio que demuestran ser efectivos en el control de R. solani (Sun et al., 2014). Los tratamientos con Sulfato de Cobre Pentahidratado concuerdan con Alburqueque & Gusqui (2018), donde sus resultados presentaron una disminución en el micelio de Fusarium y Rhizoctonia solani in vitro. También concuerda con Ihsan & Jawhary (2006) quienes también obtuvieron una disminución del crecimiento micelial de Fusarium a concen-traciones de 25 y 50 ppm e inhibieron al 100% el crecimiento micelial a una concentración de 100ppm de Sulfato de Cobre Pentahidratado. Además, estos resultados obtenidos con Fertil Cooper son consistentes con Pacheco (2022) quien obtuvo el mayor efecto en la inhibición del crecimiento micelial del hongo de Fusarium spp., al usar un tratamiento a base de Sulfato de Cobre Pentahidratado y Oxitetraciclina al 90%. Los fungicidas a base de cobre son considerados como multisitio que demuestran ser efectivos en el control de R. solani (Sun et al., 2014).
Estos fungicidas podrían utilizarse dentro de un programa de manejo integrado de estas enfermedades en el cultivo de lechuga hidropónica.
Prueba de fungicidas químicos en condiciones hidropónicas
Prueba con sustrato no estéril
En la Tabla 6 se presenta el peso fresco de las plantas de lechuga hidropónica, el tratamiento con extracto de Saccharum officinarum (Litchor) presentó el mayor rendimiento con 174 g, demostrando ser mejor en relación al control de los diferentes fitopatógenos y al promover un mejor desarrollo del vigor de la planta. Estos resultados concuerdan con Marchan (2018) quien encontró que el fungicida de origen biológico Licthor aplicado al suelo en plantas de vivero, mejoró el vigor de las plantas de vid expresado en un mejor follaje y masa radicular.
Ensayo con sustrato estéril
En la Tabla 7 se observa que el mayor rendimiento de plantas de lechuga (122,8 g) se obtuvo con los tratamientos Flutolanil y Captan (Parachupadera), con el fungicida a base de sulfato de cobre pentahidratado (Fertil Copper) se obtuvo un promedio de 114,5 g por lechuga. Estos resultados concuerdan con Valdiviezo (2010) quien mencionó que el fungicida Parachupadera redujo el índice de severidad de los hongos Rhizoctonia sp. y Fusarium sp en comparación con el testigo, en el cultivo de arroz. Este fungicida incluye en su fórmula dos ingredientes activos con propiedades curativas y sistémicas, los cuales interfieren en múltiples procesos metabólicos del patógeno. Esto resulta en un amplio espectro de acción tóxica (Aguilar, 2020) y, de manera indirecta, favorece un mejor crecimiento de la planta.
Tabla 6 Promedio del peso fresco de lechuga hidropónica en sustrato no estéril
| Trata- mientos | Productos comerciales | Media | Sig. (p ≤ 0,05) |
|---|---|---|---|
| T2 | Licthor | 174 | a |
| T3 | Action / Genuino | 146 | b |
| T6 | Parachupadera | 135, | b |
| T7 | Aliette | 124.9 | bc |
| T1 | Genuino/Action | 122,7 | bc |
| T4 | Scudo | 121,2 | bc |
| T5 | Fertil Copper/ Action | 107,4 | cd |
| T8 | Testigo | 85,7 | d |
Tabla 7 Promedio del peso fresco de lechuga hidropónica en sustrato estéril
| Trata-mientos | Productos comerciales | Media | Sig. (p ≤ 0,05) |
|---|---|---|---|
| T6 | Parachupadera | 122,8 | a |
| T5 | Fertil Copper/ Action | 114,9 | ab |
| T2 | Licthor | 109,7 | ab |
| T7 | Aliette | 105,2 | b |
| T3 | Action / Genuino | 104,8 | b |
| T4 | Scudo | 86,1 | c |
| T8 | Testigo | 68,3 | d |
| T1 | Genuino/Action | 64,6 | d |
CONCLUSIONES
Las características culturales, morfológicas y la descripción sintomatológica permitieron identifi-car a Alternaria solani causando mancha foliar, Rhizoctonia solani causando pudrición del cuello, Fusarium sp. causando marchitez y Pythium sp. causando pudrición de la raíz, demostrando que el estudio será útil para el manejo de estas enfermedades.
En las pruebas in vitro, el tratamiento T7 Parachupadera (Flutolanil y Captan) y T8 Aliette (Fosetyl Aluminio) mostró el mejor control de los patógenos Alternaria solani, Rhizoctonia solani y Fusarium sp. Por otro lado, en condiciones hidropónicas, el ensayo con sustrato no estéril “Licthor” (Extracto de Saccharum officinarum) generó un peso promedio de 174 gramos por lechuga, mientras que el ensayo con sustrato estéril “Parachupadera” obtuvo un peso promedio de 122,8 gramos.
Estos resultados subrayan la importancia de combinar estrategias de manejo integrado que incluyan tratamientos químicos efectivos como T7 Parachupadera, así como la selección adecuada de sustratos para maximizar el rendimiento y la calidad de la producción en sistemas hidropónicos.
Se propone realizar estudios adicionales para evaluar la interacción de estos tratamientos con otros factores agronómicos, como la nutrición mineral y el control biológico de patógenos, con el fin de desarrollar estrategias más sostenibles y específicas para el manejo de enfermedades en cultivos hidropónicos.












 uBio
uBio