Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista Peruana de Biología
On-line version ISSN 1727-9933
Rev. peru biol. vol.23 no.1 Lima Jan./Apr. 2016
http://dx.doi.org/10.15381/rpb.v23i1.11835
doi: http://dx.doi.org/10.15381/rpb.v23i1.11835
NOTA CIENTÍFICA
El género Sphaerocavum y dominancia de S. brasiliense y Microcystis wesenbergii (Microcystaceae, Cyanophyceae) en la floración algal de la laguna Huacachina, Perú
The genus Sphaerocavum and the dominance of S. brasiliense and Microcystis wesenbergii (Microcystaceae, Cyanophyceae) in the algae bloom of Huacachina lagoon, Peru
Leonardo H. Mendoza-Carbajal
University of South Bohemia, Faculty of Science, Department of Botany, Branišovská 31, CZ– 37005 České Budějovice, Czech Republic
Departamento de Limnología, Museo de Historia Natural – UNMSM, Apartado 14-0434, Lima 14, Perú.
Email: lhmendozac@gmail.com, ORCID http://orcid.org/0000-0002-9847-2772
Resumen
En el presente trabajo se registra por primera vez a las cianobacterias Sphaerocavum brasiliense Azevedo y Sant’Anna y Microcystis wesenbergii (Komárek) Komárek in Kondrateva (Microcystaceae, Cyanophyceae) en una floración algal de la laguna Huacachina (Ica), incluyendo el primer reporte del género Sphaerocavum para el Perú. Se sugiere el monitoreo de estas cianobacterias por ser formadoras de floraciones algales.
Palabras clave: Cianófitas; Microcystis; floraciones algales; Desierto costero; Ica.
Abstract
The present work registers for the first time the cyanobacteria Sphaerocavum brasiliense Azevedo y Sant’Anna and Microcystis wesenbergii (Komárek) Komárek in Kondrateva (Microcystaceae, Cyanophyceae) in an algal bloom on Huacachina lagoon (Ica), including the first report of Sphaerocavum for Peru. We suggest the necessity of monitoring these bloom-forming cyanobacteria.
Keywords: cyanophyta; Microcystis; algal blooms; coast desert; Ica.
Introducción
Las cianobacterias son microorganismos fotosintéticos de naturaleza procariota capaces de colonizar numerosos ambientes acuáticos y terrestres (Castenholz 2001, UNESCO 2009). Su fácil adaptación a ambientes de pH alcalino, alta radiación y elevadas temperaturas les ha permitido establecerse en diferentes cuerpos de agua alrededor del mundo (Chorus et al. 2000). Algunas cianobacterias son capaces de formar floraciones algales en ambientes lénticos, especialmente embalses y lagos eutrofizados, lo que ha conllevado a que se elaboren planes para su control y manejo (Chorus & Bartram 1999).
Las floraciones algales, también llamados blooms, son fenómenos en los que una o unas pocas especies de algas dominan el fitoplancton de un ambiente acuático, mostrando un elevado número de células y/o colonias(UNESCO 2009). En los ambientes acuáticos continentales las principales formadoras de blooms son las cianobacterias (Paerl et al. 2001), que en muchos casos pueden producir cianotoxinas, las cuales logran afectar las cadenas tróficas acuáticas (Christoffersen 1996), e influenciar la salud pública (Chorus & Bartram 1999, Codd et al. 2005, Falconer 1996, Jochimsen et al. 1998, Chorus et al. 2000). El conocimiento de las especies que forman blooms es considerado de suma importancia, lo cual es reflejado en revisiones regionales sobre estos organismos (Sant’Anna et al. 2008, UNESCO 2009, McGregor 2013).
Se han registrado numerosos taxa de cianobacterias planctónicas formadoras de floraciones algales en regiones tropicales y subtropicales. En Brasil (Komárek & Komárková 2002, Sant’Anna et al. 2004), Uruguay (UNESCO 2009), Argentina (Otaño 2012) y Colombia (Palacio et al. 2015) se han realizado importantes estudios sobre las cianofíceas formadoras de blooms.
En Perú, estudios de cianobacterias potencialmente formadoras de blooms se han realizado en humedales costeros (Maldonado 1943; Montoya 1984, 2006; Montoya et al. 1995, 2012) y recientemente en el lago Titicaca (Montoya et al. 2014, Komárková et al. 2015). Entre los humedales costeros, destaca para los Pantanos de Villa el reporte de Microcystis aeruginosa (Kütizing) Kützing (Montoya 1984, Montoya et al. 1995). En los humedales de Puerto Viejo (Cañete) se tiene registro de Lyngbya hieronymusii Lemmermann [=Limnoraphis hieronymussi (Lemmermann) Komárek et al.], Anabaena sphaerica Bornet y Flahault, A. spiroides Klebahn [=Dolichospermum spiroides (Klebahn) Wacklin, L. Hoffmann y Komárek], A. flos-aquae Brébisson ex Bornet y Flahault [=D. flos-aquae (Brébisson ex Bornet y Flahault) Wacklin, L. Hoffmann y Komárek], M. aeruginosa, Aphanizomenon flos-aquae Ralfs ex Bornet y Flahault (Montoya 2006), Romeria gracilis (Koczwara) Koczwara y R. leopoliensis (Raciborskii) Koczwara (Montoya et al. 2012). En el lago Titicaca, Montoya et al. (2014) y Komárková et al. (2015) registran la presencia de tres cianobacterias formadoras de floraciones algales: M. aeruginosa, Limnoraphis robusta Komárek et al. y Nodularia inca Montoya, Komárková y Komárek, describiéndose esta última como nueva especie. En la selva peruana ha sido citada M. aeruginosa para cuerpos de agua de Madre de Dios y Ucayali (Samanez & Zambrano 1995, Riofrío et al. 2003).
En la laguna Huacachina, existen reportes de cianobacterias como Arthrospira platensis Gomont (Maldonado 1943), Me-rismopedia glauca (Ehrenberg) Kützing, M. punctata Meyen, Oscillatoria brevis Gomont, O. chalibea Gomont, O. maldona-doana Drouet, Spirulina subsalsa Gomont, S. major Gomont y Calothrix braunii Bornet ex Flahault (Aldave 1979). Thomas-son (1960) hace referencia a un bloom de S. platensis Gomont (Geitler) (=A. platensis) en el año 1954, y Hegewald et al. (1976) registraron un bloom bacteriano producido por Lamprocystis roseo-persicinum (Kützing) Schroeter, con unos pocos individuos de A. platensis.
El presente estudio reporta por primera vez para el Perú a dos especies de cianobacterias formadoras de floraciones algales pertenecientes a la familia Microcystaceae, Sphaerocavum brasi-liense y Microcystis wesenbergii, en la laguna Huacachina (Ica).
Material y métodos
Área de estudio. - La laguna Huacachina es un humedal ubicado a 4 km al sur oeste de la ciudad de Ica y a 400 metros sobre el nivel del mar. Sus aguas son salobres, alcalinas y de color verde, con predominancia de cloruro de sodio, carbonato de sodio y bicarbonato de sodio (Maldonado 1943, Aldave 1979). A pesar que su origen se debió a filtraciones de agua de la capa freática, actualmente se considera un humedal de origen artificial (ProNaturaleza 2010) debido a que se alimenta de agua proveniente de pozos.
La superficie total del cuerpo de agua ha disminuido con el tiempo de 3 ha (Maldonado 1943) a 1 ha (ProNaturaleza 2010). La vegetación circundante de la laguna Huacachina está conformada principalmente de totorales (compuesto de Typha domingensis Pers. "totora"), juncales (compuesto principalmente de Schoenoplectus americanus (Pers.) Volkart ex Schinz y R. Keller) (Roque y Cano 1999), algunas especies leñosas propias del desierto iqueño, como Prosopis pallida Humb. y Bonlp. ex Willd., e introducidas, como Eucalyptus sp. y Ficus nitida Thunb. (ProNaturaleza, 2010).
Métodos.- Se colectaron 2 muestras de fitoplancton superficial en la laguna Huacachina, con coordenadas (14°05'17.7"S, 75°45'49.9"W, MUSML_PL_0059; 14°05'18.4"S, 75°45'51.3"W, MUSML_PL_0061, 11 de julio de 2015). Veinte litros de agua fueron filtradas con una red de plancton (20µm), y fijadas con formalina al 2%.
Las muestras fueron analizadas con un microscopio Nikon Eclipse E2000. La toma de medidas morfométricas y microfotografías se realizó con la cámara Nikon DS-Fi2 acoplada con el software NIS Elements (version 4.10.01). Las mediciones celulares se realizaron en al menos 10 células por colonia observada, con un mínimo de 20 colonias por especie. Para una mejor observación del mucílago colonial se agregó tinta china en los preparados acuosos.
Se procuró la observación de diferentes estadios coloniales para estudiar la variabilidad fenotípica de las especies. Las muestras fueron depositadas en la Colección de Plancton del Departamento de Limnología, Museo de Historia Natural – Universidad Nacional Mayor de San Marcos (MUSML_PL).
La identificación se realizó en base a la monografía de Komárek y Anagnostidis (1999) y comparación con trabajos regionales (Azevedo & Sant’Anna 2003, Wood et al. 2005, UNESCO 2009, McGregor 2013, Palacio et al. 2015). El sistema de clasificación taxonómica adoptado fue el de Komárek et al. (2014).
Resultados y discusión
Se identificaron dos especies pertenecientes a la familia Microcystaceae, los cuales dominaron en el fitoplancton de la laguna Huacachina: Sphaerocavum brasiliense y Microcystis wesenbergii.
Taxonomía
Phylum Cyanobacteria
Clase Cyanophyceae
Orden Chroococcales
Familia Microcystaceae
Género SphaerocavumAzevedo y Sant’Anna 2003
Sphaerocavum brasiliense M.T.P Azevedo y C.L. Sant’Anna
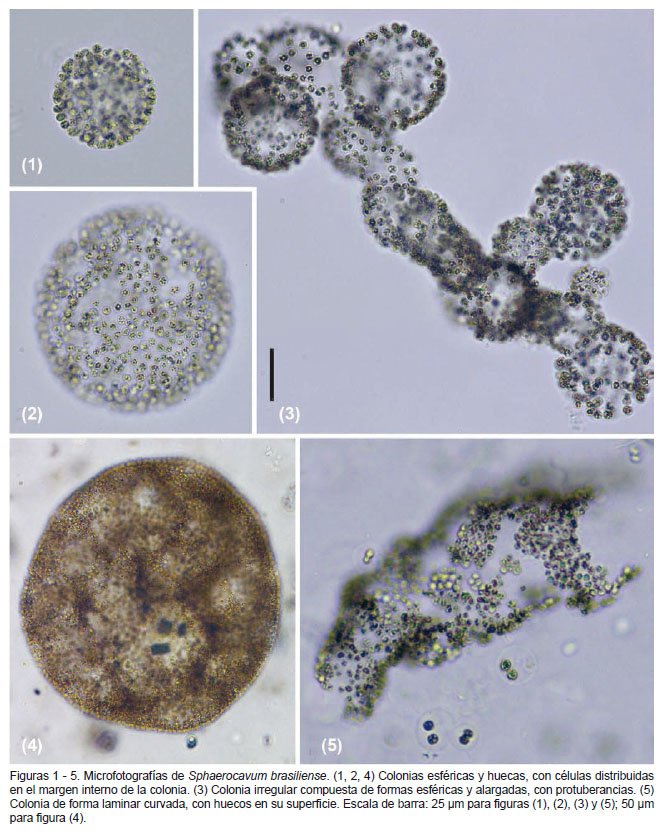
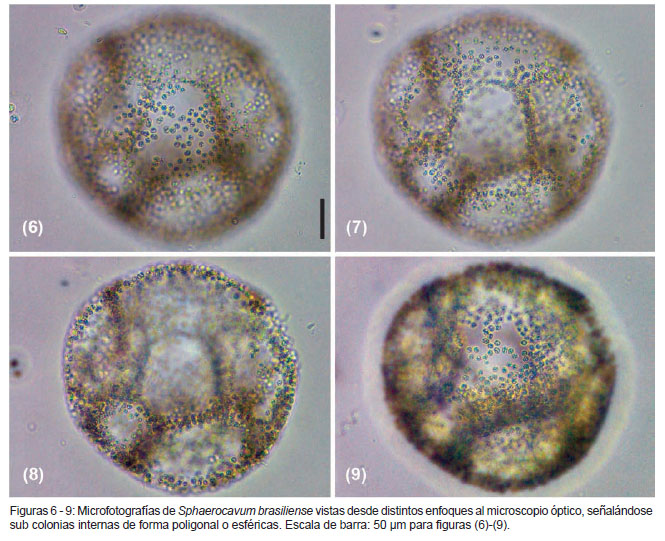
Algol. Studies 109:81. 2003 (Figs. 1 - 9)
Descripción.- Colonias huecas, esféricas cuando son jóvenes, posteriormente irregulares, elongadas, a veces aplanadas, con bordes externos a veces clatrados, mucílago inconspicuo, hialino. Células redondeadas, ligeramente alargadas antes de dividirse, con vacuolas de gas (aerotopos) brillosos; células dispuestas en la superficie interna de las colonias. Diámetro celular de 3.1 a 5.1 µm.
Comentarios.-La forma de las colonias de S. brasiliense en la laguna Huacachina coincide con la descripción de la especie tipo (Azevedo y Sant’Anna 2003). Se observó que las colonias esféricas fueron las predominantes (Figs. 1, 2 y 4; Figs. 6 - 9), aunque en menor proporción ocurrieron formas laminares o curvadas (Fig. 5), e irregulares con subcolonias (Fig. 3). La superficie de las colonias jóvenes y adultas se observaron clatradas o huecas (Figs. 2 y 4), discontinuas (Fig. 5) y a veces con protuberancias (Fig. 3), lo que concuerda con la descripción de la especie.
Las colonias presentaban un diámetro entre 3.1 a 5.1 µm, con un promedio de 3.8 µm y desviación estándar de 0.46 µm. Dichas mediciones son mayores a las citadas para Brasil (Azevedo y Sant’Anna 2003)(2.4 – 3.6 µm), Cuba (Comas et al. 2010) (3.7 – 4.4 µm) y Nueva Zelanda (Wood et al. 2005) (2.5 – 3.5 µm); sin embargo se asemeja a la de los morfotipos citados para Uruguay (UNESCO 2009)(4.0 – 5.5 µm).
En la descripción de S. brasiliense, Azevedo y Sant’Anna (2003) mencionan que la formación de colonias jóvenes es debido a la fragmentación de colonias maduras. Además, señalan que dicha fragmentación ocurre en la periferia de las colonias gracias a la disolución de la envoltura mucilaginosa colonial. En el presente estudio, además de observar lo referido a la fragmentación de colonias maduras, también se evidenció que en varias colonias esféricas adultas se presentaban capas internas de células de una a dos células de grosor, las cuales iban perpendicularmente desde el borde interno de la colonia madre hacia el centro de esta, dividiéndola en pequeñas subcolonias internas (Figs. 6 – 9). Estas sub colonias de formas esféricas a poligonales podrían ser parte del ciclo de vida de la especie. Observaciones adicionales son necesarias para la confirmación de esta hipótesis.
Según Wood et al. (2005), S. phaerocavum brasiliense podría confundirse con algunas especies del género Microcystis. La principal diferencia es que el género Sphaerocavum posee división celular en dos planos y forma colonias huecas, planas o algo irregulares (Azevedo & Sant’Anna 2003), mientras que las especies de Microcystis poseen división en tres planos, colonias irregulares o de diferentes formas según la especie (Sant’Anna et al. 2004). No obstante, Komárek et al. (2002) mencionan en la descripción de M. panniformis Komárek et al. que la disposición de sus células y filas cortas cerca de la superficie de colonias maduras sería producto de un tipo de división celular más simple que la de en tres planos. A ello podemos agregar que en otros humedales costeros del Perú se ha observado colonias de Microcystis compuestas de subcolonias irregulares producto de la división en tres planos junto a subcolonias planas y algo curvadas producto de la división en dos planos. Esto conllevaría a una revisión del tipo de división del género Microcystis y de su utilidad como marcador fenotípico para distinguirlo de otros géneros como Sphaerocavum y Pannus.
Hasta la fecha no se ha demostrado la toxicidad de S. brasilien-se (Azevedo & Sant’Anna 2003). No obstante, existen algunos reportes de S. brasiliense junto a otras cianobacterias de los géneros Microcystis, Anabaena, Cylindrospermopsis y Anabaenopsis, formando floraciones algales tóxicas en el lago Violão Torres, sur de Brasil (De Carvalho et al. 2008).
Con respecto a la distribución geográfica, S. brasiliense ha sido registrada para Brasil (Werner et al. 2010), Uruguay (Azevedo & Sant’Anna 2003, UNESCO 2009), Argentina (Salusso & Moraña 2014), Cuba (Comas et al. 2010) y Nueva Zelanda (Wood et al. 2005).
El presente trabajo amplía el registro de la especie S. brasiliense para el Perú, confirmando además su distribución en embalses y cuerpos de agua naturales de condición meso a eutróficos de zonas tropicales y subtropicales.
Género MicrocystisKützing ex Lem-mermann 1907 nom. Cons.
Microcystis wesenbergii (Komárek) Komárek in Kondrateva
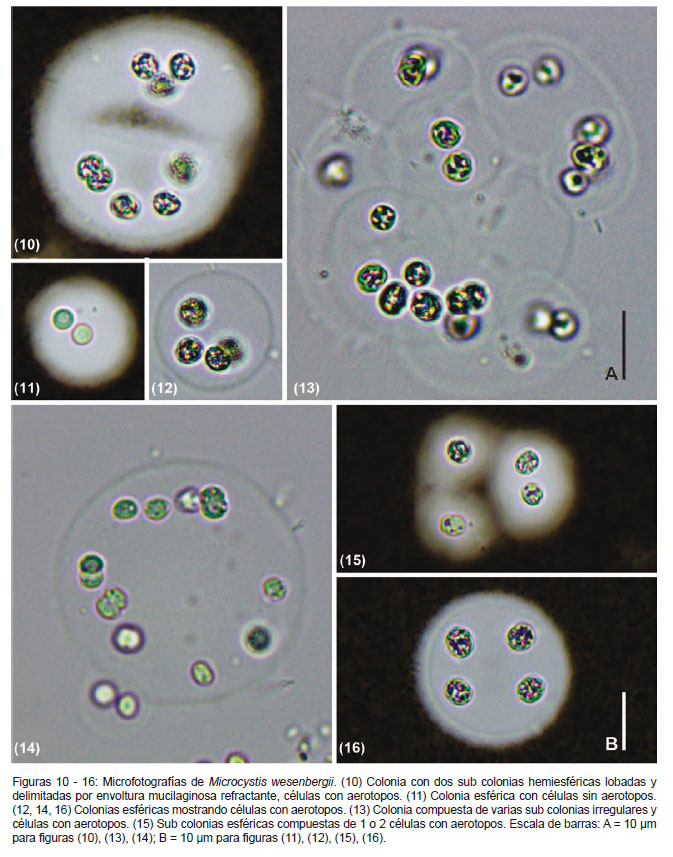
Cvetenie vody, p. 13. 1968 (Figuras 10 - 16)
Descripción.- Colonias jóvenes redondeadas, ligeramente elongadas, a veces lobadas; formas adultas clatradas, redondeadas, con subcolonias subesféricas o esféricas. Envoltura mucilaginosa incolora, hialina, firme, bien delimitada, de contorno refractante. Células dispuestas cerca al borde de la superficie interna en colonias jóvenes y subcolonias (Figs. 10 – 13), luego aleatoriamente en colonias adultas (Figs. 13, 16). Células esféricas, ligeramente elongadas antes de dividirse, contenido celular verde-azul pálido (Figs. 11, 14 y 15), con aerotopos. Dimensiones celulares de 3.8 a 5.4 µm.
Comentarios.- En las muestras observadas predominaron las colonias redondeadas a subesféricas lobadas (Figs. 10 – 12, 14), es decir, colonias jóvenes. Colonias adultas fueron observadas raramente y sin llegar a formar aglomeraciones macroscópicas como citan Komárek y Anagnostidis (1999).
El diámetro de las células observadas en el presente estudio oscilaron entre 3.8 a 5.4 µm, siendo ligeramente menor a lo referido por Komárek y Anagnostidis (1999) y Komárek y Komárková (2002), quienes mencionan un diámetro celular entre 4-7 µm y 4 – 8.5 µm respectivamente, para localidades europeas. No obstante, si comparamos los datos morfométricos celulares con los registros en otras zonas tropicales o subtropicales encontramos una mayor concordancia. Para São Paulo, Brasil, Sant’Anna et al. (2004) encuentra células de M. wesenbergii con un diámetro entre 4 – 6 µm; y para el reservorio Riogrande II, Colombia, Palacio et al. (2015) cita células entre y 3.6 – 7 µm de diámetro.
Morfológicamente, M. wesenbergii se diferencia de las otras especies del género en la forma de las colonias, el margen delimitado del mucílago, los pequeños y numerosos aerotopos (Komárek y Komárková 2002). En las colonias observadas se evidenció el mucílago bien delimitado (Figs. 10 – 16), lo cual es acorde a los registros para otras localidades (Komárek & Anagnostidis 1999, Komárek & Komárková 2002, Sant’Anna et al. 2004, McGregor 2013, Palacio et al. 2015).
Microcystis wesenbergii posee una distribución cosmopolita y está presente en el plancton de lagos y reservorios eutróficos (Komárek & Anagnostidis 1999, Komárek & Komárková 2002). El presente trabajo registra por primera vez a M. wesenbergii en Perú, siendo la especie dominante de la taxocenosis fitoplanctónica en la laguna Huacachina, llegando a formar blooms junto a S. brasiliense y otras cianobacterias filamentosas y cocales.
En varios cuerpos de agua continentales alrededor del mundo la presencia de M. wesenbergii junto a otras cianobacterias ha sido asociada al reporte de toxinas del tipo microcistinas (Namikoshi et al. 1992, Vasconcelos et al. 1996). Sin embargo, también existen casos de floraciones algales no tóxicas donde M. wesenbergii es el componente principal del fitoplancton (Xu et al. 2008). Esto sugeriría no descartar a M. wesenbergii como potencial productor de toxinas en la laguna Huacachina.
La presencia de floraciones producidas por cianobacterias debe ser vigilada de acuerdo a lo establecido por Chorus et al. (2000) y UNESCO (2009). Entre las consecuencias más importantes de un bloom cianobacterial están: 1) agotamiento del oxígeno en el agua, 2) aumento de la concentración de amoniaco, y 3) producción de cianotoxinas (Havens 2008). La disminución del nivel de oxígeno en el agua y el aumento de la concentración amoniacal pueden afectar directamente a la ictiofauna. Así también, la presencia de toxinas influiría negativamente no solo la flora y fauna dependientes del cuerpo de agua, sino también podría ser un riesgo para la salud humana. El caso de la laguna Huacachina debe merecer especial consideración debido a su uso como aguas medicinales (Escomel 1936) y el turismo, por lo que el riesgo potencial que significa la presencia de cianobacterias y la posible producción de toxinas debe ser monitoreado por las autoridades competentes (Autoridad Nacional del Agua, Dirección General de Salud, Gobierno Regional de Ica, etc.), más aun considerando el desarrollo del Fenómeno de El Niño durante el 2015 y 2016 en el Pacífico tropical, lo que junto al calentamiento global podría promover la dominancia de cianobacterias fitoplanctónicas en cuerpos de agua someros a nivel mundial (O’Farrell et al. 2011).
Agradecimientos
Al Químico Cesar Poma, gerente general de la empresa Servicios Analíticos Generales, por las facilidades en el uso de los equipos Nikon. A los Magisteres Iris Samanez y Gian Salazar por la revisión del manuscrito. A los revisores anónimos por las sugerencias y mejoras en el manuscrito.
Literatura citada
Aldave A. 1979. Spirulina platensis Geitler "natas" de la Laguna Huacachina que debe incorporarse en la alimentación humanapor su alto valor protéico. Boletin de la Sociedad Botánica de La Libertad 11(1-2):1-42. [ Links ]
Azevedo M.T.D.P. & C.L. Sant’Anna. 2003. Sphaerocavum, a new genus of planktic Cyanobacteria from continental waterbodies in Brazil. Algological Studies 109(1):79–92. DOI: http://dx.doi.org/10.1127/1864-1318/2003/0109-0079.
Castenholz R.W. 2001. Phylum BX. Cyanobacteria. In: Bergey’sManual of Systematic Bacteriology, pp.473–599. DOI:http://dx.doi.org/10.1007/978-0-387-21609-6_27.
Chorus I., I.R. Falconer, H.J. Salas & J. Bartram. 2000. Health risks caused by freshwater cyanobacteria in recreational waters. Journal of Toxicology and Environmental Health. PartB, Critical reviews 3(4):323–347. DOI: http://dx.doi.org/10.1080/109374000436364. [ Links ]
Chorus I. & J. Bartram. 1999. Toxic Cyanobacteria in Water : Aguide to their public health consequences, monitoring andmanagement. Routledge, London, UK. [ Links ]
Christoffersen K. 1996. Ecological implications of cyanobacterialtoxins in aquatic food webs. Phycologia 35(6S):42–50.DOI: http://dx.doi.org/10.2216/i0031-8884-35-6S-42.1 [ Links ]
Codd G.A., L.F. Morrison & J.S Metcalf. 2005. Cyanobacterial toxins:risk management for health protection. Toxicology and Applied Pharmacology 203(3):264–72. DOI: http://dx.doi.org/10.1016/j.taap.2004.02.016. [ Links ]
Comas A., A. Moreira González & L. Toledo. 2010. Adiciones a la flora de algas y cianoprocariotas dulciacuícolas de Cuba. Algas 44:20–29. [ Links ]
De Carvalho L.R., F. Pipole, V.R. Werner, H.D. Laughinghouse IV, et al. 2008. A toxic cyanobacterial bloom in an urban coastal lake, Rio Grande do Sul State, southern Brazil. Brazilian Journal of Microbiology 39(4):761–769. DOI: http://dx.doi.org/10.1590/S1517-83822008000400031. [ Links ]
Escomel E. 1936. Notas biológicas sobre la laguna medicinal deHuacachina, Perú. Revista Chilena de Historia Natural 40(1):136–143. [ Links ]
Falconer I.R. 1996. Potential impact on human health of toxic cyanobacteria. Phycologia 35(6S):6–11. DOI: http://dx.doi.org/10.2216/i0031-8884-35-6S-6.1. [ Links ]
De Magalhães V.F., R.M. Soares & S.M.F.O. Azevedo. 2001. Microcystin contamination in fish from the Jacarepaguá Lagoon (Rio de Janeiro, Brazil): ecological implication and human health risk. Toxicon 39(7):1077–1085. DOI: http://dx.doi.org/10.1016/S0041-0101(00)00251-8. [ Links ]
Havens K.E. 2008. Cyanobacteria blooms: effects on aquatic ecosystems. En: Cyanobacterial harmful algal blooms: stateof the science and research needs. Springer New York , pp. 733-747. DOI: http://dx.doi.org/10.1007/978-0-38775865-7_33. [ Links ]
Hegewald E., A. Aldave &T. Hakuli. 1976. Investigations on the lakesof Peru and their phytoplankton. 1. Review of literature, description of the investigated waters and chemical data. Archiv für Hydrobiologie 78(4):494-506. [ Links ]
Hereman T.C. & M.D.C. Bittencourt-Oliveira. 2012. Bioaccumulation of Microcystins in Lettuce. Journal of Phycology 48(6):1535–1537. DOI: http://dx.doi.org/10.1111/jpy.12006. [ Links ]
Jochimsen E.M., M.D.W.W. Carmichael, J. An, et al. 1998. Liver failure and death after exposure to microcystins at a hemodialysis center in Brazil. The New England Journal of Medicine 338(13):873–878. DOI: http://dx.doi.org/10.1056/NEJM199803263381304. [ Links ]
Komárek J. & K. Anagnostidis. 1999. Cyanoprokaryota, 1: Chroococcales. In: H. Ettl, G. Gardner, H. Heynig and D. Mollenheuer, eds. Süsswasserflora von Mitteleurope. Vol. 19/1. Gustav Fischer, Jena. pp.1-548. [ Links ]
Komárek J., J. Kaštovský, J. Mareš & J.R. Johansen. 2014. Taxonomic classification of cyanoprokaryotes (cyanobacterial genera) 2014, using a polyphasic approach. Preslia 86:295–335.
Komárek J., J. Komárková-Legnerová, C.L. Sant'Anna, M.T.P. Azevedo& P.A.C. Senna. 2002. Two common Microcystis species (Chroococcales, Cyanobacteria) from tropical America,including M. panniformis sp. nov. Cryptogamie, Algologie 23(2):159–177. [ Links ]
Komárek J. & J. Komárková. 2002. Review of the European Microcystis-morphospecies (Cyanoprokaryotes) from nature. Czech Phycology, Olomouc 2:1–24. [ Links ]
Komárek J. & J. Komárková-Legnerová. 2007. Several rare freshwater planktic Cyanobacteria (Cyanoprokaryotes) from reservoirsin South America. Hoehnea 34(1):49–58. DOI: http://dx.doi.org/10.1590/S2236-89062007007000100002. [ Links ]
Komárková J., H. Montoya & J. Komárek. 2016. Cyanobacterial waterbloom of Limnoraphis robusta in the Lago Mayor of Lake Titicaca. Can it develop? Hydrobiologia 764(1):249-258. DOI: http://dx.doi.org/10.1007/s10750-015-2298-x. [ Links ]
Maldonado A. 1943. Las lagunas de Boza, Chilca y Huacachina y los gramadales de la costa del Perú. Actas del 2do Congreso Peruano de Química. Pp. 95-237. [ Links ]
McGregor G.B. 2013. Freshwater Cyanobacteria of North-Eastern Australia: 2. Chroococcales. Phytotaxa 133(1):1–130. DOI:http://dx.doi.org/10.11646/phytotaxa.133.1.1. [ Links ]
Montoya H. 1984. Algas de la laguna de Villa (Lima): Cyanophyta, Chlorophyta y Chrysophyta (Xantophyceae). Boletín deLima 6(31):75-89. [ Links ]
Montoya H. 2006. Flora y ecología algal del ecosistema lagunar de Puerto Viejo, departamento de Lima. Magistri et Doctores 1(1):9–18. [ Links ]
Montoya H., I. Villanueva, C. Aguilar & M. Benavente. 1995. Biodiversidad algal de las lagunas costeras en la región central del Perú. Biotiempo 2:5-12. [ Links ]
Montoya H., J. Gómez & M. Mariano. 2012. Floraciones de especies del género Romeria: nuevos registros para la flora cianobacterial peruana. Arnaldoa 19(2):133-139. [ Links ]
Montoya H., J. Komárková & J. Komárek. 2014. Cyanobacterial species, potentially forming wáter-blooms in the Lake Titicaca (Peru). Arnaldoa 21(2):381-390. [ Links ]
Namikoshi M., K.L. Rinehard & R. Sakai. 1992. Identification of 12 hepatotoxins from Homer Lake Bloom of the cyanobacteriaMicrocystis aeruginosa, Microcystis viridis, and Microcystiswesenbergii: Nine new microcystins. The Journal of OrganicChemistry 57(3):866-872. DOI: http://dx.doi.org/10.1021/jo00029a016. [ Links ]
O’Farrell I., I. Izaguirre, G. Chaparro, et al. 2011. Water level as the main driver of the alternation between a free-floating plant and a phytoplankton dominated state: a long-term studyin a floodplain lake. Aquatic Sciences 73:275-287. DOI: http://dx.doi.org/10.1007/s00027-010-0175-2 [ Links ]
Otaño S.H. 2012. Aphanizomenon favaloroi spec. nov. (Cyanobacteria, Nostocales), a new planktic species from Argentina. Algological Studies 138(1):27–36. DOI: http://dx.doi.org/10.1127/1864-1318/2012/0056. [ Links ]
Paerl H.W., R.S. Fulton, P.H. Moisander & J. Dyble. 2001. Harmful freshwater algal blooms, with an emphasis on cyanobacteria.The Scientific World Journal 1:76–113. DOI: http://dx.doi.org/10.1100/tsw.2001.16. [ Links ]
Palacio H.M., J.J. Ramírez, R.O. Echenique, J.A. Palacio & C.L.Sant'Anna. 2015. Floristic composition of cyanobacteriain a neotropical, eutrophic reservoir. Brazilian Journal of Botany 38(4): 865-876. DOI: http://dx.doi.org/10.1007/s40415-015-0185-3. [ Links ]
ProNaturaleza. 2010. Documento base para la elaboración de unaestrategia de conservación de los humedales de la costaperuana. GyG Impresores. 94pp. [ Links ]
Riofrío J., I. Samanez, F. Carrasco & M. Clavo. 2003. Caracterización limnológica de la laguna de Cashibococha (Ucayali-Perú) durante el año 2001. Revista Peruana de Biología 10(2):183–195. DOI: http://dx.doi.org/10.15381/rpb.v10i2.2501 [ Links ]
Roque J. & A. Cano. 1999. Flora vascular y vegetación del valle de Ica, Perú. Revista Peruana de Biología 6(2):185-195. DOI: http://dx.doi.org/10.15381/rpb.v6i2.8314 [ Links ]
Salusso M.M. & L.B. Moraña. 2014. Fitoplancton de embalsessubtropicales del noroeste argentino. Gestión y Ambiente 17(1):209–222. [ Links ]
Samanez I. & F. Zambrano. 1995. Observaciones sobre la Diversidad y Algunas Características del Plancton en el Dpto. Madre deDios, Perú. Publ. Mus. Hist. Nat. (A) 51:1-12. [ Links ]
Sant’Anna C.L., M.T.P. Azevedo, P.A.C. Senna, J. Komárek & J. Komárková. 2004. Planktic Cyanobacteria from São Paulo State, Brazil: Chroococcales. Revista Brasileira de Botânica 27(2):213–227. DOI: http://dx.doi.org/10.1590/S010084042004000200002.
Sant’Anna C.L., M.T.P. Azevedo, V.R. Werner, C.R. Dogo, F.R. Rios & L.R. De Carvalho. 2008. Review of toxic species of Cyanobacteria in Brazil. Algological Studies 126(1):251–265. DOI: http://dx.doi.org/10.1127/1864-1318/2008/01260251.
Thomasson K. 1960. Ett fall av tropisk vattenblomning. Botaniska Notiser 113(2):214-216. [ Links ]
UNESCO. 2009. (en línea). Cianobacterias Planctónicas del Uruguay,manual para la identificación y medidas de gestión. <http://unesdoc.unesco.org/images/0021/002163/216319s.pdf>. Acceso 31/07/2015. [ Links ]
Werner V.R., M.M. Cabezudo, E.B. Neuhaus, T.A. Caires, et al. Cyanophyceae in Lista de Espécies da Flora do Brasil. Jardim Botânico do Rio de Janeiro. <http://floradobrasil.jbrj.gov.br/jabot/floradobrasil/FB108137> (Acceso 01/08/2015). [ Links ]
Wood S.A., A.L.M. Crowe, J.G. Ruck & R.G. Wear. 2005. New Zealand Journal of Botany New records of planktoniccyanobacteria in New Zealand freshwaters. New Zealand Journal of Botany 43(2):479-492. DOI: http://dx.doi.org/10.1080/0028825x.2005.9512969. [ Links ]
Xu Y., Z. Wu, B. Yu, X. Peng, G. Yu, Z. Wei, G. Wang & R. Li. 2008. Non-microcystin producing Microcystis wesenbergii (Komárek) Komárek (Cyanobacteria) representing a main waterbloom-forming species in Chinese waters. Environmental Pollution 156(1):162–167. DOI: http://dx.doi.org/10.1016/j.envpol.2007.12.027. [ Links ]
Presentado: 28/08/2015
Aceptado: 28/03/2016
Publicado online: 28/05/2016