Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista Peruana de Biología
On-line version ISSN 1727-9933
Rev. peru biol. vol.24 no.4 Lima Dec. 2017
http://dx.doi.org/10.15381/rpb.v24i4.14066
NOTA CIENTÍFICA
Niveles de mercurio en el tiburón martillo Sphyrna zygaena (Carcharhiniformes: Sphyrnidae) del norte del Perú
Mercury levels in the Smooth Hammerhead Shark Sphyrna zygaena (Carcharhiniformes: Sphyrnidae) from Northern Peru
Adriana Gonzalez-Pestana 1,2*, Joanna Alfaro-Shigueto 1,2,3, Jeffrey C. Mangel 1,3 y Pepe Espinoza 2,4
*Autor para correspondencia
1 ProDelphinus. Jose Galvez 780-e, Lima 18, Perú.
2 Universidad Científica del Sur. Facultad de Biología Marina, Panamericana Sur, Km 19, Lima, Perú.
3 Center for Ecology and Conservation, School of Biosciences, University of Exeter. Cornwall Campus, Penryn, Cornwall TR10 9EZ, United Kingdom
4 Instituto del Mar del Perú. Esquina Gamarra con General Valle, Chucuito, Callao, Perú.
Email Adriana Gonzalez-Pestana: adriana@prodelphinus.org
Email Joanna Alfaro-Shigueto: jas_26@yahoo.com
Email Jeffrey C. Mangel: jeffrey_mangel@yahoo.com
Email Pepe Espinoza: paespinoza@gmail.com
Resumen
El tiburón martillo (Sphyrna zygaena (Linnaeus, 1758)) es una de las especies de elasmobranquios más utilizada para consumo humano en el Perú. Sin embargo, se desconoce los niveles de mercurio que contiene su carne. Este trabajo tuvo como objetivo evaluar los niveles de mercurio hallados en el músculo del tiburón martillo y su posible implicancia en la salud humana. Además, determinar si existe una correlación entre el tamaño del tiburón y los niveles de mercurio. Analizamos 27 muestras de músculo de neonatos y juveniles capturados en el norte del Perú. La concentración de mercurio varió entre 0.13 – 0.85 mg kg-1 peso húmedo. Se encontró una relación negativa y significativa entre el tamaño corporal del tiburón y los niveles de mercurio. Este trabajo representa el primer estudio que evalúa los niveles de mercurio de tiburones en el Perú. Si bien los valores hallados fueron menores a lo recomendado por la Organización Mundial de la Salud (< 1 mg kg-1), se recomienda ampliar este tipo de estudios en individuos adultos de tiburón, así como en otros recursos hidrobiológicos de consumo humano.
Palabras clave: mercurio; tiburones, Perú; elasmobranquios; Bioacumulación; Biomagnificación; Metales traza; Contaminación marina; salud pública; contaminante de alimentos.
Abstract
The smooth hammerhead shark Sphyrna zygaena (Linnaeus, 1758) is one of the elasmobranch species most used for human consumption in Peru. However, the level of mercury in hammerhead muscle tissue is unknown. This study assessed the level of mercury found in the muscle of hammerhead sharks and its relation with human health. Moreover, we evaluated the relationship between shark body size and mercury levels. We analyzed 27 muscle samples of neonates and juveniles captured in northern Peru. Mercury concentrations varied between 0.13 and 0.86 mg kg-1 wet weight. Moreover, we found a negative and significant relationship between shark body size and mercury levels. This study represents the first evaluation of mercury levels of sharks in Peru. Although the values found do not exceed levels recommended by the World Health Organization (< 1 mg kg-1), we recommend expanding this study to include other size classes of sharks as well as other marine resources used for human consumption.
Keywords: mercury; sharks, Peru; elasmobranchs; Bioaccumulation; Biomagnification; Trace metals; Marine pollution; public health; food contaminant.
Introducción
El tiburón martillo (Sphyrna zygaena (Linnaeus, 1758)) es uno de los peces más grandes del Pacífico, que puede alcanzar hasta 4 metros de longitud (Fowler et al. 2005). El norte del Perú es una importante zona de crianza y alimentación para esta especie, y el lugar donde cumple un rol como depredador tope al alimentarse principalmente de cefalópodos, como el calamar de Humboldt (Dosidicus gigas) y el calamar común (Doritheuthis gahi) (Castañeda 2001, González-Pestana 2014).
En el Perú la pesquería de elasmobranquios es importante. Es así que es mencionado dentro de las 20 naciones que realizan el mayor comercio de elasmobranquios, siendo el más importante en el Pacífico sudeste (Mundy-Taylor & Crook 2013), también es mencionado dentro de las 12 naciones que realizan las mayores exportaciones de aletas de tiburón al mercado de Hong Kong (Cheung & Chang 2011). Sphyrna zygaena es una de las especies que forma parte de la pesquería de tiburones en el Perú, y esta a su vez es una de las más importantes en el Pacífico (González-Pestana et al. 2016). En el Perú S. zygaena es comercializada por su carne y conocida como "tollo" (González-Pestana et al. 2014).
Debido al estado de sus poblaciones, la Unión Internacional para la Conservación de la Naturaleza (UICN) determinó que S. zygaena se encuentra en estado vulnerable y su tendencia poblacional es decreciente, por lo que en los últimos años se le ha incluido en tratados internacionales para su conservación (Casper et al. 2005). Desde el 2013, la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES) lista a S. zygaena en el Apéndice II para regular su comercio internacional (https://cites.org/esp/app/appendices.php). En Perú, desde el 2016 se estableció una veda temporal y una cuota de pesca para esta especie (RM-008-2016-PRODUCE), siendo ésta la primera medida de este tipo que se establece para tiburones en el Perú.
El tiburón martillo es un depredador tope con una baja tasa metabólica por lo que debería presentar niveles altos de mercurio debido a la bioacumulación y biomagnificación, como se ha demostrado para otras especies de elasmobranquios (Penedo de Pinho et al. 2002, Storelli et al. 2003, García-Hernandez et al. 2007, Barrera-García et al. 2012). En el Perú el consumo promedio de pescado es de 15.4 kg por persona (INEI 2015), siendo una fuente importante de proteína. Estudios en la Amazonía peruana han evaluado los niveles de mercurio en peces de la zona (Rabitto et al. 2011), sin embargo, estudios en recursos hidrobiológicos marinos y su relación con temas de salud humana han sido poco explorados.
Este trabajo tiene como objetivo informar sobre los niveles de mercurio en el músculo del tiburón martillo en el Perú, y discutir si estos niveles representan una potencial amenaza para la salud humana. Además, considerando que estudios previos han determinado una relación entre el tamaño del tiburón y los niveles de mercurio (Adams et al. 1999, Penedo de Pinho et al. 2001, Kiszka et al. 2015), también discutimos la correlación entre el tamaño del tiburón, su estadio de desarrollo y los niveles de mercurio.
Materiales y métodos
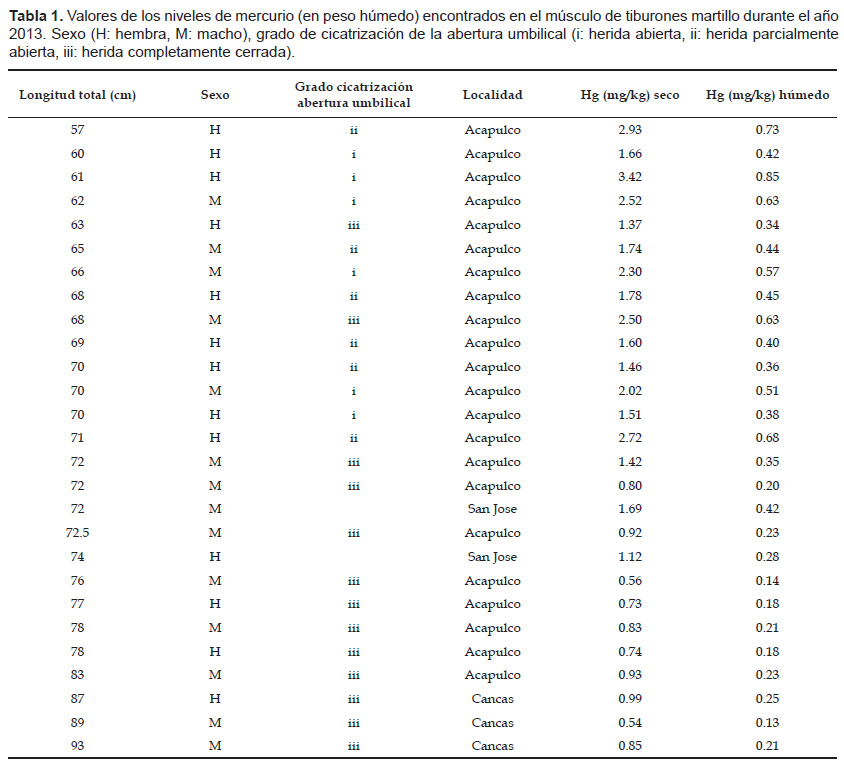
Las muestras fueron colectadas en los puertos de Acapulco, Cancas (Tumbes) y San José (Lambayeque) en el norte del Perú, provenientes de la pesquería artesanal, entre los meses de enero y mayo del 2013. Los tiburones fueron medidos (longitud total, LT) y sexados. Además, se categorizó el estadio del individuo, según el grado de cicatrización de la abertura umbilical, ya que los tiburones presentan una reproducción vivípara placentada. Se consideró: (i) herida abierta, (ii) herida parcialmente abierta, (iii) herida completamente cerrada, (iv) cicatriz umbilical ausente (Olin et al. 2011). Los tiburones fueron considerados neonatos cuando mostraban las condiciones (i) y (ii) y juveniles cuando mostraban las condiciones (iii) y (iv) (Bush et al. 2003). La talla de nacimiento considerada fue de 50 ‒ 60 cm LT (Fowler et al. 2005). Los tiburones fueron considerados adultos cuando presentaban una talla mayor a 250 ‒ 260 cm LT para machos y 265 cm LT para hembras, ya que esta es la talla de primera madurez sexual (Fowler et al. 2005).
Se tomaron muestras de músculo en la zona anterior a la primera aleta dorsal y luego éstas fueron congeladas hasta su procesamiento en el laboratorio. Las muestras fueron secadas a 60 ºC entre 18 a 24 horas en el laboratorio de Biología Marina en la Universidad Científica del Sur en Lima, Perú. Luego fueron enviadas al laborarotio Littoral Environnement et Sociétés Laboratory en la Université de La Rochelle, La Rochelle, Francia; donde se realizaron los análisis. El mercurio total (Hg) se determinó utilizando un espectrómetro AMA-254 (Advanced Mercury Analyser-254 from Altec©). La calidad analítica (precisión y reproducibilidad) de las lecturas de mercurio fue determinada utilizando el material de referencia certificado TORT-2 (Lobster Hepatopancreas Reference Material del National Research Council of Canada), al principio y al final de cada ciclo analítico. Las concentraciones de Hg en el tejido de los tiburones se obtuvieron en peso seco y luego fueron transformadas en peso húmedo para su comparación con otros estudios.
El mercurio total fue logarítmicamente transformado (Log10+1) para obtener una normalidad u homogeneidad de la varianza. Para describir la relación entre la talla corporal del tiburón y el Hg se utilizó la regresión lineal simple. Además, se utilizó el análisis de varianza (ANOVA) de una vía para determinar si hubo diferencias significativas entre los valores de mercurio de neonatos y juveniles. Los análisis estadísticos fueron llevados a cabo en R (R Core Team 2017).
Resultados
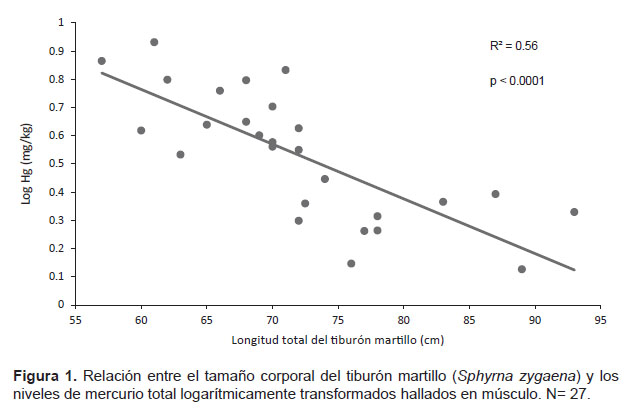
Se obtuvieron 27 muestras de músculo de tiburón martillo (Acapulco: 22, Cancas: 3, San Jose: 2), los cuales median entre 57 ‒ 93 cm LT y presentaron una abertura umbilical abierta (n=6), parcialmente abierta (n=6) o completamente cerrada (n=13) por lo que fueron clasificados como neonatos (n= 12) y juveniles (n= 13) (Tabla 1). Los valores de mercurio total tuvieron un rango entre 0.13 – 0.85 mg kg-1 en peso húmedo. La correlación entre los valores de Hg logarítmicamente transformados y el tamaño corporal de los tiburones fue negativa y estadísticamente significativa (r = 0.56, p < 0.001) (Fig. 1). Además, se encontró que existen diferencias significativas entre los valores de mercurio de neonatos y juveniles (p < 0.001). No se pudo determinar si existen diferencias significativas entre zonas de muestreo, ya que el número de muestras en San José fue bajo (n= 2)
Discusión
Según la Organización Mundial de la Salud (OMS 1997) y la Comisión Europea (CE 2006) el límite máximo permisible (LMP) para el consumo humano de mercurio total es 1 mg kg-1 en peso húmedo para peces depredadores, tales como los tiburones. Así todas las muestras analizadas tuvieron concentraciones por debajo del LMP. Sin embargo, debe señalarse que el número de muestras analizado fue bajo y no se estudiaron las tallas correspondientes a sub-adultos y adultos, por lo que es recomendable realizar más estudios.
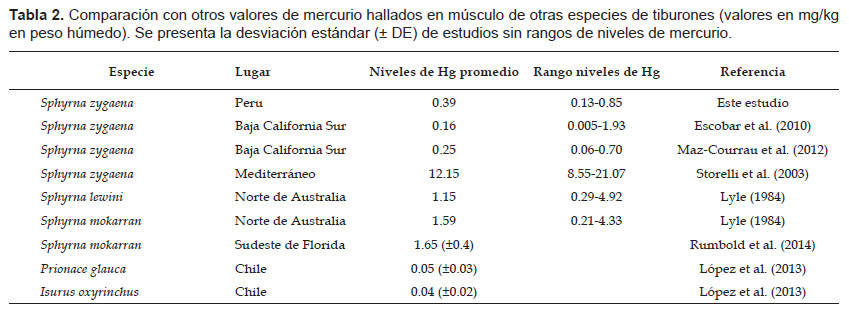
Los tiburones son indicadores del estado de salud del ecosistema marino, porque como depredadores topes tienden a acumular los mayores niveles de mercurio en la red alimenticia debido a la bioacumulación y biomagnificación (Wheeler 1996, Maz-Courrau et al. 2012), por esto, la Agencia de Alimentos y Medicamentos de Estados Unidos (Food and Drug Administration, FDA) aconseja no consumir depredadores como los tiburones y peces espada (https://www.fda.gov). Los niveles de mercurio del tiburón martillo en el Pacífico Este (México y Chile) son menores comparados con los reportados en el Mediterráneo, Australia y Florida (Tabla 2). Sin embargo, aunque los bajos niveles de mercurio encontrados en este estudio podrían sugerir que el ecosistema marino del norte del Perú es saludable, aún se necesitan otros estudios que tomen en cuenta tallas adultas y otras especies de diferentes niveles tróficos.
Los bajos niveles de mercurio que presenta el tiburón martillo en México y Perú podrían deberse a que su principal presa son los cefalópodos (ej. D. gigas; Ochoa-Díaz 2009, Gonzalez-Pestana 2014). Maz-Courrau et al. (2012) evaluaron cuatro especies presas (peces, crustáceo y cefalópodo) de cuatro especies de tiburones en Baja California (inlcuyendo a S. zygaena) y determinaron que D. gigas presenta los menores niveles de mercurio con un promedio de 0.03 mg kg-1. Los calamares presentan bajos niveles de mercurio debido a su rápido metabolismo, altas tasas de crecimiento y periodos cortos de vida (Gilly et al. 2006); características que les permiten tener periodos de exposición cortos y una eliminación efectiva de metales pesados, evitando la acumulación de mercurio en sus tejidos y órganos (Maz-Courrau et al. 2012).
Diversos estudios han demostrado una correlación positiva entre el tamaño corporal del tiburón y los niveles de mercurio (Adams et al. 1999, Penedo de Pinho et al. 2001, Kiszka et al. 2015), debido a que son organismos longevos y con una baja tasa metabólica, por lo que sus niveles de mercurio tienden a incrementarse con la edad y por ende con su tamaño (Walker 1976, Wetherbee et al. 2004, Maz-Courrau et al. 2012). Sin embargo, nuestros resultados contradicen estos estudios. Esto podría ser explicado porque S. zygaena tiene una reproducción vivípara placentada, donde los embriones están conectados a la madre a través de un cordón umbilical que les transfiere nutrientes y energía (Fowler et al. 2005). Por ende, los niveles de mercurio observados en los neonatos y juveniles en este estudio probablemente reflejan los de la madre (Adams et al. 1999). Al crecer y hacerse adultos, estos tiburones disminuirían sus niveles de mercurio como resultado de una menor exposición y un crecimiento que diluiría las concentraciones de mercurio (Coelho et al. 2011, de Penedo de Pinho et al. 2001).
Este trabajo representa el primer estudio que evalúa los niveles de mercurio de S. zygaena en el Pacífico Sudeste y los niveles de mercurio en tiburones en el Perú. Al ser S. zygaena uno de los tiburones más capturados y consumidos en el Perú es importante su monitoreo por el efecto que podría tener su consumo sobre la salud humana. Por otro lado, debido a los procesos de biomagnificación y bioacumulación, el tiburón martillo al ser un depredador tope podría ser un indicador de la calidad del ecosistema marino respecto a metales pesados.
Si bien los niveles de mercurio hallados en este estudio fueron bajos, se recomienda aumentar el número de muestras, donde se incluyan otras tallas (adultos y sub-adultos) y que permitan observar posibles cambios en las concentraciones de mercurio. Además, extender el estudio a otras especies y niveles tróficos, considerando un manejo ecosistémico que tome en cuenta la sostenibilidad de los recursos, así como al hombre como principal usuario de estos.
Agradecimientos
A David Sarmiento por el apoyo en la toma de muestras y a las comunidades pesqueras de San José, Acapulco y Cancas.
Literatura citada
Adams D. H. & R. H. Jr. McMichael 1999. Mercury levels in four species of sharks from the Atlantic coast of Florida. Fishery Bulletin 97:372–379. [ Links ]
Barrera-Garcia A., T. O’Hara, F. Galvan-Maga-a, L.C. Mendez-Rodriguez, J.M. Castellini & T. Zenteno-Savin. 2012 Oxidative stress indicators and trace elements in the blue shark (Prionace glauca) off the east coast of the Mexican Pacific Ocean. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology 156:59–66. https://doi.org/10.1016/j.cbpc.2012.04.003
Bush A. 2003. Diet and diel feeding periodicity of juvenile scalloped hammerhead sharks, Sphyrna lewini, in Kane’ohe Bay, O’ahu, Hawaii. Environmental Biology of Fishes. 67:1-11. https://doi.org/10.1023/A:1024438706814
Casper B.M., A. Domingo, N. Gaibor, M.R. Heupel, E. Kotas, A.F. Lamónaca, J.C. Pérez-Jimenez, C. Simpfendorfer, W.D. Smith, J.D. Stevens, A. Soldo, & C.M. Vooren. 2005. Sphyrna zygaena. The IUCN Red List of Threatened Species 2005: e.T39388A10193797. http://dx.doi.org/10.2305/IUCN.UK.2005.RLTS.T39388A10193797.en. Downloaded on 19 October 2017. [ Links ]
Castañeda J. 2001. Biología y Pesquería del tiburón martillo (S. zygaena) en Lambayeque, 1991-2000. Instituto del Mar del Peru, Informe Progresivo 139: 17-32. [ Links ]
Cheung G.C.K. & C.Y. Chang. 2011 Cultural identities of Chinese business: networks of the shark-fin business in Hong Kong. Asia Pacific Business Review 17(3): 343-359. https://doi.org/10.1080/13602380903461623 [ Links ]
Coelho R., J. Fernandez-Carvalho, S. Amorim & M. N. Santos. 2011. Age and growth of the smooth hammerhead shark,Sphyrna zygaena, in the Eastern Equatorial Atlantic Ocean, using vertebral sections. Aquatic Living Resources 24(4): 351-357. https://doi.org/10.1051/alr/2011145 [ Links ]
Comisión Europea (CE). 2006. Commission Regulation (EC) No 1881/2006 of 19 December 2006 setting maximum levels for certain contaminants in foodstuffs. Disponible en: http://ec.europa.eu. [ Links ]
Fowler S.L., R.D. Cavanagh & M. Camhi. 2005. International Union for the Conservation of Nature Red List assessments. In: Fowler S.L., R.D. Cavanagh, M. Camhi, G.H. Burgess, G.M. Cailliet, S.V. Fordham, C.A. Simpfendorfer, J.A. Musick (eds) Sharks, Rays and Chimaeras: The Status of the Chondrichthyan Fishes: 332-333. Status Survey. IUCN/SSC Shark Specialist Group. IUCN, Gland, Switzerland and Cambridge, UK. [ Links ]
García-Hernandez J., L. Cadena-Cardenas, M. Betancourt-Lozano, L.M. Garcia-De-La-Parra, L. Garcia-Rico & F. Marquez-Farias. 2007. Total mercury content found in edible tissues of top predator fish from the Gulf of California, Mexico. Toxicological Environmental Chemestry 89:507–522. https://doi.org/10.1080/02772240601165594 [ Links ]
Gilly W.F., U. Markaida, C.H. Baxter, B.A. Block, A. Boustany, L. Zeidberg, K. Reisenbichler, B. Robison, G. Bazzino & C. Salinas. 2006. Vertical and horizontal migrations by the jumbo squid Dosidicus gigas revealed by electronic tagging. Marine Ecology Progress Series 324:1–17. https://doi.org/10.3354/meps324001 [ Links ]
Gonzalez-Pestana A. 2014. Ecología trófica y areas de crianza del tiburón martillo, Sphyrna zygaena, juvenil en la zona norte del Peru. Tesis de pregrado. Universidad Científica del Sur, Lima, Peru. [ Links ]
Gonzalez-Pestana A., J.C. Kouri & X. Velez-Zuazo. 2016. Shark fisheries in the Southeast Pacific: A 61-year analysis from Peru. F1000 Research 3:164. https://doi.org/10.12688/f1000research.4412.2 [ Links ]
Kiszka J., A. Aubail, N. Hussey, M. Heithaus & F. Caurant. 2015. Plasticity of trophic interactions among sharks from the oceanic south-western Indian Ocean revealed by stable isotope and mercury analyses. Deep Sea Research I 96:49–58. https://doi.org/10.1016/j.dsr.2014.11.006 [ Links ]
López S., N. L. Abarca & R. Meléndez. 2013. Heavy metal concentrations of two highly migratory sharks (Prionace glauca and Isurus oxyrinchus) in the southeastern Pacific waters: comments on public health and conservation. Tropical Conservation Science 6(1): 126-137. https://doi.org/10.1177/194008291300600103 [ Links ]
Lyle J. M. 1984. Mercury concentrations in four carcharhinid and three hammerhead sharkes from coastal waters of the Northern Territory. Marine and Freshwater Research 35(4): 441. https://doi.org/10.1071/MF9840441 [ Links ]
Maz-Courrau A., C. López-Vera, F. Galván-Maga-a, O. Escobar-Sánchez, R. Rosíles-Martínez & A. Sanjuán-Mu-oz. 2011. Bioaccumulation and Biomagnification of Total Mercury in Four Exploited Shark Species in the Baja California Peninsula, Mexico. Bulletin of Environmental Contamination and Toxicology 88(2): 129-134. https://doi.org/10.1007/s00128-011-0499-1 [ Links ]
Mundy-Taylor V. & V. Crook. 2013. Into The Deep: Implementing CITES Measures For Commercially-Valuable Sharks And Manta Rays. Report prepared for the European Commission, European Union. http://www.eoth.org/into-the-deep-implementing-cites-for-sharks-and-rays/ [ Links ]
Ochoa-Díaz M.R. 2009 Espectro trófico del tiburón martillo Sphyrna zygaena (Linnaeus, 1758) en Baja California Sur: aplicación de δ13C y δ15N. Tesis de maestría. La Paz, B. C. S., Centro Interdisciplinario de Ciencias Marinas. [ Links ]
Olin J.A., N.E. Hussey, M. Fritts, M.R. Heupel, C.A. Simpfendorfer, G.R. Poulakis & A.T. Fisk 2011. Maternal meddling in neonatal sharks: implication for interpreting stable isotopes in young animals. Rapid Communications in Mass Spectrometry 25:1008–1016. https://doi.org/10.1002/rcm.4946 [ Links ]
Organización Mundial de la Salud (OMS). 1997. Codex General standard for contaminants and toxins in foods. CODEX STAN 193-1995. Disponible en: http://www.codexalimentarius.net. [ Links ]
Penedo de Pinho A.P, J.R.D. Guimares, A.S. Martins, P.A.S. Costa, G. Olavo & J. Valentin. 2002. Total mercury in muscle tissue of five shark species from Brazilian offshore waters: effects of feeding habit, sex, and length. Environmetal Research. 89:250–258. https://doi.org/10.1006/enrs.2002.4365 [ Links ]
Rabitto I.S., W.R. Bastos, R. Almeida, A. Anjos, I.B. Barbosa de Holanda, R.C. Ferreira Galvao, F. Filipak Neto, et al. 2011. Mercury and DDT exposure risk to fish-eating human populations in Amazon. Environment International 37: 56–65. https://doi.org/10.1016/j.envint.2010.07.001 [ Links ]
RM N° 008-2016-PRODUCE. 2016. Establecen temporada de pesca del recurso tiburón martillo a nivel nacional. El Peruano, NORMAS LEGALES. Viernes 15 de enero de 2016: 575501-575502 [ Links ]
Storelli M., E. Ceci, A. Storelli & G. Marcotrigiano. 2003. Polychlorinated biphenyl, heavy metal and methylmercury residues in hammerhead sharks: contaminant status and assessment. Marine Pollution Bulletin 46:1035–1039. https://doi.org/10.1016/S0025-326X(03)00119-X [ Links ]
Walker T.I. 1976. Effects of species, sex, length and locality on the mercury content of school shark Galeorhinus australis (Macleay) and gummy shark Mustelus antarcticus Guenther from south- eastern Australian waters. Australian Journal Marine Freshwater Research 27: 603-16. https://doi.org/10.1071/MF9760603 [ Links ]
Wheeler M. 1996. Measuring mercury. Environmental Health Perspectives. 104: 826-830. https://doi.org/10.1289/ehp.96104826 [ Links ]
Wetherbee B.M. & E. Cortes. 2004. Food consumption and feeding habits. In: Carrier J.A., J.C. Musick & M.R. Heithaus (eds) Biology of sharks and their relatives: 223-244. CRC Press, Boca Raton, Florida.https://doi.org/10.1201/9780203491317.ch8 [ Links ]
Información sobre los autores:
AGP lidero el diseño de la investigación, la colección y análisis de la data y preparación del manuscrito. JAS y JCM asistieron en la preparación del manuscrito. PE asistió en el diseño de la investigación y la preparación del manuscrito.
Los autores no incurren en conflictos de intereses
Fuentes de financiamiento: La fundación PADI financio la colecta de las muestras y el Laborarorio Littoral Environnement et Sociétés Laboratory de la Université de La Rochelle financio el análisis de las muestras.
Presentado: 26/04/2017
Aceptado: 20/10/2017
Publicado online: 14/12/2017