Introducción
El conocimiento de la biodiversidad es de suma importancia para la toma de decisiones y la base de estudios en los sectores agrícola, minero, económico, salud, educación (e.g., SERFOR 2018, Aguirre et al. 2019, Pacheco et al. 2009), además de ser la herramienta más importante para la conservación de naturaleza. En este contexto, aunque las listas de diversidad de especies del país y sus departamentos representan documentos valiosos de este conocimiento, llama la atención las pocas listas de especies de mamíferos elaboradas para el Perú, en particular, los escasos listados por departamentos, con las excepciones de Arequipa (Zeballos- Patrón et al. 2001) y Ucayali (Quintana et al. 2009). Por otro lado, varios trabajos con una cobertura geográfica más puntual representan importantes avances en el conocimiento de la diversidad de mamíferos, por ejemplo, la lista de los mamíferos del Parque Nacional del Manu (Solari et al. 2006), murciélagos del Parque Nacional Cerros de Amotape, Tumbes (Pacheco et al. 2007b), murciélagos de Arequipa (Pari et al. 2015), murciélagos de la Amazonía (Patterson et al. 1996, Ascorra et al. 1993, Hice et al. 2004, Fernández-Arellano & Torres-Vásquez 2013, Ruelas et al. 2018). Por otro lado, encontramos otras publicaciones sobre mamíferos, pero que tienen diferentes enfoques; así, con una orientación integral para el país tenemos las de Pacheco (2002) y Pacheco et al. (2018a), este último un libro de divulgación, desde un punto de vista histórico el de Velazco y Cornejo (2014) y la de Cossios (2018) sobre especies amenazadas.
Después de la última compilación de mamíferos para Perú que reportó 508 especies nativas (Pacheco et al. 2009), la lista fue parcialmente actualizada a 541 especies (Medina et al. 2016) y últimamente a 559 especies (Pacheco et al. 2018a); aunque estas últimas contribuciones no proveen notas taxonómicas que expliquen los cambios. Después de más de diez años, numerosos cambios taxonómicos han ocurrido a nivel de especie, género, familia, e incluso orden. Bastan unos pocos ejemplos en comparación a Pacheco et al. (2009) que reflejan lo mencionado. El orden Soricomorpha actualmente está incluido en el orden Eulipotyphla (Burgin et al. 2018) y el orden Cetartiodactyla, aunque es monofilético e incluye a los artiodáctilos y cetáceos, debe ceder su prioridad al orden Artiodactyla, con el mismo contenido (Asher & Helgen 2010). Igualmente, a nivel de familia han ocurrido cambios importantes, como la familia Chlamyphoridae que incluye en un clado a todos los Cingulata que no sean Dasypus (Delsuc et al. 2016). Asimismo, los perezosos de dos dedos Choloepus ahora están clasificados en la familia Choloepodidae (Delsuc et al. 2019). A nivel de géneros, los primates han presentado numerosos cambios taxonómicos, aunque no siempre con consenso (Buckner et al. 2015, Byrne et al. 2016, Lynch-Alfaro et al. 2012b, Ruiz-García et al. 2012, 2016b). Diversos tratados a nivel regional y mundial han contribuido a dilucidar la situación taxonómica de muchas especies y su distribución, entre ellos los trabajos de Wilson y Reeder (2005), Wilson y Mittermeier (2009), Rowe y Myers (2016), además de una numerosa literatura publicada en revistas especializadas. Estos cambios con respecto a Pacheco et al. (2009) son tratados en la sección de comentarios taxonómicos.
En este trabajo presentamos una lista actualizada de todas las especies de mamíferos silvestres sean terrestres, marinos o de agua dulce (excepto murciélagos y roedores), conocidas para Perú hasta el presente (junio, 2020). Para cada especie se actualiza su distribución por ecorregiones naturales según Brack-Egg (1986), su distribución altitudinal y su situación de endemismo para el Perú. Además, se incluye por primera vez una lista anotada de la diversidad por cada uno de los 24 departamentos en que se divide el Perú. Por motivos prácticos la Provincia Constitucional del Callao es incluida en el departamento de Lima. Se proveen además perspectivas y sugerencias para el estudio de los mamíferos.
Material y métodos
En este trabajo se incluyen todos los mamíferos, excepto a los órdenes Chiroptera y Rodentia, los cuales, por su alta diversidad, estimada en dos terceras partes de la diversidad de mamíferos (Pacheco et al. 2009, 2018a), y por la magnitud de cambios taxonómicos serán tratados en publicaciones posteriores. El ordenamiento jerárquico desde orden hasta familia, y en algunos casos hasta subfamilia, es filogenético continuando el ordenamiento seguido en Pacheco et al. (2009) y actualizado con Voss y Jansa (2009), Burgin et al. (2018) y Woodman (2018). Dentro de estas categorías todos los géneros y especies están ordenados alfabéticamente.
Se incluyen notas taxonómicas cuando hay cambios taxonómicos o de distribución con respecto a Pacheco et al. (2009). Todas las especies mencionadas en el presente trabajo, al igual que su distribución en departamentos, ecorregiones, rangos de elevación o estado de endemismo están sustentadas por una o dos referencias bibliográficas y de no haberlas, el sustento es dado por al menos un voucher de una colección científica. En este caso, el voucher mencionado debe interpretarse como el primer registro conocido. Especies potencialmente presentes en el país no han sido incluidas para no sobrestimar la biodiversidad del país. De igual modo, registros basados solo en informes no publicados, tesis, disertaciones, resúmenes de congresos y similares no fueron incluidos; no obstante, estos registros fueron rastreados hasta conseguir una referencia bibliográfica o voucher de colección, y de no haberlo no fue incluido.
Se optó por seguir incluyendo algunas especies consideradas nuevas para la ciencia (por expertos taxónomos) y que han sido nombradas así en algún libro o publicación, aunque aún no reportada formalmente (e.g., Thylamys sp.). Al igual que Pacheco et al. (2009), se continuó usando las ecorregiones de Brack-Egg (1986) con la modificación de que presentamos Serranía Esteparia como Vertiente Occidental y Desierto como Costa. Se actualiza también las especies y géneros endémicos. No se incluye una lista de especies introducidas ni tampoco nombres comunes en español o inglés, los cuales pueden encontrarse en Pacheco et al. (2009). Para el estado de conservación de las especies tratadas aquí se sugiere consultar la legislación nacional vigente de la lista de categorización para especies amenazadas del Decreto Supremo N.º 004-2014-AG (Ministerio de Agricultura y Riego 2014), ampliada en el Libro Rojo de la Fauna Silvestre Amenazada del Perú (SERFOR 2018) y las listas actualizadas de las organizaciones internacionales: Convention on International Trade in Endangered Species (CITES 2006; http://checklist.cites.org/#/es) e International Union for the Conservation of Nature (IUCN 2020; https://www.iucnredlist.org/). Para una lista de especies introducidas consultar Pacheco et al. (2009).
Se incluyen también los acrónimos de las siguientes instituciones: AMNH = American Museum of Natural History, New York; FMNH = Field Museum of Natural History, Chicago; MVZ = Museum of Vertebrate Zoology, University of California, Berkeley; MUSM = Museo de Historia Natural, Universidad Nacional Mayor de San Marcos, Lima.
Resultados
Diversidad.- Para el Perú, la diversidad de los mamíferos terrestres, acuáticos y marinos de los órdenes tratadosaquí (excepto Chiroptera y Rodentia) alcanza a 11 órdenes,32 familias, 93 géneros y 191 especies (Tablas 1, 2). Estadiversidad por órdenes taxonómicos incluye a 46 didelfimorfos, 2 paucituberculados, 1 sirenio, 8 pilosos, 5 cingulados, 42 primates, 2 lagomorfos, 3 eulipotiflanos, 33 carnívoros, 2 perisodáctilos, 47 artiodáctilos; de los cuales, 22especies son endémicas para el Perú. A escala ecorregional,los órdenes Didelphimorphia (69.6%), Sirenia (100%),Cingulata (80%), Pilosa (87.5%), Primates (95.2%) sonpredominantes en Selva Baja; mientras que los Paucituberculata (100%) y Eulipotyphla (100%) solo ocurren enlas Yungas y en Páramo. Carnivora y Artiodactyla son losórdenes que se encuentran en todas las ecorregiones terrestres, seguidos por Didelphimorphia que está en todaslas ecorregiones excepto en Páramo (Tabla 1).
Tabla 1.- Lista de especies de mamíferos registrados para el Perú (con excepción de Rodentia y Chiroptera), con datos de rango de elevación, distribución por departamentos y ecorregiones (sensu Brack-Egg, 1986). Cada una de las celdas está sustentada por al menos una referencia bibliográfica (representada por números arábigos) o voucher de museo (ver Material y métodos por los acrónimos). Las abreviaturas empleadas son: Ama, Amazonas; Anc, Ancash; Apu, Apurímac; Are, Arequipa; Aya, Ayacucho; Caj, Cajamarca; Cus, Cuzco; Hcvl, Huancavelica; Hua, Huánuco; Ica, Ica; Jun, Junín; LLi, La Libertad; Lam, Lambayeque; Lim, Lima; Lor, Loreto; MdD, Madre de Dios; Moq, Moquegua; Pas, Pasco; Piu, Piura; Pun, Puno; SMa, San Martín; Tac, Tacna; Tum, Tumbes; Uca, Ucayali; OCE, Oceánica; BPP, Bosque Pluvial del Pacífico; BSE, Bosque Seco Ecuatorial; COS, Costa; VOC, Vertiente occidental; PAR, Páramo; PUN, Puna; YUN, Yungas; SB, Selva Baja; SP, Sabana de Palmera; END, Especie endémica. Los números en paréntesis indican el número total de especies por categoría taxonómica y los números en negrita y cursiva indican el número total de especies por categoría taxonómica en cada departamento. Los números de las citas al pie de la Tabla 1 van en orden creciente, pero no son necesariamente consecutivos.
La mayor diversidad de mamíferos se encuentran en Selva Baja (113) y Yungas (76), seguidas por un grupo de ecorregiones moderadamente diversas: Bosque Pluvial del Pacífico (20), Vertiente Occidental (22), Puna (17), Bosque Seco Ecuatorial (18), Sabana de Palmeras (25) y Costa (19); mientras que la ecorregión Oceánica (30) y el Páramo (12) son las menos diversas (Tabla 1).
Los departamentos que albergan la mayor diversidad son Loreto (95), Cusco (84) y Madre de Dios (77); mientras que los menos diversos son Huancavelica (11), Moquegua (12) e Ica (13) (Tabla 1, Fig. 1). Se incluyen también varios nuevos registros para los departamentos y también ampliación de rango de distribución o de elevación (ver notas taxonómicas).
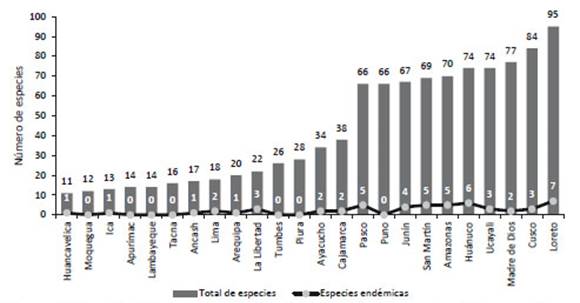
Figura 1 Diversidad de especies y endemismos por departamentos de los mamíferos del Perú (con excepción de Rodentia y Chiroptera).
Notas taxonómicas y nuevos registros
Presentamos comentarios taxonómicos usando como referencia principal a Pacheco et al. (2009):
Didelphimorphia
Cryptonanus unduaviensis (Tate, 1931)
Voss et al. (2005) basados en evidencia no molecular y secuencias del gen nuclear IRBP describieron a Cryptonanus como nuevo género diferenciándolo de Gracilinanus y otros didélfidos. Pacheco et al. (2009) no incluyeron a Cryptonanus porque en ese entonces no se conocían especímenes para el Perú. Recientemente, Medina et al. (2016) reportaron el primer ejemplar de este género y especie para el país en Pampas del Heath, en el departamento de Madre de Dios.
Didelphis marsupialis Linnaeus, 1758
Cerqueira y Tribe (2008) incluyeron registros de Didelphis marsupialis para los departamentos de Lima (Brown 2004), La Libertad (Osgood 1914) y Lambayeque (Cerqueira 1985); siendo Lima su registro más austral en el lado occidental de los Andes. El registro de Lima está basado en un ejemplar de Yangas (MVZ 137241) reportado por Pearson (1968) e incluido en Brown (2004), pero este ejemplar ha sido reidentificado como D. pernigra por E. Escobar y V. Pacheco. El ejemplar de D. albiventris previamente reportado por Diaz y Willig (2004) para Ninarumi, Loreto fue reidentificado como D. marsupialis por Pacheco et al. (2009) y Diaz (2014). Hurtado y Pacheco (2015) lo registraron en Tumbes, en el Parque Nacional Cerros de Amotape. Adicionalmente, Ruelas et al. (2018) lo registraron cerca de la frontera con Brasil, en Purús, Ucayali. Los registros de Rodríguez (1995) y Amanzo (2003) para Tabaconas-Namballe, Cajamarca no son considerados por estar basados en entrevistas, pudiendo corresponder también a D. pernigra, el cual es frecuente a mayores elevaciones. Reportamos también el registro de elevación más bajo (3 m de altitud) en base al ejemplar colectado en el Manglar de San Pedro de Vice, Sechura, Piura (MUSM 47702).
Didelphis pernigra J. A. Allen, 1900
Lemos y Cerqueira (2002) y Cerqueira y Tribe (2008) indicaron que D. pernigra se encuentra en el Perú en la costa (desde el nivel del mar) y los bosques de la vertiente occidental de los Andes, y aparentemente ausente en la Puna. Pacheco et al. (2009) registraron la especie para el Perú en las ecorregiones de Desierto Costero y Serranía Esteparia. Medina et al. (2012) lo reportaron por primera vez para el Parque Nacional del Manu, Cusco; mientras que Pacheco et al. (2013) lo reporta en las yungas de la provincia de La Mar, Ayacucho. Nosotros confirmamos su distribución desde el nivel del mar en base a un ejemplar colectado en la Albufera de Medio Mundo, Huacho, Lima (MUSM 44718); no obstante, no está clara su distribución en el norte del Perú y su simpatría con D. marsupialis.
Gracilinanus aceramarcae (Tate, 1931)
Pacheco et al. (2009) indicaron que esta especie se encuentra presente en la ecorregión de Yungas en los departamentos de Puno, Cusco, Junín y Piura. En este trabajo agregamos registros confirmados para los departamentos de San Martín, Huánuco y Ayacucho; sin embargo, esta especie es considerada un complejo conformado por más de un taxón.
Gracilinanus peruanus (Tate, 1931)
Pacheco et al. (2009) incluyeron a Gracilinanus agilis para el Perú, siguiendo a Creighton y Gardner (2008a) quienes consideraron a G. agilis como una especie monotípica pendiente de revisión taxonómica. Huamaní et al. (2009) reportaron a G. agilis por primera vez para Loreto, en la localidad de Pucacuro, resaltando que correspondería a la subespecie peruana; añadiendo registros de Amazonas, Huánuco, Cusco, Ucayali y Madre de Dios. Posteriormente, Semedo et al. (2015) elevaron Gracilinanus peruanus a especie plena, lo cual es seguido aquí.
Marmosa Gray, 1821
La sistemática de las marmosas ha sufrido numerosos cambios en los últimos años (Gutiérrez et al. 2010, Rossi et al. 2010b, Voss et al. 2014a, Voss et al. 2019), reconociéndose cinco subgéneros, que agrupan a 11 especies de Perú de la siguiente manera: Eomarmosa (rubra), Exulomarmosa (simonsi), Marmosa (macrotarsus, waterhousei), Micoureus (constantiae, rutteri, phaea, rapposa y germana) y Stegomarmosa (andersoni, lepida) (Voss et al. 2014a).
Marmosa (Eomarmosa) rubra Tate, 1931
Especie considerada rara, revisada por Rossi et al. (2010b), quienes incluyeron registros de Amazonas, Loreto y Cusco para Perú (Creighton & Gardner 2008b). Pacheco et al. (2011) incluyeron un registro para Puno, basado en Ascorra y Orihuela (in litt). Adicionalmente, incluimos un nuevo registro para Camisea, el río Urubamba, Cusco (MUSM no catalogado).
Marmosa (Exulomarmosa) simonsi Thomas, 1899
Rossi et al. (2010b) formalizaron el uso de Marmosa simonsi para el taxón presente en la zona occidental de la costa de Ecuador y Perú diferenciándolo de M. robinsoni. Esta última especie fue listada para el Perú (Pacheco et al. 2009), aunque Rossi et al. (2010b) lo restringieron para Panamá, Colombia y Venezuela.
Marmosa (Marmosa) macrotarsus (Wagner, 1842)
Pacheco et al. (2009) listaron a M. quichua para el Perú siguiendo a Voss et al. (2001) quienes notaron que M. quichua era craniodentalmente distinguible de M. murina y que debía reconocerse como especie válida. Sin embargo, Gutierrez et al. (2010) incluyeron a M. quichua dentro de M. macrotarsus, dando prioridad a Wagner (1842), señalando además que su distribución incluye Perú, Brasil y Bolivia. Rossi (2005) fue el primero en con
firmar la presencia de esta especie para el Perú, al volver a identificar los ejemplares de Nuevo San Juan, Río Gálvez, Loreto (AMNH 272816, 272870).
Marmosa (Marmosa) waterhousei (Tomes, 1860)
Gutiérrez et al. (2010, 2011) reconocieron a M. macrotarsus y M. waterhousei como especies distintas de M. murina. Según Gutiérrez et al. (2010), ambas especies se encontrarían en Perú pero no M. murina. Gutiérrez et al. (2011) listaron varias localidades de waterhousei para Amazonasy Loreto, todas al norte de los ríos Marañón y Amazonas.Adicionalmente, se reporta la especie para Junín, en el Santuario Nacional Pampa Hermosa (MUSM 45834).
Marmosa (Micoureus) constantiae Thomas, 1904
Pacheco (2009) listaron a Marmosa (Micoureus) demerarae Thomas, 1905 para el Perú. Pero, recientemente Silva et al. (2019) y Voss et al. (2019) reconocieron constantiae para especímenes previamente conocidos como demerarae en Perú. Marmosa constantiae se distribuye en el suroeste de la Amazonía, incluido el oeste de Brasil, el este de Perú y el norte de Bolivia (Silva et al. 2019); mientras que Marmosa demerarae queda restringida al este de la Amazonía (Silva et al. 2019). Registros novedosos incluyen el primer registro para Tambopata en Puno (Pacheco et al. 2011), San Martín (Voss et al. 2019), Junín en el Santuario Nacional Pampa Hermosa (Cervantes K. com. pers.) y Huánuco en el Parque Nacional Tingo María (MUSM 44666).
Marmosa (Micoureus) germana Thomas, 1904
Gardner (2003) consideró a Marmosa germana como sinónimo de Marmosa regina, tratándola posteriormente como subespecie de M. regina y como un sinónimo junior de Marmosa rutteri (Gardner 2005; Creighton & Gardner 2008b). Sin embargo, Voss et al. (2019:31-32) sugieren que M. germana sea una especie válida y se encuentre restringida al margen izquierdo (norte) del río Amazonas, lo cual fue corroborado por Voss et al. (2020).
Marmosa (Micoureus) phaeaThomas, 1899
Según Creighton y Gardner (2008b), esta especie se distribuye en el lado occidental de los Andes de Colombiay Ecuador. Después, Pacheco et al. (2009) ampliaron sudistribución hasta el departamento de Tumbes. En base aeste patrón de distribución, es probable que el espécimende M. phaea reportado en Panguana, Huánuco (Huttereret al. 1995) corresponda a Marmosa (Micoureus) rutteri.
Marmosa (Micoureus) pardaTate, 1931, Marmosa (Micoureus) rapposaThomas, 1899 y Marmosa (Micoureus) rutteri Thomas, 1924
Pacheco et al. (2009) listaron a Marmosa (Micoureus) regina Thomas, 1898 para el Perú; sin embargo, Voss et al. (2019) restringieron a M. regina solo para la localidad tipo en Colombia, revalidando los nombres de rutteri Thomas, 1924 para el sur del río Amazonas y rapposaThomas, 1899 para las elevaciones medias en bosques nublados andinos desde Junín hasta las yungas bolivianas, siendo Huaquiña, Cusco, la localidad tipo de este último taxón (Ceballos-Bendezú 1981). Recientemente, Voss et al. (2020) realizaron una revisión del subgénero Micoureus en base a evidencia morfológica y molecular de citocromo-b, dando soporte a M. rapposa y M. rutteri como especies válidas, revalidando además el taxón pardaTate, 1931, la cual es endémica para el Perú y las yungas de Huánuco y La Libertad.
Marmosa (Stegomarmosa) andersoni Pine, 1972
Especie endémica anteriormente conocida sólo para el río Urubamba, Camisea, en el departamento de Cusco (Solari & Pine 2008). Recientemente, Zeballos et al. (2019) ampliaron su distribución hacia el norte hasta Oxapampa, Pasco, representando también el registro de mayor elevación (1100 m) y el primer reporte de esta especie para las yungas.
Marmosops Matschie, 1916
Díaz-Nieto & Voss (2016) y Díaz-Nieto et al. (2016) revisaron el género Marmosops reconociendo dos subgéneros: Sciophanes y Marmosops. El nuevo subgénero Sciophanes incluye a M. bishopi y M. juninensis, mientras que en el subgénero Marmosops se incluye a M. soinii, M. caucae y M. noctivagus. Marmosops (Sciophanes) juninensis (Tate, 1931) y Marmosops (Marmosops) soinii Voss, Fleck y Jansa, 2019 son especies endémicas(Peralta & Pacheco 2014, Voss et al. 2019).
Marmosops (Marmosops) caucae (Thomas, 1900)
Pacheco et al. (2009) incluyeron a M. impavidus (Tschudi, 1845) y a Marmosops neblina (Gardner 1990) para Perú, siguiendo a Gardner y Creighton (2008a). Recientemente, Díaz-Nieto et al. (2016) propusieron a caucae como especie válida, considerando a M. neblina Gardner, 1990 como sinónimo junior y a M. impavidus como nomen dubium (nombre dudoso), debido a que Tschudi (1845) no asignó un holotipo y su descripción no se puede asociar con certeza a la descripción de Marmosops. Siguiendo a Díaz-Nieto et al. (2016), en Perú, se encuentra "caucae A" para el norte, en Piura y Cajamarca, y "caucae B" para San Martín. Estos taxones son un grupo hermano de M. ucayaliensisTate 1931, probable especie válida, que se diferencia de ellas en 3.9 % usando secuencias de citocromo-b (Diaz-Nieto et al. 2016). Sin embargo, estos autores no encontraron diferencias morfológicas, por lo que no reconocen a ucayaliensis como especie plena ni optan por alguna categoría taxonómica. Dado que ucayaliensis se agrupa con caucae, es conveniente considerar ucayaliensis como una subespecie de M. caucae, reconociéndose su divergencia genética y sus relaciones filogenéticas. M. c. ucayaliensis estaría en Madre de Dios, Pasco y Ucayali. Incluimos registros que amplían la distribución de M. caucae: Loreto (MUSM 37668), Junín (Cervantes K. com. pers.)y Ayacucho (MUSM 26181), identificados por Rob Voss; y el registro del Parque Nacional Yanachaga Chemillén, Pasco (previamente identificada como M. neblina) identificado por Diaz-Nieto.
Marmosops (Marmosops) soinii Voss, Fleck y Jansa, 2019
Esta es una especie recientemente descrita por Voss et al. (2019) en base a características morfométricas y morfológicas y sólo es conocida para el interfluvio Yaraví- Ucayali, Loreto.
Marmosops (Sciophanes) bishopi (Pine, 1981)
Voss et al. (2001), Díaz-Nieto et al. (2016) y Voss et al. (2019) reconocen a Marmosops bishopi como especie válida y distinta de M. parvidens. Gardner y Creighton (2008a) lo citaron solo en dos localidades: Huánuco y Cusco; luego, Diaz-Nieto y Voss (2016) lo incluyeron también para los departamentos de Amazonas, Loreto, Madre de Dios, San Martín y Ucayali. Pacheco et al. (2011) lo reportaron por primera vez para el departamento de Puno y es aquí reportado para Junín (MUSM 41237, 41238 y 41372).
Metachirus myosuros (Temminck, 1824)
Pacheco et al. (2009) listaron a Metachirus nudicaudatus (É. Geoffroy, 1803) para Perú. Recientemente, Voss et al. (2019) basados en comparaciones morfológicas y análisis filogenéticos con secuencias de citocromo-b elevaron a myosurus como especie plena, restringiendo a M. nudicaudatus para el noreste de la Amazonía (Guyana, Guyana Francesa, Surinam y norte de Brasil) y a myosurus para el suroeste de la Amazonía (Perú, Bolivia y sur de Brasil).
Monodelphis Burnett, 1830
Desde el último listado de Pacheco et al. (2009) los colicortos peruanos han tenido pocos cambios taxonómicos. A nivel específico se describió a M. gardneri (Solari et al. 2012), mientras que Pavan y Voss (2016) sugirieron el reconocimiento de cinco subgéneros monofiléticos en base a clados multiespecies recuperados por análisis moleculares y definidos morfológicamente. Los subgéneros reconocidos que contienen especies peruanas son: Microdelphys Burmeister, 1856 (para M. gardneri), Monodelphis Burnett, 1830 (M. glirina), Mygalodelphys Pavan y Voss, 2016 (para M. adusta, M. handleyi, M. osgoodi, M. peruviana y M. ronaldi) y Pyrodelphys Pavan y Voss, 2016 (para M. emiliae).
Monodelphis (Microdelphys) gardneri Solari, Pacheco, Vivar y Emmons, 2012
Solari et al. (2012) describieron a M. gardneri en base a evidencias morfológicas y moleculares. Esta especie fue reconocida en estudios previos como M. theresa por Gardner (1993) y Pacheco et al. (1995), Monodelphis species C por Pine y Handley (2008) y Solari (2010) y Monodelphis sp. por Pacheco et al. (2009). M. gardneri ha sido registrado en los departamentos de Huánuco, Pasco, Junín y Cusco (Solari 2010, Solari et al. 2012, Pacheco & Noblecilla 2019). Morfológicamente presenta algunas similitudes externas y craneales con M. americana y M. scalops (que incluye a M. theresa como sinónimo) de Brasil como las tres líneas longitudinales dorsales oscuras (menos evidentes en adultos de M. americana), un proceso timpánico alisfenoide globular y el curso extracraneal del nervio mandibular consistentemente encerrado por una lámina bullar anteromedial que forma un agujero oval secundario (Solari et al. 2012; Pavan & Voss 2016). Esta especie es endémica y cohabita con M. peruviana en la Cordillera de Vilcabamba, Cusco (Solari et al. 2012).
Monodelphis (Monodelphis) glirina (Wagner, 1842)
Voss et al. (2001) restringieron a M. glirina para el sur del río Amazonas y el oeste del río Xingu. Esta especie ha sido registrada en los departamentos de Madre de Dios (Voss & Emmons 1996; Solari 2004) y Cusco (registrado como M. brevicaudata por Solari et al. 2001b) y recientemente en Ucayali (Ruelas et al. 2016a).
Monodelphis (Mygalodelphys) adusta (Thomas, 1897)
Pavan y Voss (2016) designaron a M. adusta como especie tipo del subgénero Mygalodelphys. En el Perú, M. adusta está presente al norte del río Amazonas (Solari 2004, 2007; Hice 2001). Aquí adicionamos un registro para la quebrada Chinganaza, distrito El Cenepa en el departamento de Amazonas (MUSM 27045). El registro de Patton et al. (1982) para la cuenca baja del río Cenepa en este mismo departamento probablemente corresponda a esta especie.
Monodelphis (Mygalodelphys) handleyi Solari, 2007
Considerado como endémico para Jenaro Herrera, Loreto (Solari 2007). Recientemente Bezerra et al. (2019) reportaron un espécimen de esta especie para Humaitá, Estado de Amazonas, Brasil, en base a caracteres morfológicos y filogenia usando el gen citocromo-b. Sin embargo, a pesar de que este ejemplar tiene algunos caracteres distintos a los de la serie tipo y una distancia genética de 5.1% con M. handleyi s.s., los autores conservadoramente lo reportaron bajo este nombre. Consideramos que los autores no sustentan convincentemente que su ejemplar sea M. handleyi, por lo que seguimos manteniendo la especie como endémica de Perú. Más bien, es posible que el ejemplar de Humaitá corresponda a un taxón no descrito.
Monodelphis (Mygalodelphys) osgoodi Doutt, 1938
Solari (2004, 2007) consideró que las diferencias reportadas por diversos autores entre M. peruviana y M. osgoodi eran suficientes para tratar a M. osgoodi como una especie plena y no una subespecie. Además, Solari (2007) y Vilela et al. (2015) sugirieron que M. osgoodipodría ser un complejo de al menos dos especies candidatas con una distancia genética intraespecífica de 6 %. M. osgoodi ha sido reportada para los departamentos de Cusco (Solari et al. 2001a, Medina et al. 2012) y Puno (Pine & Handley 2008).
Monodelphis (Mygalodelphys) peruviana (Osgood, 1913)
Aunque Solari (2004, 2007) reconoció a M. peruviana como una especie plena y diferente de M. adusta,falta aún un estudio taxonómico que permita delimitarmorfológicamente a ambos taxones. Este autor sugirióque el río Amazonas estaría delimitando la distribución de estas especies, al norte, M. adusta y al sur, M. peruviana. Utilizando los caracteres sugeridos por Solari (2004), Voss et al. (2019) no lograron diferenciar a M. peruviana, proveniente de Nuevo San Juan, de M. adusta, proveniente de Maynas, ambas localidades enLoreto. Ante esta dificultad, Voss et al. (2019) sugirieron mantener ambos taxones como válidos, ya que enuna filogenia molecular no son grupos hermanos. Porotro lado, Vilela et al. (2015) basados en una filogeniamultigenes sugirieron que puede ser un complejo deespecies. Solari (2007) reportó una distancia genética,en base a citocromo-b, de 6.1% entre las poblacionesde Perú y Bolivia, mientras que Lim et al. (2010), de4.6%. M. peruviana ha sido registrada para los departamentos de Loreto (Jansa & Voss 2000), San Martín(Osgood 1913), Ucayali (Ceballos-Bendezu 1959), Huánuco (Pine & Handley 2008, Pavan & Voss 2016), Junín(Pavan & Voss 2016), Ayacucho (Pacheco et al. 2007),Cusco (Solari et al. 2001a; Medina et al. 2012), Madrede Dios (Woodman et al. 1991, Luna et al. 2002, Medinaet al. 2016) y Puno (Pacheco et al. 2011). El registro deAniskin et al. (1991) para el IVITA (Instituto Veterinariode Investigaciones Tropicales y de Altura) de Pucallpaen Ucayali citado como M. osgoodi por Pine y Handley (2008) corresponde a M. peruviana siguiendo a Quintana et al. (2009). Adicionamos los primeros registrospara los departamentos de Amazonas (MUSM 36900) y Pasco (MUSM 24217).
Monodelphis (Mygalodelphys) ronaldiSolari, 2004
Descrito en base a un individuo adulto y conocido sólo para la localidad tipo en Pakitza, Madre de Dios (Solari 2004). Se desconocen su historia natural y sus relaciones filogenéticas. Solari (2007) sugirió que podría ser muy cercano a M. handleyi. En base a morfología, Solari (2010) lo incluyó en el grupo de especies adusta, posteriormente Pavan y Voss (2016) lo incluyeron en el subgénero Mygalodelphys.
Monodelphis (Pyrodelphys) emiliae (Thomas, 1912)
Ha sido reportado para Loreto (Jansa & Voss 2000, Solari 2007, Voss et al. 2019), Cusco (Solari et al. 2001b), Madre de Dios (Solari et al. 2006) y recientemente para el Parque Nacional Sierra del Divisor, en los departamentos de Ucayali y Loreto (Medina et al. 2015). Es la única especie contenida en el subgénero Pyrodelphys (Pavan & Voss 2016).
Philander andersoni (Osgood, 1913)
Voss et al. (2018) restringieron a Philander andersoni al norte del río Amazonas y al oeste del río Negro, quedando su distribución en el Perú para los departamentos de Amazonas y Loreto.
Philander canus (Osgood, 1913)
Pacheco et al. (2009) listaron a P. opossum para Perú. Recientemente, Voss et al. (2018) reconocieron a P. canus como especie distinta de P. opossum (Linnaeus, 1758), distribuida en Perú al sur del Río Amazonas, restringiendo a P. opossum, para el noreste de Sudamérica.
Philander mcilhennyi Gardner y Patton, 1972
Voss et al. (2018) restringieron esta especie en el Perú al sur del río Amazonas, quedando su distribución para los departamentos de Huánuco, Loreto, Ucayali, Junín (Flores et al. 2008), Ayacucho (Patton & Da Silva 2008) y Madre de Dios (Woodman et al. 1991).
Philander nigratus (Thomas, 1923)
Esta especie fue recientemente revalidada por Voss y Giarla (2020) en base a evidencia morfológica y molecular diferenciándolo de P. andersoni, P. mcilhennyi y P. canus. Esta especie se distribuye en el lado oriental de los Andes en los departamentos de Ayacucho y Junín.
Philander pebasVoss, Díaz-Nieto y Jansa, 2018
Esta es una nueva especie descrita por Voss et al. (2018), confundida anteriormente con P. opossum o P. canus. P. pebas se encuentra ampliamente distribuida en tres departamentos de Selva baja (Loreto, Madre de Dios y Ucayali) en hábitats de bosques estacionalmente inundados y bosques de tierras altas de terrazas y laderas bien drenadas.
Thylamys Gray, 1843
Pacheco et al. (2009) listaron a T. pallidior, T. tatei yuna especie no descrita, Thylamys sp., para el Perú. Un año después, Giarla et al. (2010), basados en evidencia morfológica y molecular de ADNmt, reconocieron los subgéneros Xerodelphys y Thylamys; estando las especiesperuanas incluidas en el subgénero Thylamys. Palma et al. (2014) realizaron una filogenia molecular del género donde confirmaron la existencia de Thylamys sp. de losAndes del Perú como hermana de T. tatei; sin embargo, esta nueva especie aún no ha sido descrita formalmente. Thylamys (Thylamys) tatei (Handley, 1957) y Thylamys (Thylamys) sp. son especies endémicas para el país (Solari 2003, Palma et al. 2014).
Paucituberculata
Caenolestes caniventer Anthony, 1921
Se encuentra restringido a los Andes del norte delPerú (Timm & Patterson 2008), abarcando las ecorregiones de Yungas y Páramo (Pacheco et al. 2009)y típicamente restringido al norte de la Depresión deHuancabamba (Lunde & Pacheco 2003). Caenolestes caniventer ha sido registrado en Huancabamba, Piura(Albuja & Patterson 1996) y Las Ashitas en el norte deJaén y Cutervo, ambos en el departamento de Cajamarca (Lunde & Pacheco 2003). Adicionamos cuatro registros importantes al sur de la Depresión de Huancabamba, el primero en Kañaris, Lambayeque (MUSM 46580),y los restantes en el departamento de Cajamarca, enlas localidades de La Granja, en la provincia de Chota(MUSM 41542), Bancuyoc en la provincia Santa Cruz(MUSM 25686) y el Bosque de San Pedro también en laprovincia de Santa Cruz (MUSM 46907). Este último podría ser el registro más austral para el género. A pesarde tener una distribución regularmente amplia, que vadesde el sur de Ecuador hasta el norte de Perú, poco eslo que se conoce sobre su historia natural y el estado deconservación de sus poblaciones.
Lestoros inca (Thomas, 1917)
Lestoros inca se encuentra en los departamentosde Junín, Cusco y Puno, entre los 2000 y 3600 m s.n.m.(Myers & Patton 2008, Emmons et al. 2001); pero existenregistros con mayor elevación en Ruinas de Runcaraccay,Machu Picchu a 3962 m de altitud (USNM 194418) y enTorontoy, Cusco a 4200 m (Thomas 1917). El registro másboreal de la especie es en el Campamento "Dos" al norte de la Cordillera de Vilcabamba, Junín (Emmons et al.2001), el cual no fue incluido por Myers y Patton (2008).
Sirenia
Trichechus inunguis (Natterer, 1883)
El manatí Trichechus inunguis es considerado mono-típico y aunque Satizábal et al. (2012) encontraron que la población peruana es diferenciable de la colombiana en base a secuencias de D-loop y microsatélites, no propusieron un cambio taxonómico. Por otro lado, Vianna et al. (2006) encontraron un proceso de hibridización entre esta especie y T. manatus en el río Amazonas, igualmente sin planteamiento taxonómico. Esta especie se encuentra distribuida en Perú sólo en los departamentos de Loreto (Husar 1977, Ronald et al. 1978) y Ucayali (Ronald et al. 1978). Grimwood (1969), Husar (1977), Ronald et al.
(1978) y Mármol (1995) precisan su distribución en los ríos Putumayo, Ucayali, Samiria, Pastaza, Nanay, Orosa, Yaguas, Pacaya, Maniti, Amazonas, Napo, Marañón y Tigre, aunque Reeves et al. (1996) dudan de su presencia en este último por falta de evidencia y la ausencia de aguas negras, aunque podría estar en sus tributarios.
Cingulata
Dasypus Linnaeus, 1758
Gibb et al. (2016) propusieron la distinción del género Hyperoambon para Dasypus kappleri basada en un análisis mitogenómico y por la presencia de escudos únicos en la rodilla; apoyando la propuesta de Rincón et al. (2008) quienes sugirieron la inclusión de D. kappleri en el género Hyperoambon (Peters, 1864). Sin embargo, en este trabajo seguimos a Feijo et al. (2018), quienes optaron por mantener Dasypus sin subgéneros ya que todas las especies comparten características ecológicas y re-productivas y las filogenias no sustentan subdivisiones.
Dasypus novemcinctus Linnaeus, 1758
Esta especie está ampliamente distribuida en la llanura amazónica (Wetzel 1985), donde se conocen registros para Huampani, Amazonas (Patton et al. 1982), Pagoreni, Cusco (Boddicker et al. 1999), Estación Biológica Panguana, Huánuco (Hutterer et al. 1995); Cocha Cashu, Madre de Dios (Terborgh et al. 1984); Huancabamba, Piura (Grimwood 1969) y Yurac Yacu, San Martín (Thomas 1927); registros nombrados y mapeados en Wetzel et al. (2008). Además, se conocen registros para Ucayali, Río Curanja, Balta (Voss & Emmons 1996) y para Tumbes (Encarnación & Cook 1998). Este último registro fue al parecer ignorado por Wetzel et al. (2008). Hurtado y Pacheco (2015) confirmaron la presencia de la especie para Tumbes, en el Parque Nacional Cerros de Amotape, con registros de cámaras trampas y avistamientos. La especie también está presente en Junín, Loreto, Pasco y Cajamarca (Abba & Superina 2010). El registro más alto para la especie, a 2300 m, proviene de Amazonas, Yambrasbamba (Allgas et al. 2015).
Dasypus pastasae (Thomas, 1901)
Feijó y Cordeiro-Estrela (2016) elevaron a pastasaea especie plena en base a un análisis morfológico y morfométrico. Se sigue esta propuesta, aunque en otro trabajo reciente, Hautier et al. (2017) no encontraron una marcada segregación geográfica de D. kappleri, pastasae y beniensis. Esta especie está registrada a unas pocas localidades de selva baja, con registros confirmados en Roque, San Martín y Pozuzo, Pasco (Wetzel et al. 2008, Feijó et al. 2018). Wetzel et al. (2008) indicaron también su presencia para Cocha Cashu en Madre de Dios citando a Terborgh et al. (1984), aunque estos últimos autores sólo indicaron que la especie era probable; por ello, Solari et al. (2006) no la incluyeron para el Parque Nacional del Manu. La confirmación de la especie para Madre de Dios provino de Emmons y Romo (1994) y Emmons et al. (1994), para las localidades de Tambopata y la reserva Explorer’s Inn. Adicionalmente, Leite-Pitman (2009) presentó fotos de cámaras trampa de la especie sin precisar la localidad de origen. Incluimos el registro de Panguana, Huánuco, en base a restos óseos (Hutterer et al. 1995), aunque no fue considerado por Feijó et al. (2018). Amanzo (2003) lo reporta por primera vez para El Chaupe en Tabaconas Namballe, Cajamarca, en base a entrevistas; sin embargo, dado que la localidad es muy alta y la especie se ubica en zonas más bajas, preferimos no considerarla, quedando a la espera de una confirmación. De igual forma, tentativamente no se acepta el registro por entrevista de Pacheco (2003) para la cuenca del río Cenepa en Amazonas.
Dasypus pilosus (Fitzinger, 1856)
El armadillo peludo de hocico largo Dasypus pilosus es una especie endémica para Perú (Leo 1995, Pacheco et al.2009) y es el único armadillo cuyo caparazón se encuentra completamente cubierto de densos pelos (Wetzel etal. 2008), lo cual ha llevado a diversos autores a proponer distinciones taxonómicas primero como subgénero Cryptophractus (Wetzel & Mondolfi 1979) y recientemente como género válido por Castro et al. (2015) basado enuna filogenia morfológica. Sin embargo, Gibb et al. (2016) encontraron a D. pilosus en un clado de especies de Dasypus en una filogenia mitogenómica de los xenarthros, porlo que sugieren mantener a pilosus dentro de Dasypus.
La especie habita en los bosques montanos y el subpáramo de los Andes peruanos desde Amazonas hastaJunín (Wetzel et al. 2008, Castro et al. 2015, Allgas etal. 2015, Feng et al. 2017). Sin embargo, sugerimos quelos registros de Junín necesitan ser sustentados. Castroet al. (2015) basaron el registro de Junín en Grimwood(1969) aunque él textualmente dice "...the British Museum has a specimen [NHM 27.11.1.235] collected atAcobamba (45 miles NE. of Cerro, Department of Junín)in 1927."; sin embargo, esta localidad podría corresponder a Acobamba en Ambo, Huánuco o Acobamba enHuariaca, Pasco; ambos al NE de Cerro de Pasco, perono en Junín. Feng et al. (2017) incluyeron también elregistro de NHM 94.10.1.13 para Junín basándose enCastro et al. (2015); sin embargo, estos últimos autores indican que este ejemplar está en Huánuco. Por ello,pendiente de confirmación, optamos por no incluir registros de esta especie para Junín.
Cabassous unicinctus (Linnaeus, 1758)
Wetzel (1980) reconoció la presencia de dos subespecies: C. u. unicinctus y C. u. squamicaudis, pero Abbay Superina (2010) mencionaron que éstas podrían pertenecer a diferentes especies según una comunicaciónpersonal de E. Cuéllar en el 2004. La distribución geográfica de estas subespecies en el Perú se encuentra representada en dos regiones: al norte del río Amazonas C. u. unicinctus y al sur C. u. squamicaudis, pero con sus límites no bien definidos (Wetzel et al. 2008 y Hayssen 2014). Los registros conocidos para esta especieson: Loreto, localidad de Iquitos y Orosa (Silveira et al.2013); Amazonas, Huampami (Patton et al. 1982), Madre de Dios, Río Tambopata (Emmons & Romo 1994) yPampas del Heath (Emmons et al. 1994); por reportesde caza en Huánuco, Panguana (Hutterer et al. 1995)y Parque Nacional Tingo María (González & Llerena2014); Ucayali, Balta (Voss & Emmons 1996); y basadoen entrevistas en Cusco, Cashiari pero aún no confirmado (Boddicker et al. 2002). Wetzel (1985) y Wetzel etal. (2008) mencionaron además su presencia en Chanchamayo, Junín, aunque no indican el museo de dondeproviene el espécimen y por último, Allgas et al. (2015)lo reportan para la localidad de Larga Vista, San Martín.Se agrega aquí un registro del Caserío de San Juan, SanIgnacio, Cajamarca (MUSM 9393), en base a un caparazón parcial colectado en noviembre de 1992 por B.Guevara; y otro de Pasco obtenido con cámaras trampapor TEAM (2016).
Pilosa
Bradypus variegatus Schinz, 1825
Gardner (2008b) compiló la distribución conocida de Bradypus variegatus para la ecorregión de Selva baja. Pacheco et al. (2009) mencionaron que la especie se encuentra también en el Bosque Pluvial del Pacífico (BPP) en Tumbes, basado en una entrevista registrada por Pulido y Yockteng (1983) y anteriormente por Grimwood (1969). Sin embargo, Hurtado y Pacheco (2015) en su actualización de la diversidad de mamíferos del BPP no hallaron evidencia de la especie. Pero, recientemente una foto tomada por un guardaparque confirma su presencia en Tumbes (Hurtado C. com. pers.).
Choloepus Illiger, 1811
Los perezosos de dos dedos, Choloepus, estaban convencionalmente clasificados en la familia Megalonychidae, pero recientemente Delsuc et al. (2019) en un análisis filogenético empleando mitogenoma ancestral demostraron que Megalonychidae no es monofilética y para resolver este problema taxonómico erigieron la familia Choloepodidae para contener a Choloepus.
Choloepus didactylus (Linnaeus, 1758)
Voss y Fleck (2017) consideraron que los patronesde pelaje son ambiguos para diferenciar C. didactylus de C. hoffmanni, utilizando más bien caracteres craneales para esta diferenciación. Por ello es necesario sustentarlos registros directos de Allgas et al. (2015) para los departamentos de Amazonas y San Martín, ya que fuerondiferenciados sólo en base al patrón de pelaje. Igualmente, es necesario confirmar el registro del Field Museum para Chanchamayo, Junín (FMNH 65796). Estos registros sontentativamente aceptados aquí, pendientes de su revisión.
Choloepus hoffmanni Peters, 1858
Choloepus hoffmanni se distribuye en dos áreas diferenciadas, al norte y sur de Sudamérica, reconociéndose cinco subespecies (Gardner & Naples 2008). Según el mapa presentado por Hayssen (2011), en Perú se encontrarían C. h. pallescens a lo largo de la vertiente oriental de los Andes y C. h. juruanus para el lado oriental sur. Sin embargo, Hurtado y Pacheco (2015) ampliaron su distribución para el lado occidental de los Andes con un registro en el Parque Nacional Cerros de Amotape en Tumbes, confirmando los registros previos por entrevista de Pulido y Yockteng (1983). La subespecie que corresponde a este registro sería C. h. capitalis (siguiendo a Hayssen 2011a), el cual constituye una ampliación de distribución hacia el sur en el occidente.
Cyclopes ida Thomas, 1900
Pacheco et al. (2009) listaron al serafín C. didactylus para el Perú siguiendo a Gardner (2008c). Posteriormente, la subespecie C. d. ida referida en Gardner (2008c) fue elevada a especie plena por Miranda et al.(2017) basándose en evidencias morfológicas, morfo-métricas y moleculares (ADN nuclear y mitocondrial).Según Miranda et al. (2017) C. ida se encontraría en el Perú al norte del Río Juruá en los departamentos de Lo-reto y Amazonas. La localidad del río Pisqui (07°39’S,75°03’W, AMNH 98520), que Miranda et al. (2017) refieren como Ucayali es en realidad Loreto. El registrode C. didactylus de Patton et al. (1982) en Huampami,Amazonas, es tentativamente asignado a ida. De acuerdo con las características descritas por Miranda (2017),los ejemplares analizados por Voss y Fleck (2017) corresponden a C. ida por la coloración dorsal y ventralsin banda y el perfil del cráneo deprimido.
Cyclopes thomasiMiranda et al. 2017
Según Miranda et al. (2017) Cyclopes thomasi se encontraría en el Perú al suroeste del río Juruá en los departamentos de Pasco y Ucayali. Otros registros publicados bajo el nombre de C. didactylus para Huánuco (Hutterer et al. 1995), Cusco (Boddicker et al. 2002), Madre de Dios (Terborgh et al. 1984, Woodman et al. 1991, Pa-checo et al. 1993, Voss & Emmons 1996) y Puno (AMNH 98522: no pub.) corresponderían a C. thomasi debido a su patrón de distribución, lo cual queda pendiente de confirmación. Sin embargo, el espécimen de Marcapata, Cusco (MUSM 2008) ejemplifica el impreciso estado taxonómico de los serafines en el Perú. Este ejemplar es un juvenil con extremidades amarillentas, sin línea dorsal y una línea ventral tenue, características que coinciden con C. catellusThomas, 1928 siguiendo a Miranda et al. (2017); sin embargo, este taxón fue restringido por estos mismos autores para Bolivia central y dado a que no pudieron obtener evidencia molecular de C. catellus no queda claro si en el sur de Perú existen una o dos especies. Por otro lado, el registro de C. didactylus para Cusco podría ser subjetivo ya que está basado en entrevistas (Boddicker et al. 2002). Urge una exhaustiva revisión de las poblaciones peruanas de Cyclopes. Según Miranda et al. (2017), C. didactylus sensu stricto queda restringida para norte y noreste de Brasil, Guyanas y Venezuela.
Primates
Cebuella Gray, 1866
Cebuella pygmaea fue incluida en el género Callithrix por Rosenberger (1981) y Groves (1989, 2001), lo cual fue seguido en Pacheco et al. (2009). Sin embargo, filogenias moleculares recientes ubican a Cebuella como grupo hermano de Mico en lugar de Callithrix (Buckner et al.2015), justificando que Cebuella se mantenga a nivel de género. Recientemente, Boubli et al. (2018), basados en datos genómicos y morfológicos, concluyeron que este género contendría al menos dos especies y tres morfo-tipos: Cebuella aff. pygmaea (del alto río Japurá), Cebuella cf. pygmaea (del alto río Juruá al Este hasta dentro de Perú y Ecuador) y Cebuella cf. niveiventris (al margen derecho del río Amazonas). Sin embargo, estos autores no designaron los nombres disponibles para cada población argumentando que era imposible conocer con exactitud si la localidad tipo de Cebuella pygmaea informada por Spix (1823) estaría en la margen norte o sur del río Amazonas. Al contrario, Garbino et al. (2019) afirmaron que la localidad tipo de C. pygmaea corresponde a los alrededores de Tabatinga, al norte del río Amazonas, Brasil, documentando además dos especies para el Perú: C. pygmaea al norte de los ríos Amazonas y Napo y C. niveiventris en la Amazonía occidental desde sur del río Napo hasta el río Madre de Dios en el sur.
Saguinus Hoffmannsegg, 1807
La sistemática de los pichicos ha cambiado drásticamente. Pacheco et al. (2009) listaron siete especies del género para el Perú: S. fuscicollis, S. graellsi, S. imperator, S. labiatus, S. mystax, S. nigricollis y S. tripartitus siguiendo a diversos autores; sin embargo, Matauschek et al. (2011) elevaron al rango de especie a S. illigeri, S. lagonotus, S. leucogenys, S. nigrifrons, S. tripartitus y S. weddelli,antes consideradas subespecies de S. fuscicollis (Hershkovitz 1977), dejando a S. fuscicollis s.s. restringida a los ríos Blanco, Yavarí y Tapiche. Además, estos autores consideraron a S. graellsi como subespecie de S. nigricollis,coincidiendo con Hershkovitz (1977). Por otro lado, Buckner et al. (2015), basados en un análisis concatenado de 4 genes mitocondriales y 6 nucleares separaron el grupo de pichicos pequeños al género Leontocebus, dejando a los pichicos de mayor tamaño en el género Saguinus.Recientemente, Garbino y Martins-Junior (2017) actualizaron la nomenclatura de los Callitrichinae basados en evidencia genética, morfológica y vocalizaciones, reconociendo a Leontocebus y Saguinus como subgéneros; revalidando además a Tamarinus como un tercer subgénero que incluye a imperator, labiatus y mystax. Siguiendoestos últimos estudios, reconocemos once especies del género Saguinus presentes en el Perú: S. (Leontocebus) fuscicollis, S. (Leontocebus) illigeri, S. (Leontocebus) lagonotus, S. (Leontocebus) leucogenys, S. (Leontocebus) nigricollis, S. (Leontocebus) nigrifrons, S. (Leontocebus) tripartitus, S. (Leontocebus) weddelli, S. (Tamarinus) imperator, S. (Tamarinus) labiatus y S. (Tamarinus) mystax.
Saguinus (Leontocebus) illigeri (Pucheran, 1845) y Saguinus (Leontocebus) leucogenys (Gray, 1866)
Las poblaciones del norte y sur del río Pachitea, Ucayali, fueron consideradas S. fuscicollis leucogenys (sensu Hershkovitz 1977); sin embargo, Matauschek et al. (2011) con base en evidencia molecular y morfológica reconocieron a la población de S. f. leucogenys del sur (río Pachitea) como S. leucogenys y a la población de S. f. leucogenys del norte como S. illigeri. Sin embargo, recalcaron que faltan estudios para una delimitación más exacta, puesto que su único sitio de muestreo de la parte sur fue la Estación Biológica Panguana, río Pachitea, Huánuco. Estas dos especies junto a Saguinus (Leontocebus) nigrifrons (I. Geoffroy, 1850) son endémicas para el Perú (Aquino et al. 2015a).
Saguinus (Leontocebus) weddelli Deville, 1849
Se sigue aquí a Groves (2001, 2005) y Matauschek et al. (2011) quienes reconocieron esta forma como especie plena. Estos últimos autores establecieron a S. melanoleucus como subespecie de S. weddelli, argumentando que weddelli y melanoleucus son genéticamente cercanas. Además, S. f. crandalli fue considerado como una variación en la coloración de pelaje de S. melanoleucus (Groves 2001) y podría ser el resultado de la hibridización entre S. w. melanoleucus y S. fuscicollis (Rylands et al. 2000), por lo que hacen falta estudios para resolver las relaciones intraespecíficas de esta especie.
Aotus Illiger, 1811
Pacheco et al. (2009) listaron cinco especies de monos nocturnos para el Perú: A. azarae, A. miconax, A. nancymaae, A. nigriceps y A. vociferans siguiendo a Hershkovitz (1983), lo cual fue soportado molecularmente por Ruiz-García et al. (2011) y Ruiz-García et al. (2016c). A. nancymaae es considerada una corrección injustificada de A. nancymae (ver Garbino & Costa 2015), lo cual es seguido aquí. Ruiz-García et al. (2011) y Ruiz-García et al. (2016c) realizaron un estudio filogenético del género Aotus obteniendo cuatro superespecies: A. vociferans (incluyendo A. vociferans para el noreste del Perú), A. miconax (incluyendo A. miconax y A. nancymae para el este del Perú), A. azarae (incluyendo A. nigriceps y A. a. boliviensis para el sureste del Perú) y A. trivirgatus (norte de Brasil y Venezuela). Este estudio incluyó muestras de A. miconax (por primera vez en un estudio molecular) el cual resultó tener 2% de distancia genética (COII) con respecto a A. nancymae, por lo que los autores sugirieron que A. nancymae podría ser una subespecie de A. miconax. Además, Voss y Fleck (2011) recalcaron que morfológicamente A. miconax no es claramente diferenciable de A. nancymae,concordando con Ford (1994) quien no encontró diferencias fenotípicas entre ambos taxones; por lo que miconax sería un sinónimo senior de nancymae. Del mismo modo, Ruiz-García et al. (2016c) mencionaron la posibilidad de que A. nigriceps sea una subespecie de A. azarae. Dado que el cariotipo de A. miconax es desconocido, y pendiente de una revisión moderna de Aotus, concordamos con Voss y Fleck (2011) en temporalmente seguir la taxonomía de Groves (2005) que reconoce a nancymae y miconax como especies diferentes; siendo la última especie, endémica (Aquino et al. 2015a).
Cebus Erxleben, 1777
Los monos machines o capuchinos han sufrido también varios cambios taxonómicos en los últimos años tanto a nivel específico como genérico. Pacheco et al. (2009) listaron a todos los monos capuchinos dentro del género Cebus, incluyendo una especie de machín grácil o sin mechón (C. albifrons) y dos de los robustos o con mechón (C. apella y C. libidinosus) siguiendo a Groves (2001). Más adelante, Lynch-Alfaro et al. (2012b) propusieron que el género Cebus debería ser dividido en los géneros Sapajus para los capuchinos robustos y Cebus para los gráciles, esto basado en el tiempo de divergencia entre estos dos linajes; apoyando a Silva Jr. (2001) quien reconoció ambos grupos, pero propuso que la distinción podría formalizarse a nivel subgenérico. Ruiz-García et al. (2012, 2016b) basados en estudios moleculares de COII, indicaron que, aunque las diferencias morfológicas entre Cebus y Sapajus son notorias, las diferencias moleculares y cariotípicas son relativamente pequeñas, por lo que recomendaron mantener el género Cebus para todos los monos capuchinos. Nosotros seguimos a Gutiérrez y Marinho-Filho (2017), quienes propusieron que los géneros Sapajus y Cebus sean tratados como subgéneros, argumentando que el uso del nivel genérico en este caso sería innecesario y poco práctico, generando confusión y una visible inflación taxonómica; además que ambos grupos siguen siendo un grupo monofilético.
Cebus (Cebus) albifrons (Humboldt, 1812)
Pacheco et al. (2009) listaron a C. albifrons como la única especie de machin grácil para el Perú siguiendo a Hershkovitz (1949), quien la reconoció como politípica conformada por 13 subespecies. De estas, cuatro están en el Perú: C. a. unicolorSpix, 1823, C. a. yuracus Hershkovitz, 1949, C. a. cuscinus Thomas, 1901 y C. a. aequatorialis Allen, 1921; este último restringido al noroeste en Tumbes. Sin embargo, el estado taxonómico de C. albifrons es aún controversial. Encarnación y Cook (1998) reportaron por primera vez a C. cf. albifrons para la Zona Reservada de Tumbes, lo cual fue seguido por Pacheco et al. (2009) y confirmado por Hurtado et al. (2016a). Sin embargo, Cornejo y de la Torre (2015) consideraron a aequatorialis como especie plena basados en las inferencias de la filogenia molecular presentada por Boubli et al. (2012), aunque estos últimos autores incluyeron pocas muestras de Perú y ninguna del lado occidental de los Andes. Recientemente, Ruiz-García et al. (2018) presentaron una filogenia con una mayor densidad de muestras de Ecuador y Perú, concluyendo que C. albifrons es un complejo aún no resuelto, por lo que es mejor considerarlo monotípico. Pendientes de mayores estudios, es más conservador no modificar la taxonomía actual que reconoce la subespecie C. a. aequatorialis (siguiendo a Hershkovitz 1949), coincidiendo también con Hurtado et al. (2016a) quienes sostienen que no hay suficiente evidencia para elevar C. a. aequatorialis a nivel de especie. En cuanto a las otras tres subespecies peruanas, sugerimos también reconocer a C. a. unicolor, C. a. yuracus, C. a. cuscinus y C. a. aequatorialis como subespecies presentes en Perú, esperando una revisión taxonómica de las poblaciones de Cebus en nuestro territorio.
Cebus (Sapajus) apella (Linnaeus, 1758)
Silva Jr. (2001) incluyó al grupo de capuchinos robustos en el subgénero Sapajus Kerr, 1972 y trató a C. apellacomo especie válida; mientras que Groves (2001, 2005) incluyó a macrocephalusSpix, 1823 como subespecie de C. apella, lo que fue seguido por Pacheco et al. (2009). Posteriormente, Lynch-Alfaro et al. (2012b: 279) no encontraron evidencia molecular que diferencie a macrocephalus de apella, por lo que recomendaron tratarlo como una sola especie. Aunque contradictoriamente, estos autores tomaron la decisión de mantener a apella y macrocephalus como especies separadas. Por otro lado, Ruiz-García et al. (2016a) realizaron un análisis filogenético con microsatélites de ADN nuclear, concluyendo que C. libidinosus pallidus (sensu Groves 2001, 2005) y macrocephalus son molecularmente indiferenciables; pudiendo ambos ser unificados como C. a. macrocephalus. Debido a la confusión taxonómica aún presente en esta especie, conservadoramente seguimos a Groves (2001, 2005) y reconocemos a C. a. apella y C. a. macrocephalus como los taxones de machines robustos presentes en Perú, aunque según Ruiz-García et al. (2016a) solo C. a. macrocephalus estaría en Perú.
Saimiri Voigt, 1831
Pacheco et al. (2009) listaron a S. sciureus y S. boliviensis para el Perú siguiendo a Hershkovitz (1984) y no aCostello et al. (1993) quienes reconocieron solamente a S. sciureus para Sudamérica y S. oerstedii para Centroamérica. La propuesta de Hershkovitz (1984) tuvo mayor apoyocon el trabajo de Groves (2001) y los análisis molecularesde ADN mitocondrial de Lavergne et al. (2010) y Chiou etal. (2011). Por otro lado, Carretero-Pinzón et al. (2009)sugirieron elevar a nivel de especie a S. macrodon (distribuida en el norte de Perú) utilizando el concepto filogenético de especie. Sin embargo, Lynch-Alfaro et al. (2015)basados en su análisis molecular de citocromo-b y D-loop,optaron por considerar a macrodon como subespecie de S. cassiquiarensis. Sin embargo, Ruiz-García et al. (2015) enbase a una filogenia del género utilizando los genes COIy COII y basándose en el concepto biológico de especie,coincidieron en gran parte con Costello (1993) proponiendo la siguiente clasificación: S. oerstedii para Centroamérica y para Sudamérica a S. vanzolinii (en caso no sedemuestre hibridación) y S. sciureus con dos subespecies: S. s. boliviensis (con 2 linajes principales) y S. s. sciureus (con 12 linajes principales). Siguiendo esta clasificación, en el Perú ocurriría solo S. sciureus con las subespecies S. s. boliviensis (con los linajes boliviensis y peruviensis) y S. s. sciureus (con los linajes macrodon I y macrodon IV).Alternativamente, estos autores postularon otra clasificación donde los linajes peruanos macrodon I y macrodon IV estarían incluidos en una tercera subespecie S. s. cassiquiarensis. Dado que la taxonomía de los monos ardillaaún es debatible, optamos tentativamente por mantener la clasificación de Hershkovitz (1984) reconociendo a Saimiri boliviensis boliviensis, S. b. peruviensis y S. sciureus macrodon, porque numerosos estudios de ecología, conductay conservación se han realizado con ese esquema. Por otrolado, desafortunadamente los registros de Saimiri cf. sciureus para Tumbes (Encarnación & Cook 1998) son ahorahistóricos, ya que la especie es considerada localmenteextinta (Hurtado & Pacheco 2015, Hurtado et al. 2016a).
Callicebus Thomas, 1903
Pacheco et al. (2009) listaron seis especies de este género para Perú: C. aureipalatii, C. brunneus, C. cupreus, C. discolor, C. lucifer y C. oenanthe; sin embargo, como en otros primates, este género ha sufrido también varios cambios taxonómicos. Estos cambios en la taxonomía de Callicebus comenzaron con Van Roosmalen et al. (2002), quienes sin mayor sustento elevaron al nivel de especies todas las subespecies de este género reconocidas por Hershkovitz (1963, 1988, 1990) o Kobayashi (1995), argumentando que el rango subespecífico sería de "mínimo valor" para describir la diversidad de primates neotropicales. Con respecto a la filogenia de los monos tocones, Byrne et al. (2016) dividieron el género Callicebus en tres, Callicebus y dos nuevos géneros Plecturocebus y Cheracebus, quedando las especies peruanas incluidas en estos dos últimos: P. cupreus, P. discolor, P. oenanthe, P. toppini, P. urubambensis y Ch. lucifer. Sin embargo, estos géneros propuestos por estos autores son considerados aquí como subgéneros siguiendo a Serrano-Villavicencio et al. (2017), Gutiérrez y Marinho-Filho (2017), Garbino y de Aquino (2018) y Teta (2018). Futuros estudios con más marcadores nucleares y mitocondriales probable mente modificarán la taxonomía del género como está ocurriendo con otros primates.
Callicebus oenanthe Thomas, 1924
Aunque Byrne et al. (2016) no incluyeron material de C. oenanthe dentro de sus análisis filogenéticos, infirieron que oenanthe estaría dentro del subclado denominado como Plecturocebus debido a que C. donacophilus,el único representante analizado del grupo donacophilus(sensu Hershkovitz 1990), se ubicó en este subclado. Sin embargo, esta es una inferencia basada en una malinterpretación de los grupos taxonómicos de Callicebus propuestos por Hershkovitz (1990) y Kobayashi (1995), debido a que estos grupos no son naturales (en un sentido filogenético). Por ello, la posición filogenética de C. oenanthe, especie endémica del Perú (Aquino et al. 2015a), se mantiene como pendiente hasta que sea evaluada correctamente.
Callicebus toppini Thomas, 1914
Vermeer y Tello-Alvarado (2015) reconocieron a C. toppini como una especie válida, distribuida al sureste del Perú, la cual fue considerada por mucho tiempo como sinónimo de C. cupreus. Los autores también la incluyeron en el grupo moloch y en el género Plecturocebus por Byrne et al. (2016), aunque como en el caso de C. oenanthe, estos últimos autores no incluyeron muestras de esta especie dentro de su análisis. La validez de C. aureipalatiiWallace, Gómez, Felton y Felton, 2006 ha sido cuestionada considerándose que podría ser una variación de coloración de C. toppini y por ende un sinónimo junior (Vermeer y Tello-Alvarado et al. 2015). Hace falta una revisión del género en la parte sureste del Perú.
Callicebus urubambensisVermeer y Tello-Alvarado, 2015
Esta especie fue recientemente descrita asignándose como holotipo a un espécimen colectado en la margen izquierda del río Urubamba (MUSM 42398). La distribución incluiría la selva tropical entre las márgenes derecha del río Tambo e izquierda del río Urubamba y el bosque entre las márgenes izquierda del río Manu e izquierda del río Alto Madre de Dios. Esta especie es endémica para Perú y compartiría hábitat con Callicebus toppini a lo largo de toda su distribución.
Pithecia Desmarest, 1804
Pacheco et al. (2009) listaron las especies P. aequatorialis, P. irrorata y P. monachus para el Perú siguiendo a Hershkovitz (1987). Recientemente, Marsh (2014) realizó una revisión taxonómica del género Pithecia basándose principalmente en los patrones de coloración de pelaje, proponiendo un total de 16 especies monotípicas. Estos arreglos son parcialmente seguidos aquí, pero debido a los problemas taxonómicos y nomenclaturales encontrados en este último trabajo, una revisión rigurosa acompañada de un análisis filogenético del género son necesarios.
Pithecia irrorata Gray, 1843
Hershkovitz (1987) revalidó a P. irrorata como especie politípica con P. i. irrorata y P. i. vanzolinii como subespecies. Recientemente, Marsh (2014) reconociendo que P. irrorata era un complejo de especies elevó de allí a vanzolinii como especie plena y nombró a P. rylandsi, P. mittermeieri y P. pissinattii como nuevas especies, utilizando básicamente patrones de coloración. Marsh (2014) se basó en el hecho de que el holotipo de P. irrorata habría sido colectado en alguna parte de Perú y no en Brasil como fue informado por Gray (1843), pero sin sustentar su afirmación. Recientemente, Serrano-Villavicencio et al. (2019), después de una extensa revisión bibliográfica, corroboraron que el holotipo de P. irrorata fue colectado en Brasil, tal como fue informado en la descripción original. Adicionalmente, usando los mismos caracteres de patrones de coloración empleados por Marsh (2014), estos autores encontraron variación individual a lo largo de la distribución de P. irrorata, pero que no existen grupos distintos asociados con alguna barrera geográfica, por lo que consideraron a P. rylandsi como sinónimo de P. irrorata, lo cual es seguido aquí. Esta especie se distribuye al sureste del Perú, confirmada para el río Madre de Dios (Serrano-Villavicencio et al. 2019) y los ríos Camisea y Urubamba, Cusco (Gregory et al. 2012).
Pithecia isabelaMarsh, 2014 y P. aequatorialisHershkovitz, 1987
Pithecia isabela es una especie nueva propuesta por Marsh (2014), diferenciada morfológicamente de P. aequatorialis y P. napensis, siendo la principal diferencia la cantidad de pelos blancos presente en la región circunfacial. Marsh (2014) indicó que el río Marañón separaría las poblaciones de P. isabela y P. aequatorialis; sin embargo, los límites entre esta última y P. napensis permaneceninciertos. Pithecia isabela y P. aequatorialis serían endémicas para nuestro país; sin embargo, es necesario comprobar esta propuesta mediante una revisión urgente del género. Por otro lado, Garbino y Costa (2015) indicaron que el epíteto específico isabela sería un error nomenclatural debido a que esta especie es un homenaje a Isabel Godin de Odonais, y siguiendo el Código Internacional de Nomenclatura Zoológica, el nombre correcto sería isabelae o incluso isabel (si es tomado como un nombre en aposición), mas no isabela. Sin embargo, como estos autores no plantearon una enmienda formal optamos tentativamente por seguir la designación original isabela.
Pithecia monachus (É. Geoffroy, 1812)
Marsh (2014) denominó la situación taxonómica de Pithecia monachus como "the monachus mess" (la confusión monachus) debido a la complicada historia taxonómica y nombres asociados a esta especie. Además,esta autora revalidó dos especies descritas por Spix(1823): Pithecia hirsuta y P. inusta que habían sido previamente consideradas como sinónimos de P. monachus por muchos autores y más recientemente por Hershkovitz (1987). Sin embargo, la revalidación de P. inusta fue basada en una supuesta falta de información en la descripción original de Spix (1823). Marsh (2014:49) afirmó que este autor no brindó la información relacionadaa la localidad tipo de P. inusta, lo cual es incorrecto. Spix(1823:16) informó que el material tipo de esta especiefue colectado en las inmediaciones de Tabatinga (Amazonas, Brasil), lo cual fue claramente omitido por Marsh(2014) en la distribución propuesta para P. inusta (verMarsh 2014:131). Debido a esta omisión y a la falta deuna clara diagnosis entre estas tres especies, seguimos la propuesta taxonómica de Hershkovitz (1987) y mantenemos a P. hirsuta y P. inusta como sinónimos junior de P. monachus como también fue seguido por Pacheco et al. (2009).
Pithecia napensis Lönnberg, 1938
Hershkovitz (1987) consideró a Pithecia napensis como un sinónimo junior de P. monachus, pero como subespecie de esta última por Groves (2001). Marsh (2014) elevó a P. monachus napensis al rango de especie debido a diferencias en la coloración del pelaje que lo separan de P. monachus, P. isabela y P. aequatorialis. Esta especie se distribuye entre los ríos Curaray y Napo (Marsh 2014, Aquino et al. 2015a).
Ateles belzebuth É. Geoffroy, 1806
Pacheco et al. (2009) listaron a A. belzebuth y A. chamek para Perú siguiendo a Groves (2001). Recientemente, Ruiz-García et al. (2016e) realizaron un análisis molecular del género utilizando los genes mitocondriales de citocromo-b, COI y COII de numerosas muestras (la mayor hasta ahora), reconociendo conservadoramente solo dos especies: A. paniscus y A. belzebuth, la última con cuatro subespecies. La subespecie peruana vendría a ser A. b. belzebuth que contiene los morfotipos belzebuth y chamek; es decir, chamek sería solo la forma oscura de A. b. belzebuth. No obstante, creemos conveniente seguir manteniendo la clasificación de Groves (2001), quedando pendiente futuros estudios que incluyan marcadores nucleares.
Lagothrix flavicauda (Humboldt, 1812)
Fooden (1963) reconoció dos especies del género: L. lagothricha y L. flavicauda; sin embargo, Groves (2001), basado en un análisis de parsimonia, resucitó Oreonax para flavicauda, argumentando que esta especie formaba un clado con una especie desconocida de Ateles, pero esto fue criticado por carecer de soporte (Matthews & Rosenberger 2008, Pacheco et al. 2009, Serrano-Villavicencio & Silveira 2019). Pacheco et al. (2009) optaron por mantener L. flavicauda siguiendo el análisis morfológico de Paredes (2003). Más adelante, esto fue confirmado molecularmente con las filogenias de Ruiz-García et al. (2014) y Di Fiore et al. (2015), cuyos análisis soportan la monofilia del género Lagothrix incluyendo a L. flavicauda. Esta especie es endémica para el país (Pacheco et al. 2009) y era restringida para el bosque montano de niebla entre los ríos Marañón y Huallaga, en los departamentos de Amazonas (Leo-Luna 1980), San Martín (Graves & O’Neill 1980) y La Libertad (Parker & Barkley 1981). No obstante, recientes estudios han ampliado su rango de distribución para los bosques montanos de Loreto (Patterson & López-Wong 2014), Huánuco (Aquino et al. 2015b, 2016) y Junín (McHugh et al. 2019).
Lagothrix lagothricha (Humboldt, 1812)
Fooden (1963) propuso que Lagothrix lagothricha es una especie politípica que incluye las subespecies L. l. lagothricha, L. l. lugens, L. l. poeppigii y L. l. cana. Sin embargo, Groves (2001) elevó estas subespecies al nivel de especie, lo cual fue seguido por Pacheco et al. (2009) listando a L. cana, L. lagothricha y L. poeppigii para el Perú. Recientemente, Ruiz-García et al. (2014) y Di Fiore et al. (2015), basados en la baja divergencia genética entre estos taxones, decidieron regresar a la taxonomía propuesta por Fooden (1963), la cual seguimos aquí. Recientemente, Ruiz-García et al. (2019a) diferenciaron molecularmente a tschudii de L. l. cana, reconociéndola como una quinta subespecie. Consecuentemente, reconocemos cuatro subespecies peruanas con la siguiente distribución: L. l. lagothricha para Loreto (Fooden 1963), L. l. poeppigii para Loreto, Ucayali, Amazonas y San Martín (Ruiz-García et al. 2014) y L. l. tschudii presente en Ucayali, Huánuco, Pasco, Junín (Aquino et al. 2019), Cusco y Madre de Dios (Ruiz- García et al. 2019a) y Puno (Sanborn 1953).
Alouatta palliata (Gray, 1849)
Aunque Groves (2005) no citó a esta especie para Perú, Pacheco et al. (2009) en base a diversos trabajos sustentó su presencia en el departamento de Tumbes. Recientemente, Hurtado y Pacheco (2015) y Hurtado et al. (2016a) refirieron a la población de Cerros de Amotape, Tumbes, como Alouatta palliata aequatorialis Festa, 1903. Sin embargo, Ruiz-García et al. (2016d, 2017) sugirieron con base en árboles filogenéticos multigenes que A. p. palliata y A. p. aequatorialis de poblaciones de Costa Rica, Colombia y Ecuador son indiferenciables y que A. p. mexicana y A. p. palliata serían las únicas subespecies válidas. En este contexto, la subespecie distribuida en Perú sería palliata; no obstante, ninguno de estos estudios incluyó muestras peruanas, quedando esto por confirmar.
Alouatta seniculus (Linnaeus, 1766) y Alouatta sara Elliot, 1910
Pacheco et al. (2009) listaron las especies A. juara para el centro del Perú y A. puruensis y A. sara para el sur, siguiendo a Gregorin (2006) pero recalcando también la necesidad de una revisión exhaustiva de las poblaciones peruanas. Ruiz-García et al. (2016d) realizaron un análisis molecular de Alouatta concluyendo que A. juara y A. puruensis son indiferenciables de A. seniculus. Voss y Fleck (2011) encontraron también que especímenes atribuidos a juara son indistinguibles de seniculus en el patrón de coloración del pelaje y morfología craneal. Por esta razón, Ruiz-García et al. (2016d) reconocieron únicamente a dos especies cis-andinas: A. seniculus para la parte norte (ríos Napo, Yavarí, Tapiche y bajo Ucayali) y centro (río Pachitea) y A. sara para el sur (ríos Tambopata y Madre de Dios). A. sara es también distinguible de seniculus en cariotipos (Minezawa et al. 1986) y secuencias de ADN mitocondrial (Cortés-Ortiz et al. 2003).
Lagomorpha
Sylvilagus andinus (Thomas, 1897)
Ruedas et al. (2017) revalidaron la especie Sylvilagus andinus diferenciándola de S. brasiliensis en base a un análisis filogenético de secuencias genéticas concatenadas de los genes 12S rRNA y citocromo-b. Estos autores incluyeron a capsalis (localidad tipo: San Pablo, Cajamarca, Vertiente del Pacífico N Perú, 2000 m de elevación) como sinónimo de S. andinus. Esta especie habita en los bosques montanos y páramo de Ecuador y norte de Perú; sin embargo, recalcaron que aún falta una caracterización morfológica y conocer su distribución precisa en el Perú. Los registros de Grimwood (1969) para S. brasiliensis de la parte andina de Cajamarca, Piura y La Libertad son tentativamente reconocidos aquí como S. andinus en base a su distribución y hábitat siguiendo a Ruedas et al. (2017), quedando pendientes estudios morfológicos y moleculares que incluyan poblaciones peruanas.
Sylvilagus brasiliensis (Linnaeus, 1758)
Ruedas et al. (2017) restringieron la localidad tipo de S. brasiliensis para Pernambuco, Brasil enfatizando que apesar de los estudios recientes aún necesita una urgenterevisión. Esta especie fue reportada en Perú para Zarumilla, Tumbes por Grimwood (1969) y confirmada mediante avistamientos por Pulido y Yockteng (1983). Sin embargo, trabajos más recientes como el de Encarnación y Cook(1998) y Hurtado y Pacheco (2015) no lograron registrarsu presencia en dicho departamento. Ruedas et al. (2019)reconocieron a S. daulensis J.A. Allen, 1914 como especieválida, la cual fue descrita de la localidad de "Daule (nearsea-level), Guayas, Ecuador", en el lado occidental de losAndes. Es posible que los avistamientos de Tumbes (Grimwood 1969) y de Piura (García-Olaechea A. com. pers.)puedan corresponder a esta especie; sin embargo y pendiente de la evaluación de algún espécimen se mantiene lapresencia de S. brasiliensis sensu lato para Tumbes y Piura.
Eulipotyphla
Cryptotis Pomel, 1848
Cryptotis peruviensisVivar, Pacheco y Valqui, 1997 fue reportada por primera vez en base a un ejemplar colectado en Las Ashitas, Cajamarca y otro de Machete carretera Zapalache-El Carmen, Piura; ambas localidades en Perú (Vivar et al. 1997). Sin embargo, en base a una mayor cantidad de muestras de Piura, Pacheco et al. (2009) restringieron peruviensis solo a la localidad tipo en Las Ashitas, Cajamarca; mientras que el ejemplar de Machete fue referido como C. equatoris, junto a una serie de Huancabamba, Carmen de la Frontera, Piura (MUSM 2345258). Recientemente, Zeballos et al. (2018) describieron a Cryptotis evaristoi Zeballos, Pino, Medina, Pari y Ceballos, 2018 a partir de una población de Tabaconas-Namballe, Cajamarca y reconocieron la presencia de C. montivagus (Anthony, 1921) para Perú reidentificando la poblaciòn de Huancabamba y Machete en Piura. Zeballos et al. (2018) aseguraron en base a caracteres morfológicos y moleculares que estos ejemplares fueron erróneamente identificados como equatoris; sin embargo, ninguno de estos ejemplares, ni peruviensis, fueron incluídos en sus árboles filogenéticos. En Zeballos et al. (2018: Tabla 6), siete caracteres asemejan a los ejemplares de Piura a C. equatoris y cuatro a C. montivagus, excluyendo caracteres merísticos. Además, la determinación del ejemplar de Machete, Piura sustentada en Pacheco et al. (2009) como equatoris, no ha sido testada por Zeballos et al. (2018), dado que no revisaron el ejemplar. Teniendo en cuenta las consideraciones expuestas, se acepta tentativamente a C. montivagus para Perú, quedando pendiente una revisión de las musarañas peruanas. Esta especie es nominada montivagus y no montivaga siguiendo una disposición de la ICZN (2006) que determinó que Cryptotis debería ser tratado como un nombre masculino, aunque el género Cryptotis haya sido tratado históricamente como femenino (Woodman 2018).
Carnivora
Leopardus garleppi (Matschie, 1912) y Leopardus jacobita (Cornalia, 1865)
Ambas especies fueron incluidas para el Perú porPacheco et al. (2009) como L. colocolo y L. jacobitus siguiendo a Wozencraft (2005); sin embargo, recientesestudios han cambiado la nomenclatura de estos gatos. L. colocolo ahora es nominado como L. colocola dando prevalencia a la ortografía original de Molina (1782), la que equivocadamente fue considerada como un errorde colocolo. Por ello, los miembros de la Cat Classification Task Force (CCTF) acordaron que, a pesar de que colocolo podría mantenerse por considerarse una enmienda justificada, se opte por volver a la ortografía original de colocola de Molina para esta especie, ya que colocola seguía vigente en la literatura (Kitchener et al.2017). Hasta ese momento estos autores reconocían lasubespecie L. c. garleppi para Perú; pero recientemente,Nascimento et al. (2020), utilizando una filogenia multilocus, técnicas de delimitación de especies y análisisde nichos ecológicos, reconocieron a Leopardus garleppi (Matschie, 1912) como especie válida, coincidiendoasí con el clado de gatos de las pampas de Perú y Bolivia de Cossíos et al. (2009). L. garleppi presenta rasgosdiagnósticos claros, distancia genética de moderada aalta respecto de las otras cuatro especies reconocidas (L. colocola Molina, 1782, L. pajeros Desmarest, 1816, L. braccata Cope, 1889 y L. munoai Ximénez, 1961) y una distribución geográfica bien definida, encontrándose a lo largo y en ambas laderas de los Andes pasando porEcuador, Perú, noroeste de Argentina y norte de Chile.Además, Nascimento et al. (2020) sinonimiza budini y wolffsohni, consideradas subespecies por Kitchener etal. (2017), con L. garleppi.
El gato andino fue descrito originalmente como Felis jacobita por Emilio Cornalia (1865). Posteriormente, Nowell y Jackson (1996) latinizaron el epíteto específico a jacobitus. Sin embargo, Seymour (1999) y Yensen y Seymour (2000) explicaron que el epíteto jacobita fue acuñado en honor a una persona (doña Jacobita Mantegazza) y, según establece el Código Internacional de Nomenclatura Zoológica, en casos como ése debe respetarse el nombre original, sin latinizaciones. El nombre científico correcto del gato andino es pues Leopardus jacobita.
Leopardus tigrinus (Schreber, 1775)
Esta especie relativamente rara es registrada en Pacheco et al. (2009) para las yungas del Perú. Se encuentra confirmada para Amazonas (Pacheco 2003), Cusco (Solari et al. 2006) y Cajamarca (MINAM 2011a).
Leopardus wiedii (Schinz, 1821)
Pacheco et al. (2009) mencionaron que esta especie se distribuye en las ecorregiones de selva baja y sabana de palmeras del Perú. Más adelante, un estudio llevado a cabo por Hurtado y Pacheco (2015) en el Bosque Pluvial del Pacífico y Bosque Seco Ecuatorial confirmaron la presencia de la especie para dichas ecorregiones.
Puma yagouaroundi (É. Geoffroy Saint-Hilaire, 1803)
Esta especie fue listada en Pacheco et al. (2009) siguiendo a Wozencraft (2005) quien lo formalizó dentro del género Puma. Johnson et al. (2006), apoyaron esta decisión al encontrar al yaguarundi como especie hermana del puma en una filogenia molecular de Felidae usando secuencias de 30 ADNn y 9 ADNmt. Sin embargo, Agnarsson et al. (2010) utilizando el gen mitocondrial citocromo-b en una filogenia de Carnivora, encontraron que el yaguarundi no era especie hermana del puma y aunque reconocieron que su posición era incierta, optaron por mantener a Herpailurus. Kitchener et al. (2017) provisionalmente optaron también por mantener Herpailurus hasta disponer de más evidencias. Chimento et al. (2014) optaron por una tercera alternativa al incluir Herpailurus como un subgénero de Puma, reconociendo implícitamente que Puma es monofilético. Luego, Zhou et al. (2017) utilizando genes mitocondriales y mitogenomas apoyaron la hipótesis de Johnson et al. (2006) al encontrar al yaguarundi y al puma como especies hermanas. Reconociendo que faltan más evidencias, optamos por mantener temporalmente al yaguarundi en el género Puma por tener, en nuestra opinión, mayor soporte en las filogenias moleculares, siguiendo así la taxonomía usada por Wozencraft (2005) y Pacheco et al. (2009).
Esta especie se encuentra primariamente distribuida en la selva amazónica (Espinosa et al. 2018); sin embargo, García-Olaechea et al. (2019) reportaron su presencia en el lado occidental de los Andes, en el Refugio de Vida Silvestre Laquipampa en Lambayeque mediante cámaras trampa, en bosque montano y en la zona de transición entre bosque montano y bosque seco ecuatorial; confirmando de este modo el registro histórico noroccidental de Grimwood (1969) obtenido en Sunchubamba, La Libertad a 2200 msnm. Se conoce además de un registro adicional para el lado occidental de los Andes en Udima, Cajamarca (Sierra 2019).
Panthera onca (Linnaeus, 1758)
Pacheco et al. (2009) registraron esta especie para las yungas, selva baja, sabana de palmeras, bosque pluvial del Pacífico y bosque seco ecuatorial del Perú. Diversos autores como Pulido y Yockteng (1983) la reportaron en el Parque Nacional Cerros de Amotape, Tumbes, mediante entrevistas; sin embargo, Hurtado y Pacheco (2015) consideraron al jaguar localmente extinto para esa zona del país, dado que no se registró en cámaras-trampa ni fue confirmada en entrevistas.
Lycalopex Burmeister, 1854
La taxonomía de los zorros sudamericanos ha estado en debate por mucho tiempo. Pacheco et al. (2009) listaron tres especies para el Perú bajo el género Lycalopex Burmeister, 1854, siguiendo a Zunino et al. (1995) y Zrzavy y Rikanková (2004). Posteriormente, Ruiz-García et al. (2013a) y Tchaicka et al. (2016) encontraron que vetulus es más divergente que el resto de zorros, por lo que emplearon Lycalopex sólo para vetulus y Pseudalopex para las demás especies. Alternativamente, Tchaicka et al. (2016) sugirieron que todo el cluster de zorros podría estar agrupado bajo el género Lycalopex siguiendo a Wozencraft (2005). Nosotros optamos por una tercera opción, igualmente válida taxonómicamente, usando Lycalopex como un género único con dos subgéneros: Lycalopex Burmeister, 1854 para vetulus y Pseudalopex Burmeister, 1856 para culpaeus, griseus, gymnocercus, sechurae y fulvipes. Esta alternativa se sustenta en la filogenia de Tchaicka et al. (2016) donde ambos linajes son taxones hermanos. Por otro lado, añadimos dos nuevos registros: Lycalopex (Pseudalopex) culpaeus para Ancash (MUSM 5398) y Lycalopex (Pseudalopex) sechurae para Amazonas (MUSM 37047).
Nasua olivacea (Gray, 1985)
Pacheco et al. (2009) registraron por primera vez a esta especie para el Perú como Nasuella olivacea. Helgen et al. (2009) en un análisis filogenético basado en citocromo-b, encontraron que el género Nasua no es monofilético dado que Nasuella fue recuperado como taxon hermano de Nasua narica, por lo que recomendaron clasificar a todos los coatíes dentro del género Nasua. Sin embargo, estos autores optaron por seguir utilizando Nasuella pendiente de futuros estudios con marcadores nucleares y comparaciones morfológicas. Nosotros optamos por seguir la propuesta de incluir a todos los coatíes en Nasua, puesto que recientes estudios encuentran a Nasuella dentro del clado de especies de Nasua (Jaramillo et al. 2019, Ruiz-García et al. 2019b).
Perissodactyla
Tapirus Brisson, 1972
En el Perú están presentes 2 especies de tapir: Tapirus terrestris y T. pinchaque (Pacheco et al. 2009). Recientemente, Cozzuol et al. (2013) describieron una nueva especie de tapir, T. kabomani para la Amazonía de Brasil y Colombia basándose en pruebas morfológicas y moleculares(ADNmt). Según estos autores, T. kabomani es el tapir vivomás pequeño y se diferencia en morfología externa de T. terrestris y en rasgos craneales de T. terrestris y T. pincha-que. Sin embargo, Voss et al. (2014b) cuestionaron estaespecie argumentando que no hay evidencia morfológica,genética y etnográfica suficientemente convincente paraser una nueva especie. Además, Voss et al. (2014b) abrieron la posibilidad de que T. pinchaque no sea más que unmorfotipo de altura o una subespecie de T. terrestris debido al poco soporte en divergencia genética, recomendando ampliar los estudios taxonómicos con genes nuclearesy evaluaciones detalladas de la variación morfológica.
Artiodactyla
Pecari tajacu (Linnaeus, 1758)
Los sajinos del Perú han sido considerados tradicionalmente en una sola especie, Pecari tajacu (Grubb 2005,Pacheco et al. 2009). Después, Groves y Grubb (2011) elevaron a nivel de especie a P. t. crassus (Merriam, 1901),sinonimizando tentativamente y sin mayor argumento a P. t. torvus (Bangs, 1898) con localidad tipo en Santa Marta, Colombia, y P. t. niger (J.A. Allen, 1913) con localidad tipo en Esmeraldas, en el lado occidental de Ecuador; sin embargo, Taber et al. (2011) mantienen a P. t. crassus como subespecie distribuida en México (Sur de San Luis Potosí a Veracruz) y a P. t. niger como subespecie del suroeste de Colombia y oeste de Ecuador. Parisi-Druta et al. (2016) consideraron que P. crassus no es ampliamente aceptado. Tirira et al. (2019) reconocieron a P. tajacu y Tayassu pecari como únicos miembros de la familia Tayassuidae en Ecuador; sin embargo, recientemente Tirira et al. (2020) han reconocido a P. crassus como especieválida para las poblaciones ecuatorianas de occidente siguiendo a Groves y Grubb (2011). Sugerimos que esta decisión es aún prematura, pendiente de demostrar que niger y crassus son un mismo linaje y diferenciables de P. tajacu. En el lado occidental de Perú, Grimwood (1969) reportó que el sajino es conocido en la provincia de Zarumilla, en Tumbes, y en las provincias de Ayabaca y Huancabamba, departamento de Piura. Encarnación & Cook (1998) y Hurtado & Pacheco (2015) confirmaron su presencia en Tumbes. Es urgente la caracterización taxonómica de la población occidental; pendiente de ello es prudente seguir considerando a P. tajacu como una sola especie, al igual que en Pacheco et al. (2009).
Mazama Rafinesque, 1817
Los venados de las Américas han tenido en general una taxonomía basada mayormente en morfología. Gutiérrez et al. (2017) presentaron una filogenia de la tribu Odocoileini usando secuencia de citocromo-b y entre varios resultados notables encontraron que Mazama, Odocoileus, Pudu, M. americana, M. nemorivaga, O. hemionus y O. virginianus no son monofiléticos. M. americana está conformada de dos clados no emparentados que denominaron grupo 1 y grupo 2. El grupo 1, que incluye una muestra de Cajamarca, muy probablemente sea el M. americana sensu stricto, dado que incluye muestras de Guyana Francesa de donde es el ejemplar tipo; y este forma un clado, junto con M. rufina y otras especies de Mazama, más relacionado a Odocoileus que a M. chunyi, M. gouazoubira y M. nemorivaga.
Mazama chunyi fue recuperada como especie hermana de M. gouazoubira, de confirmarse esta relación ambas especies deberían ser asignadas a otro género distinto de Mazama (basado en M. americana, probablemente el grupo 1). Aun si no fueran especies hermanas, ambas necesitarían estar en un género distinto a Mazama porque no comparten un ancestro en común. Los autores anotan también que el nombre genérico Nanelaphus Fitzinger, 1873 estaría disponible para dicho clado. Por otro lado, M. nemorivaga fue recuperada como un linaje aislado no emparentado con los otros linajes de Mazama, porlo que le correspondería un reconocimiento a nivel de género dentro de los Blastocerina. Los autores postulan que el nombre genérico Passalites Gloger, 1841 estaría disponible para ese clado. M. nemorivaga está compuesto también de dos grupos recíprocamente monofiléticos, el primero incluye muestras más cercanas a la localidad tipo en Guayana Francesa y el segundo a muestras de la Amazonía occidental, incluyendo Perú; por lo que es probable que este último grupo necesite un nuevo nombre a nivel de especie. Otra de las propuestas de los autores es restringir el género Mazama, al grupo que incluye M. americana grupo 1 con M. temama (del sureste de Mexico a Panamá), necesitándose también otro nombre genérico para M. rufina. Pendiente de la formalización de estos cambios taxonómicos, idealmente ampliada con una filogenia basada en varios genes y diagnosis morfológica, continuamos considerando conservadoramente las especies peruanas en Mazama.
Odocoileus virginianus (Zimmermann, 1780)
Pacheco et al. (2009) listaron al venado de cola blanca como Odocoileus peruvianus (Gray, 1874) siguiendo el tratamiento provisional de Molina y Molinari (1999), seguido también en Solari et al. (2006). Gutiérrez et al. (2017) recuperaron a O. virginianus como un grupo polifilético, considerando a Odocoileus peruvianus como una subespecie (O. v. peruvianus). Seguimos tentativamente el arreglo propuesto por dichos autores, cuya solución deberá esperar sin duda a un reanálisis sistemático de O. virginianus, O. hemionus y formas relacionadas.
Pudu mephistophiles (de Winton, 1896)
El género Pudu contiene dos especies, P. (Pudu) puda y P. (Pudella) mephistophiles (Hershkovitz 1982), nomenclatura seguida en Pacheco et al. (2009). Recientemente, Gutiérrez et al. (2017) encontraron que Pudu no es monofilético, donde Pudu puda, especie tipo del género, estaría más emparentado con Blastocerina, una subtribu endémica de Sudamérica (que incluye a M. chunyi, M. gouazoubira, M. nemorivaga, Hippocamelus, Blastocerus y Ozotoceros); y todo este clado recién estaría emparentado con P. mephistophiles. De confirmarse estos resultados, Pudella (Thomas, 1913) sería el nombre disponible y tendría que ser elevado al nivel genérico.
Delphinus Linnaeus, 1758
Recientemente, Moura et al. (2020) realizaron un análisis filogenético de la subfamilia Delphininae con énfasis en el género Tursiops soportando su monofilia. Además, también encontraron que los géneros Stenella junto con Delphinus y Lagenodelphis forman un solo clado, por lo que Delphinus tendría prevalencia para todo ese clado por Principio de Prioridad (ICZN, 1999: Art. 23.1). Moura et al. (2020) sugirieron continuar los estudios con más muestras y no dieron recomendaciones taxonómicas; por ello, optamos en continuar con la taxonomía empleada en Pacheco et al. (2009) reconociéndolos temporalmente como géneros diferentes.
Physeter macrocephalus Linnaeus, 1758
Pacheco et al. (2009) listaron esta especie bajo elnombre P. catodon siguiendo a Jefferson et al. (1993).Actualmente, seguimos a Reyes (2009) y a ITIS (2019)para su clasificación taxonómica. En este último, se argumenta que P. macrocephalus es el nombre correcto,sustentado por el Principio del Primer Revisor (ICZN,1999: Art. 24.2, Holthuis, 1987).
Endemismos
El grupo de órdenes tratados aquí, mayormente de mamíferos medianos y grandes tiene pocos endémicos para Perú. Destacan 1 cingulado, 10 didelfimorfos, 9 primates y 2 musarañas (Tabla 1). Asimismo, Yungas y Selva Baja son las ecorregiones con mayor cantidad de especies endémicas (12) (Fig. 2).
Discusión
La diversidad de mamíferos del Perú (excepto Chiroptera y Rodentia) estimada hasta junio 2020 es de 191 especies y está constituida por los siguientes órdenes: Didelphimorphia (46), Paucituberculata (2), Sirenia (1), Pilosa (8), Cingulata (5), Primates (42), Lagomorpha (2), Eulipotyphla (3), Carnivora (33), Perissodactyla (2) y Artiodactyla (47); lo cual significa un incremento de 10 especies con respecto a Pacheco et al. (2009). Si a nuestros resultados agregamos la diversidad de murciélagos (182 especies) y roedores (188 especies) reportada por Pa-checo et al. (2018a) y cambios recientes en esos grupos, la diversidad total de mamíferos para el Perú sería de 569 especies (Tabla 2). Cambios recientes incluyen Lasiurus arequipae, Sturnira giannae, Anoura javieri, Neacomys macedoruizi, N. rosalindae, entre otros (Málaga et al. 2020, Velazco & Patterson 2019, Pacheco et al. 2018b, Sánchez-Vendizú et al. 2018).
Además de los estimados a nivel de país y ecorregión, semejante al formato de Pacheco et al. (2009), este trabajo reporta por primera vez en un solo trabajo la diversidad de mamíferos del Perú por departamentos.
Solo Arequipa (Zeballos-Patrón et al. 2001) y Ucayali (Quintana et al. 2009) tenían un estimado de la diversidad de sus mamíferos, la cual es actualizada aquí. Arequipa incrementa el número de especies (sin contar cetáceos) en 11.1% (de 63 a 70) y Ucayali tiene un incremento de especies en 8.9% (de 192 a 209).
Esperamos que este trabajo se constituya en un referente para incentivar estudios detallados en cada uno de los departamentos.
Pacheco et al. (2009) reportaron 508 especies para el país y estimaron que nuestra diversidad podría estar en el orden de las 600 especies. Recientemente, Pacheco et al. (2018a) reportaron 559 especies para el Perú. Si los descubrimientos se mantienen al ritmo actual (Fig. 3), en menos de una década más estaríamos sobrepasando las 600 especies. En conclusión, el conocimiento de nuestra diversidad de mamíferos es aún incompleto, contradiciendo la percepción de que los grupos de vertebrados ya están bien conocidos.
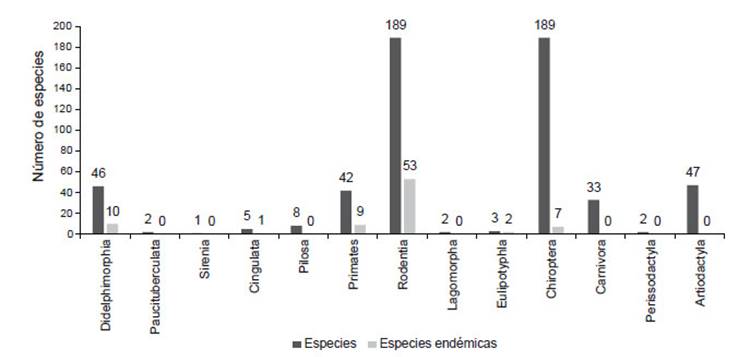
Figura 3 Diversidad y endemismo de los mamíferos del Perú por la categoría taxonómica de orden. Los números arriba de las barras indican la cantidad de especies.
Recientemente, Cossios (2018) estimó que en el Perú hay 92 especies de mamíferos nativos amenazados, el cual es el segundo número más alto de América del Sur y el quinto entre los países megadiversos; y más preocupante aún porque varias especies endémicas están en Peligro Crítico, tales como Cryptotis peruviensis, Melanomys zunigae, Callicebus oenanthe, Lagothrix flavicauda, Mormopterus phrudus o Rhipidomys ochrogaster. Pacheco et al. (2009) sugirieron que las especies endémicas deberían tener una alta prioridad en ser estudiadas y en las políticas de conservación, sin tener en cuenta si son útiles para el desarrollo humano o no; y propusieron como meta que ninguna especie endémica debería estar en situación de amenaza. Actualmente y lamentablemente poco se ha avanzado en este aspecto.












 uBio
uBio