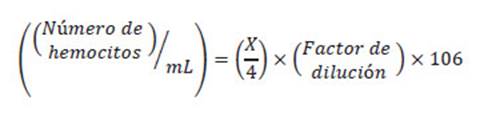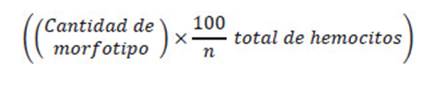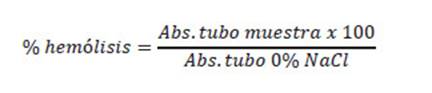Introducción
Anadara tuberculosa (G. B. Sowerby I, 1833) conocida comúnmente como concha negra, concha prieta o pingua es una especie que habita en los ecosistemas de manglares y es importante en las economías locales de las costas del Pacífico tropical americano (Lucero et al. 2012, Panta-Vélez et al. 2020, Vega et al. 2021), ya que de su recolecta depende un número significativo de pescadores artesanales (Rodríguez-Monroy et al. 2020, Quiñónez-Cabeza et al. 2020). Sin embargo, sus densidades han disminuido debido a la sobreexplotación, la pérdida de hábitat por la deforestación de manglares, la contaminación costera producto de la acuicultura de camarones, la agricultura, la minería, el turismo y el desarrollo urbano (Castellanos-Galindo et al. 2011). Por tal motivo, esta especie se encuentra protegida por una veda permanente que restringe la extracción de ejemplares con tallas menores de 45 mm en su axis anteroposterior (Mora et al. 2010, VMAPE 2021).
El estado fisiológico de los animales de cultivo puede ser determinado a través de parámetros hematológicos y bioquímicos de su hemolinfa, los cuales son de importancia crítica en el diagnóstico de diversas condiciones fisiopatológicas (Reshma et al. 2020, Nabi et al. 2022). Las cantidades, distribución, tipos y diámetro de hemocitos son índices sencillos, económicos y de fácil interpretación para estimar la salud animal (Zapata-Vívenes et al. 2012, Loján et al. 2021, Kladchenko et al. 2022). Sin embargo, no existen registros de los valores referenciales normales de la mayoría de los animales y en particular de bivalvos.
Las poblaciones de hemocitos en bivalvos son heterogéneas, y su identificación y caracterización depende de las técnicas citoquímicas utilizadas (De la Ballina et al. 2022). En las distintas especies de bivalvos se han clasificado a los hemocitos en dos, tres o más morfotipos (Cheng 1996, Hine 1999, Donaghy & Volety 2011). Algunos investigadores coinciden en la existencia de tres tipos principales de hemocitos en moluscos bivalvos: granulocitos, hialinocitos y células blásticas. En particular, en el género Anadara (familia Arcidae), además de las células antes nombradas, también se observan glóbulos rojos, los cuales contienen hemoglobina como pigmento respiratorio (Uria-Galicia 1988, Fernández-Arias et al. 1988, Mangum 1992). La hemoglobina le confiere un color rojo oscuro a la hemolinfa, de allí su otro nombre popular "almejas de sangre". En la actualidad, se conoce poco sobre la fisiología de los hemocitos de la familia Arcidae.
En el presente trabajo se estudia la condición fisiológica de individuos reproductores de A. tuberculosa recolectados de una población natural de la isla Corazón (estuario del río Chone, Ecuador), a través de la estimación de parámetros hemocitarios y química sanguínea. Esta información será útil en la valoración del estado de salud de las poblaciones de reproductores silvestres para potenciar su acuicultura y realizar planes de repoblación.
Material y métodos
Colecta de ejemplares. Entre 40 a 50 reproductores maduros de concha prieta, A. tuberculosa, con tallas de 50 - 60 mm (50 - 60 g) fueron colectados manualmente durante la temporada de verano ecuatorial (agosto de 2021) en la localidad de isla Corazón (0°39'08"S, 80°22'12"W), estuario del río Chone, Ecuador. Los organismos fueron transportados al laboratorio de Moluscos de la Universidad Técnica de Manabí, en envases de aislamiento térmico (26 ± 1 °C). Las conchas fueron limpiadas y sumergidas en tanques de 200 L, a una densidad de 1 individuos por cada 10 L durante 24 h con agua de mar filtrada (10 µm) con salinidad 30‰, pH 7.8 ± 0.2 y temperatura 26 ± 1 °C, con aireación constante y moderada.
Extracción de hemolinfa. Fue realizada por punción directa en la región anterior del pie utilizando una jeringa hipodérmica. Se recolectó entre 1 - 1.5 mL de hemolinfa por cada individuo. Para mejorar la extracción se realizó un pequeño orificio en entre las valvas a la altura del pie. La hemolinfa fue colocada en tubos sellados que contenían cristales de ácido etilendiaminotetraacético (EDTA) y mantenidos a 18 °C, en un contenedor isotérmico totalmente oscuro durante 30 min, hasta el momento de los análisis.
Parámetros celulares
Viabilidad y contaje de hemocitos. La viabilidad fue determinada por tinción diferencial con el colorante azul de tripano al 0.4 % (Louis & Siegel 2011). La viabilidad fue expresada como porcentaje de células vivas. El número total de hemocitos por mL fue determinado en una cámara Neubauer y se calculó de acuerdo con la siguiente fórmula:
En el conteo diferencial los hemocitos se tomo en cuenta su forma y tamaño en fresco y se aplicó:
Citometría de flujo. Un mililitro de hemolinfa de cada almeja fue colocado directamente en un tubo de citometría de flujo, a través de un analizador de hematología diferencial de 5 partes (Urit BH-5100). Las poblaciones de hemocitos se discriminaron en histogramas biparamétricos de morfología relativa (dot-plot): la dispersión lateral, que mide la complejidad interna y granulocidad (CI); y la dispersión frontal, que mide el tamaño de las células (TC).
Parámetros químicos
Hemoglobina (Hb). Las concentraciones de Hb fueron estimadas por formación de cianometahemoglobina a través de método colorimétrico (Kampen & Zijlstra 1966).
Proteínas. Las proteínas fueron determinadas por método colorimétrico de Biuret (Gomall et al. 1949). La lectura fue obtenida a una absorbancia a 540 nm frente al blanco. El color es estable 1 h. Se usó como estándar albúmina de suero de bovino (1 mg/mL).
Glucosa. La glucosa total fue determinada por el método de Trinder (1969), acoplada a la reacción oxidación de glucosa a ácido glucónico, por medio de la catálisis de glucosa oxidasa (GOD). El peróxido de hidrógeno (H2O2) producido se detectó mediante un aceptor cromogénico de oxígeno, fenol, 4-aminofenazona, en presencia de la peroxidasa (POD). La reacción fue seguida a 500 nm.
Triglicéridos. Los niveles de triglicéridos fueron determinados a través del Kit GPO-POD (Bucolo et al. 1973). Se realizó una curva de calibración con patrón primario acuoso de palmitato (200 mg/mL). Las muestras fueron leídas a 505 nm.
Lactato deshidrogenasa (LDH, EC 1.1.1.27). La actividad máxima de la LDH fue determinada a 25 °C por seguimiento de la oxidación del Nicotinamina Adenina Dinucléotido reducido (NADH) por piruvato a 340 nm (E= 6.22 mM.cm-1) (Livingstone et al. 1990). La actividad de la LDH se expresó como actividad específica por miligramos de proteínas.
Catalasa (CAT, EC 1.11.1.6). La actividad fue determinada por el descenso de la concentración de H2O2 (ɛ= 40 mmol L-1 cm-1) a una longitud de onda de 240 nm (Aebi 1984). La actividad específica de la CAT del tejido fue expresada como unidad (U) por mg de proteínas.
Estabilidad lisosomal. Una alícuota de suspensión celular (10 µL) se mezclaron e incubaron en tubos de centrífuga con 40 μL de la solución de rojo neutro (22.80 mg/mL disuelto en dimetilsulfóxido-Sigma), en cámara húmeda y oscura (Lowe & Pipe 1994). Cada 15 a 30 min, las láminas fueron observadas en un microscopio óptico a 400 X. Se estimó (en porcentaje) el número de hemocitos sin daños (lisosomas teñidos) y dañados (tinción del citoplasma) hasta dos horas (Zapata-Vívenes et al. 2012).
Fragilidad osmótica. La suspensión hemocitaria de cada individuo (100 µL) se colocaron en 2.5 mL de concentraciones descendentes de NaCl (en unidades de 0.1 g/v %) desde 1.5% hasta 0%, a pH 7.20 a 25 °C. Se mantuvieron durante una hora a temperatura ambiente en cámara oscura. Cada muestra fue centrifugada a 2000 g por 10 min, se tomaron lecturas a 540 nm de los sobrenadantes en un espectrofotómetro UV-Vis Evolution™ 220. El porcentaje de hemólisis se determinó comparándolo con la solución 0% (que corresponde al 100% de hemólisis). El porcentaje de hemólisis se estimó mediante la fórmula de Daci y Lewis (1996):
La concentración media de hemolisis (FO50) fue estimada por método gráfico.
Resultados
Parámetros celulares. En la Tabla 1 se muestran los parámetros hemocitarios (viabilidad, número total y diferencial) de la hemolinfa de los reproductores de A. tuberculosa. La viabilidad de los hemocitos es elevada observándose más del 99%, inclusive pueden mantenerse viables (80 - 90%) en solución fisiológica salina (0.90%) a 25 °C durante 3 días. El número de hemocitos totales por mililitro registró valores entre 1.9 - 2.4 x107 hemocitos/mL, siendo considerado una alta concentración celular en contraste a otros bivalvos. El conteo diferencial mostró dos grupos de células de acuerdo a la granularidad: los granulocitos (≈88%) y los agranulocitos (≈12%). Los hemocitos principalmente distribuidos en orden de abundancia: eritrocitos (87 - 90%), granulocitos traslucidos (1 - 2%), hialinocitos (4 - 8%), amebocitos (1 - 3%) y células blásticas (3 - 6%) (Fig. 1). En eritrocitos se incluyen los subtipos eritrocitos tipo I y II, y hialinocitos subdivididos en grandes y pequeños. Similarmente, en la citometría de flujo se demuestra la presencia de las 3 poblaciones celulares que varían en sus tamaños y cantidad de gránulos, los cuales son granulocitos, hialinocitos y blastocistos (Fig. 2).
Tabla 1 Parámetros hemocitarios de Anadara tuberculosa en reproductores aparentemente sanos (N=8). Los resultados se muestran en media ± desviación estándar (DE). NTH=Número total de hemocitos.
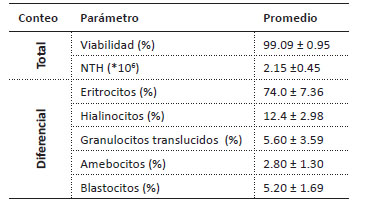
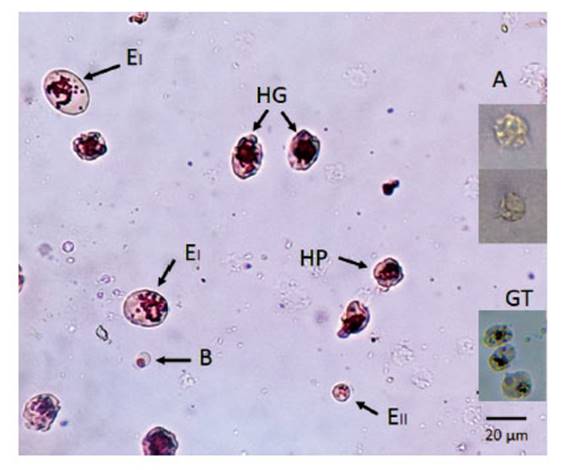
Figura 1 Hemocitos (morfotipos) de Anadara tuberculosa: Eritrocitos (tipo I, EI), Eritrocitos (tipo II, EII), granulocitos translucidos (GT) teñidos con rojo neutro, hialinocitos grandes (HG), hialinocitos pequeños (HP), amebocitos (A) y blastocitos (B).
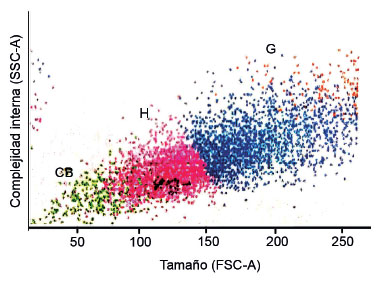
Figura 2 Análisis por citometría de flujo de las poblaciones de hemocitos de Anadara tuberculosa. Tamaño (FSC-A) frente a la complejidad interna (SSC-A). Se distinguen tres tipos de células: granulocitos (G) que incluyen Eritrocitos tipo I, Eritrocitos tipo II, granulocitos traslucidos, hialinocitos (H) grandes y pequeños, y células de tipo blastocitos (CB).
Desestabilización lisosomal y fragilidad osmótica. La retención de rojo neutro fue mayor a los 240 min, lo que indica hemocitos de membranas lisosomales muy estables y un estado saludable (Fig. 3). Fue perceptible un aumento de tamaño de los lisosomas, sin fuga de colorante al citoplasma desde los primeros 15 min hasta los 120 min; mientras durante los 240 min se observó baja proporción de lisosomas aumentados de tamaño (algunos fusionados), pero sin el citoplasma teñido, lo que sugiere que el colorante no ha salido de los lisosomas.
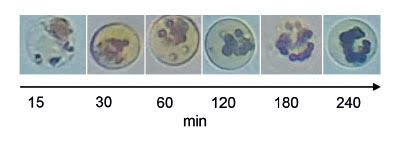
Figura 3 Hemocitos de Anandara tuberculosa mostrando lisosomas reteniendo rojo neutro durante 15, 30, 60, 120, 180 y 240 minutos. Fotomicrografías (400X).
La curva sigmoidal monótona muestra que la fragilidad osmótica media (FO50) ocurre una salinidad de 4.8‰ (Fig. 4). Por debajo de 6.0‰ se evidencia la ruptura de la membrana plasmática de los hemocitos por choque hiposmótico, alcanzado un 22% de lisado hemocitario.
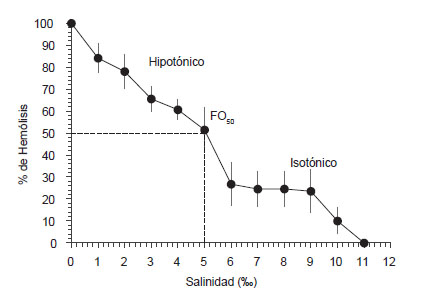
Figura 4 Porcentaje de hemólisis en la almeja Anadara tuberculosa (N=8) en función a la salinidad extracelular (‰). La línea punteada representa la fragilidad osmótica media (FO50).
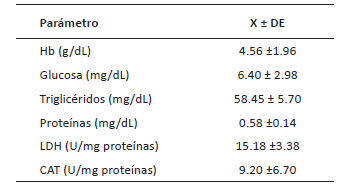
Química sanguínea. Las concentraciones de hemoglobina oscilaron entre 2.7 a 6.6 g/dL. Las moléculas relacionadas con las funciones energéticas tales como glucosa, triglicéridos y proteínas oscilaron entre 3.4 - 10.1 mg/dL; 55.24 - 66.50 mg/dL y de 0.4 a 0.8 g/dL respectivamente. La actividad de las enzimas LDH y catalasa muestran rangos entre 9.00 - 19.5 U/mL y de 3.50 - 20.00 U/mL, respectivamente (Tabla 2).
Discusión
En la hemolinfa de A. tuberculosa se observan cinco morfotipos celulares; eritrocitos, granulocitos traslucidos, hialinocitos, amebocitos y blastocitos, ordenados según su abundancia. La variedad celular confirma la complejidad funcional de este tejido y la posible participación en los mecanismos de tolerancia a las condiciones ambientales del manglar. Al igual que en la mayoría de los bivalvos, los granulocitos son un tipo celular abundante, los cuales contienen en su citoplasma numerosos gránulos ricos en diferentes moléculas de almacenaje, inmunitarias y pigmentos respiratorios (Allan & Raftos 2015, Kladchenko et al. 2020a). Se ha sugerido que la aparición de varios tipos de gránulos intracelulares podrían estar relacionados con los procesos de diferenciación y maduración; concretamente los gránulos inmaduros son basófilos, y que al madurarse se convierten en acidófilos (Chen et al. 1996). De igual manera, los amebocitos comparten funciones defensivas con los eritrocitos y hialinocitos (Kladchenko et al. 2020b).
Comparando los morfotipos celulares encontrados en las especies de Anadara, encontramos que en A. senilis (Gabriel et al. 2011), A. broughtonii (Zhou et al. 2013) y A. antiqueta se han dividido a los hemocitos en células rojas, blancas y trombocitos (Hameed et al. 2018). En A. inaequivalvis fueron denotados como granulocitos, hialinocitos, blastocitos y eritrocitos (Holden et al. 1994; Kim et al. 2020), y agranulocitos, fibrocitos, monocitos, plaquetas (Suganthi et al. 2009). En A. trapecia y A. ovalis se mencionan agranulocitos, amebocitos y eritrocitos (Dang et al. 2013). Recientemente, Kladchenko et al. (2020) consideró separar a los hemocitos de A. kagoshimensis en eritrocitos, amebocitos y células intermediarias. Por otra parte, se conoce que la abundancia relativa de los hemocitos puede ser afectada por los cambios estacionales, la temperatura, el tamaño, el sexo, la madurez, la disponibilidad de alimento y la variabilidad interindividual (Soudant et al. 2004; Matozzo et al. 2010; Kim et al. 2022); aspectos que deben ser investigados en A. tuberculosa.
La retención de rojo neutro en los hemocitos de A. tuberculosa fue mayor a los 240 min, lo que demuestra la estabilidad de sus membranas lisosomales y el óptimo estado de salud de los reproductores. Cualquier alteración de los organelos produciría una reducción en el tiempo de retención del colorante, por ejemplo, se esperaría que células estresadas en los primeros minutos de observación muestren hemocitos con lisosomas fragmentados y citoplasma coloreado (Martínez-Gómez et al. 2015, Zapata-Vívenes et al. 2022). Se conoce que valores menores de 90 min en el tiempo de retención del rojo neutro sugieren que los organismos muestreados están gravemente estresados o probablemente presentan una patología; pero los valores de retención menores de 120 min indicarían estrés, que puede ser compensado (Davies et al. 2012). La poca retención del colorante seria el reflejo del deterioro de la bomba de iones H+ de la membrana (Lowe & Pipe 1994)
La concentración hemolítica media demostró la tolerancia de los hemocitos de A. tuberculosa hasta 5‰ de salinidad durante 2h; resistencia celular que estaría regida por la tonicidad de sus membranas. Este registro evidencia la capacidad de osmorregulación y su adaptación a ambientes con fluctuaciones osmóticas. La fragilidad osmótica puede proporcionar información sobre la relación superficie/volumen de los hemocitos, la cual puede variar bajo cambios de osmorregulación u otras condiciones patológicas, como puede ocurrir en vertebrados (Beutler, 1990; Tritschler 2015). En A. tuberculosa, la FO demuestra la tolerancia celular a los cambios de salinidad en el medio y los trastornos asociados a la resistencia de las membranas hemocitarias. En experimentosrealizados con adultos de A. tuberculosa se ha registrado tolerancias entre 20 y 40‰; sin embargo, en el ecosistema de manglar la salinidad puede descender hasta 10‰ durante las temporadas de lluvias intensas, provocando incremento en mortalidad de semillas y adultos (Nieves et al. 2009, Mendoza et al. 2017). Vega et al. (2021) señalan que el hábitat ideal de A. tuberculosa está influenciado por lo ciclos de mareas y salinidades superiores a 12‰. Posiblemente esta capacidad de los hemocitos pueda garantizar la supervivencia en medios de cambios de salinidad temporales. Kladchenko et al. (2022) reportan tolerancia de salinidades menores a 7‰ en hemocitos de A. kagoshimensis. También, se conoce que la fragilidad de las células sanguíneas puede aumentar por la edad, contaminación y daño celular (Orbach et al. 2017). Entonces, la FO puede llegar a ser una prueba para examinar la tolerancia de bivalvos reproductores a cambios de salinidad de su entorno.
Las concentraciones de hemoglobina demuestran la importancia que tiene esta proteína en la fisiología y supervivencia de la almeja. Los hemocitos de las almejas del género Anadara contienen Hb dimérica (30%) y tetramérica (60%) localizadas en citoplasma o acumulada en gránulos (Bao et al. 2013). En A. tuberculosa, al igual que en vertebrados, la Hb es de tipo A y está contenida en los eritrocitos en elevadas concentraciones, cumpliendo funciones de transporte del oxígeno y otras sustancias desde la hemolinfa a los tejidos. Sin embargo, se ha implicado a la Hb en las respuestas de defensa inmunitaria contra infección bacteriana (Bao et al. 2011), reflejando un alto grado de especialización y adaptación a una mayor gama de condiciones. Las concentraciones de Hb pueden variar de acuerdo con ciertas condiciones ambientales de baja disponibilidad de oxígeno (Kladchenko et al. 2020; Wang et al. 2021). Adicionalmente, el hábito de A. tuberculosa de vivir enterrada en el fango y condicionados a los cambios de mareas propicia el mantenimiento de reservas de biomoléculas tales como carbohidratos, lípidos y proteínas en sus tejidos blandos, para luego ser transferidos y mantenerlos disponibles en la hemolinfa, con la finalidad de suplir los requerimientos energéticos de la reproducción y crecimiento (Haider et al. 2020). Por lo tanto, los análisis de química sanguínea indicarían la disponibilidad de los combustibles energéticos en la hemolinfa y la condición fisiológica de los reproductores.
La actividad de las enzimas LDH y catalasa dan referencia a la capacidad anaeróbica y aeróbica que posee A. tuberculosa para tolerar los cambios ambientales en el ecosistema donde habita, particularmente los cambios de marea. Durante la bajamar, la LDH citoplasmática es preponderante para la generación continua de energía bajo condiciones anaeróbicas provocada por una hipoxia inducida (Farhana et al. 2022). La liberación de LDH puede señalar la perdida de la integridad de la membrana celular bajo procesos de apoptosis, necrosis u otras formas de deterioro (Chan, 2013; Kamiloglu et al. 2020). Sin embargo, durante la pleamar la entrada de oxígeno a los tejidos estimula a la reactivación de producción de energía a través las rutas aeróbicas mitocondriales, lo puede conllevar a la formación de especies reactivas del oxígeno (ROS) (Freire et al.2011; Donaghy et al.2015; Yin et al. 2017), particularmente el peróxido de hidrogeno (H2O2). El H2O2 es un potente oxiradical el cual puede ser removido rápidamente por la acción de la catalasa (Soldatov et al. 2013). La actividad de catalasa en la hemolinfa demuestra la capacidad de protección antioxidante en el continuo cambio de condiciones aeróbicas durante la disponibilidad de oxígeno de la pleamar a condiciones anaeróbicas durante en la baja mar (hipoxia), garantizando la supervivencia de las almejas durante los cambios de mareas.
Se propone el uso de los parámetros hemocitarios y la química sanguínea como marcadores de salud en reproductores de A. tuberculosa, los cuales pueden servir como referencia del estado fisiológico en individuos de vida libre, cultivados, mantenidos en cautiverio y/o afectados por estrés ambiental.












 uBio
uBio