INTRODUCCIÓN
La pancreatitis aguda es la inflamación del páncreas que se caracteriza por dolor abdominal epigástrico intenso y persistente con niveles elevados de enzimas pancreáticas en la sangre (1, 2). La pancreatitis aguda tiene una incidencia anual que varía de 4,9 a 73,4 casos por 100 000 habitantes a nivel mundial 3 y es la enfermedad gastrointestinal más común de los pacientes que se hospitalizan en los Estados Unidos (más de 270 mil casos, que generan costos anuales de hasta 2,6 mil millones de dólares) (4, 5). En Perú, se ha registrado una incidencia anual de pancreatitis aguda de 28 casos por cada 100 mil habitantes durante el 2009 6). La causa más común de la pancreatitis aguda es la litiasis biliar (75%) 7), seguida del alcoholismo 8).
La severidad de la pancreatitis aguda debe evaluarse mediante un examen clínico identificando pérdidas tempranas de líquidos, insuficiencia orgánica (cardiovascular, respiratoria o renal) o síndrome de respuesta inflamatoria sistémica. Según la clasificación de Atlanta 9), la pancreatitis se puede categorizar en leve, moderada-severa o severa 10-12 (Tabla 1). Por otro lado, el pronóstico de severidad en la pancreatitis aguda se basa en datos clínicos, laboratoriales y/o radiológicos 13-17), los cuales se han agrupado en sistemas de puntuación útiles para determinar el índice de severidad en pancreatitis aguda como el “Bedside Index for Severity in Acute Pancreatitis” (BISAP) (18) y el índice de severidad tomográfica 19 (Tabla 1).
La evaluación y el manejo adecuados de los casos de pancreatitis aguda pueden reducir la mortalidad y las complicaciones de esta condición. Por ello, el Seguro Social de Salud del Perú (EsSalud) priorizó la realización de la presente guía de práctica clínica (GPC) para establecer lineamientos basados en evidencia para gestionar de la mejor manera los procesos y procedimientos asistenciales de la presente condición. Esta GPC fue realizada por la Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) de EsSalud.
METODOLOGÍA
El procedimiento seguido para la elaboración de la presente GPC está detallado en su versión “inextenso”, la cual puede descargarse de la página web del IETSI de EsSalud (http://www.essalud.gob.pe/ietsi/guias_pract_clini.html).
En resumen, se aplicó la siguiente metodología:
Conformación del grupo elaborador de la guía (GEG)
Se conformó un GEG, que incluyó metodólogos, médicos gastroenterólogos, médicos internistas y médicos cirujanos generales.
Formulación de preguntas
En concordancia con los objetivos y alcances de esta GPC, el GEG formuló 7 preguntas clínicas (Tabla 2), cada una de las cuales pudo tener una o más preguntas PICO (Population, Intervention, Comparator, Outcome). A su vez, cada pregunta PICO pudo tener uno o más desenlaces (o outcomes) de interés.
Búsqueda y selección de la evidencia
Para cada pregunta PICO, durante el periodo marzo - octubre del 2022, se buscaron revisiones sistemáticas (RS) publicadas como artículos científicos (mediante búsquedas sistemáticas en PubMed y Central) o realizadas como parte de una GPC previa (mediante una búsqueda sistemática de GPC). Cuando se encontraron RS de calidad aceptable según el instrumento A Measurement Tool to Assess Systematic Reviews-II (AMSTAR II) modificado por EsSalud 21), se escogió una para cada desenlace de interés, la cual fue actualizada cuando el GEG lo consideró necesario. Cuando no se encontró ninguna RS de calidad aceptable, se realizó una búsqueda de novo de estudios primarios.
Evaluación de la certeza de la evidencia y cálculo de efectos absolutos
Para cada desenlace de cada pregunta PICO, se evaluó la certeza de la evidencia siguiendo la metodología de Grading of Recommendations Assessment, Development, and Evaluation (GRADE) 22).
Asimismo, se calcularon los efectos absolutos para cada desenlace (diferencias de riesgos para desenlaces dicotómicos, o diferencias de medias para desenlaces numéricos). Para el cálculo de las diferencias de riesgos, se consideró que la incidencia del desenlace en el grupo control fue la reportada por el cuerpo de la evidencia, salvo se mencione lo contrario para alguna pregunta.
Formulación de las recomendaciones
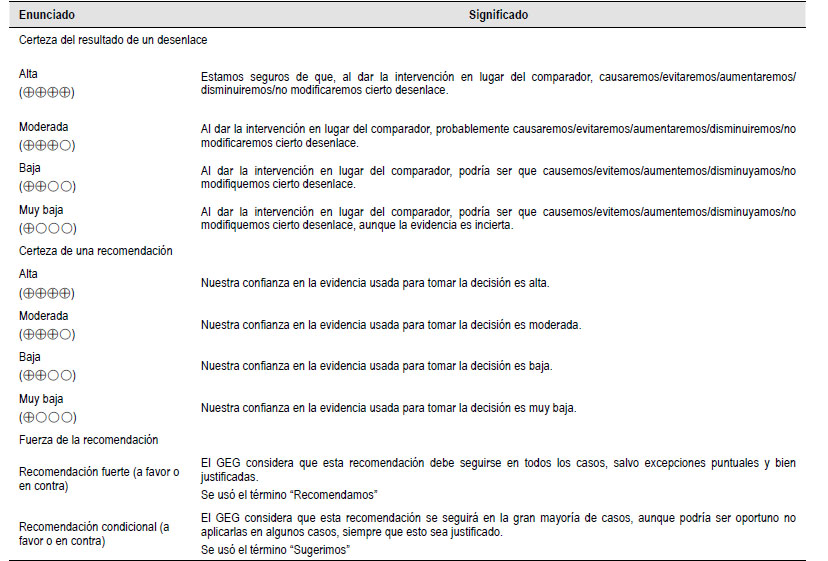
El GEG revisó la evidencia seleccionada para cada pregunta clínica en reuniones periódicas, usando los marcos Evidence to Decision (EtD) de la metodología GRADE (23, 24). Para ello, tuvo en consideración: 1) Beneficios y daños de las opciones, 2) Valores y preferencias de los pacientes, 3) Aceptabilidad por parte de los profesionales de salud y pacientes, 4) Equidad, 5) Factibilidad de las opciones en EsSalud, y 6) Uso de recursos. Luego de discutir estos criterios para cada pregunta, el GEG, por consenso o por mayoría simple, formuló cada recomendación, asignándole una fuerza (fuerte o condicional) y una certeza de la evidencia (alta, moderada, baja, o muy baja) (Tabla 3).
Formulación de buenas prácticas clínicas
El GEG formuló buenas prácticas clínicas (BPC), usualmente en base a su experiencia clínica o a adopciones de otras guías o protocolos (Tabla 2).
Revisión por expertos externos
La presente GPC fue revisada en reuniones con especialistas representantes de otras instituciones, tomadores de decisiones de EsSalud, y pacientes. Asimismo, su versión extensa fue enviada por vía electrónica a expertos externos para su revisión (mencionados en la sección de agradecimientos). Cuando fue pertinente, el GEG tuvo en cuenta los resultados de estas revisiones para modificar las recomendaciones finales.
Aprobación de la GPC
La presente GPC fue aprobada para su uso en EsSalud con la resolución de IETSI N° 105-ESSALUD-2022.
Actualización de la GPC
La presente GPC tiene una vigencia de cinco años. Al acercarse al fin de este período, se procederá a realizar una RS de la literatura para su actualización, luego de la cual se decidirá si se actualiza la presente GPC o se procede a realizar una nueva versión.
Desarrollo de recomendaciones
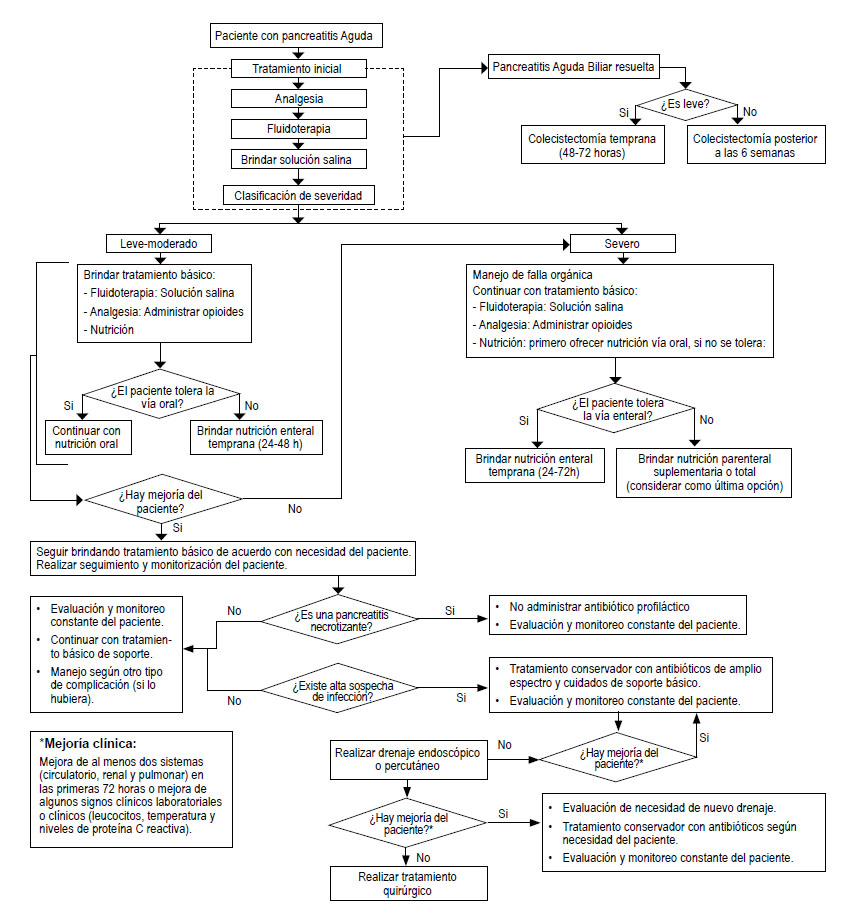
La presente GPC abordó 7 preguntas clínicas, y se formularon 8 recomendaciones (1 fuerte y 7 condicionales), 13 BPC, y 1 flujograma (Tabla 2, Figura 1).
A continuación, se expondrán las recomendaciones para cada pregunta clínica, así como un resumen del razonamiento seguido para llegar a cada recomendación. No se incluyó la justificación de las BPC adicionales (que no respondían directamente a la pregunta clínica planteada), la cual se puede leer en el documento inextenso.
Pregunta 1. El pacientes con pancreatitis aguda, ¿qué tipo de fluido intravenoso debería usarse para la reanimación?
La fluidoterapia juega un rol crítico en la evolución de la pancreatitis aguda durante las primeras horas al mantener la euvolemia 25). Los cristaloides (como la solución salina normal y al lactato de ringer) son el tipo de fluidoterapia más utilizado en la pancreatitis aguda. El tipo de fluido intravenoso más utilizado es la solución salina normal. Sin embargo, se ha planteado que el lactato de Ringer podría tener ventajas al reducir el riesgo de acidosis hiperclorémica e inflamación pancreática 25-27). Por este motivo, el GEG planteó esta pregunta clínica.
Evidencia: Encontramos dos RS publicadas (25, 28). Para la mayoría de los desenlaces elegimos la de Guzmán 2021 25) por ser la de mayor calidad. Para el desenlace de complicaciones locales elegimos a la RS de Zhou 2021 28) por ser la única que abordó dicho desenlace.
Beneficios: Si brindamos lactato de Ringer a 1000 personas en lugar de brindar la solución salina normal, posiblemente evitemos 92 ingresos a la unidad de cuidados intensivos (IC 95%: -127 a -17), posiblemente evitemos 126 casos de complicaciones locales de pancreatitis (IC 95%: -186 a -23) y posiblemente disminuyamos en promedio 1.10 días de duración de estancia hospitalaria (IC 95%: -0,28 a -1,92), aunque la evidencia es incierta. En contraste, posiblemente no modificaremos la mortalidad y posiblemente no modificaremos la falla orgánica (a las 24h, 48h y 72h), aunque la evidencia es incierta para este último desenlace.
Daños: Al brindar lactato de Ringer en lugar de solución salina, no se encontró ningún daño relevante.
Recomendación: El GEG consideró que, según la evidencia presentada, los beneficios de brindar lactato de Ringer en lugar de la solución salina se consideraron pequeños (puesto que el tamaño de los efectos en el ingreso a la unidad de cuidados intensivos, estancia hospitalaria y complicaciones locales posiblemente no sean clínicamente relevantes) y los daños se consideraron triviales. Por este motivo, el GEG decidió emitir una recomendación a favor del uso de la solución salina normal. Considerando que la certeza general de la evidencia fue muy baja, esta recomendación fue condicional.
Pregunta 2. En pacientes con pancreatitis aguda, ¿cuál sería el mejor momento para iniciar la nutrición enteral?
La nutrición enteral para los pacientes con pancreatitis aguda estimula la actividad metabólica del intestino para preservar la integridad de la mucosa intestinal, preservar el metabolismo de las proteínas y reducir la respuesta de las citoquinas. Existe controversia respecto al momento óptimo para iniciar la nutrición enteral (temprana versus tardía) (29, 30). Por ello, el GEG decidió priorizar esta pregunta clínica para que sea desarrollada, dividiéndola en dos poblaciones de pancreatitis aguda: no severa y severa.
Población 1: pancreatitis aguda no severa
Evidencia: Encontramos cinco RS publicadas 29-33), elegimos la de Qi 2018 30 por ser la de mayor calidad y más reciente.
Beneficios: Si brindamos nutrición enteral temprana en lugar de brindar la nutrición enteral tardía, posiblemente no modificaremos el desarrollo de infecciones pancreáticas, aunque la evidencia es incierta. A pesar de que los resultados no fueron estadísticamente significativos, si brindamos nutrición enteral temprana en lugar de brindar la nutrición enteral tardía, posiblemente evitemos 55 muertes (IC 95%: -90 a 19), posiblemente evitemos 137 casos de falla multiorgánica (IC 95%: -219 a 7), aunque la evidencia es incierta.
Recomendación: El GEG consideró que, según la evidencia presentada, los benecios de brindar nutrición enteral temprana en lugar de la nutrición enteral tardía se consideraron pequeños (dado que se encontró cierto efecto protector en los desenlaces críticos como mortalidad y falla multiorgánica, aunque este no fue estadísticamente signicativo) y los daños se consideraron triviales. Por ello, consideró emitir una recomendación a favor del uso de la nutrición enteral temprana. Considerando que la certeza general de la evidencia fue muy baja, esta recomendación fue condicional.
Población 2: pancreatitis aguda severa
Evidencia: Encontramos cinco RS publicadas (29-33), elegimos la de Qi 2018 (30) por ser la de mayor calidad y más reciente.
Beneficios: Si brindamos la nutrición enteral temprana a 1000 personas en lugar de brindar la nutrición enteral tardía posiblemente evitemos 295 casos de falla multiorgánica (IC 95%: -383 a -17), posiblemente evitemos 109 casos de infecciones pancreáticas (IC 95%: -159 a -27), aunque la evidencia es incierta. En contraste, posiblemente no modificaremos la mortalidad, aunque la evidencia es incierta.
Daños: Si brindamos nutrición enteral en lugar de brindar la nutrición enteral tardía, posiblemente esto no tenga efecto en los eventos adversos, aunque la evidencia es incierta.
Recomendación: El GEG consideró que, según la evidencia presentada los beneficios de brindar nutrición enteral temprana en lugar de la nutrición enteral tardía se consideraron moderados y los daños se consideraron triviales. Por ello, se emitió una recomendación a favor del uso de la nutrición enteral temprana. Considerando que la certeza general de la evidencia fue muy baja, esta recomendación fue condicional.
Pregunta 3. En pacientes con pancreatitis aguda, ¿cuál sería el analgésico de elección?
El manejo del dolor abdominal es una de las prioridades para el manejo temprano de los pacientes con pancreatitis aguda (34). Para el manejo del dolor se pueden prescribir fármacos como los opioides o antiinflamatorios no esteroides (35, 36). Los opioides han sido prescritos con mayor frecuencia; sin embargo, existe controversia respecto a su eficacia y seguridad en comparación con otros fármacos en los pacientes con pancreatitis aguda. Por este motivo, el GEG planteó esta pregunta clínica.
Evidencia: Encontramos dos RS publicadas (34, 37). Para la mayoría de los desenlaces elegimos la de Thavanesan 2022 37 por ser la de mayor calidad. Para el desenlace de necesidad de analgesia para rescate, elegimos a la RS de Cai 2021 34 por ser la única que abordó dicho desenlace.
Beneficios: Si brindamos opioides a 1000 personas en lugar de no brindarlos posiblemente evitemos 326 casos de necesidad de analgesia rescate (IC 95%: -501 a -37), aunque la evidencia es incierta. En contraste, posiblemente no modificaremos el nivel de intensidad de dolor, presencia de complicaciones y duración de estancia hospitalaria, aunque la evidencia es incierta.
Daños: Si administramos opioides en lugar de no administrarlos, posiblemente esto no tenga efecto en los eventos adversos (nauseas o vómitos, cefalea, constipación, disnea, entre otros), aunque la evidencia es incierta.
Recomendación: En pacientes con pancreatitis aguda, los beneficios de administrar opioides en lugar de no administrarlos se consideraron pequeños y los daños se consideraron triviales. Por ello, se emitió una recomendación a favor de la administración de los opioides. Debido a que la certeza general de la evidencia fue muy baja, esta recomendación fue condicional.
Pregunta 4: En pacientes con pancreatitis aguda severa, ¿se debería usar nutrición enteral o parenteral?
La nutrición parenteral consiste en brindar nutrientes por vía exógena, lo que evitaría agravar el estado inflamatorio producto de la sobreestimulación del páncreas y liberación de enzimas 38). Sin embargo, es un procedimiento invasivo que puede dar lugar a sepsis por infección del catéter o de origen intestinal al promover la atrofia intestinal y traslocación bacteriana 39). Por otro lado, la nutrición enteral se realiza a través de la colocación de una sonda nasoyeyunal o nasogástrica para brindar nutrientes al tracto gastrointestinal. Esto permitiría mantener la integridad y funcionamiento del tracto gastrointestinal reduciendo el riesgo de sepsis de este origen o de infecciones 40). Debido a que se requiere conocer el balance entre beneficios y daños de ambas vías de nutrición, se planteó esta pregunta.
Evidencia: Encontramos 10 RS publicadas 41-50), elegimos la de Al-Omran 2010 48 por ser la de mayor calidad. Para los desenlaces de mortalidad y falla multiorgánica, se actualizó la RS de Al-Omran 2010 48 y se adicionaron 4 ECA: Doley 2009 51), Wu 2010 52), Wang 2012 53), y Stimac 2016 54). Para el desenlace de estancia hospitalaria, se actualizó la RS de Al-Omran 2010 48 y se adicionó 1 ECA: Doley 2009(51). Para el desenlace de cualquier complicación infecciosa, se actualizó la RS de Al-Omran 2010 48 y se adicionó 1 ECA: Wu 2010 52).
Beneficios: Si brindamos la nutrición enteral a 1000 personas en lugar de brindar la nutrición parenteral posiblemente evitemos 129 muertes (IC 95%: -179 a -33), posiblemente evitemos 179 casos de falla multiorgánica (IC 95%: -261 a -51) y posiblemente evitemos 298 casos de cualquier complicación infecciosa (IC 95%: -351 a -213), aunque la evidencia es incierta. En contraste, posiblemente no modificaremos los días de estancia hospitalaria, aunque la evidencia es incierta.
Daños: Al brindar nutrición enteral en lugar de la parenteral, no se encontró ningún daño relevante.
Recomendación: En pacientes con pancreatitis aguda, los beneficios de brindar nutrición enteral en lugar de la nutrición parenteral se consideraron grandes (puesto que los tamaños de los efectos para la disminución de casos de mortalidad, falla multiorgánica y presentar cualquier complicación infecciosa fueron importantes) y los daños se consideraron triviales. Por ello, se emitió una recomendación a favor del uso de la nutrición enteral como vía de elección inicial. Si bien la certeza general de evidencia fue muy baja, la magnitud de los potenciales beneficios orienta a iniciar la nutrición por vía enteral. Además, los costos serían menores y sería la vía más aceptable tanto por el personal de salud como por los pacientes. Por ello, esta recomendación fue fuerte.
Pregunta 5: En personas con pancreatitis aguda severa necrotizante, ¿se debería administrar antibióticos profilácticos?
Los pacientes con pancreatitis aguda necrotizante tienen riesgo de presentar infección, falla orgánica y muerte 55). En base a ello, se ha propuesto el uso de antibióticos administrados de forma profiláctica. Sin embargo, se desconoce los beneficios y daños de esta intervención (56, 57). Por este motivo, el GEG planteó esta pregunta clínica.
Evidencia: Encontramos dos RS publicadas (58, 59). Para la mayoría de los desenlaces elegimos la de Moggia 2017 59 por ser la de mayor calidad y ser más reciente. Para el desenlace de infecciones no pancreáticas, elegimos a la RS de Ding 2020 58 por ser la única que abordó dicho desenlace.
Beneficios: Si administramos los antibióticos profilácticos a 1000 personas en lugar de no administrarlos, posiblemente evitemos 105 casos de infección no pancreática (IC 95%: -159 a -37), aunque la evidencia es incierta. Sin embargo, estos resultados pudieron estar sobreestimados debido que se realizó un modelo de efectos fijos a pesar de la moderada heterogeneidad. Además, en sus análisis por subgrupos según la dosis y tipo de antibiótico no encontraron alguna diferencia significativa. En contraste, posiblemente no modificaremos la mortalidad, falla orgánica y necrosis pancreática infectada, aunque la evidencia es incierta.
Daños: Si administramos los antibióticos profilácticos en lugar de no administrarlos posiblemente esto no tenga efecto en los eventos adversos, aunque la evidencia es incierta.
Recomendación: En pacientes con pancreatitis aguda severa necrotizante, los beneficios de administrar los antibióticos profilácticos en lugar de no administrarlos se consideraron triviales (puesto que el tamaño de los efectos para las infecciones no pancreáticas no se consideró importante dado que este resultado pudo estar sobreestimado y el tamaño de los efectos para el resto de los desenlaces fueron inciertos) y los daños se consideraron triviales. Adicionalmente, los gastos para la administración de los antibióticos profilácticos fueron moderados. Por ello, se emitió una recomendación en contra del uso de la intervención. Debido a que la certeza general de la evidencia fue muy baja, esta recomendación fue condicional.
Pregunta 6: En pacientes con pancreatitis aguda severa necrotizante infectada ¿se debería brindar solo antibiótico, antibiótico con drenaje, o antibiótico con cirugía?
El enfoque tradicional para el tratamiento de la pancreatitis necrotizante infectada es la necrosectomía abierta para eliminar completamente el tejido necrótico infectado. Sin embargo, esto podría conllevar a un aumento de la incidencia de complicaciones e incluso la muerte 60). En base a ello, surge como alternativa el uso de técnicas menos invasivas con un enfoque escalonado, que inicia con la administración de los antibióticos y en casos de no mejoría el tratamiento va escalando hasta la realización de drenaje y necrosectomías (61, 62). Sin embargo, se desconoce cual sería la alternativa más óptima para el manejo de los pacientes con pancreatitis necrotizante infectada. Por este motivo, el GEG planteó esta pregunta clínica.
Evidencia: No se encontraron comparaciones que hayan evaluado estas tres intervenciones. Por lo tanto, se buscaron estudios que comparen alguna de las intervenciones de interés. De esta manera, encontramos 6 RS publicadas 61-66 y 1 ECA 60). Se seleccionó la RS de Ricci 2021 62), RS de Haney 2019 61 y el ECA de Van Sanvoort 2010 60 por ser las de mayor calidad y las más recientes. El ECA de Van Sanvoort 2010 (60) no se pudo metaanalizar con los ECA de las RS seleccionadas (Bakker 2012 67), Van Brunschot 2018 68 y Bang 2019 69)) debido a que los estudios evaluaron diferentes intervenciones. Tratamiento escalonado endoscópico versus el tratamiento escalonado quirúrgico o necrosectomía abierta:
Beneficios: Si brindamos el tratamiento endoscópico a 1000 personas en lugar del tratamiento quirúrgico, posiblemente evitemos 98 casos de falla orgánica múltiple (IC 95%: -133 a -3), posiblemente disminuyamos en promedio 6.46 días de estancia hospitalaria (IC 95%: -12.55 a -0.36), y posiblemente evitemos 281 casos de fístula pancreática (IC 95%: -308 a -205), aunque la evidencia es incierta. En contraste, posiblemente no modificaremos la mortalidad y duración de estancia en la unidad de cuidados intensivos, aunque la evidencia es incierta.
Daños: Si brindamos el tratamiento endoscópico en lugar del tratamiento quirúrgico no modificaremos el sangrado intraabdominal postoperatorio, aunque la evidencia es incierta. Tratamiento escalonado versus necrosectomía abierta:
Beneficios: Si brindamos el tratamiento escalonado a 1000 personas en lugar de la necrosectomía abierta posiblemente evitemos 292 casos de falla orgánica múltiple (IC 95%: -352 a -128), aunque la evidencia es incierta. En contraste, posiblemente no modificaremos la mortalidad, duración de estancia hospitalaria y estancia en la UCI, aunque la evidencia es incierta.
Daños: Si brindamos el tratamiento escalonado en lugar de la necrosectomía abierta posiblemente no modificaremos la aparición de fístulas pancreáticas, aunque la evidencia es incierta.
Recomendación: A pesar de que el tratamiento escalonado endoscópico muestra ventajas con respecto al tratamiento escalonado quirúrgico o necrosectomía abierta, debido a que el tratamiento endoscópico no es factible en la mayoría de establecimiento de EsSalud se decidió emitir una recomendación sobre el tratamiento escalonado comparado con la necrosectomía abierta.
En pacientes con pancreatitis aguda severa necrotizante infectada, los beneficios de realizar un tratamiento escalonado en lugar de la necrosectomía abierta se consideraron moderados (puesto que el tamaño de los efectos para la disminución de casos de falla orgánica y estancia hospitalaria se consideraron importantes) y los daños se consideraron triviales. Por este motivo, el GEG decidió emitir una recomendación a favor de realizar el tratamiento escalonado. Considerando que la certeza general de la evidencia fue muy baja, esta recomendación fue considerada como condicional.
Pregunta 7: En pacientes con pancreatitis aguda biliar resuelta, ¿cuál es el momento más adecuado para realizar la colecistectomía?
Los pacientes con pancreatitis aguda biliar deben someterse a la extracción quirúrgica de la vesícula biliar (colecistectomía). La colecistectomía temprana podría prevenir la presencia de complicaciones dependiendo de la severidad del cuadro, pero se desconoce los beneficios y daños al compararlo con la colecistectomía tardía. Por este motivo, el GEG planteó esta pregunta clínica.
Evidencia: Encontramos dos RS publicadas (70, 71), elegimos la de Prasanth 2022 70 por ser la de mayor calidad y la más reciente.
Beneficios: Si brindamos la colecistectomía temprana a 1000 personas en lugar de brindarles la colecistectomía tardía, posiblemente evitemos 91 casos de readmisión (IC 95%: -124 a -6), posiblemente disminuyamos 2,56 días de estancia hospitalaria (-3,59 a -1,52), posiblemente evitemos 60 casos de pancreatitis recurrente (IC 95%: -69 a -37), posiblemente evitemos 273 casos de eventos biliares recurrentes (IC 95%: -288 a +245) y posiblemente evitemos 25 casos de colecistitis (IC 95%: -29 a -2), aunque la evidencia es incierta.
Daños: Si brindamos la colecistectomía temprana en lugar de brindar la colecistectomía tardía posiblemente no modificaremos las complicaciones quirúrgicas, la conversión (laparoscópica a abierta) y la necesidad de intervención endoscópica preoperatoria (CPRE), aunque la evidencia es incierta.
Recomendación: En pacientes con pancreatitis aguda biliar leve resuelta, los beneficios de realizar brindar colecistectomía temprana en lugar de la tardía se consideraron moderados y los daños se consideraron triviales. Por ello, se emitió una recomendación a favor de realizar la colecistectomía temprana en lugar de la tardía. Debido a que la certeza general de la evidencia fue muy baja, esta recomendación fue condicional.
Contribuciones de autoría: Todos los autores participaron en la realización de la guía. Lesly Chávez-Rimache, Sergio Goicochea-Lugo, Víctor Velásquez-Rimachi y Jonathan Mejía-Santiváñez realizaron las búsquedas sistemáticas, la evaluación de calidad de los estudios y de la certeza de la evidencia para cada pregunta. Lesly Chávez-Rimache redactó la primera versión del artículo. Todos los autores participaron en la discusión de los estudios encontrados y la formulación de las recomendaciones y las buenas prácticas clínicas. Todos los autores revisaron y aprobaron la versión final del artículo.