INTRODUCCIÓN
La anisakidosis es una zoonosis parasitaria causada por la ingestión accidental de larvas del estadio L3 de nematodos Anisakidae, Anisakis simplex s.l. (tipo I), A. physeteris s.l. (tipo II), Pseudoterranova decipiens s.l. (Phocanema d.), Contracaecum osculatum s.l. e Hysterothylacium sp. 1. Las larvas se encuentran enquistadas sobre la superficie visceral o tejido muscular de peces marinos que son los hospederos intermediarios y/o paraténicos. El hombre es un hospedero accidental, se infecta con la larva L3 al ingerir pescado marinado insuficientemente cocido 2. Los hospederos definitivos de las formas adultas de Anisakis sp., son mamíferos marinos, principalmente cetáceos 2. En Perú, se ha descrito Anisakis sp. en los delfines, lobo marino y el cachalote; C. osculatum en el lobo fino y Contracaecum spp. en aves marinas 3.
Desde que se publicó el primer caso humano de lesión gastrointestinal causada por Anisakis, actualmente, se han reportado más de 20 000 casos de anisakiasis en todo el mundo 5,6, la mayoría reportados en Japón 2. España es el segundo país que reporta más casos de anisakiasis a nivel global, estimándose entre 7700 a 8320 casos anuales debido a la costumbre del consumo de anchoas marinadas 4. Se ha sugerido que la anisakiasis es una zoonosis parasitaria emergente, debido a un incremento de casos en las dos últimas décadas 4,6,7.
Las larvas L3 de Anisakis, principalmente A. simplex s.l., al ingresar al estómago o intestino, origina lesiones granulomatosas o abscesos que se caracterizan por necrosis y hemorragia con infiltración eosinofílica masiva, fiebre y diarrea 1. También producen una reacción alérgica inducida por ciertos antígenos del parásito, que se presenta en algunas personas luego de la ingesta de pescado o cefalópodos, caracterizada por cuadros de urticaria, angioedema o respuesta anafiláctica, al que se le ha denominado anisakidosis gastroalérgica 2.
En el Perú, no se considera un problema de salud pública porque se desconoce la prevalencia real de la infección, a pesar que las larvas de Anisakis se han reportado en más de 20 especies de peces marinos y en Dosidicus gigas "calamar gigante" 8; sin embargo, se han reportado casos humanos comprobados de anisakidosis 9,uno por endoscopía por larva de Anisakis sp. adherida a la mucosa gástrica y dos casos de personas que eliminaron la larva de P. decipiens por vía oral 10. Durante el fenómeno El Niño 1997-1998 se describieron probables casos de anisakidosis; posteriormente, se reportó otro caso de infección por P. decipiens 3) y un probable brote en 5 miembros de una familia en Lima, que presentaron síntomas compatibles con anisakiasis aguda gástrica después de consumir cebiche de "perico" Coryphaena hippurus 11.
El hombre no es el hospedero final natural de Anisakis; por lo tanto, estas larvas pueden ser expulsadas o penetrar en la mucosa gástrica donde muere y se descompone en los tejidos 1. En este último caso es importante el antígeno somático porque distingue entre 30 a 40 bandas 2. Asimismo, en infección experimental en ratones, los niveles de anticuerpos principalmente IgM e IgG contra antígenos somáticos pueden permanecer hasta 42 días después de la infección e inclusive mantenerse en niveles altos por un largo período 2.
Existe escasa información referente al patrón proteico de larvas de Anisakis tipo I, tipo II y C. osculatum; sin embargo, hay reportes sobre el perfil antigénico de la larva de Anisakis tipo I, particularmente con la Ag de excreción-secreción (E/S) utilizado para evaluar la seroprevalencia 12, pero no de Anisakis tipo II y C. osculatum.
Identificar, caracterizar y determinar las proteínas antigénicas de los anisákidos es de utilidad para la búsqueda de anticuerpos en pacientes con problemas gástricos, después de la ingesta de pescado o de etiología desconocida, ya que brinda una potencial herramienta específica importante para el diagnóstico de la anisakiasis.
Por ello, el objetivo de nuestro estudio fue caracterizar el patrón proteico y perfil antigénico de las larvas de Anisakis tipo I, Anisakis tipo II y C. osculatum de importancia médica aisladas de peces comerciales de la costa peruana.
MÉTODOS
Obtención de la larva infectante (L3)
Se aislaron 146 larvas de Anisakis tipo I (figura 1) del peritoneo visceral de 30 especímenes de Trachurus picturatus mur-phyi "jurel", 75 larvas de Anisakis tipo II (figura 2) de 50 ejemplares de Scomber japonicus peruanus "caballa" y 85 larvas de C. osculatum (figura 3) de 50 Mugil cephalus "lisas", provenientes del terminal pesquero de Ventanilla, Callao (11° 59' 20" S y 77° 07' 34" O), y del Puerto de San Andrés en Pisco, Ica (13° 43' 59" S y 76° 13' 30" O), durante los años 2001 y 2002. Las larvas fueron identificadas morfológicamente 13 antes de ser conservadas a -20 º C hasta su procesamiento. El estudio se llevó a cabo en el Laboratorio de Parasitología de la Facultad de Ciencias Biológicas e Inmunología y Bioquímica del Instituto de Medicina Tropical de la Universidad Nacional Mayor de San Marcos.
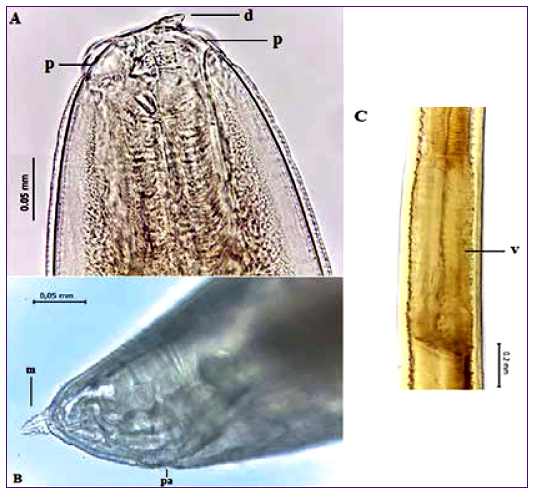
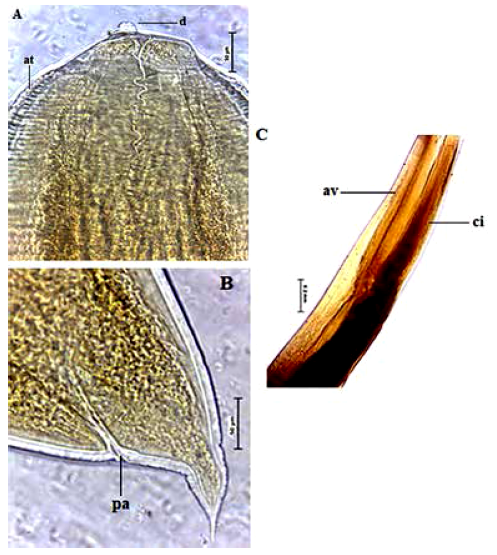
Figura 1 Microfotografias de Anisakis sp. tipo I. A. Región anterior, mostrando el diente (d) y papilas (p); B. Región posterior, con el poro anal (pa) y mucrón (m); C. Parte ventrícular (v).
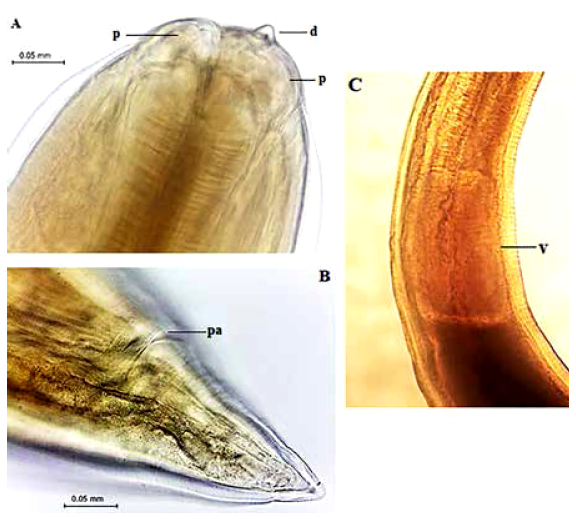
Figura 2 Microfotografias de Anisakis sp. tipo II. A. Región anterior, diente (d) y papilas (p); B. Región posterior, poro anal (pa); C. Parte ventricular (v).
Caracterización del patrón proteico por SDS-PAGE
Obtención de antígeno. Se prepararon antígenos somáticos (AS) de 30 larvas de Anisakis tipo I, tipo II y C. osculatum. Se homogeneizó en frío utilizando buffer fosfato salino estéril (PBS pH 7,2). Se sonicaron a 4oC utilizando un desintegrador ultrasónico (Braun Sonic 2000) y se centrifugó a 8000 rpm x 30 min (centrífuga refrigerada Sorval). Al sobrenadante se le agregó 2mM de fluoruro de fenilmetilsulfonilo (PMSF) solución inhibidora de la proteasa (1:10 en PBS a pH 7,2). La cantidad de proteínas se determinó por el método de Bradford 14, leyendo la absorbancia a 595 nm.
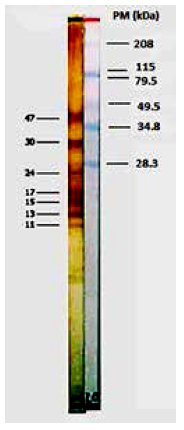
Separación de las proteínas por electroforesis en SDS-PAGE. Para el análisis de las proteínas, se realizaron corridas electroforéticas en geles de poliacrilamida dodecil sulfato de sodio (SDS-PAGE) al 15 %, según la metodología descrita por Laemmli 15. Se usó 20 µg de proteína por carril, con buffer de muestra en condición reductora y no reductora. Con un patrón de peso molecular de 14 - 94 kDa (Sigma-Aldrich-Química). Se corrió a 25 mA/5 h a 4 °C.
Coloración de las proteínas totales. Los geles se colocaron en una solución fijadora (ácido acético al 10% y metanol al 50%) y teñidos por inmersión en 0,125% de azul de Comassie en metanol, ácido acético y agua (50:10:45) durante toda la noche y desteñidos en metanol, ácido acético y agua (20:14:76).
Caracterización del perfil antigénico por Western blot (EITB)
Obtención de suero hiperinmune. Se inmunizaron seis conejos (New Zealand) de 1,5 -2 meses de edad entre 2,5 a 3Kg de peso con los extractos somáticos (AS) de las larvas de acuerdo al método propuesto en la Guide for the care and use of Laboratory Animals de la Oficina de Bienestar para Animales de Laboratorio 16. Se le aplicó una concentración de 1 mg/ mL de antígeno distribuido en 4 dosis en una proporción 1:1 con el adyuvante de Freund completo (Sigma) en la primera dosis y el incompleto en las tres últimas dosis. Se inmunizó por vía subcutánea con intervalos de 15 días. Previo a la primera inmunización se obtuvo una muestra de sangre (suero control negativo) y después de cada inmunización. Se evaluó el título de anticuerpos (IgG) específicos mediante ELISA indirecto (ensayo por inmunoabsorción ligado a enzimas) 17.
Análisis del antígeno somático (SDS PAGE) Para el análisis antigénico, se fraccionaron los Ag por electroforesis en gel SDS-PAGE usando Mini protean II (Bio-Rad) 18. Se corrió en un gel de gradiente de 5-22,5% y el stacking acrilamida al 3%. Se diluyó 2 µg/mL de Ag con un buffer de muestra en dilución 1:1, preparado con 0,5 M Tris-HCl (pH 6,8), conteniendo SDS al 2%, azul de bromofenol 0,1%, 2- mercaptoethanol 2% y glicerol 20%. Se aplicó el Ag a una concentración de 1 µL/mm, iniciando la corrida electroforética a 50 V y 0,6 A/5 min, incrementando a 100 V/ 50 min. Se usó un buffer de corrida a pH 8,6 (Tris-HCl/ácido bórico en 0,1% de SDS). Se incluyó un estándar de peso molecular de amplio rango (7,2-208 kDa, Bio-Rad).
Evaluación de proteínas inmunogénicas por Western blot. Las fracciones antigénicas fueron transferidas sobre un papel de nitrocelulosa con poro de 0,45 µm y en un buffer Tris-HCl a pH 9,18 y 40% (v/v) de metanol, utilizando un mini trans-blot para transferencia electroforética (Bio-Rad), aplicándose 100 V y 2,0 A por 2 h 18. Luego, se enfrentaron a los antisueros de conejo (Anisakis tipo I, II y C. osculatum) en una dilución 1/50 en PBS-Tween 20 al 0,3% (buffer de lavado) y leche descremada al 5%, se incubó en agitación a Ta/1 h y se dejó a 4ºC toda la noche. Posteriormente, se lavó tres veces, usando el buffer a 56o C en el primer lavado. Se agregó anti inmunoglobulina G de conejo marcado con peroxidasa (Bio-Rad) diluido 1/1000 con PBS-Tween 20 al 0,3% e incubándose en agitación a Ta/1h. Finalmente, se lavó con el buffer 3 veces y se agregó el buffer de revelado (10 mL PBS, 5 mg de 3-3' Diaminobencidina, 30% H2O2). Las reacciones positivas aparecieron a los minutos. Se detuvo la reacción lavando con agua destilada.
RESULTADOS
Se caracterizó el perfil proteico de los extractos somáticos de las larvas de Anisakis tipo I, II y C. osculatum por SDS-PAGE, visualizándose mejor con azul de Comassie en condiciones reductoras: para Anisakis tipo I, 12 bandas proteicas de 11 a 52 kDa (11, 14, 17, 18, 21, 25, 30, 38, 40, 42, 47, 52); Anisakis tipo II, 18 bandas de 10 a 73 kDa (10, 11, 14, 15, 17, 18, 21, 25, 30, 35, 38, 40, 42, 47, 52, 58, 64, 73 kDa), y C. osculatum, 13 bandas de 11 a 77 kDa (11, 14, 15, 17, 24, 28, 30, 40, 42, 47, 51, 73, 77 kDa). Figura 4.
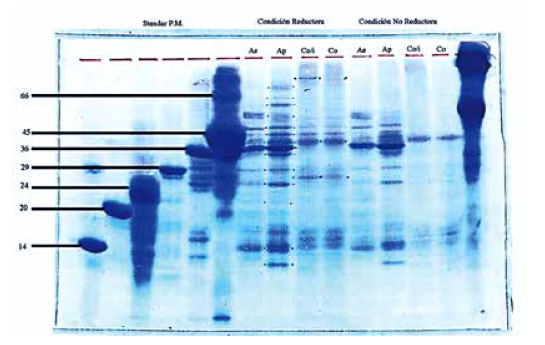
Figura 4 Patrón proteico de los extractos somáticos de las larvas L3 de Anisakis tipo I (As), tipo II (Ap) y Contracaecum osculatum (Co) sin inhibidor y con inhibidor (Co/i), en condición reductora y no reductora por SDS- PAGE. Standar P.M. (Estándar de Peso molecular) de 14, 20, 24, 29, 36, 45, 66 y 94 kDa (Sigma).
Asimismo, se hallaron proteínas similares para las tres especies con peso molecular de 11, 14, 17, 30, 40, 42 y 47 kDa. Anisakis tipo I y II comparten casi todas las proteínas, excepto el tipo II que presenta además las bandas de 10, 15, 35, 58, 64 y 73 kDa.
Se evaluaron los Ag por la prueba de ELISA, frente a los sueros hiperinmunes de conejo, utilizando diferentes concentraciones: 1/250, 1/500, 1/1000, 1/2000 y 1/4000, obteniendo una buena respuesta antigénica hasta la dilución 1/2000, disminuyendo en la última dilución.
Se determinó el perfil antigénico de Anisakis tipo I, II y C. osculatum, frente a los sueros hiperinmunes de conejo, por Western blot. Para Anisakis tipo I, 06 bandas antigénicas, con pesos moleculares de 11, 14, 18, 21, 25 y 40 kDa; 07 para el tipo II de 9, 10, 12, 24, 30, 35 y 41 kDa (figura 5) y 07 para C. osculatum de 11, 13, 15, 17, 24, 30 y 47 kDa (figura 6).

Figura 5 Perfil antigénico de las larvas L3 de Anisakis tipo I y II en las concentraciones: 1,5 (1), 2,0 (2) y 2,5 (3) µg, mediante Western blot. En Anisakis tipo I se obtuvieron 6 bandas proteicas inmunogénicas (11, 14, 18, 21, 25, 40 kDa) y en A. tipo II 7 bandas (9, 10, 12, 24, 30, 35, 41 kDa). PM: peso m.
DISCUSIÓN
El análisis de las proteínas de los extractos somáticos se encontró que Anisakis tipo I comparte las bandas proteicas de 11, 14, 17, 30, 40, 42 y 47 kDa con el tipo II y C. osculatum, diferenciándose Anisakis tipo II por las bandas de 10 y 35 kDa y C. osculatum de 28 y 77 kDa.
Asimismo, Anisakis tipo I y II comparten tres bandas proteicas de 18, 21 y 38 kDa y el tipo II y C. osculatum una de 73 kDa indicando un parentesco entre las especies. Actualmente utilizando marcadores genéticos moleculares sólo del género de Anisakis se reconocen 9 especies y en el complejo Anisakis simplex se incluyen a 3 especies hermanas: A. simplex "senso estricto", A. pegreffii y A. berlandi 4.
Algunos autores mencionan, haber distinguido entre 30 a 40 bandas en el extracto somático de A. simplex s.l., con pesos moleculares entre 13 a 150 kDa, los cuales fueron reconocidos por anticuerpos en el suero de ratones experimentalmente infectados con las larvas 2. Así también, se ha reportado que la proteína de 14 kDa, está presente en Ascaris lumbricoides, A. suum y Toxocara canis, utilizando los AS o E/S 2; e inclusive con la Ag pseudocelómico de A. suum; por lo tanto, la banda de 14 kDa es una proteína característica en los anisákidos estudiados y los ascáridos antes mencionados 19.
En cuanto al perfil antigénico, en este estudio se ha caracterizado para Anisakis tipo I: 06 bandas de 11, 14, 18, 21, 25 y 40 kDa; para el tipo II: 07 de 9, 10, 12, 24, 30, 35 y 41 kDa; y C. osculatum 07 de 11, 13, 15, 17, 24, 30 y 47 kDa. Se ha reportado dos enzimas de 23,4 y 46,1 kDa en el antígeno de E/S de A. simplex (tipo I), con valor antigénico 2. Nosotros identificamos bandas antigénicas tanto en Anisakis tipo I (25 kDa) como en el tipo II (24 kDa) y C. osculatum (24 kDa), muy similares a las reportadas 2; la segunda (46.1 kDa) es una banda muy marcada en el patrón proteico de las tres especies. Igualmente determinaron una proteína de 25 kDa en el E/S de A. simplex s.l. de importancia antigénica, esta proteína denominada Ani s 1 se describe como potente alérgeno, importante en el serodiagnóstico 2.
Anisakis tipo I presentó una banda de 40 kDa y el tipo II de 41 kDa frente al antisuero de conejo, no presente en C. osculatum, pero si en el patrón proteico (42 kDa); otros autores determinaron bandas semejantes de 40 y 42 kDa correspondientes al anticuerpo monoclonal Ani s 3 (41 kDa), que se hace más intensa en el purificado mediante Western blot 2. Asimismo, señalan que la banda de 40 kDa de A. simplex s.l. corresponde a la enzima hialuronidasa, que tiene la propiedad de degradar glicosaminoglicano de sulfato de condroitina, enzima que produce hidrólisis del tejido permitiendo a la larva invadir la mucosa 2, marcador importante en el serodiagnóstico de anisakiasis.
Con relación a las bandas antigénicas de bajo peso molecular, en A. simplex s.l. se ha reportado las bandas 11-18 kDa 2, reconocida en el suero de ratones infectados experimentalmente, pero no especifican las bandas intermedias que observamos en las tres especies, en Anisakis tipo I (11, 14 y 18 kDa), tipo II (9, 10 y 12 kDa) y en C. osculatum (11, 13, 15 y 17 kDa); asimismo, se menciona que la banda 17 kDa en A. simplex s.l. es responsable de una reacción alérgica 20, en nuestro estudio también está presente en el perfil antigénico de C. osculatum, pero en el patrón proteico se encuentra en Anisakis tipo I y II.
Las larvas recolectadas durante los años de muestreo permitieron estandarizar la técnica sin constituir ninguna limitación en el presente estudio.
En conclusión, se determinaron bandas inmunogénicas específicas, para Anisakis tipo I las proteínas de 11, 14, 25 y 40 kDa, tipo II de 9, 10, 12, 35 y 41 kDa y C. osculatum de 13, 15, 17, 30 y 47 kDa, las que podrían ser consideradas importantes marcadores de serodiagnóstico.