Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista Peruana de Biología
On-line version ISSN 1727-9933
Rev. peru biol. vol.25 no.2 Lima Apr./Jun. 2018
http://dx.doi.org/10.15381/rpb.v25i1.14034
TRABAJOS ORIGINALES
Producción de Pseudomonas sp. LMTK32 en medio modificado para peletizar semillas de maca (Lepidium meyenii Walp.)
Pseudomonas sp. LMTK32 production in modified media for pelleting seeds of maca (Lepidium meyenii Walp.)
Martin Guerra-López y Doris Zúñiga-Dávila*
Laboratorio de Ecología Microbiana y Biotecnología, Departamento de Biología-Facultad de Ciencias, Universidad Nacional Agraria La Molina. Av. La Molina s/n. Lima 12, Perú.
Resumen
Se produjo biomasa de Pseudomonas sp. LMTK32 a partir de la modificación del medio de cultivo Caldo Extracto de Levadura Manitol (LMC) con el objetivo de incrementar el número de células viables con capacidad de promover la germinación de semillas de maca peletizadas y reducir los costos de producción. En el proceso de optimización, los componentes extracto de levadura y manitol del medio de cultivo LMC fueron reemplazados por fuentes comerciales de sacarosa y glutamato, cuyas concentraciones fueron determinadas en matraces mediante el diseño estadístico de Box-Behnken; además, se determinó el efecto del porcentaje de inóculo en el tiempo de producción de biomasa. Posteriormente se determinó a nivel de biorreactor que 28.57 h-1 fue el valor adecuado del coeficiente volumétrico de transferencia de oxigeno (kLa) a 600 rpm, produciendo 1.28x1011 UFC/mL. En el medio modificado M1, empleando 12.06 g/L-1 de sacarosa, 11.50 g/L-1 de glutamato de sodio y 10.9% de inoculante se obtuvo 15x108 UFC/mL, superando en 52% más el número de células viables con respecto al tratamiento control LMC (7.8x108 UFC/mL). A nivel in vitro, la peletización de semillas de maca con Pseudomonas sp. LMTK32 producidas en biorreactor y en el medio modificado M1 favoreció su germinación. A partir de sustratos orgánicos comerciales se puede producir inoculantes bacterianos eficientes en el desarrollo de cultivos de maca, sin alterar su capacidad de promover el crecimiento vegetal.
Palabras clave: Rhizobacteria; Fertilización biológica; germinación de semillas; Lepidium meyenii; PGPR.
Abstract
Biomass of Pseudomonas sp. LMTK32 was produced from modification of culture media Yeast Extract Mannitol Broth (YEMB) with the aim of increasing the number of viable cells with the ability to promote the germination of maca seeds pelleted with the bacteria and reduce production costs. In the optimization process, the yeast extract and mannitol components of the LMC culture media were replaced by commercial sources of sucrose and glutamate, whose concentrations were determined in flasks by statistical design from Box-Behnken; in addition, the effect of the inoculum percentage on the time of biomass production was determined. Subsequently, it was determined at the bioreactor level that 28.57 h-1 was the adequate value of the volumetric oxygen transfer coefficient (kLa) at 600 rpm, producing 1.28 x 10 11 CFU / mL. In the LMC M1 modified media, using 12.06 g / L-1 of sucrose, 11.50 g / L-1 of sodium glutamate and 10.9% of inoculant obtained 15x108 CFU / mL, increasing in 48% the number of viable cells with respect to the YEMB control treatment (7.8x10 8 CFU / mL). At the in vitro level, the pelleting of maca seeds with Pseudomonas sp. LMTK32 produced in bioreactor and in the modified media M1 favored its germination. From commercial organic substrates, efficient bacterial inoculants can be produced in the development of maca crops, without altering their ability to promote plant growth.
Keywords: Rhizobacteria; Biological fertilization; seed germination; Lepidium meyenii; PGPR.
Introducción
Las PGPR´s (Plant Growth-Promoting Rhizobacteria) son bacterias de vida libre o simbióticas que ejercen efectos beneficiosos al disponer de nutrientes y hormonas que promueven el crecimiento de plantas suprimiendo a los patógenos, además de mejorar el estado nutricional del suelo. (Abdul et al. 2007; Bashan 1998; Macleod et al. 2015, Egamberdieva et al. 2015). Pseudomonas sp. LMTK32 fue caracterizada como una bacteria PGPR (Ortiz 2013), por lo que favorecería el crecimiento de cultivos de interés agronómico.
La maca (Lepidium meyenni Walp.), debido a su alto valor nutraceútico, en los dos últimos años ha alcanzado gran demanda internacional (Mendieta 2016), lo que ha incentivado a los agricultores a obtener cultivos de mayor calidad y en cantidades necesarias para la exportación.
La peletización de semillas de maca, consiste en cubrir a las semillas con el/los PGPR´s, un adhesivo y un soporte sólido que proteja la semilla y estabilice a la bacteria para promover el crecimiento en los primeros estadios de la planta (Kloepper & Schroth 1980). En el proceso de peletizado, la inoculación con el mayor número de células viables influye en el efecto promotor de crecimiento vegetal (Puente et al. 2011); por lo que optimizar un medio de cultivo adecuado para la producción de Pseudomonas, puede reducir el tiempo-costo de producción y garantizar incrementos en la biomasa microbiana (Gómez & Batista 2006). Por tal motivo, el objetivo de este estudio fue optimizar la fuente de carbono y nitrógeno del medio de cultivo Extracto de Levadura y Manitol (LMC), con el fin de incrementar el número de células viables y que estas al ser peletizadas promuevan el crecimiento vegetal en los primeros estadios de la planta de maca. De esta manera la optimización de un medio alternativo de bajo costo, de fácil preparación y obtención puede utilizarse como una herramienta para producir inoculantes bacterianos que estimulen la germinación y el desarrollo de la maca (Santillana 2006; Montañez et al. 2012).
Material y métodos
Microorganismo. Pseudomonas sp. LMTK32 fue aislada de la rizósfera de plantas de maca cultivadas en San Pedro de Cajas, Junín-Perú y caracterizada como promotor del crecimiento vegetal (Ortiz et al. 2017).
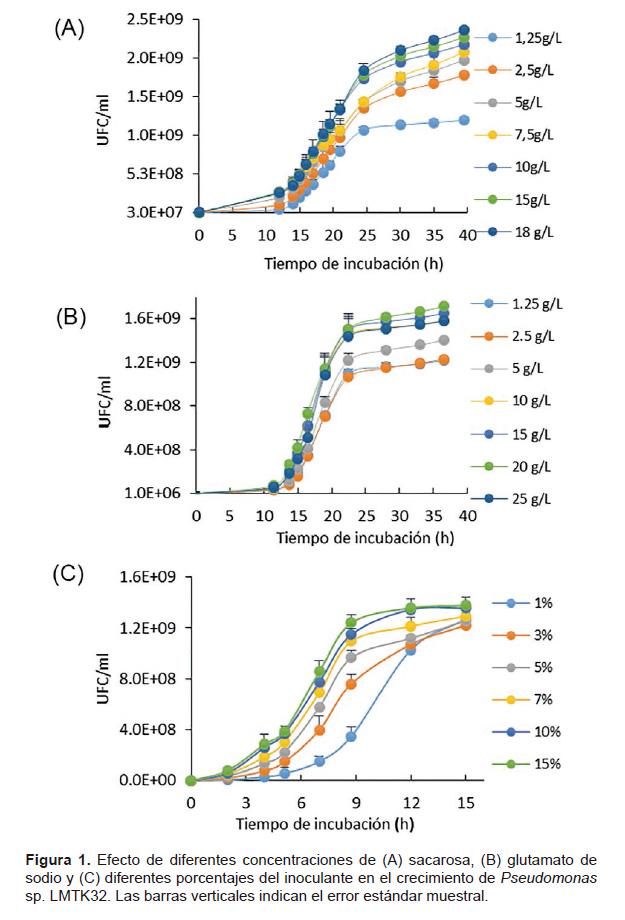
Optimización del medio de cultivo y porcentaje de inóculo de Pseudomonas sp. Para el crecimiento de Pseudomonas sp. LMTK32, se usó el medio de cultivo LMC: manitol 10gL-1,extracto de levadura 0,5 gL-1, K HPO 0,5 gL-1, NaCl 0,2 gL-1, MgSO4.7H2O 0,1gL , Agua 1 L y pH 7. Se reemplazó el manitol por azúcar rubia y el extracto de levadura por glutamato de sodio, ambos de uso doméstico, como fuentes de carbono y nitrógeno. Se analizó por separado distintas concentraciones de sacarosa (1.25, 2.5, 5, 7.5, 10, 15 y 18 gL-1) y de glutamato de sodio (1.25, 2.5, 5, 10, 15, 20 y 25 gL-1). La cepa se cultivó en matraces de 150 mL de capacidad con 100 mL de medio de cultivo inoculado con 0.2% v/v (0.015600nm) y fueron incubados a 25 °C en un agitador orbital a 150 rpm. El ensayo se realizó por triplicado.
Para el proceso de optimización se utilizó el diseño estadístico de Box-Behnken (Statgraphics centurión XVII). Se estableció tres niveles ‒1, 0, +1 para cada variable, siendo el nivel 0 una concentración intermedia, dando un total de 15 corridas experimentales con 3 repeticiones del punto central. Los cultivos se realizaron en matraces de 250 mL de capacidad con 100 mL de medio de cultivo y fueron incubados a 25 °C en agitación orbital a 150 rpm. Se realizó el seguimiento del crecimiento y antes de la fase estacionaria se detuvo el ensayo para medir la biomasa en el espectrofotómetro a 600 nm. Se calculó las UFC/mL en una curva estándar de crecimiento celular.
Para determinar el porcentaje de inoculante se realizaron ensayos por triplicado en matraces de 150 mL con 99, 97, 95, 93, 90 y 85 mL de medio de cultivo LMC empleando 10 g/L-1 de sacarosa y 10 g/L-1 extracto de levadura. Se inoculó con 1%, 3%, 5%, 7%, 10% y 15% (v/v) a una absorbancia de 0,65 600nm, luego se incubaron a 25 °C en agitación orbital a 150 rpm. Se midió la cantidad de biomasa producida durante las horas de crecimiento exponencial. La población microbiana se expresó como UFC/mL y fue obtenida mediante una curva de calibración con valores de absorbancia. Se tomó el menor porcentaje de inóculo que produjo el mayor número de células viables en menor tiempo.
Producción de Pseudomona sp. LMTK32 a nivel de biorreactor. Se evaluó 3 niveles de agitación 450, 600 y 700 rpm (Najafpour 2015), para determinar el coeficiente volumétrico de transferencia de oxígeno (KLa) durante la fase exponencial en un bioreactor batch de tanque agitado Applikon Biotechnology de un litro. El Kla se determinó utilizando el método de Gassing out dinámico (Bu'lock & Kristiansen 1991) y manteniendo el ingreso de aire a 2 vvm, pH 7 y 25 °C. La velocidad de transferencia de oxígeno (OTR) y la velocidad de consumo de oxígeno (OUR) se determinaron según Torres et al. (2008) y Garcia-Ochoa y Gómez (2009). Los ensayos para cada agitación en biorreactor se realizaron por duplicado.
Peletización de semillas de maca. Las semillas de maca fueron desinfectadas para luego ser colocadas en sistemas de tambor rotativo estériles, en el proceso de peletización se inoculó la cepa producida en el medio modificado M1 y posteriormente se adicionó el adhesivo y la mezcla de arcilla, aserrín y cal (soporte sólido) hasta que se formaran los pellets homogéneos. Previamente el peletizado ya había sido realizado por Ayaipoma (2014).
A nivel in-vitro, se evalúo el porcentaje de germinación a partir de semillas peletizadas con Pseudomonas sp. LMTK32 producidas a nivel de matraz y biorreactor. Los tratamientos consistieron en: semillas peletizadas con la cepa producida en el medio modificado M1, producida en medio LMC y semillas peletizadas sin inoculante (CN). El ensayo de germinación se realizó con 4 repeticiones, se colocaron 25 semillas en una placa Petri con agar agua y se evaluó la germinación a 13 °C durante 6 días.
Análisis estadísticos. Se realizó el análisis de variancia ANOVA y prueba de múltiples rangos para los ensayos de optimización del medio de cultivo, porcentaje de inoculante, medida del kLa y porcentajes de germinación de semillas de maca.
Resultados
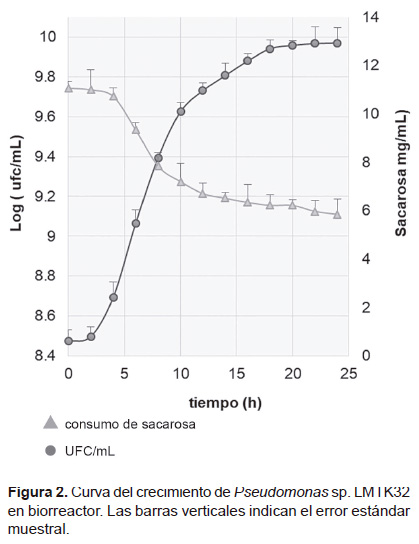
Optimización del medio de cultivo y porcentaje de inóculo de Pseudomonas sp. Las evaluaciones determinaron que a medida que aumenta la concentración de sacarosa y glutamato de sodio, incrementa también el crecimiento de la cepa, pero a concentraciones superiores de 10 gL-1, no se observaron diferencias estadísticamente significativas en el crecimiento de células viables (Fig. 1). En la Figura 1C se observó, que el tiempo de crecimiento microbiano de la fase exponencial se redujo proporcionalmente al porcentaje de inóculo empleado. A las 9 horas de iniciado el cultivo, no hubo diferencias estadísticamente significativas entre el 15 y 10% de inóculo, por lo que se definió emplear el menor porcentaje. Se determinó usar 10 gL-1 de sacarosa y glutamato de sodio y 10% de inoculante para en ensayo de optimización.
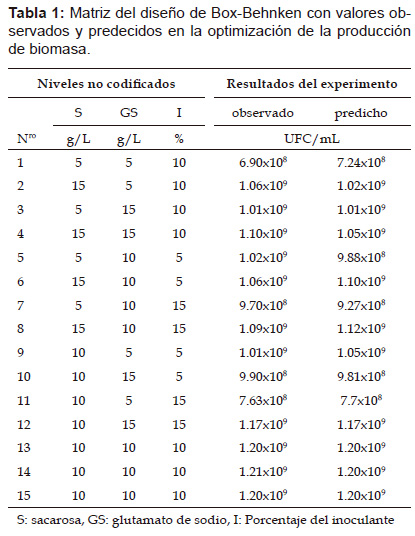
Según los resultados de los experimentos preliminares, se determinó usar concentraciones de sacarosa y glutamato de sodio de 5 gL-1, 10 gL-1 15 gL-1 para los niveles de ‒1, 0, +1, mostrándose 15 corridas experimentales en un solo bloque, como se puede observar en la Tabla 1. El número de células viables obtenidas (UFC/mL) experimentalmente fueron comparadas con los valores predichos por el modelo estadístico.
Análisis de regresión generó la siguiente ecuación de segundo grado:
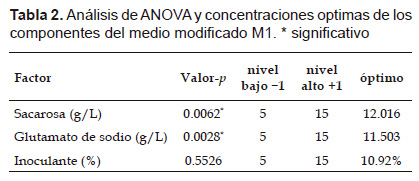
Biomasa (UFC/mL) = -1.43x108 +1.1x108xS + 1.2x108xGS + 7.15x106xI – 3.73x106xS2 – 2.8x106x SxGS + 8 x SxI – 5.8x106 x GS2+ 4.27x106 x GSxI – 3x106xI [Ec. 1]
Donde S es sacarosa; GS, es glutamato de sodio e I, porcentaje de inoculante. La sacarosa y el glutamato de sodio tuvieron efectos significativos en la formación del número de células viables como se muestra en la Tabla 2 y su interacción incrementa el número de células. Los valores significativos se correlacionaron con los coeficientes para sacarosa y el glutamato de sodio en la ecuación 1. El análisis de varianza ANOVA determinó significancia y adecuación del modelo. El modelo de regresión describió con precisión los datos experimentales con un valor de correlación R2 de 0.96. De acuerdo al diseño estadístico de Box-Benhken las concentraciones que maximizan el crecimiento celular se muestra en la Tabla 2.
Producción de Pseudomonas sp. LMTK32 en biorreactor batch. Se compararon los parámetros de crecimiento de Pseudomonas sp. LMTK32 producida en el medio modificado M1 respecto al medio control LMC. En la Tabla 3 se puede observar que se redujo el tiempo de generación, se incrementó la velocidad específica máxima de crecimiento así como la biomasa en un 48% más respecto al medio control LMC y se redujo el costo en un 85.9%. A las 9 horas de iniciado el cultivo la producción de biomasa obtenida fue de 1.5x109. Según la ecuación 1, el modelo predijo que la producción de biomasa en matraz podría alcanzar un valor de 1,23x109. De acuerdo con el valor observado el resultado verificó el modelo y el punto óptimo de producción de biomasa de la cepa en el medio modificado LMC.
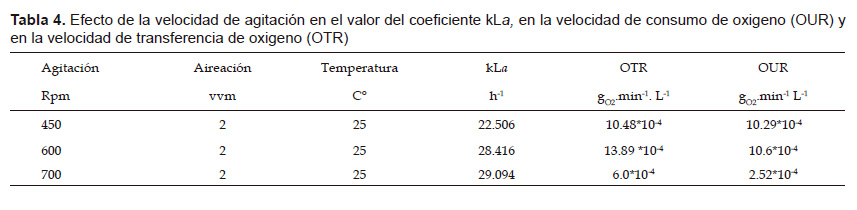
A fin de incrementar la producción de biomasa a nivel de biorreactor se probaron 3 niveles de agitación 450, 600 y 700 rpm a 2 vvm de aire. En la Tabla 4 se puede observar los valores obtenidos de la constante volumétrica de transferencia de oxígeno (kLa) evaluados a las 10 horas de iniciado el cultivo. A 450 rpm, el valor de la velocidad de consumo de oxigeno (OUR) se igualo a la velocidad de transferencia de oxígeno (OTR) de modo que se detuvo el crecimiento por la falta de oxígeno. A 600 rpm el crecimiento de la cepa fue constante y no presentó limitaciones de oxígeno durante todo el cultivo. A 700 rpm, los valores de la OUR y la OTR fueron disminuidos, a pesar de una mayor kLa.
A las 23 horas de iniciado el cultivo (Figura 2) se produjo 1.28x1011 UFC/mL, Las condiciones establecidas para el crecimiento de la cepa a nivel de biorreactor fueron de 28 °C, pH 7, 600 rpm, 2 vvm de aire y el medio modificado M1, Simultáneamente la cepa consumió la sacarosa hasta llegar al consumo de 5.84 mg de glucosa/mL.
La producción de la cepa en bioreactor permitió incrementar el rendimiento de peletización, es decir con 1 mililitro de inóculo producido (1.5x109 UFC/mL) en el medio modificado M1 y a nivel de matraz se peletizaba 4 gramos de semillas de maca. Con 1 mL de inóculo producido en el medio modificado M1 y a nivel de bioreactor (1.28x1011 UFC/mL) se peletizó 85.33 gramos de semillas de maca.
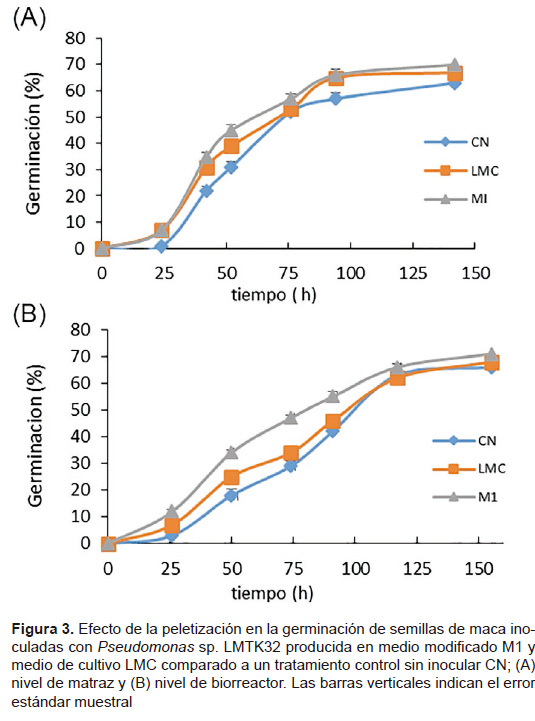
Efecto de la peletización con Pseudomonas sp. LMTK32 en la germinación de semillas de maca. En la Figura 3 se muestra el efecto de la peletización en la germinación de semillas de maca con la cepa producida en medio modificado M1, medio tradicional LMC y un tratamiento control sin inocular. En Figura 3A, las semillas peletizadas con Pseudomonas sp. LMTK32 producida en el medio modificado M1 a nivel de matraz germinaron más rápido con respecto al tratamiento control (CN) durante las primeras horas de germinación (p< 0,05); del mismo modo, en la Figura 3B se muestra el efecto de la peletización de semillas de maca con la cepa producida en el medio modificado M1 a nivel de biorreactor.
Discusión
Los carbohidratos son tradicionalmente las fuentes de energía en la industria de la fermentación (Crueger 1993). La azúcar de mesa comercial que contiene principalmente sacarosa, es un sustrato ampliamente utilizado como una fuente alterna para producción de cepas de interés agrícola (Vanegas et al. 2016). Las concentraciones de sacarosa y glutamato de sodio que se obtuvieron a partir de la optimización concuerdan con las de Peighami et al. (2008), quienes utilizaron 10 gL-1 de sacarosa producir Pseudomonas fluorescens; mientras que Ashnaei et al. (2007) encontraron que el uso de sacarosa es el principal factor para la producción de biomasa de P. fluorescens. Por otro lado, Osawa et al. (1963) empleó 10 gL-1 de ácido glutámico en un medio utilizado para el crecimiento de Pseudomonas aeruginosa; y Ormeño y Zúñiga (1998) usaron glutamato de sodio como una eficiente fuente de nitrógeno para crecimiento de inoculantes bacterianos. Estos resultados corroboran el uso y la concentración de sacarosa y glutamato de sodio como nutrientes alternativos para el crecimiento de Pseudomonas sp. LMTK32. Pero no solo las fuentes de carbono y nitrógeno utilizadas influyen en el incremento de las células viables, sino también la reducción del tiempo de producción tiene una importancia económica en el proceso (Vyas et al. 2013) como se observa en la Figura 1C, las inoculaciones entre 15 y 10% (v/v) de la cepa permitió reducir el tiempo de crecimiento respecto a los menores porcentajes de inóculo.
El análisis estadístico, basado en el diseño Box-Behnken, permitió hallar las concentraciones de sacarosa, glutamato de sodio y porcentaje de inoculante que maximizaron el número de células viables en el menor tiempo. El diseño estadístico permitió incrementar en un 48% más el número de células viables de la cepa respecto al medio LMC, como se muestra en la Tabla 3. Vyas et al. (2014) logra incrementar en un 17.6% la biomasa de Pseudomonas trivialis mediante la optimización del medio de cultivo. La optimización de los componentes del medio de cultivo y de las condiciones ambientales garantiza notables incrementos de los procesos fermentativos de forma rápida y económica (Gómez & Batista 1996).
El oxígeno es el componente gaseoso más importante para el metabolismo microbiano, lo que frecuentemente es un factor limitante en la fermentación debido a su baja solubilidad. (Crueger 1993). Los valores de kLa y de la velocidad de transferencia de oxigeno (OTR) aumentan al incrementar los niveles de agitación y aireación, lo que favorece la transferencia de masa y por tanto la producción microbiana (Bedoya & Hoyos 2010). Se incrementó el valor del kLa a medida que se incrementó los niveles de agitación, pero a 700 rpm los valores de la velocidad de trasferencia de oxigeno (OTR) y la velocidad de consumo de oxigeno (OUR) fueron afectados (Tabla 4), probablemente el alto nivel de agitación generó en el medio una alta fuerza de cizalla y grandes remolinos que actuaron simultáneamente dañando las células (Trujillo & Valdéz 2006). Se seleccionó el nivel de agitación de 600 rpm porque el OTR evaluado a las 10 horas de iniciado el cultivo fue mayor que la OUR y se observó que el contenido de oxígeno disuelto en el medio de cultivo no afectó el crecimiento durante todo el proceso. Este resultado concuerda con lo presentado por Borgues et al. (2015) quienes utilizaron una agitación de 600 rpm para incrementar la biomasa de Pseudomonas aeruginosa.
Es difícil encontrar los mismos parámetros de crecimiento obtenidos en literatura científica, pero con el objetivo de incrementar biomasa bacteriana, Peng et al. (2014) produjo 1.x1013 UFC/mL de Pseudomonas putida en harina de maíz y de soya como medio de bajo costo y sin afectar su capacidad de solubilizar el fosfato y productor de ácido indol acético. Thonart y Mputu (2013) produjeron Pseudomonas fluorescens (1.3x1011 UFC/mL) como agente de biocontrolador de patógenos fúngicos. Wu et al. (2008) utilizaron harina de maíz y miel como medio óptimo para una mayor producción de Bacillus sp. como controlador de Rhizoctonia solani en cultivos de tomate, estas investigaciones afirman la utilización y optimización de componentes alternativos como una herramienta útil para reducir costos de producción y maximizar la productividad de biomasa (Arora et al. 2008); además de establecer una base sólida para ampliar el proceso de producción de microorganismos con potencial agroindustrial.
Los resultados mostraron que la peletización con Pseudomonas sp. LMTK32 producida en el medio modificado M1 favoreció la germinación (Fig. 4) a nivel in vitro en comparación del control sin inoculación. No se han reportado estudios acerca del efecto de la peletización con Pseudomonas en el desarrollo de la maca, pero estudios similares han reportado que peletizar semillas con inoculantes bacterianos beneficia al desarrollo y crecimiento de las plantas (O’Callaghan 2006; Ryu et al. 2006), por otro lado se ha reportado que solo la inoculación de Pseudomonas en semillas de maíz, tomate y maní promueve el crecimiento y estimula la germinación ratificando la aplicación de inoculantes bacterianos en semillas y plantas (Widnyana 2016; Fatemeh 2014; Dey et al. 2004). El efecto promotor del crecimiento vegetal se debe a que producen y segregan reguladores del crecimiento como auxinas, giberelinas y citoquininas, mejorando procesos como germinación de semillas, nutrición mineral y desarrollo de raíces (De Souza et al. 2015), y a la vez las raíces pueden segregar exudados radiculares como lipopolisacáridos, celulosa, tiamina, aminoácidos, biotina e isoflavonoides, que sirven como nutrientes para las bacterias (Hansen et al. 1997).
Conclusión
Se demostró que una adecuada optimización de la fuente de carbono y nitrógeno a partir de fuentes comerciales incrementó la producción de biomasa de Pseudomonas sp. LMTK32, sin afectar su capacidad promotora de crecimiento vegetal en semillas de maca peletizadas. Se puede utilizar medios de cultivo alternativos a partir de sustratos orgánicos comerciales para la producción de inoculantes bacterianos que promueven el crecimiento de la maca a bajo costo.
Agradecimientos
El trabajo fue financiado por el Programa Nacional de Innovación para la Competitividad y Productividad (Innóvate Perú) de acuerdo al contrato 225-FINCYT-IA-2013. A la M.Sc. Miriam Memenza por la revisión del manuscrito.
Fuentes de financiamiento: Programa Nacional de Innovación para la Competitividad y Productividad (Innóvate Perú); contrato 225-FINCYTIA-2013.
Información sobre los autores: MGL, DZD: realizaron el diseño experimental; analizaron los datos; DZD: redactó el manuscrito; MGL, DZD: revisaron y aprobaron el manuscrito.
Los autores no incurren en conflictos de intereses.
Literatura citada
Abdul J.C., P. Manivannan, B. Sankar, A. Kishorekumar, R. Gopi, R. Somasundaram & R. Panneerselvam. 2007. Pseudomonas fluorescens enhances biomass yield and ajmalicine production in Catharanthus roseus under water deficit stress Colloids and Surfaces. Biointerfaces 60: 7–11. https://doi. org/10.1016/j.colsurfb.2007.05.012 [ Links ]
Ayaipoma C. 2014. Peletización de semillas de trébol con Pseudomonas sp. aisladas de la rizosfera de maca y evaluación de su efecto en la emergencia de semillas. Tesis de grado de Bióloga. Facultad de Ciencias. Universidad Nacional Agraria La Molina. [ Links ]
Arora N. E. Khare, R. Naraian & D. Maheshwari. 2008. Sawdust as a superior carrier for production of multipurpose bioinoculant using plant growth promoting rhizobial and pseudomonas strains and their impact on productivity or Trifolium repense. Current Science. 95(1):90-95. [ Links ]
Ashnaei P. S. Tehrani, M. Ahmadzadeh & K. Behboudi. 2007. Effect of carbon and nitrogen sources on growth and biological efficacy of Pseudomonas fluorescens and Bacillus subtilis against Rhizoctonia solani, the causal agent of bean damping-off. Communications in agricultural and applied biological sciences 72(4):951-6. [ Links ]
Bashan Y. 1998. Inoculants of plant Growth-Promoting bacteria for use in agricultura. Biotechnology advances 16(4):729-770. https://doi.org/10.1016/S0734-9750(98)00003-2 [ Links ]
Bedoya J. & R. Hoyos. 2010. Efecto de la relación agitaciónaireación sobre el crecimiento celular y la producción de azadiractina en cultivos celulares de Azadirachta indica a. juss. Revista Facultad Nacional de Agronomía Medellín 63(1):5293-5305. [ Links ]
Box G.E.P. & D.W. Behnken. 1960. Simplex-Sum Designs: A Class of Second Order Rotatable Designs Derivable From Those of First Order. The Annals of Mathematical Statistics 31(4):838-864. https://doi.org/10.1214/aoms/1177705661 [ Links ]
Borges W.S., A.A.O. Moura, U. Coutinho, V. L. Cardoso & M. M. Resende.2015. Optimization of the operating conditions for rhamnolipid production using slaughterhousegenerated industrial float as substrate. Brazilian Journal of Chemical Engineering. 32(02):357 – 365. https://doi. org/10.1590/0104-6632.20150322s00003675 [ Links ]
Bu'lock J. & B. Kristiansen. 1991. Basic biotechnology. 1era. Edn. Edit. Acribia. I.S.B.N.: 978842000704-5. 586 p. [ Links ]
Crueguer W., A. Crueger.1993. Biotecnologia: Manual de microbiologia industrial. Sustratos para la fermentación industrial. 3era edn. Edit. Acribia. I.S.B.N.: 84-200-0743-9. 411 p. [ Links ]
De Souza R., A. Ambrosini & L. Passaglia. 2015. Plant growthpromoting bacteria as inoculants in agricultural soils. Genet Mol Biol. 38(4):401–419. https://doi.org/10.1590/S1415-475738420150053 [ Links ]
Dey R. K.K. Pal,DM Bhatt & S.M. Chauhan. 2004. Growth promotion and yield enhancement of peanut (Arachis hypogaea L.) by application of plant growth-promoting rhizobacteria. Microbiological Research 159(4):371-94. https://doi.org/10.1016/j.micres.2004.08.004 [ Links ]
Egamberdieva D., D. Jabborova & A. Hashem. 2015. Pseudomonas induces salinity tolerance in cotton (Gossypium hirsutum) and resistance to Fusarium root rot through the modulation of indole-3-acetic acid. Saudi Journal of Biological Sciences 22: 773–779. https://doi.org/10.1016/j.sjbs.2015.04.019 [ Links ]
Fatemeh A, Masoud T., Pejman A, Aidin H. 2014 Effect of plant growth promoting rhizobacteria (PGPRs) and stratification on germination traits of Crataegus pseudoheterophylla Pojark. Scientia Horticulturae 172: 61–67. https://doi. org/10.1016/j.scienta.2014.03.049 [ Links ]
Garcia-Ochoa F. & E. Gómez. 2009. Bioreactor scale-up and oxygen transfer rate in microbial processes: An overview. Biotechnology Advances 27:153–176. https://doi.org/10.1016/j.biotechadv.2008.10.006 [ Links ]
Gómez G. & C. Batista. 2006. Optimización de medios de cultivos para microorganismos, una valiosa estrategia para la producción de biopreparados de interés agrícola. Cultivos Tropicales. Instituto Nacional de Ciencias Agrícolas. 27(3):17-24. [ Links ]
Hansen M., L. Krsgelund, O. Nybroe & J. Sorensen 1997. Early colonization of barley roots by Pseudomonas fluorencens studied by immunofluorescence technique and confocal laser scanning microscopy. FEMS Microbiol. Ecol. 23(4)353-360. https://doi.org/10.1111/j.1574-6941.1997.tb00416.x [ Links ]
Kloepper J.W. & M. N. Schroth. 1980. Development of a Powder Formulation of Rhizobacteria for Inoculation of Potato Seed Pieces. Techniques. 71(6):590-592. [ Links ]
Macleod K., K. Rumbold & K. Padayachee. 2015. A systems approach to uncover the effects of the PGPR Pseudomonas koreensis on the level of drought stress tolerance in Helianthus annuus. Procedia Environmental Sciences 29:262–263. https://doi.org/10.1016/j.proenv.2015.07.200 [ Links ]
Mendieta J. 2016. Boletín estadístico de comercio exterior agrario. Sistema integrado de estadistica agraria (SIEA). [ Links ]
Monta-ez A., A. Rodríguez, C. Barlocco & M. Beracochea. 2012. Characterization of cultivable putative endophytic plant growth promoting bacteria associated with maize cultivars (Zea mays L.) and their inoculation effects in vitro. Applied Soil Ecology (58):21–28. https://doi.org/10.1016/j.apsoil.2012.02.009 [ Links ]
Najafpour G. 2015. Industrial Microbiology. Biochemical Engineering and Biotechnology. ISBN: 978-0-444-52845-2. 1–13 p. https://doi.org/10.1016/B978-0-444-63357-6.00001-8 [ Links ]
O'Callaghan M, Swaminathan, J. Lottm, D. Wright & TA. Jackson. 2006. Seed coating with biocontrol strain Pseudomonas fluorescens F113. NZ Plant Prot.59:80–85. [ Links ]
Ormeño E. & D. Zuñiga. 1998. Modificación del caldo extracto de levadura y manitol para la producción a mediana escala de inoculantes para leguminosas. Revista Peruana de Biología 5(2): 83:89. http://dx.doi.org/10.15381/rpb.v5i2.8323 [ Links ]
Ortiz P., K. Ogata & D. Zú-iga. 2017. Evaluation of plant growth promoting activity and heavy metal tolerance of psychrotrophic bacteria associated with maca (Lepidium meyenii Walp.) rhizosphere. AIMS Microbiology. 3(2):279-292. https://doi.org/10.3934/microbiol.2017.2.279 [ Links ]
Osawa C. E. Yabuuchi, Y. Narano, Y. Kosono, K. Takashina & K. Tanabe. 1963. Pigment production by Pseudomonas aeruginosa on glutamic acid medium and gel filtration of the culture fluid filtrate. Japan Microbiology and Immunology 7(3). https://doi.org/10.1111/j.1348-0421.1963. tb00246.x [ Links ]
Peng Y., Y. He, Z. Wu. J. Lu & L. Chun. 2014. Screening and optimization of low-cost medium for Pseudomonas putida Rs-198 culture using RSM. Brazilian Journal of Microbiology 45(4). https://doi.org/10.1590/S1517-83822014000400013 [ Links ]
Puente M., J. Garcia & A. Perticari. 2011. Inoculación de leguminosas forrajeras con rizobios eficientes. Revista Producir XXI. 19(232):68-71. [ Links ]
Peighami-Ashnaei A., A. Sharifi-Tehrani, M. Ahmadzadeh & K. Behboudi. 2008. Production of Pseudomonas fluorescens P-5 and P-6 for Bean Damping-off Disease. International Journal of Agriculture and Biology 10(5):573-576 [ Links ]
Ryu M, J. Kima, O. Choi, S.H. Kima & C.S. Park. 2006. Improvement of biological control capacity of Paenibacillus polymyxa E681 by seed pelleting on sesame. Biological Control 39:282–289. https://doi.org/10.1016/j.biocontrol.2006.04.014 [ Links ]
Santillana N. 2006. Producción de biofertilizantes utilizando Pseudomonas sp. Ecologia Aplicada. 5:87-91. https://doi. org/10.21704/rea.v5i1-2.322 [ Links ]
Thonart P. & K.J. Mputu. 2013. Optimisation of production, freezedrying and storage of Pseudomonas fluorescens btp1. International Journal of Microbiology Research 5(2):371-374. https://doi.org/10.9735/0975-5276.5.2.371-374 [ Links ]
Torres A. D. Quinteros & L. Atehortúa. 2008. Determinación de la velocidad específica de consumo de oxígeno en microorganismos incluyendo el tiempo de respuesta del electrodo de oxígeno. Revista Facultad de Ingeniería –Universidad de Antioquia. 43: 33-41. [ Links ]
Trujillo M. & N. Valdez. 2006. El estrés hidrodinámico: Muerte y da-o celular en cultivos agitados. Revista latinoamericana de microbiologia. 48(3-4): 269 – 280. [ Links ]
Vanegas D. & M. Ramirez. 2016. Correlación del Crecimiento de Pseudomonas fluorescens en la Producción de Polihidroxialcanoatos de Cadena Media (PHAMCL) mediante Modelos Primarios de Gompertz, Logístico y Baranyi. Información Tecnológica 27(2):87-96. http://dx.doi.org/10.4067/S0718-07642016000200011 [ Links ]
Vyas P., P. Rahi, B.S. Chadha & A. Gulati. 2014. Statistical Optimization of Medium Components for Mass Production of Plant Growth-Promoting Microbial Inoculant Pseudomonas trivialis BIHB 745 (MTCC5336). Indian Journal of Microbiology 54(2): 239–241. https://doi.org/10.1007/s12088-013-0425-9 [ Links ]
Widnyana K. & C. Javandira. 2016. Activities Pseudomonas spp. and Bacillus sp. to Stimulate Germination and Seedling Growth of Tomato Plants. Agriculture and Agricultural Science Procedia 9: 419 – 423. https://doi.org/10.1016/j.aaspro.2016.02.158 [ Links ]
Wu Y., J.Tao & S.F. Zhao. 2008. Optimizing the fermentation conditions for Bacillus sp. combination CL-8 thalli with cooperative and synergistic action and its biocontrol efficacy. Transactions of the Chinese Society of Agricultural Engineering 24:204–208. [ Links ]
Presentado: 11/12/2017
Aceptado: 03/02/2018
Publicado online: 28/05/2018
*Autor para correspondencia
Email Doris Zúñiga: dzuniga@lamolina.edu.pe
Email Martin Guerra: martin20_15@hotmail.com