Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Medica Herediana
versión impresa ISSN 1018-130Xversión On-line ISSN 1729-214X
Rev Med Hered v.8 n.1 Lima ene. 1997
Avances recientes en VIH/SIDA: Terapia antiretroviral.
Recent advances in HIV/AIDS: Antiretroviral therapy.
Scerpella Ernesto*, Campo Rafael*.
*Departamento de Medicina y Programa de SIDA para Adultos, Escuela de Medicina de la Universidad de Miami. Miami, Florida.
SUMARY
Recent advances in our understanding of HIV infection in patients with the acquired immunodeficiency syndrome (AIDS) are leading us to explore new treatment strategies, including the use of combination antiretroviral therapy. In this review, we present information from recently completed clinical trials explore the use of combination therapy, including ACTG 175, the Delta studies, and the NUCA studies. In addition, we present preliminary about use of protease inhibitors, the newest class of antiretrovirals. (Rev Med Hered 1997; 8: 23-31).
KEY WORDS: HIV, AIDS, antiretroviral therapy.
INTRODUCCIÓN
Durante los últimos meses han ocurrido muchos cambios en nuestra manera de entender la fisiopatología y patogénesis de la infección causada por el virus de la inmunodeficiencia humana (HIV, HIV-1) en pacientes con el síndrome de inmunodeficiencia adquirida SIDA). Dos años atrás fuimos sorprendidos por los hallazgos presentados por los grupos de Ho et al. en Nueva York, y Shaw et al en Alabama, respecto a la gran capacidad de replicación que este virus posee (1-2). Los cálculos más recientes (3) indican que el número total de partículas virales producidas diariamente es del orden de 1010 viriones/día. La duración mínima del ciclo vital de HIV es un promedio de 1.2 días, de los cuales 0.6 días transcurren en plasma a manera de virus libre extracelular; y el tiempo de sobrevida de los linfocitos CD4 infectados productivamente es de 2.2 días. Estos hallazgos nos proveen de un modelo kinético de patogénesis, en el cual la replicación continua y a gran escala de HIV es la fuerza principal que media la destrucción de los linfocitos CD4, fuerza que nuestro sistema inmune trata de equiparar continua y permanentemente para tratar de llegar a un estado de equilibrio estable. Cuando este equilibrio se balancea a favor del virus el resultado es progresión de la enfermedad con destrucción subsecuente de linfocitos CD4, hasta que se alcanza un nuevo estado de equilibrio, pero este nuevo equilibrio ocurre a un grado más avanzado en la evolución clínica de la enfermedad. De lo dicho a la vez se concluye que drogas que causen una disminución o arresto de la replicación viral pueden alterar este equilibrio a favor de nuestro sistema inmune.
Actualmente se encuentran disponibles métodos directos y sensibles para medir la cantidad de RNA viral presente en plasma (HIV-RNA, la llamada carga viral). Dos de los métodos comercialmente disponibles en los Estados Unidos para medir la carga viral incluyen la reacción en cadena de la polimerasa (PCR) y amplificación de señal utilizando sondas de DNA (b-DNA assay). Una discusión detallada de estos métodos va más allá de los propósitos de esta revisión. Simplemente nos limitaremos a decir que la cuantificación de la carga viral puede ayudar a predecir las posibilidades de progresión de la enfermedad a largo plazo así como la probable sobrevida de las personas infectadas con HIV. Al mismo tiempo, una disminución en los valores de carga viral puede ser utilizada como un indicador positivo de la eficacia del tratamiento utilizado en cada paciente. En contraste, aumentos progresivos en los valores de carga viral pueden señalar de manera mucho más temprana que los recuentos de linfocitos CD4 la posible falla de tratamiento, deterioro clínico futuro, y emergencia de cepas virales resistentes a los medicamentos antiretrovirales.
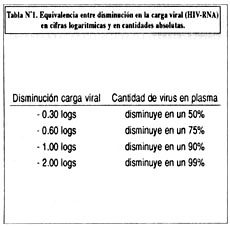
La carga viral es expresada como el número de copias del material genético viral presente en un mililitro de plasma (copias/mL). Debido a que el número de copias presente en pacientes con grados avanzados de la enfermedad puede ser bastante alto (del orden de los cientos de miles o millones de copias/mL de plasma), se ha convenido en transformar este número a la escala logarítmica. Así tenemos por ejemplo que 100,000 copias/mL se convierte en una carga viral de 5.0 en la escala logarítmica. A lo largo de la presente revisión, cuando hablemos de la efectividad de los tratamientos utilizados nos referiremos a la disminución de la carga viral en cifras logarítmicas, cuyas correlación con cifras absolutas es necesario tener presente a manera de referencia (Tabla Nº1).
A continuación revisaremos los avances recientes más importantes en lo referente al tratamiento de la infección causada por HIV, señalando algunos de los estudios más significativos y discutiendo el posible impacto de los resultados de estos estudios en nuestra práctica clínica diaria.
TERAPIA COMBINADA: ¿QUE APRENDIMOS DE ACTG 175, DELTA, Y NUCA?
Desde que la zidovudina (ZDV, AZT) fue aprobada en 1987, hemos aprendido muchas cosas acerca del tratamiento de la infección HIV y SIDA utilizando medicamentos antiretrovirales. Sabemos que la terapia antiretroviral retarda el progreso de la enfermedad y prolonga la sobrevida de los pacientes, sin embargo la duración de este beneficio clínico cuando se utiliza monoterapia es limitada, y correlaciona con una supresión incompleta de la replicación viral y la aparición de cepas virales con una susceptibilidad disminuída al medicamento utilizado. Siguiendo de cierta manera el modelo de tuberculosis en el que se combinan medicamentos para disminuir la emergencia de resistencia a la vez que aumentamos la potencia (capacidad esterilizante) del tratamiento utilizado, existía desde hace algún tiempo interés en explorar el uso de medicamentos antiretrovirales en combinación.
1. ACTG 175
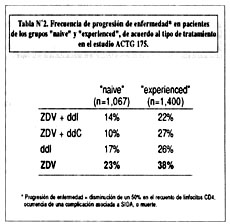
El estudio ACTG 175 fue diseñado para comparar el uso de monoterapia versus terapia combinada (4). Pacientes con HIV en estadío intermedio, con recuentos de linfocitos CD4 entre 200-500 células/m L (promedio 350 células/m L) fueron randomizados a uno de 4 posibles tratamientos: monoterapia con ZDV, monoterapia con didanosina (ddI), combinación ZDV+ddI, y combinación ZDV + zalcitabina (ddC). Un total de 2,467 pacientes fueron enrolados y seguidos por aproximadamente 3 años. Del total de 2,467 pacientes, un subgrupo de 1,067 no había recibido nunca ninguna terapia antiretroviral (grupo "naive"). Los restantes 1400 habían sido ya tratados anteriormente, la gran mayoría con ZDV (grupo "experienced"). Los resultados del estudio se muestran en la Tabla Nº2.
Los pacientes que recibieron monoterapia con ddI y combinación de antiretrovirales (ZDV + ddI y ZDV + ddC) respondieron mejor que los que recibieron monoterapia con ZDV. Las tendencias favorecieron el uso de combinación sobre ddI, y el uso de combinación ó ddI sobre ZDV. El uso de terapia combinada en pacientes "naive" and "experienced" ofrece una clara ventaja cuando se compara con el inicio o continuación de monoterapia con ZDV. Se observa también que los pacientes del grupo "naive" respondieron mejor que los del grupo "experienced", lo cual se puede explicar por la probable existencia de cepas virales resistentes a ZDV debido a su uso previo en los pacientes "experienced", lo cual se puede explicar por la probable existencia de cepas virales resistentes a ZDV debió a su uso previo en los pacientes "experienced", lo que disminuiría la utilidad de combinaciones que incluyan ZDV. Un hallazgo inesperado fue el hecho de que la monoterapia con ddI dio mejores resultados que la monoterapia con ZDV. Los resultados en adultos del estudio ACTG 175 han sido corroborados en un estudio pediátrico recientemente terminado (ACTG 152).
En un subgrupo de pacientes enrolados en ACTG 175 se llevó a cabo un estudio virológico (5-6). Los resultados del análisis virológico fueron paralelos a los resultados del estudio clínico. Terapia antiretroviral combinada causó una mayor supresión de la carga viral en comparación con monoterapia. Los pacientes con los mayores niveles de HIV-RNA al comienzo del estudio tuvieron las más altas frecuencias de progresión (Tabla Nº3).
Una disminución de 1 logaritmo en la carga viral estuvo asociada con una reducción del 50% en el riesgo de progresión de la enfermedad. Los mejores factores para definir el pronóstico de los pacientes fueron los cambios observados en la carga viral en las primeras 8 semanas, y los cambios observados en el recuento de linfocitos CD4 luego de 52 semanas de tratamiento. Es evidente que usando la carga viral se puede evaluar la respuesta al tratamiento rápidamente, midiendo las diferencias entre la carga viral al inicio de tratamiento y la carga viral a las 8 semanas de comenzado el mismo.
2. Estudio DELTA
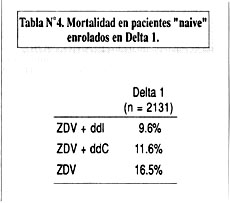
Al mismo tiempo ACTG 175 se desarrollaba en los Estados Unidos, un estudio similar se desarrollaba en Europa y Australia, denominado estudio Delta (7). En Delta se estudió una población en un estadío más avanzado que la estudiada en ACTG 175. Pacientes con recuentos de linfocitos CD 4 por debajo de 350 células/m L (promedio aproximado 200 células/m L), con ARC ó SIDA fueron randomizados a uno de 3 posibles tratamientos: monoterapia con ZDV, combinación ZDV+ddI, y combinación ZDV+ddC. Un total de 3,214 pacientes fueron enrolados y seguidos por más de 2 años. De ese total de pacientes, un subgrupo de 2,131 no habían recibido nunca ninguna terapia antiretroviral (grupo "naive" - subestudio Delta I). Los restantes 1083 habían sido ya tratados anteriormente, la gran mayoría con ZDV (grupo "experienced" - subestudio Delta II). Los resultados del subestudio Delta I se muestran en la Tabla Nº4).
En Delta I (grupo "naive") se observó una mejor sobrevida en los pacientes que recibieron terapia combinada versus monoterapia con zidovudina (p=0.0003), con una disminución en la mortalidad del 38%. No se observaron diferencias significativas entre los diferentes grupos de tratamiento en los pacientes del grupo "experienced" enrolados en Delta II. Los resultados combinados de Delta I y II señalan una reducción en la mortalidad de aproximadamente 20% a favor de terapia combinada.
3. Conclusiones de los estudios ACTG 175 y DELTA
Los resultados de estos 2 estudios confirman que el uso de terapia antiretroviral retarda en forma significativa la progresión de la enfermedad causada por HIV. Estos resultados se obtuvieron en pacientes en estadíos intermedios y avanzados, sobre un amplio rango de CD4s. Monoterapia con ZDV deja de ser la terapia inicial de elección o "gold standart" en pacientes infectados con HIV. Las opciones como terapia combinada utilizando por lo menos 2 medicamentos de acuerdo a los resultados de estos estudios, y considerando que los pacientes que no han sido tratados previamente (grupo "naive") responden mejor, lo que indica que un tratamiento agresivo en forma temprana puede lograr mejores resultados.
Al mismo tiempo estos estudios provocan nuevas preguntas. Por ejemplo, ¿deben los pacientes que actualmente reciben monoterapia con ZDV cambiar de terapia?, la respuesta es un rotundo sí. ¿Cuál es el papel actual de los estudios clínicos grandes multicéntrico en esta era de PCR, b-DNA y cargas virales? A este respecto fue bueno ver la correlación existente entre los resultados clínicos y virológicos del estudio ACTG 175, y en el futuro probablemente veremos estudios más cortos cuyas conclusiones serán basadas en los resultados de diversos marcadores de laboratorio.
4. Lamivudina (3TC)
Lamivudina (3TC) fue recientemente aprobada para el tratamiento de los pacientes con HIV. Pertenece a la familia de los nucleósidos inhibidores de la transcriptasa reversa al igual que ZDV, ddI, ddC, y stavudina (d4T). Lamivudina tiene actividad in vitro contra una gran variedad de cepas de HIV, incluyendo cepas resistentes a ZDV. Cuando se usa 3TC como monoterapia encontramos que el medicamento pierde efectividad en pocas semanas, y que a través de una mutación en el codon 184 de la porción del material genético viral que codifica la enzima transcriptasa reversa, HIV desarrolla resistencia de alto grado con una disminución de la susceptibilidad a 3TC en el orden de 500 a 1000 veces. Sin embargo, parece ser que la mutación en el codon 184 es desventajosa para el virus, y esto permite que cuando se combina 3TC con otros antiretrovirales como ZDV se observe una potenciación del efecto de los mismos, con una disminución en la frecuencia de aparición de cepas resistentes a ZDV. Es importante menciona que la mutación en el codon 184 puede al mismo tiempo causar resistencia aun que de bajo grado a la acción de ddI y ddC con una disminución de la susceptibilidad de HIV a estos medicamentos en el orden de 4 a 8 veces.
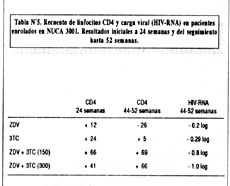
El uso de 3TC como monoterapia y en combinación en pacientes "naive" y "experienced" fue estudiado en los Estados Unidos en los estudios NUCA 3001 y NUCA 3002, respectivamente. NUCA 3001 (8) fue un estudio de 366 pacientes "naive" con recuentos de linfocitos CD4 entre 200-500 células/m L, randomizados a uno de 4 posibles tratamientos: monoterapia con ZDV, monoterapia con 3TC, y 2 combinaciones de ZDV +3TC (ZDV 600 mg/d y 3TC a 150 o 300 mg dos veces al día). Los resultados del estudio se muestran en la Tabla Nº5.
Puede apreciarse que las diferencias iniciales a 24 semanas se acentuaron aún más cuando se continuó el tratamiento más allá de las 52 semanas, punto en el cual la diferencia entre los pacientes recibiendo monoterapia con ADV versus terapia combinada era de aproximadamente 100 células CD4. Luego de 52 semanas de tratamiento, 10/66 (15%) pacientes recibiendo la combinación de ZDV+3TC tenían niveles indetectables de HIV-RNA (<500 copias/mL). En contraste, ninguno de los pacientes en monoterapia tuvo disminuciones de la carga viral a niveles indetectables.
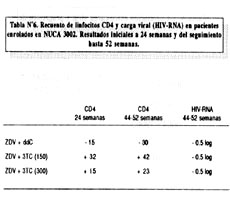
NUCA 3002 (9) fue un estudio de 254 pacientes que habían recibido antiretrovirales previamente (grupo "experienced"), con un grado más avanzado de enfermedad y con recuentos de linfocitos CD4 entre 100-300 células/m L. Estos pacientes fueron randomizados a una de 3 posibles combinaciones: ZDV+ddC(ZDV 600/mg/d y ddC 2.25 mg/d), y 2 combinaciones de ZDV+3TC(ZDV 600mg/d y 3TC a 150 o 300 mg dos veces al día). Los resultados del estudio se muestran en la Tabla Nº6.
Nuevamente podemos apreciar que la combinación de ZDV+3TC tiene un efecto sostenido que parece acentuarse con el paso del tiempo. Basados en los resultados de estos estudios, 3TC ha sido aprobado para se usado a la dosis de 150 mg dos veces al día en combinación con ZDV. Los resultados de los estudios NUCA demuestran que ZDV+3TC es una de las combinaciones más potentes entre los nucleósidos inhibidores de la transcriptasa reversa, con un efecto durable y manifiesto tanto en pacientes "naive" como en el grupo "experienced". Podemos afirmar que el uso de ZDV+3TC podría ser apropiado como terapia inicial en pacientes infectados con HIV que aún se encuentran asintomáticos, confirmando y expandiendo las conclusiones obtenidas inicialmente en los estudios ACTG 175 y Delta. Se desconoce aún si la combinación de 3TC con otros nucleósidos inhibidores de la transcriptasa reversa diferentes de ZDV producirá los mismos resultados. Una llamada de atención debe hacerse al hecho de que la resistencia a 3TC mediada por la mutación en el codon 184 conlleva en sí cierto grado de disminución de la sensibilidad de ddI y ddC, y el uso inicial de 3TC podría disminuir la efectividad de futuras combinaciones que incluyan a ddI y ddC.
Adicionalmente, mencionaremos que resultados preliminares recientemente presentados acerca del uso en combinación de ddI+d4T (10) sugieren que ésta puede ser una alternativa promisoria, lo que continúa confirmando que el uso en combinación de los nucleósidos inhibidores de la transcriptasa reversa ofrece las ventajas de una mayor inhibición de la replicación viral, lo que probablemente resulte en un mayor incremento en el recuento de linfocitos CD4 con una menor posibilidad de desarrollo de resistencia a los medicamentos, lo cual se traduciría en una mejoría en la calidad de vida y sobrevida de nuestros pacientes.
LOS INHIBIDORES DE LA PROTEASA VIRAL: UNA NUEVA GENERACION DE DROGAS ANTIRETROVIRALES
Hasta hace poco tiempo, todos los medicamentos antiretrovirales aprobados para uso en pacientes con HIV y SIDA pertenecían a la familia de los nucleósidos inhibidores de la transcriptasa reversa, tal como el caso de ZDV, ddI, ddC, d4T y 3TC. Estas drogas actúan inhibiendo en forma competitiva la conversión o transcripción del RNA viral en DNA en una fase temprana del ciclo vital de HIV y si bien puede prevenir la infección aguda de nuevas células, tienen efecto limitado en las células crónicamente infectadas.
La enzima proteasa (o proteinasa) que posee HIV es una enzima que actúa en la fase final del ciclo viral permitiendo el procesamiento y ensamblaje de los diferentes componentes proteicos esenciales presentes en el provirus un virión maduro y con capacidad infectante. Los inhibidores de proteasa constituyen una clase totalmente nueva de medicamentos antiretrovirales, con estructura y modo de actual diferente a los nucleósidos inhibidores de la transcriptasa e irreversible la actividad de la proteasa de HIV. La inhibición de la enzima proteasa de HIV causa la generación de viriones inmaduros, no infecciosos, lo cual interrumpe la propagación viral.
Los inhibidores de proteasa son de las medicinas antiretrovirales más potentes con las que contamos actualmente y suprimen en forma efectiva la replicación viral, causando una disminución en la cantidad de virus presente en plasma que es de varios órdenes de magnitud. Estas drogas no requieren ser activadas (o fosforiladas como los nucleósidos), y por ello ejercen actividad contra una amplia variedad de células, incluyendo linfocitos en replicación activa y linfocitos crónicamente infectados.
Debido a su diferente mecanismo de acción pueden ser utilizados en combinación con los nucleósidos inhibidores de la transcriptasa reversa.
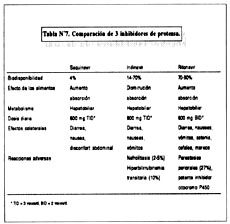
Hasta la fecha, 4 inhibidores de proteasa han sido aprobados por la Administración Federal de Drogas y Alimentos (FDA) para su uso en los Estados Unidos. Saquinavir (Invirase - laboratorios Roche) fue el primero en ser aprobado en Diciembre de 1995, y fue rápidamente seguido de ritonavir (Norvir - laboratorios Abbott) e indinavir (Crixivan - laboratorio Merck) en febrero y marzo de 1996 y nelfinavir (Viracef - laboratorios Aqouran) (Tabla Nº7).
1. Saquinavir (SAQ)
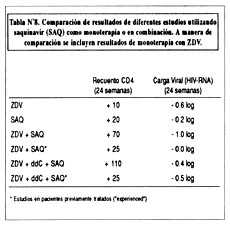
En el estudio ACTG 229(11) participaron 302 pacientes con enfermedad avanzada, con recuentos de linfocitos CD4 entre 50-300 células/m L (media: 156 células/m L). Todos los pacientes habían sido previamente tratados con ZDV (promedio 843 días), y 36% previamente tratados con ZDV+ddC (pacientes "experienced"). Los pacientes fueron randomizados a 3 posibles combinaciones: ZDV+ddC versus ZDV+SAQ versus ZDV+ddC+SAQ. Los pacientes que recibieron terapia triple (ZDV+ddC+SAQ) tuvieron mejores resultados que los pacientes que recibieron solamente 2 drogas en combinación. Los incrementos en CD4s (+25 células/m L) y disminuciones en la carga viral (-0.5 logs) observados a las 24 semanas en pacientes recibiendo terapia triple no son tan impresionantes, lo que probablemente refleja en parte el hecho de ser pacientes "experienced". Es de notar de que debido a su muy baja biodisponibilidad (4%, rango: 1-9%) la potencia de saquinavir es relativamente baja in vivo, a pesar de ser uno de los inhibidores de proteasa más potente in vitro.
Los resultados de los estudios con saquinavir como monoterapia o terapia combinada se muestran en la Tabla Nº8.
2. Ritonavir (RIT)
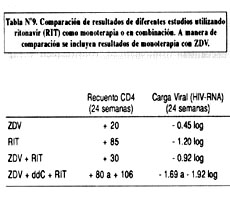
El estudio 247 (12) incluyó a 1090 pacientes con enfermedad muy avanzada, con recuentos de linfocitos CD4 por debajo de 101 células/m L (promedio: 32 células/m L), todos previamente tratados ("experienced"), a quienes se les ofreció añadir tratamiento al momento de ser enrolados. La mortalidad a 6 meses fue menor en el grupo que recibió RIT (5.8%, vs. 10.1% en el grupo placebo). Igualmente las medidas de progresión de la enfermedad mostraron una reducción del 50% en el grupo que recibió RIT (17%, vs 34% con placebo). En un subgrupo de pacientes en quienes se hicieron estudios virológicos (13), se observaron mayores incrementos en el recuento de CD4s en los pacientes que recibieron RIT (+50 células/m L a 16 semanas vs. +2 con placebo) así como mayores disminuciones en la carga viral (-0.6 logs a 16 semanas vs 0.0 logs con placebo). Con este estudio, RIT se convierte en el primer inhibidor de proteasa en demostrar un efecto beneficioso en la sobrevida de los pacientes tratados.
En la Tabla Nº9, se muestra los resultados del tratamiento con ritonavir.
Ritonavir es un potente inhibidor de varias de las enzimas del citocromo P450, y tiene varias interacciones medicamentosas potenciales. Es importante al utilizar ritonavir o cualquiera de los otros inhibidores de proteasa el conocer las drogas que son contraindicadas así como las posibles alternativas. Dado que los inhibidores de proteasa es un grupo nuevo de medicinas es importante revisar toda la información disponible cuando comenzamos a utilizarlos hasta que nos familiaricemos con ellos.
3. Indinavir (IND)
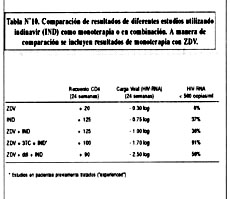
El estudio 035 (14) incluyó a pacientes previamente tratados con ZDV (grupo "experienced"), con un recuento promedio de linfocitos CD4 de 174 células/m L, quienes fueron randomizados a 3 posibles tratamientos: monoterapia con IND versus ZDV + 3 TC versus IND+ZDV+3TC. Al cabo de 6 meses, se observó una disminución de la carga viral de - 1.7 logs en los pacientes recibiendo IND+ZDV+3TC, -1.0 logs en los pacientes que recibieron IND solamente, y -0.7 logs en los pacientes randomizados a ZDV+3TC. Igualmente se observó un incremento en el recuento de linfocitos CD4 de aproximadamente + 100 células/m L en los dos grupos de pacientes que recibieron IND (monoterapia como parte de una triple-terapia) en comparación con 33 células /m L en los pacientes tratados con ZDV+3TC. Al cabo de 24 semanas, 20/22 (91%) pacientes tomando IND+ZDV+3TC tenían niveles indetectables de HIV+RNA en plasma (menos de 500 copias/mL), en comparación con 7/20 (35%) en IND monoterapia, y 0/19 recibiendo ADV+3TC. Los resultados del tratamiento utilizado indinavir, se aprecian en la Tabla Nº10.
Es importante recordar que los diferentes estudios en las Tablas 8 al 10 fueron realizados en poblaciones diferentes de pacientes, así que no es siempre posible comparar los diferentes resultados cara a cara. Sin embargo la presentación conjunta de los mismos nos permite sacar algunas conclusiones respecto a la potencia relativa de las diferentes opciones de tratamiento, y la ventaja de combinar diferentes medicaciones. A continuación presentaremos 2 casos clínicos de nuestra experiencia para ilustrar la utilidad y potencia de estas nuevas drogas.
Caso Clínico Nº1
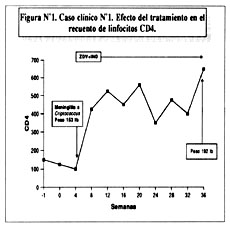
Varón de 35 años de edad recientemente diagnosticado con serología positiva para HIV. Recuento inicial de linfocitos CD4 fue 190 células/m L. A las 3 semanas de ser diagnosticado, el paciente desarrolla meningitis debida a Cryptococcus neoformans. Una vez resuelto este episodio, se decide comenzar terapia con la combinación de ZDV más un inhibidor de proteasa (indinavir en este caso). El efecto del tratamiento en el reucento de linfocitos CD4 se muestra en la Figura Nº1.
Puede observarse la respuesta tan significativa en el recuento de CD4s, que aumentó de aproximadamente 150 células/m L (al momento el paciente fue diagnosticado con meningitis) hasta un nivel por encima de 600 células/m en el último control. Físicamente el paciente se sintió muy mejorado, aumentando casi 40 libras en el mismo lapso de tiempo. Es importante reconocer que este paciente no había recibido terapia antiretroviral previamente (paciente "naive"), lo que en parte le explica la respuesta tan excelente al tratamiento.
Caso Clínico Nº2
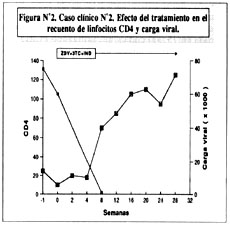
Paciente varón hispano de 47 años de edad con SIDA. Seropositivo para HIV desde 1989. El recuento más reciente de linfocitos CD4 fue 25 células/m L. Al mismo tiempo, la carga viral fue cuantificada en 75,000 copias/mL utilizando PCR. Complicaciones relacionadas a SIDA incluyen hepatitis crónica, herpes genital, sarcoma de Kaposi cutáneo y con compromiso de los ganglios linfáticos inguinales bilaterales por lo que recibía tratamientos de radioterapia. Tratamiento antiretroviral previo incluye ZDV monoterapia (1990-1991), ddI monoterapia (1992-1993), y d4T monoterapia (a partir de 1995). El paciente fue enrolado en un protocolo de investigación utilizando un inhibidor de proteasa (indinavir en este caso) en combinación con ZDV y 3TC. El tratamiento con radioterapia para sarcoma de Kaposi fue interrumpido al iniciar el tratamiento triple antiretroviral. El efecto del tratamiento en el recuento de linfocitos CD4 se muestra en la Figura Nº2.
Puede apreciarse una elevación significativa en el conteo de CD4s (cuadrados blancos) de un nivel inicial de 25 células /m L a un conteo estable por encima de 100 células/m L. La carga viral (cuadrados negros) disminuyó rápidamente a niveles por debajo de 200 copias/mL (indetectable). Al mismo tiempo se notó una mejoría significativa en las lesiones de sarcoma de Kaposi: a las 24 semanas de tratamiento triple antiretroviral desaparecieron las lesiones cutáneas de Kaposi así como la induración presente en los ganglios inguinales, que retornaron a un tamaño normal. Para poner estos resultados en perspectiva hay que tener presente el estado de inmunosupresión tan avanzado de este paciente al inicio del tratamiento con inhibidores de proteasa, además del uso previo de diferentes nucleósidos a lo largo de los años (paciente "experienced").
En el futuro cercano veremos varios nuevos medicamentos introducidos en el mercado. Candidatos incluyen una larga lista de nuevos inhibidores de proteasa que se encuentran en fases de desarrollo, nuevos nucleósidos algunos tan potentes como los inhibidores de proteasa actuales, y drogas pertenecientes a 2 nuevas familias: los nucleótidos (que no necesitan ser fosforilados) y los no-nucleósidos inhibidores de la transcriptasa reversa (inhiben la enzima de manera no-competitiva), entre otros posibles candidatos. También veremos un incremento en el uso de las pruebas para medir carga viral (HIV-RNA) en el momento de toma de decisiones en cuanto a tratamiento, y en el seguimiento. Qué drogas se deben utilizar en cada caso particular continúa siendo una decisión que deberá basarse en el conocimiento del paciente, estadío de la enfermedad, posibles efectos tóxicos, interacción con otras drogas siendo utilizadas, y costos.
REFERENCIAS BIBLIOGRAFICAS
1.Ho DD, Neumann AU, Perelson AS, et al. Rapid turnover of plasma virions and lymphocytes in HIV-1 infection. Nature 1995; 373: 123-126. [ Links ]
2.Wei X, Ghosh SK, Taylor ME, et al. Viral dynamics in human immunodeficiency virus type 1 infection. Nature 1995; 373: 117-122. [ Links ]
3.Perelson AS, Neumann AU, Markowitz M, Leonard JM, Ho DD. HIV-1 dynamics in vivo: Virion clearance rate, infected cell lifespan, and viral generation time. Washington DC: Third Conference on Retroviruses and Opportunistic Infections;1996. [ Links ]
4.Hammer S, Katzenstein D, Hughes M, Gundacker H, Hirsch M, Merigan T, ACTG 175 Study Team. Nucleoside monoterapy (MT) vs. Combination therapy (CT) in HIV infected adults: A randomized, double-blind, placebo-controlled trial in persons with CD4 cell counts 200-500/mm. San Francisco, California: Thirty-fifth Interscience Conference on Antimicrobial Agents and Chemotherapy (ICAAC); 1995. [ Links ]
5.Katzenstein D, Hammer S, Hughes M, ACTG 175 Virology Team. Plasma virion RNA in response to early antiretroviral drug therapy in ACTG 175. Do changes in virus load parallel clinical and immunologic outcomes? San Francisco, California:Thirty-fifth Interscience Conferencie on Antimicrobial Agentes and Agents and Chemotherapy (ICAAC); 1995. [ Links ]
6.Hammer SM, Katzenstein DA, Hughes MD, Hirsch MS, Merigan TC, ACTG 175. Virology Substudy Team. Virologic markers and outcome in ACTG 175. Washington DC: Third Conference on Retroviruses and Opportunistic Infections;1996. [ Links ]
7.Gazzard B, International coordinating committee. further results from the european/australian delta trial. Washington, DC: Third Conference on Retroviruses and Opportunistic Infections;1996. [ Links ]
8.Eron JJ, Quinn JB, Hill-Prince S, Rooney J, Rubin M, North American HIV Working Party. 52 week follow-up of NUCA 3001: 3TC, zidovudine (ZDV) or both in the treatment of HIV-positive patients with CD4 cell counts of 200-500 cells/mm. Washington DC: Third Conference on Retroviruses and Opportunistic Infections;1996. [ Links ]
9.Barlett JA, Johnson VA, Quinn JB, Benoit SL, Rubin M, NUCA 3002 Study Group. Long-term safety and efficacy of lamivudine (3TC) plus zidovudine (ZDV) compared with zalcitabine (ddC) plus ZDV in ZDV - experienced patients with absolute CD4 cells of 100-300/mm. Washington DC: Third Conference on Retroviruses and Opportunistic Infecctions; 1996. [ Links ]
10.Pollard R, Peterson D, Hardy D, et al. Antiviral effect and safety of stavudine (d4T) and didanosine (ddI) combination therapy in HIV-infected subjects in an ongoing pilot randomized double-blinded trial. Washington, DC: Third Conference on Retroviruses and Opportunistic Infections;1996. [ Links ]
11.Collier AC, Coombs RW., Schoenfeld DA, et al. Treatment of human immunodeficiency virus infection with saquinavir, zidovudine, and zalcitabine. N Engl J Med 1996; 334: 1011-1017. [ Links ]
12.Cameron B, Heath-Chiozzi M, Kravcik S, et al. Prolongation of life and prevention of AIDS in advanced HIV immunodeficiency with ritonavir. Washington, DC: Third Conference on Retroviruses and Opportunistic Infections; 1996. [ Links ]
13.Healt-Chiozzi M, Leonard J, Henry D, et al. Anti-HIV activity and lymphocyte surrogate marker response dynamics to ritonavir therapy in advanced HIV immunodeficiency. Washington, D:Third Conference on Retroviruses and Opportunistic Infections; 1996. [ Links ]
14.Gulick R, Mellors J, Havlir D, et al. Potent and sustained antiretroviral activity of indinavir in combination with zidovudine and lamivudine (3TC). Washington, DC: Third Conference on Retroviruses and Opportunistics Infections; 1996. [ Links ]
Correspondencia
Ernesto G. Scerpella, M.D.
University of Miami School of Medicine.
Departament of Medicine. Special Immunology (D-90A).
P.O.Box 016960. Miami, FL 33101
Teléfono: (305) 243-4598
Fax: (305) 243-4037