Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Medica Herediana
versión impresa ISSN 1018-130Xversión On-line ISSN 1729-214X
Rev Med Hered v.21 n.3 Lima jul. 2010
Epidemiología de la colonización intestinal con enterococo resistente a vancomicina en pacientes de alto riesgo del Hospital Nacional Edgardo Rebagliati Martins. Lima, Perú.
Epidemiology of intestinal tract colonization with vancomycin resistant enterococci in high risk patients in the Edgardo Rebagliati Martins National Hospital. Lima, Perú.
Wilfredo Flores-Paredes1.
1
Médico Patólogo Clínico. Hospital Nacional Guillermo Almenara Irigoyen. Lima,Perú.
RESUMEN
Objetivos: Determinar la prevalencia y los factores de riesgo asociados a la colonización intestinal con enterococo resistente a vancomicina (ERV) en pacientes de alto riesgo. Material y métodos: El hospital Rebagliati es un hospital docente de 1492 camas. Se realizó un estudio transversal para determinar tasas de prevalencia. En la fecha de estudio (23 Agosto 2004), 243 pacientes de alto riesgo de colonización con ERV fueron enrolados al estudio y se les tomó una muestra de hisopado rectal para el aislamiento microbiológico de ERV. Para identificar los factores asociados se realizó un estudio caso control (28 casos y 28 controles). Resultados: La prevalencia de colonización con ERV en pacientes de alto riesgo fue de 11,5% (28/243). La prevalencia en áreas de alto riesgo (UCI, unidades de transplante, oncohematología, nefrología) y en áreas de bajo riesgo (los demás servicios) fue muy similar: 11,6% y 11,5% respectivamente. En medicina interna (16,9%) se halló tasas casi tan altas como en las UCI (18,2%). Los factores de riesgo asociados a la colonización con ERV fueron: postración crónica, hemodiálisis, exposición a múltiples procedimientos invasores y exposición a antibióticos de amplio espectro. El tratamiento con "antibióticos relacionados a ERV" (vancomicina, cefalosporinas de 3ra generación, agentes antianaeróbicos), y en particular con los agentes antianaeróbicos, se relacionaron con la colonización con ERV. Conclusión: El ERV ha emergido hasta volverse endémico en la institución y gran parte de los servicios hospitalarios ya han sido expuestos. Esta emergencia se debe principalmente a las deficientes técnicas de control de infecciones, al uso de antibióticos de amplio espectro y a la presencia de reservorios. Esclarecer la epidemiología del ERV en la institución permite aplicar medidas estratégicas para controlar su diseminación. (Rev Med Hered 2010;21:128-138).
PALABRAS CLAVE: Resistencia a la vancomicina, Enterococcus, epidemiología, vigilancia.
SUMMARY
Objectives: To determine the prevalence and the risk factors associated to colonization with vancomycin resistant enterococci (VRE) in high risk patients. Material and methods: The Hospital Rebagliati is a 1492-bed teaching hospital. A Cross-Sectional Study was applied to determine the point prevalence. The day of the study (August 23rd, 2004), 243 high risk patients were enrolled to the study and a stool samples were obtained by rectal swab for microbiology identification of VRE. To identify the risk factors associated with VRE colonization a Case-Control Study (28 cases and 28 controls) was done. Results: The prevalence of VRE colonization in high risk patients was 11.5% (28/243). The rate of colonization in high-risk wards (ICUs, transplant units, oncohematology, nephrology) and low-risk wards (the rest of inpatient units) was similar: 11.6% and 11.5% respectively. In internal medicine the rates were almost as high as in ICUs (16.9% and 18.2% respectively). Bed/chair-bound state, hemodialysis, exposure to multiple invasive procedures, and exposure to broad spectrum antibiotics were the risk factors related to VRE colonization. Having received a VRE related antibiotic (vancomycin, third-generation cephalosporins and antianaerobic drugs), particularly antianaerobic drugs, were related to VRE colonization. Conclusion: The VRE has emerged until becoming endemic inside the institution and great part of the hospital was already exposed. This emergence is basically due to deficient infection control techniques, the use of broad spectrum antibiotics, and the presence of reservoirs of VRE. The understanding of the epidemiology of VRE in the institution allows applying strategic measures to control its dissemination. (Rev Med Hered 2010;21:128-138).
KEY WORDS: Vancomycin resistance, Enterococcus, colonization, epidemiology, surveillance.
INTRODUCCIÓN
Ya han pasado dos décadas desde la aparición del primer caso de Enterococo con Resistencia a la Vancomicina (ERV) en Europa (1), y desde entonces el germen continúa emergiendo como una causa importante de infección nosocomial en todo el mundo. De acuerdo al Sistema de Vigilancia Nacional de Infecciones Nosocomiales (NNIS) de los Centros para el Control y Prevención de Enfermedades (CDC), el porcentaje de aislamiento de enterococo resistente a vancomicina en las Unidades de Cuidados Intensivos (UCI) en Estados Unidos de América (EU) se incrementó de 0,3% en l989 a 28,5% en 2003 (2).
El tracto gastrointestinal es indudablemente el mayor reservorio de ERV; varios estudios subrayan las características críticas de la colonización por ERV, señalando que el paciente portador "silencioso" de ERV es un importante factor que va a la cabeza en la diseminación nosocomial del microorganismo (3). La relación infección/colonización del ERV difiere en cada población en particular. Montecalvo y col. (4) en una unidad oncológica hallaron una relación de 10 pacientes con colonización intestinal por cada paciente infectado con ERV. Elizaga y col. (5) observaron que sólo 11 (19%) de 59 pacientes colonizados con ERV serían identificados con los resultados de los cultivos clínicos únicamente. También en un hospital sin casos clínicos conocido de infección con ERV se encontró portadores fecales de este germen (6).
La infección o colonización con ERV ha sido asociado con una variedad de factores como hospitalización prolongada, severidad de la enfermedad, afecciones quirúrgicas concomitantes, proximidad a un paciente y, exposición a equipo contaminado con ERV, alimentación enteral, entre otros (7). Se ha encontrado también que los pacientes de las UCI, unidades de transplante, oncología, hematología, nefrología y unidad de diálisis tienen riesgo incrementado y por ello sus tasas de ERV son mayores (7). Las evidencias sugieren que la emergencia y diseminación de estos patógenos son promovidas por pobres técnicas de control de infecciones y por la presión antibiótica selectiva (8,9).
El primer ERV aislado en el Hospital Rebagliati fue en septiembre del año 2000 (10). En un estudio retrospectivo de dos años (setiembre 2000 - agosto 2002) se reportó que los ERV aislados provenientes de muestras clínicas iban en aumento y que hubo dos brotes nosocomiales, en una UCI y en una unidad de transplante renal (10). Este estudio se realiza 4 años después del primer ERV aislado en el hospital y anteriormente no se había realizado un estudio de portadores intestinales de ERV.
El objetivo del presente trabajo fue especificar algunos aspectos epidemiológicos del ERV dentro de la institución como la frecuencia de colonización, los factores de riesgo asociados, y algunas características de su diseminación.
MATERIAL Y MÉTODOS
El Hospital Nacional Edgardo Rebagliati Martins es un hospital docente de nivel IV, cuenta con 1492 camas. Es uno de los principales centros de referencia regional de la seguridad social de Lima, Perú. Sus especialidades incluyen unidades de cuidados intensivos tanto generales como especializados, unidades de transplante renal y de médula ósea, cardiología, medicina interna, cirugía general, neurocirugía, entre otros.
La población de estudio lo conformaron los pacientes con alto riesgo de colonización por ERV. Un paciente de alto riesgo es el que está expuesto a factores de riesgo conocidos de colonización/infección con ERV como estancia hospitalaria prolongada, severidad de la enfermedad, uso de antibióticos de amplio espectro y la exposición a unidades de alto riesgo. Como lo señalan varios estudios epidemiológicos (11-14) nosotros consideramos a las UCIs, unidades de transplante, oncología, hematología y nefrología como áreas de alto riesgo para adquirir ERV.
Se realizó un estudio transversal para determinar la prevalencia puntual de colonización intestinal con ERV, y un estudio caso control para identificar los factores de riesgo asociados a la colonización.
Sujetos de estudio
Para el estudio transversal, entre todos los pacientes adultos hospitalizados en la fecha de estudio (23 Agosto 2 004) se halló 261 pacientes con alto riesgo de colonización intestinal por ERV de los cuales 18 no consintieron participar en el estudio. A los 243 pacientes participantes se les tomó una muestra de hisopado rectal y se transportó al laboratorio de microbiología para el cultivo selectivo de ERV. La selección de los pacientes en riesgo en las áreas de alto riesgo fue con un tiempo de hospitalización ³ 5 días y en el resto de servicios del hospital (áreas de bajo riesgo) con ³ 10 días.
Para el estudio caso control (28 casos y 28 controles), los casos lo conformaron los pacientes con cultivo ERV positivo. Un caso fue pareado con un paciente control (cultivo ERV negativo) ubicado en el mismo servicio, mismo periodo de estancia y con igual número de días de hospitalización. Se recolectó información de datos demográficos y clínicos de las historias clínicas de los pacientes. Las condiciones clínicas, la estancia hospitalaria y la exposición a antibióticos se analizaron retrospectivamente hasta 60 días previos a la toma de muestra.
Definiciones
Exposición a antibióticos relacionados a ERV: Uso de vancomicina, cefalosporinas de 3ra generación (ceftriaxona, ceftazidima) o agentes antianaeróbicos (clindamicina, metronidazol, imipenem). Se midió el uso de uno o varios de ellos (variable categórica) y la intensidad del tratamiento en días-antimicrobianos (variable numérica). A esta lista de antibióticos específicos se les consideró factores de riesgo para desarrollar ERV (13,15-21).
Día-antimicrobiano: Uso de un solo antibiótico por 1 día; por lo tanto, 10 días-antimicrobianos podría resultar del uso de un solo antibiótico por 10 días o de dos antibióticos por un periodo de 5 días cada uno (18).
Exposición a procedimientos invasores: presencia de uno o varios de los siguientes ocho procedimientos: ventilación mecánica, traqueostomía, línea venosa central, catéter urinario, alimentación por tubo, alimentación parenteral, cirugía abdominal o multioperación.
Postración crónica: paciente postrado en cama o silla de ruedas por al menos un mes.
Métodos de laboratorio
No existe un método estandarizado para el aislamiento del ERV a partir de muestras de heces. El medio de transporte Stuart sirvió para llevar la muestra de hisopado rectal al laboratorio. Las muestras se cultivaron en agar Enterococcosel (Becton Dickinson) y en caldo de enriquecimiento Enterococcosel (Becton Dickinson), ambos con 6 µg de vancomicina/mL (22). Se incubaron y se examinaron los cultivos a las 24, 48 y 72 horas para ver la presencia de crecimiento. Las cepas se subcultivaron en agar sangre de oveja. Se identificaron primero a género Enterococcus (tinción Gram, catalasa, prueba bilis-esculina, antígeno grupo D y crecimiento en NaCl al 6,5%), y luego a especie por el sistema API 20 Strep (bioMérieux). La prueba de Metil-a-D-glucopiranósido (Sigma Chemicals) permitió diferenciar Enterococcus gallinarum y Enterococcus casseliflavus de las especies del grupo Enterococcus faecium y del Enterococcus faecalis (23). Como lo recomenda la National Committee for Clinical Laboratory Standards (NCCLS) (24), actualmente llamado Clinical and Laboratory Standards Institute (CLSI), para el tamizaje de resistencia a la vancomicina, las cepas de enterococo se subcultivaron en agar BHI (Brain Heart Infusion) con 6 µg de vancomicina/mL.
La confirmación de la resistencia a la vancomicina, junto con la susceptibilidad a ampicilina, eritromicina y teicoplanina, se hizo por el método E-test (AB Biodisk). La resistencia a altos niveles de aminoglucósidos se hizo por el método de dilución en agar; se utilizó agar BHI con 2000 µg de estreptomicina (Sigma Chemicals)/mL y en agar BHI con 500 µg de gentamicina (Sigma Chemicals)/mL (24). Para el control de calidad se usó cepas de E. faecalis ATCC 29212 como susceptible y E. faecalis ATCC 51299 como resistente.
Análisis estadístico
Los datos se ingresaron al programa SPSS versión 11. En el análisis univariado, para comparar variables continuas se usó las pruebas t de Student y U de Mann Whitney; para variables categóricas se usó la prueba Chi Cuadrado y la prueba exacta de Fisher. Se calculó OR no ajustado y sus intervalos de confianza al 95%. En el análisis multivariado mediante regresión logística se siguieron 2 estrategias: un análisis predictivo en el que se buscó el mejor modelo para predecir la colonización con ERV y un análisis estimativo (25,26) para estimar la relación entre la exposición a antibióticos y la colonización con ERV. Se controlaron las variables confusoras: tiempo de exposición y comorbilidad, que son causas de sesgo en los estudios caso control en los que se analizan factores de riesgo para organismos con resistencia a antibióticos (27,28). La variable tiempo de hospitalización se controló en el diseño mediante pareamiento y la comorbilidad se controló en la etapa de análisis. La comorbilidad se evaluó con la escala Charlson (29).
Ética de la investigación
El estudio fue aprobado por el Comité de Ética hospitalario. A los pacientes que cumplían con los criterios de inclusión se les pedió su consentimiento informado. Diez y ocho pacientes rehusaron a participar en el estudio. A los pacientes ERV positivos se les instaló medidas de aislamiento y de control de infecciones.
RESULTADOS
De los 243 pacientes a quienes se les tomó una muestra de hisopado rectal, 28 tuvieron un cultivo positivo para ERV, dando una prevalencia puntual de 11,52% de colonización intestinal con ERV en pacientes de alto riesgo.
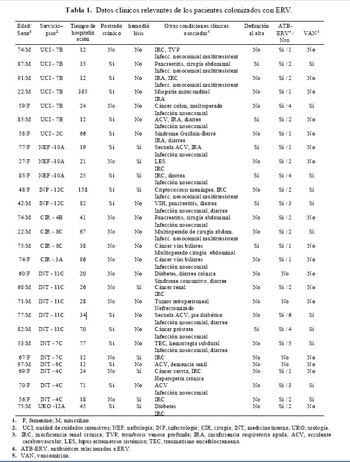
Las características clínicas de los pacientes colonizados con ERV se muestran en la tabla 1.
Doce (43%) pacientes fueron de sexo femenino. La edad promedio fue de 66 (22-97) años. Los pacientes tuvieron serias condiciones médicas subyacentes: 9 (32%) pacientes requerían de hemodiálisis, 15 (54%) eran postrados crónicos, de estos 7 (25%) tenían úlcera de decúbito. Cinco (18%) pacientes tuvieron cirugía abdominal y 3 eran multioperados. Diecisiete (60,7%) pacientes tuvieron infección nosocomial, de éstos 7 (25%) eran a gérmenes multirresistentes. Se observó además alta mortalidad intrahospitalaria (25%) y de los 28 pacientes colonizados sólo 1 tuvo un cultivo positivo a partir de una muestra clínica.
Identificación microbiológica y susceptibilidad antimicrobiana.
De las 28 cepas de enterococo resistentes a vancomicina aisladas, 27 fueron cepas de E. faecium y una cepa de E. avium. Todas las cepas aisladas fueron resistentes a altos niveles de vancomicina (MIC, ³ 128 µg/mL). Catorce cepas fueron resistentes a teicoplanina (MICs, ³ 32 µg/mL), 6 tuvieron resistencia intermedia (MIC, 16 µg/mL), y 8 fueron sensibles (MIC£8 µg/mL). Veinticinco (89,3%) cepas pertenecían a fenotipo VanA (con resistencia a vancomicina y teicoplanina) y 3 (10,7%) al fenotipo VanB (con resistencia a vancomicina y sensible a teicoplanina con un MIC £ 2 µg/mL). La única cepa E. avium fue de fenotipo VanA. El 100% de los aislados fueron resistentes de ampicilina. La resistencia a altos niveles de aminoglucósidos, fue del 75% para la gentamicina (>500 µg/mL), y el 68% para la estreptomicina (>1000 µg/mL). Dieciséis (57%) cepas fueron resistentes a ambos aminoglucósidos.
Distribución de los pacientes colonizados con ERV en el hospital
En las áreas de alto riesgo se encontró 11,6% (10/86) de portadores ERV, una tasa similar se halló en las áreas de bajo riesgo, 11,5% (18/157). En los servicios de alto riesgo fueron: 18,2% (4/22) en las UCI, 14,3% (3/21) en una unidad de cuidados intermedios y 14,3% (3/21) en nefrología. En los servicios de bajo riesgo, 5,9% (4/68) en áreas quirúrgicas y 16,9% (11/65) en servicios de medicina interna.
Factores de riesgo para la colonización con ERV (estudio caso control).
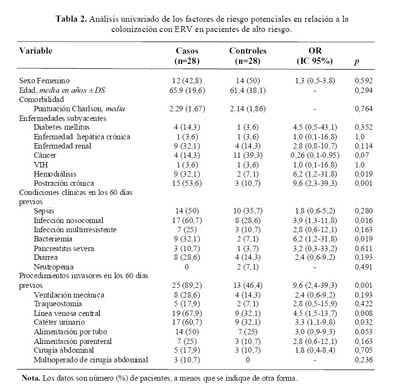
En el análisis univariado (Tabla 2), la postración crónica (OR 9,6 [2,3-39,3]; p=0,001), la hemodiálisis (OR 6,2 [1,2-31,8]; p=0,019), la presencia de infección nosocomial (OR 3,9 [1,3-11,8]; p=0,016) y de bacteriemia (OR 6,2 [1,2-31,8]; p=0,019), fueron factores de riesgo significativos para la colonización con ERV. También, los casos estuvieron expuestos a mayores procedimientos invasores (ventilación mecánica, traqueostomía, línea venosa central, catéter urinario, alimentación por tubo, alimentación parenteral, cirugía abdominal, multioperación) que los controles (OR, 9,6 [2,4-39,3]; p=0,001). No hubo diferencias significativas en la edad promedio (p=0,294), en edad avanzada (>60 años) (p=0,784), ni en la comorbilidad (p=0,764) entre los pacientes casos y controles.
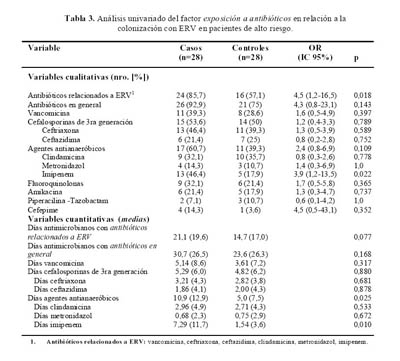
El tratamiento con antibióticos se analizó en forma individual, por clases de antibióticos, y también agrupados en antibióticos relacionados a ERV y antibióticos en general (
Tabla 3). El uso (variable categórica) de antibióticos relacionados a ERV (OR 4,5 [1,2-16,5]; p=0,018) e imipenem (OR 3,9 [1,2-13,5]; p=0,022) tuvieron una relación estadística significativa con la colonización con ERV. La intensidad del tratamiento (variable numérica) en días-antimicrobianos, fue significativa para los agentes antianaeróbicos (p=0,025), y en particular con el imipenem (p=0,010).
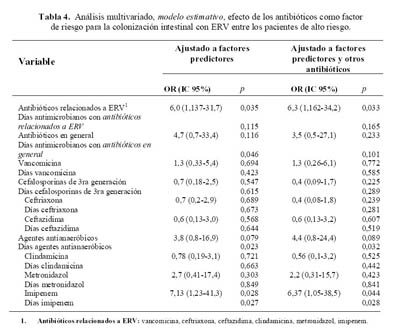
En el análisis multivariado mediante regresión logística, la postración crónica (OR ajustado (a), 7,516 [1,359-41,56]; p=0,021), la hemodiálisis (ORa, 6,871 [1,006-46,90]; p=0,049) y la exposición a procedimientos invasores (ORa, 6,599 [1,138-38,27]; p=0,035) fueron los factores predictores más importantes que se relacionan con la colonización con ERV en los pacientes con alto riesgo (análisis predictivo).
En el análisis estimativo (después de ajustar el efecto de variables confusoras como el tiempo de riesgo, la comorbilidad del paciente, y el efecto debido a los otros antibióticos), se obtuvo que el uso de antibióticos relacionados a ERV (ORa, 6,3 (1,16-34,2); p=0,033), la duración del tratamiento en días-antimicrobianos con agentes antianaeróbicos (p=0,032), y de estos agentes, tanto el uso (ORa, 6,37 (1,05-38,5); p=0,044) como la duración (p=0,028) del tratamiento con imipenem, se relacionaron con la colonización con ERV. El tratamiento con vancomicina y cefalosporinas de 3ra generación no se asociaron con la adquisición de ERV (
Tabla 4).
DISCUSIÓN
Este estudio, el primero del país, fue realizado 4 años después de la aparición del primer caso de ERV en el hospital Rebagliati. La tasa relativamente alta de portadores de ERV (11,5%) en pacientes de riesgo pone en evidencia de que estos últimos años el ERV ha ido emergiendo hasta ser endémico dentro de la institución y gran parte de los servicios hospitalarios ya fueron expuestos a ERV.
La comparación de las tasas de prevalencia con otros estudios puede tener cierto margen de error, ya que las tasas de cada estudio dependen de factores como: localización geográfica, tipo de hospital, características de los pacientes, metodología aplicada, técnicas de laboratorio e instrumentos de recolección de datos. Estos elementos también explican las diferencias observadas en cuanto a los factores de riesgo asociados a ERV. En 4 hospitales de la República de Sudáfrica, en pacientes de servicios de alto riesgo (UCI, oncología, unidad de diálisis y unidad de quemados) encontraron una tasa de colonización de 10,9% (20/184) (14), cifra similar a la tasa de las áreas de alto riesgo del hospital Rebagliati (11,6%). En una unidad renal en el Reino Unido hallaron una tasa portador ERV de 15% (11/73) (30), cifra también similar al servicio de nefrología del hospital (14,3%).
Dos grandes estudios multicéntricos realizados en Europa encuentran prevalencias bajas de colonización con ERV: en 13 hospitales de 8 países europeos (Austria, Bélgica, Francia, Alemania, Italia, los Países Bajos, España y Reino Unido), en pacientes de las UCI y hematología, la tasa de colonización fecal con ERV varió entre 0% y 1,2%, con excepción de Italia (7,5%) y el Reino Unido (32,6%) (31); y en 9 hospitales de los Países Bajos, en pacientes de UCI y oncohematología, se encontró una tasa de portador fecal de ERV de 2% (12/624) (32). En EU se reportan tasas de colonización mucho más altas que en Europa y varían de 16% a 41% (11,17,18,33). La prevalencia de portadores encontrada en el hospital Rebagliati tiende a semejarse con las tasas de hospitales de EU.
Aunque muchos estudios reconocen que la mayoría de pacientes infectados o colonizados con ERV provienen de servicios de alto riesgo (11-14,17); en recientes años, se reportan tasas más altas en medicina interna y cirugía en relación con las unidades de cuidados críticos (15,16,18). En este estudio la tasa de portadores en áreas de bajo riesgo fue similar a la tasa encontrada en las áreas de alto riesgo. Además, causó sorpresa que en los servicios de medicina interna (16,9%) se hallara tasas casi tan altas como en las UCI (18,2%).
Las áreas con alta prevalencia como las UCI, nefrología, una unidad de cuidados intermedios y dos unidades de medicina interna, constituyen reservorios de ERV y a partir de los cuales se puede seguir diseminando el germen al resto del hospital. Así, observamos que dos pacientes positivos a ERV ubicados en áreas de baja prevalencia tuvieron una estancia previa en una UCI, existiendo la posibilidad de que ahí lo hayan adquirido.
No encontramos un estudio donde la postración crónica se asocie con ERV, esta variable comúnmente no es medida a pesar de su importancia en la epidemiología del ERV. La presencia de hemodiálisis en relación a ERV sí ha sido destacada por otros estudios (34,35). Estos dos factores de riesgo juegan un rol importante en la propagación de ERV en el hospital Rebagliati ya que los pacientes postrados crónicos y hemodializados representan una proporción considerable de toda la población hospitalaria. Se observa también que ambas poblaciones, postrados crónicos y hemodializados, comparten similares características clínico-epidemiológicas respecto al ERV como: tener complicaciones frecuentes por ende frecuentes hospitalizaciones; al ser readmitidos se exponen al ERV y a antibióticos que ejercen presión selectiva; requieren de una mayor cantidad de asistencia del personal de salud con el consiguiente riesgo de transmisión ERV; su colonización con ERV sirve como un reservorio para una potencial infección del mismo paciente y para la propagación del ERV a otros pacientes y también a otros hospitales (5,13,15,35).
Se acepta que el modo más común de transmisión del ERV es por las manos de los trabajadores de salud; a pesar de ello, existen pocos estudios (15,19,36) que hayan examinado el rol del personal sanitario en la transmisión del ERV. En un estudio prospectivo de Loeb y col. (15) se señala que el incremento de la carga de trabajo del personal sanitario puede comprometer la habilidad de mantener prácticas apropiadas de control de infecciones y con ello contribuir a la transmisión de gérmenes multirresistentes. La transmisión de gérmenes vía las manos del personal es una variable difícil de medir, más aún si se trata de un diseño transversal como en este estudio, pero quizás la carga de trabajo del personal sanitario este aquí representada por la variable exposición a múltiples procedimientos invasores, que resultó ser un factor significativo en la colonización con ERV.
En los estudios relacionados a ERV la variable "exposición a antibióticos" es medida de diversas formas, ya sea en forma cualitativa o cuantitativa, para cada antibiótico individualmente o por clases de antibióticos. Esta falta de uniformidad en la medición podría ser la causa de la gran heterogeneidad en los resultados; así, en algunos trabajos se reporta a la vancomicina como factor de riesgo para la adquisición de ERV (6,13,17,25), mientras que para otros no lo es (16,27,35). Está presente también el hecho de que cada institución aplica distintos patrones de prescripción. Frente al hecho de que un paciente reciba vancomicina junto con varios otros antibióticos, es un hecho, como lo señalan también otros autores (9,27), de que el efecto de presión selectiva a nivel intestinal para el ERV no lo ejercerá únicamente la vancomicina sino que debe existir un efecto aditivo ejercido por los otros antibióticos recibidos. Ahora, no todos los antibióticos ejercen presión selectiva, Donskey y col. (20,21) demuestran que no todos los agentes con acción antianaeróbica ejercen presión selectiva, antibióticos como quinolonas, cefepime y aztreonam, tendrían incluso un efecto protector contra el ERV. Varios estudios señalan que los antibióticos que intervienen en la inducción o facilitación de la colonización o infección con ERV son los glucopéptidos, las cefalosporinas de amplio espectro, y varios agentes antianaeróbicos (13,15–21). En este estudio la exposición conjunta a estos antibióticos se denominó "exposición a antibióticos relacionados a ERV" y quizás represente una mejor medida de la presión de selección. Un trabajo que se aproxima a esta propuesta es el de Tokars y col. (18) que agruparon 6 antibióticos (vancomicina, ceftriaxona, ceftazidima, cefuroxima, clindamicina, ticarcilina-ácido clavulánico) y hallaron que esta medición conjunta fue un factor de riesgo para la colonización con ERV. En este estudio también se encontró que la exposición a antibióticos relacionados a ERV tuvo un efecto significativo en la colonización con ERV.
La emergencia del ERV en el hospital Rebagliati, como en la mayor parte de hospitales donde el ERV es endémico, se debe básicamente a la transmisión del ERV por deficientes técnicas de control de infecciones, al uso de antibióticos de amplio espectro, y a la presencia de reservorios de ERV. El Consejo Consultivo de Prácticas de Control de Infecciones Hospitalarias (HICPAC) de la CDC (12), señala los lineamientos para prevenir y controlar la propagación del ERV bajo cuatro enfoques: vigilancia microbiológica, medidas adecuadas de control de infecciones, educación del personal sanitario y uso apropiado de la vancomicina (aunque también deben considerarse a las cefalosporinas de amplio espectro y los agentes antianaeróbicos). El tamizaje fecal es un elemento clave en un programa de control. Para la realidad de nuestro hospital, el tamizaje de pacientes de alto riesgo (tanto de áreas de alto como de bajo riesgo) es una estrategia de vigilancia costo-efectiva ya que incrementa el rendimiento de detección y puede realizarse en muy corto tiempo. En las áreas de mayor endemicidad debe realizarse con mayor periodicidad, así también deben incluirse a todos los pacientes con postración crónica y en hemodiálisis.
En este estudio se trató de obedecer a los principios metodológicos más adecuados para estudios caso control que analizan factores de riesgo para organismos con resistencia a antibióticos (27,28); estos son: adecuada selección del grupo control, ajuste al tiempo de riesgo, y ajuste a la comorbilidad. Una de las limitaciones del presente estudio, al igual que en la mayor parte de estudios caso control de ERV, es que su tamaño fue pequeño, y queda la posibilidad de que no tuvo la suficiente potencia para detectar algunas diferencias entre los sujetos casos y controles; pero la aplicación de un diseño con control de variables clave quizás pudo mejorar un poco su eficiencia y a su vez su precisión.
En conclusión, la postración crónica, la hemodiálisis, la exposición a múltiples procedimientos invasores y el uso de antibióticos relacionados a ERV son los principales factores de riesgo para la colonización con ERV. Este microorganismo ha emergido hasta volverse endémico en la institución y gran parte de los servicios hospitalarios ya han sido expuestos. Esta emergencia se debe a las deficientes técnicas de control de infecciones, al uso de antibióticos de amplio espectro y a la presencia de reservorios. Este estudio contribuye a esclarecer la epidemiología del ERV dentro del hospital Rebagliati, lo cual es importante para aplicar medidas estratégicas para controlar su diseminación.
Agradecimiento: Un agradecimiento muy especial al Dr. Jorge Alarcón Villaverde por el asesoramiento y participación activa en el desarrollo del estudio. También a la Unidad de Promoción y Desarrollo de la Investigación de la Organización Panamericana de la Salud (OPS) por el financiamiento parcial del trabajo.
REFERENCIAS BIBLIOGRÀFICAS
1. Uttley AH, Collins CH, Naidoo J, George RC. Vancomycin-resistant enterococci (letter). Lancet 1988; 1:57–8. [ Links ]
2. National National Nosocomial Infections Surveillance (NNIS) System Report, data summary from January 1992 through June 2004, issued October 2004. Am J Infect Control 2004;32:470-85. [ Links ]
3. Beltrami EM, Singer DA, Fish L, et al. Risk factors for acquisition of vancomycin-resistant enterococci among patients on a renal ward during a community hospital outbreak. Am J Infect Control 2000;28(4):282-5. [ Links ]
4. Montecalvo MA, de Lencastre H, Carraher M, et al. Natural history of colonization with vancomycin-resistant Enterococcus faecium. Infect Control Hosp Epidemiol 1995; 16(12): 680-5. [ Links ]
5. Elizaga ML, Weinstein RA, Hayden MK. Patients in long-term care facilities: a reservoir for vancomycin-resistant enterococci. Clin Infect Dis 2002;34(4):441-6. [ Links ]
6. Gordts B, Van Landuyt H, Ieven M, Vandamme P, Goossens H. Vancomycin-resistant enterococci colonizing the intestinal tracts of hospitalized patients. J Clin Microbiol 1995;33(11):2842-6. [ Links ]
7. Cetinkaya Y, Falk P, Mayhall CG. Vancomycin-resistant enterococci. Clin Microbiol Rev 2000; 13(4):686-707. [ Links ]
8. Hayden MK. Insights into the epidemiology and control of infection with vancomycin-resistant enterococci. Clin Infect Dis. 2000;31(4):1058-65. [ Links ]
9. Rice LB. Emergence of vancomycin-resistant enterococci. Emerg Infect Dis 2001;7(2):183-7. [ Links ]
10. Flores-Paredes W. Características clínico-epidemiológicas de 14 casos con aislamiento clínico de Enterococo Resistente a Vancomicina en el Hospital Nacional Edgardo Rebagliati Martins. Rev Med Hered 2007;18 (2):68-75. [ Links ]
11. Coque TM, Tomayko JF, Ricke SC, Okhyusen PC, Murray BE. Vancomycin-resistant enterococci from nosocomial, community, and animal sources in the United States. Antimicrob Agents Chemother 1996;40 (11):2605-9. [ Links ]
12. Centers for Disease Control and Prevention. Recommendations for preventing the spread of vancomycin resistance: recommendations of the Hospital Infection Control Practices Advisory Committee (HICPAC). MMWR Morb Mortal Wkly Rep 1995;44(RR-12):1-13. [ Links ]
13. DAgata EM, Green WK, Schulman G, Li H, Tang YW, Schaffner W. Vancomycin-resistant enterococci among chronic hemodialysis patients: a prospective study of acquisition. Clin Infect Dis 2001;32(1):23-9. [ Links ]
14. Von Gottberg A, Van Nierop W, Duse A, et al. Epidemiology of glycopeptide-resistant enterococci colonizing high-risk patients in hospitals in Johannesburg, Republic of South Africa. J Clin Microbiol 2000;38(2):905-9. [ Links ]
15. Loeb M, Salama S, Armstrong-Evans M, Capretta G, Olde J. A case-control study to detect modifiable risk factors for colonization with vancomycin-resistant enterococci Infect Control Hosp Epidemiol 1999;20: 760-3. [ Links ]
16. MacIntyre CR, Empson M, Boardman C, Sindhusake D, Lokan J, Brown GV. Risk factors for colonization with vancomycin-resistant enterococci in a Melbourne hospital. Infect Control Hosp Epidemiol 2001;22 (10): 624-9. [ Links ]
17. Morris JG Jr, Shay DK, Hebden JN, et al. Enterococci resistant to multiple antimicrobial agents, including vancomycin. Establishment of endemicity in a university medical center. Ann Intern Med 1995;123(4): 250-9. [ Links ]
18. Tokars JI, Satake S, Rimland D, et al. The prevalence of colonization with vancomycin-resistant Enterococcus at a Veterans Affairs institution. Infect Control Hosp Epidemiol 1999;20(3):171-5. [ Links ]
19. Bonten MJ, Slaughter S, Ambergen AW, et al. The role of "colonization pressure" in the spread of vancomycin-resistant enterococci: an important infection control variable. Arch Intern Med 1998;158 (10):1127-32. [ Links ]
20. Donskey CJ, Chowdhry TK, Hecker MT, et al. Effect of antibiotic therapy on the density of vancomycin-resistant enterococci in the stool of colonized patients. N Engl J Med 2000;343(26):1925-32. [ Links ]
21. Donskey CJ, Hanrahan JA, Hutton RA, Rice LB. Effect of parenteral antibiotic administration on persistence of vancomycin-resistant Enterococcus faecium in the mouse gastrointestinal tract. J Infect Dis 1999;180:384-90. [ Links ]
22. Van Horn K, Gedris Ch, Rodney K. Selective isolation of vancomycin-resistant Enterococci. J Clin Microbiol. 1996;34(4):924-7. [ Links ]
23. Turenne CY, Hoban DJ, Karlowsky JA, Zhanel GG, Kabani AM. Screening of stool samples for identification of vancomycin-resistant Enterococcus isolates should include the methyl-alpha-D-glucopyranoside test to differentiate nonmotile Enterococcus gallinarum from E. faecium. J Clin Microbiol 1998;36(8):2333-5. [ Links ]
24. National Committee for Clinical Laboratory Standards. Performance Standards for Antimicrobial Susceptibility Testing; Eleventh Informational Supplement. NCCLS document M100 – S11. Pennsylvania USA:NCCLS; 2001. [ Links ]
25. Atta MG, Eustace JA, Song X, Perl TM, Scheel PJ. Outpatient vancomycin use and vancomycin-resistant enterococcal colonization in maintenance dialysis patients. Kidney Int 2001;59(2):718-24. [ Links ]
26. Carmeli Y, Eliopoulos GM, Samore MH. Antecedent treatment with different antibiotic agents as a risk factor for vancomycin-resistant Enterococcus. Emerg Infect Dis 2002;8(8):802-7. [ Links ]
27. Carmeli Y, Samore MH, Huskins C. The association between antecedent vancomycin treatment and hospital-acquired vancomycin-resistant enterococci: a meta-analysis. Arch Intern Med 1999;159(20):2461-8. [ Links ]
28. Harris AD, Karchmer TB, Carmeli Y, Samore MH. Methodological principles of case-control studies that analyzed risk factors for antibiotic resistance: A systematic review. Clin Infect Dis 2001;32:1055-61. [ Links ]
29. Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J Chron Dis 1987;40:373-83. [ Links ]
30. Jordens JZ, Bates J, Griffiths DT. Faecal carriage and nosocomial spread of vancomycin-resistant Enterococcus faecium. J Antimicrob Chemother 1994; 34(4): 515-28. [ Links ]
31. Goossens H, Jabes D, Rossi R, Lammens C, Privitera G, Courvalin P. European survey of vancomycin-resistant enterococci in at-risk hospital wards and in vitro susceptibility testing of ramoplanin against these isolates. J Antimicrob Chemother 2003;51 (S3):iii5-iii12. [ Links ]
32. Endtz HP, van den Braak N, van Belkum A, Kluytmans JA, Koeleman JG, Spanjaard L, et al. Fecal carriage of vancomycin-resistant enterococci in hospitalizad patients and those living in the community in The Netherlands. J Clin Microbiol 1997;35(12):3026-31. [ Links ]
33. Bonten MJ, Hayden MK, Nathan C, et al. Epidemiology of colonisation of patients and environment with vancomycin-resistant enterococci. Lancet 1996;348 (9042):1615-9. [ Links ]
34. Warren DK, Kollef MH, Seiler SM, Fridkin SK, Fraser VJ. The epidemiology of vancomycin-resistant Enterococcus colonization in a medical intensive care unit. Infect Control Hosp Epidemiol 2003;24(4):257-63. [ Links ]
35. Webb M, Riley LW, Roberts RB. Cost of hospitalization for and risk factors associated with vancomycin-resistant Enterococcus faecium infection and colonization. Clin Infect Dis 2001;33(4):445-52. [ Links ]
36. Slaughter S, Hayden MK, Nathan C, et al. A comparison of the effect of universal use of gloves and gowns with that of glove use alone on acquisition of vancomycin-resistant enterococci in a medical intensive care unit. Ann Intern Med 1996;125(6):448-56. [ Links ]
Correspondencia
Dr. Wilfredo Flores Paredes
Teléfono: 511-9985-0399.
Correo electrónico: wido2@hotmail.com