Cardiac hydatid cyst in a child. A case report.
Luis Castillo De la Cadena1,2, Yany Cuba1, Carlos Mendoza3, Martín Mispireta4, José Parra4, Primo Pacheco5.
1Médico Asistente del Servicio de Cirugía de Tórax y Cardiovascular del Hospital María Auxiliadora. Lima, Perú.
2Unidad de Epidemiología Clínica de la facultad de Medicina Alberto Hurtado de la Universidad Peruana Cayetano Heredia. Lima, Perú.
3Médico Asistente del Departamento de Anestesiología del Hospital Dos de Mayo. Lima, Perú.
4Médico Asistente del Servicio de Cardiología del Hospital María Auxiliadora. Lima, Perú.
5Cirujano de Tórax y Cardiovascular de la Clínica San Felipe. Lima, Perú.
RESUMEN
El quiste hidatídico es una enfermedad parasitaria humana causada por el estado quístico del parasito Echinococcus granulosus. En el Perú la prevalencia de hidatidosis humana en los últimos 5 años oscila de 7 – 11 / 100 000 habitantes. Se localizan principalmente en hígado (> 65% de los casos) y en pulmones (25%). La localización cardiaca es infrecuente; reportándose entre 0,5 a 2%. Presentamos el caso de un niño de 11 años con quiste hidatídico cardíaco tratado quirúrgicamente utilizando circulación extracorpórea y clamplaje aórtico, en forma exitosa.
PALABRAS CLAVE: Quiste hidatídico, diagnóstico, cirugía, corazón, Equinococosis. (Fuente: DeCS Bireme).
SUMMARY
Hydatid cyst is a human parasitic disease caused by the larval stage of Echinococcus granulosus. Prevalence of human hydatid disease in Peru during the last 5 years ranges from 7-11 cases per 100,000 inhabitants. The disease is mainly localized in the liver (>65% of cases) and in the lungs (25%). Involvement of the heart is rare, reported in 0.5-2% of cases. We present the case of an 11-year-old child with cardiac hydatidosis successfully removed using extracorporeal circulation and aortic cross-clamp.
KEYWORDS: Cardiac hydatid cyst, diagnostic, surgery, heart, Echinoccocosis.
(Source: Mesh database NLM)
INTRODUCCIÓN
El quiste hidatídico es una enfermedad parasitaria humana causada por el estado quístico del parasito Echinococcus granulosus, el cual infecta el intestino de los perros, su huésped definitivo. El humano sirve como huésped incidental por ingestión de huevos en vegetales o agua contaminada con las heces del perro. La enfermedad hidatídica es endémica en Sudamérica especialmente donde existe crianza de ganado ovino (1-3).
En el Perú la prevalencia de hidatidosis humana en los últimos 5 años es 7 – 11 / 100 000 habitantes. Sin embargo, hay regiones de alta prevalencia oscilando entre 14 y 34 /100 000 habitantes, como en Huancavelica, Ayacucho e Ica (2,3).
Los quistes hidatídicos comúnmente se localizan en el hígado (> 65% de los casos) y en los pulmones (25%). La localización cardiaca es infrecuente; reportándose de 0,5 a 2% (1-7).
Presentamos el caso de un paciente pediátrico con hidatidosis cardiaca en el ventrículo izquierdo tratado quirúrgicamente utlizando circulación extracorpórea.
Caso clínico
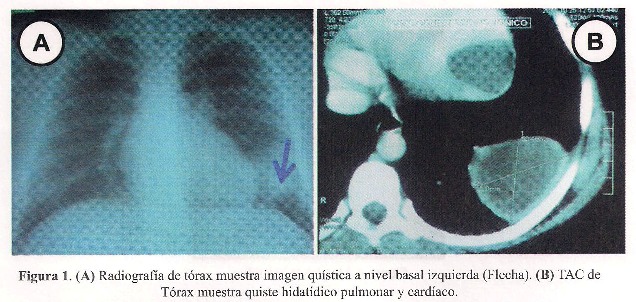
Niño de 11 años, procedente de Villa María del Triunfo, con antecedente de viajes frecuentes a Ayacucho, que consulta por tos exigente y dolor torácico tipo opresivo. La radiografía de tórax mostró una imagen redondeada compatible con quiste hidatídico en la base pulmonar izquierda ( Figura 1). La serología Western blot para hidatidosis fue positiva.
La tomografía de tórax mostró la imagen quística de 50,4 x 36 mm en región basal de pulmón izquierdo y además una imagen quística intracardiaca de 35,2 x 31 mm en la pared lateral de ventrículo izquierdo ( Figura 1).
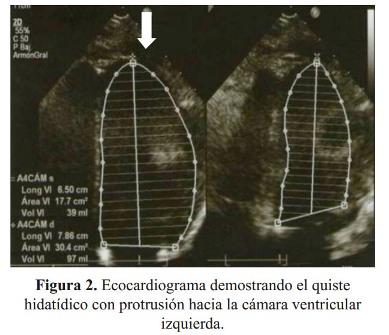
El ecocardiograma demostró quiste intracardíaco en la región postero lateral del ventrículo izquierdo de 32,8 x 32,9 cm con protrusión hacia la cámara ventricular izquierda ( Figura 2). En la ecografía abdominal se encontraron múltiples quistes hidatídicos.
Se realizó una Junta Médica y se decidió la intervención quirúrgica con circulación extracorpórea y clampaje aórtico.
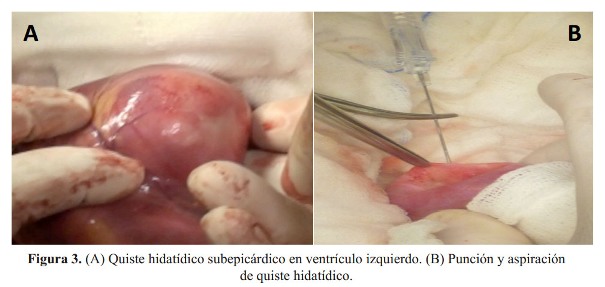
Se realizó esternotomía media. Se aplicó hipotermia moderada y cardioplejia a 10 grados. El quiste hidatídico fue encontrado en la pared posterolateral cerca al ápice del ventrículo izquierdo. El quiste tenía localización subepicárdica y el pericardio estaba indemne ( Figura 3).
El campo operatorio fue cubierto con gasas embebidas en cloruro de sodio al 20% para evitar la contaminación con escolices a otras estructuras; posteriormente, se procedió a la punción y aspiración del quiste ( Figura 3).
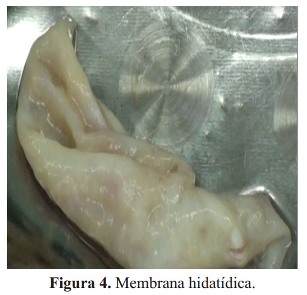
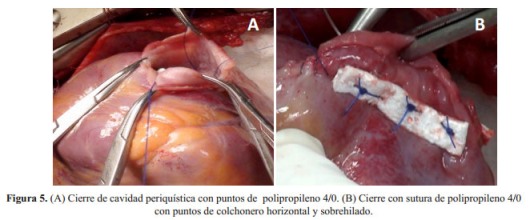
Después de abrir el quiste hidatídico, se removió la membrana germinativa. No hubo comunicación entre la cavidad quística y la cámara ventricular izquierda ( Figura 4). Se realizó el capitonaje en dos planos, el primer plano con sutura de polipropileno 4/0 con almohadilla de teflón en puntos de colchonero horizontal ( Figura 5) y el segundo plano con doble tira de teflón sobre los bordes de la cavidad y sutura de polipropileno 4/0 con puntos de colchonero horizontal y sobrehilado ( Figura 5).
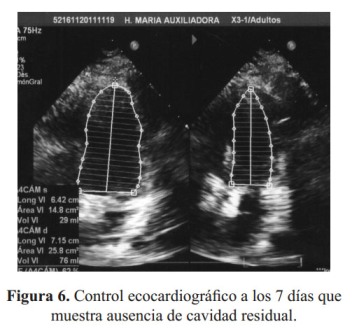
No hubo intercurrencias en el post operatorio. Después de 2 semanas fue re-intervenido para quistectomía pulmonar por toracotomía anterior izquierda. El ecocardiograma de control a los 7 días mostró ausencia de cavidad quística residual y mejoría de la fracción de eyección ( Figura 6).
DISCUSIÓN
El embrión hexacanto del parásito que es liberado del huevo dentro del intestino humano entra a la circulación portal o linfática. La enfermedad hidatídica resulta de la expansión de los quistes parasitarios en los órganos viscerales. El compromiso cardiaco es infrecuente (1-3).
El parásito alcanza al miocardio a través de la circulación coronaria. El ventrículo izquierdo -la parte del corazón con más flujo sanguíneo- es el que se compromete con más frecuencia (55-60% de los casos) (4-7) como en el caso de nuestro paciente en quien el quiste se alojó en la pared postero lateral del ventrículo izquierdo.
Una vez que el parásito alcanza al miocardio el quiste se forma entre 1 a 5 años (4-7). Debido al lento crecimiento de los quistes el compromiso cardíaco usualmente es detectado en pacientes adultos; sin embargo hay reportes de quistes hidatídicos cardiacos en niños (8-10). En nuestro medio sólo se ha reportado el caso en un adulto (11).
El cuadro clínico varía de acuerdo al tamaño, lugar y efecto de masa del quiste, como los quistes crecen estos se desplazan y adelgazan la pared ventricular entre el epicardio hacia el endocardio. Los quistes hidatídicos del ventrículo izquierdo son usualmente localizados sub-epicárdicamente y rara vez se rompen dentro del espacio pericárdico (4-7).
La serología es más sensible y específica para enfermedad hidatídica hepática que para enfermedad hidatídica cardiaca. Se reporta que la prueba de ELISA es la más sensible (94%) y especifica (99%) para la mayoría de localizaciones del quiste hidatídico (12). Nuestro paciente tuvo resultado positivo de western blot dado que tenía hidatidosis hepática múltiple, pulmonar y cardíaca.
El ecocardiograma permanece como el método de imagen más fiable en el diagnóstico de hidatidosis cardíaca (13). En nuestro caso la hidatidosis cardíaca fue un hallazgo casual en la tomografía de tórax y confirmada por el ecocardiograma.
El uso de circulación extracorpórea brinda una seguridad para la manipulación del quiste hidatídico cardiaco (4-7). La circulación extracorpórea con el clampaje aórtico previene la embolización hacia la circulación sistémica y permite la visión directa del quiste hidatídico y las estructuras cardiacas (4-6).
Como regla general el corazón no debería ser manipulado antes del clampaje aórtico (6). Es crucial minimizar la posibilidad de contaminación antes de la quistectomía. Primero se aspira el contenido del quiste y se aplica un agente escolicida en la cavidad quística; en nuestro caso utilizamos solución hipertónica.
No hay consenso con respecto al manejo de la cavidad residual después de retirar la membrana hidatídica. Birincioglu y col (14), concluyeron que todas las cavidades residuales deberían ser dejadas abiertas para auto-cierre por segunda intención, debido a que el cierre con sutura puede causar anormalidades de contracción y relajación miocárdica regional o incluso desgarros en el miocardio. Tuncer y col (4), prefieren el capitonaje en la cavidad residual de los quistes sub-epicárdicos; ellos no observaron las consecuencias adversas arriba mencionadas. En nuestro caso se aplicó capitonaje y cierre de los bordes del quiste con doble tira de teflón lo que disminuye la posibilidad de desgarro ventricular.
Las secuelas pos operatorias incluyen desgarro miocárdico, bloqueo auriculo-ventricular, arritmias ventriculares y muerte súbita (3-10).
En conclusión la hidatidosis cardiaca se puede presentar con una variedad de signos y síntomas; la sospecha de quiste hidatídico cardíaco debe estar siempre presente en zonas endémicas debido al alto riesgo de complicaciones serias. El quiste hidatídico cardíaco debe ser removido quirúrgicamente incluso en pacientes asintomáticos. Durante la operación se debe prevenir la embolización peri operatoria de los escólices. La quistectomía debe realizarse bajo circulación extracorpórea como método de elección.
REFERENCIAS BIBLIOGRÁFICAS
1.Legua P. Hidatidosis. Rev Med Hered. 2002; 13(3): 77-78. [ Links ]
2.Náquira C, Bullón F, Balvín G, Reyes N. 1989. Epidemiología de la hidatidosis en el Perú. En: Anales del Seminario Nacional de Hidatidosis y Enfermedades de Transmisión Alimentaria. Lima: MINSA;1989. p 122-137. [ Links ]
3.Náquira C. Situación de la Hidatidosis en el Perú .Reunión del grupo científico de trabajo sobre Hidatidosis. Montevideo, Octubre 1994. Washington DC: Organización Panamericana de la Salud; 1993. p. 262-77. [ Links ]
4.Tuncer E, Gezer S, Mataraci L. Surgical treatment of cardiac hydatid disease in 13 patients. Tex Hert Inst J. 2010; 37(2):189-93. [ Links ]
5.Kaplan M, Demirtas M, Cimen S, Ozler A. Cardiac hydatid cysts with intracavitary expansion. Ann Thorac Surg. 2001; 71(5):1587-90. [ Links ]
6.Yaliniz H, Tokcan A, Salih OK, Ulus T. Surgical treatment of cardiac hydatid disease: a report of 7 cases. Tex Heart Inst J. 2006; 33(3):333-9. [ Links ]
7.Miralles A, Bracamonte L, Pavie A, et al. Cardiac echinococcosis. Surgical Treatment and results. J Thorac Cardiovasc Surg. 1994; 107(1):184-90. [ Links ]
8.Cakir O, Eren N, Kilinc N. Cardiac hydatic cyst causing cerebral emboli in a child. Pediatr Cardiol. 2002; 23(5):555-6. [ Links ]
9.Byard RW, Bourne AJ. Cardiac echinococcosis whith fatal intracerebral embolism. Arch Dis Child. 1991; 66(1):155-6. [ Links ]
10.Sinha PR, Jaipuria N, Avasthey P. Intracardiac hydatid cyst and sudden death in a child. Int J Cardiol. 1995; 51(3):293-5. [ Links ]
11.Ramírez JA, Hernández J, Orlovac A, et al. Equinococcosis cardiaca y obesidad mórbida: Consideraciones quirúrgicas. Acta Med Peruana 2010; 27(2): 123-126. [ Links ]
12.Force L, Torres JM, Carrillo A, Busca J. Evaluation of eight serological tests in the diagnosis of human echinococcosis and follow-up. Clin Infect Dis. 1992; 15(3):238-44. [ Links ]
13.Tufekcioglu O, Birincioglu CL, Arda K, Fansa I, Saritas A, Karahan M. Echocardiography findings in 16 Cases of cardiac echinococcosis: proposal for a new classification system. J Am Soc Echo. 2007; 20(7): 895-904. [ Links ]
14.Birincioglu CL, Tarcan O, Bardakci H, Saritas A, Tasdemir O. Off-pump technique for the treatment of ventricular myocardial echinococcosis. Ann Thorac Surg 2003; 75(4):1232-7. [ Links ]