Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Medica Herediana
versión On-line ISSN 1729-214X
Rev Med Hered vol.24 no.4 Lima oct./dic. 2013
Reducción de la aurícula izquierda y reemplazo de válvula mitral mediante técnica de autotransplante en paciente con aurícula izquierda gigante
Left atrial reduction and mitral valve replacement through autotransplant technique in giant left atrium
Josías Ríos (1), Julio Morón (2).
(1) Médico Asistente del Servicio de Cirugía Cardíaca, Instituto Nacional Cardiovascular, INCOR, EsSalud. Lima, Perú.
(2) Jefe del Servicio de Cirugía Cardíaca, Instituto Nacional Cardiovascular, INCOR, EsSalud. Lima, Perú.
RESUMEN
El 19% de los pacientes con patología mitral reumática presenta aurícula izquierda gigante (diámetro mayor a 65mm), esta patología ha sido asociada con incremento del riesgo de stroke y de muerte súbita. La indicación de reducción auricular se establece cuando existe compresión de las extructuras vecinas, antecedentes de fenómenos tromboembólicos o en pacientes asintomáticos para restablecer el ritmo sinusal (Cirugía de Maze). Se presenta el caso de una mujer de 63 años con estenosis e insuficiencia mitral reumáticas severas, atrio izquierdo gigante (diámetro mayor a 90 mm) y fibrilación auricular permanente, a quien se le realizó mediante técnica de autotrasplante, reemplazo de válvula mitral y reducción de aurícula izquierda. En el postoperatorio la paciente presentó insuficiencia renal que requirió diálisis y soporte ventilatorio con intubación orotroqueal por tres semanas. Sin embargo al tercer mes del postoperatorio la paciente se encontraba en Clase funcional I (NYHA) y en ritmo sinusal.
PALABRAS CLAVE: Cardiopatía reumática, diagnóstico, atrios cardiacos, patologia, volumen cardíaco. (Fuente: DeCS BIREME)
SUMMARY
19% of patients with rheumatic mitral valve disease have giant left atrium (diameter greater than 65mm), this condition has been associated with increased risk of stroke and sudden death. The indication for atrial reduction are established when there are compression of neighboring extructura, history of thromboembolic events and in asymptomatic patients for restore sinus rhythm (Maze surgery). We report the case of a patient of 63 years old with rheumatic mitral disease, giant left atrium (diameter greater than 90 mm ) and permanent atrial fibrillation, we performed mitral valve replacement and left atrial reduction. Postoperatively, the patient had renal failure requiring dialysis and ventilatory support with intubation orotroqueal for three weeks. However at the third postoperative month the patient was in functional class I (NYHA) and sinus rhythm.
KEYWORDS: Rheumatic heart disease, diagnosis, Heart Atria, pathology, Cardiac Volume (Source: MeSH NLM).
INTRODUCCIÓN
La mayoría de los pacientes que se someten a cirugía de la válvula mitral tienen algún grado de dilatación de la aurícula izquierda (AI) y además fibrilación auricular (FA). Esto último es causa importante de complicaciones cardioembólicas. En consecuencia reducir quirúrgicamente el tamaño de la aurícula izquierda y restaurar el ritmo sinusal han demostrado disminuir la aparición de estas complicaciones (1,2).
Según Di Eusanio et al. (3) alrededor del 19% de los pacientes que requieren cirugía de la válvula mitral tienen aurícula izquierda gigante. Estos pacientes tienen siempre una larga historia de enfermedad de la válvula mitral y de fibrilación auricular y frecuentemente presentan complicaciones hemodinámicas o respiratorias así como formación de trombos en la aurícula izquierda (4,5). El estudio Framinghan demostró que el incremento en el tamaño del atrio izquierdo en presencia de fibrilación auricular aumentan el riesgo de stroke y muerte súbita (6).
Kawazoe et al (4), definen aurícula izquierda gigante cuando el diámetro de la misma es mayor de 65 mm en la ecocardiografía modo M. La etiología exacta de esta condición es desconocida, sin embargo, está fuertemente asociada a enfermedad reumática crónica de la válvula mitral. Otras condiciones como la disfunción del ventrículo izquierdo, fibrilación auricular crónica, persistencia del conducto arterioso o presencia de defectos del septum interventricular también han sido asociadas (7).
Esta condición puede ser asintomática en una minoría de los casos. Se han reportado casos asintomáticos con AI de un diámetro de hasta 145 mm. Cuando es sintomática, las manifestaciones clínicas más comunes son: arritmias, palpitaciones, dolor torácico, dificultad para respirar, fatiga y disnea, ortopnea, fibrilación auricular, disnea paroxística nocturna, y eventos tromboembólicos. Los síntomas se originan a partir de la relación anatómica de la pared posterior de la aurícula izquierda por presión del esófago y de las vías respiratorias (7).
Se presenta el caso de una mujer con atrio izquierdo gigante secundario a valvulopatía mitral a quien se le realizó reducción atrial mediante autotrasplante. En nuestro país no existen reportes sobre el tema.
Caso clínico
Mujer, de 63 años de edad, con historia de 5 años de fibrilación auricular sin tratamiento regular establecido y un episodio de accidente isquémico transitorio hacía 4 meses. Ingresó con historia de disnea Clase Funcional (CF) II (New York Heart Asociation) de 5 años de evolución que progresó a CF III hacía 2 meses. Además presentaba palpitaciones y disnea paroxística nocturna desde aproximadamente un año. En el examen físico resaltaba el mal estado nutricional (Índice de masa corporal de 16,5) y un soplo sistólico y diastólico en el foco mitral.
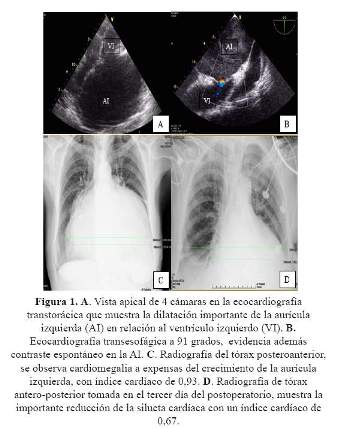
La ecocardiografía transtorácica (Figura 1) mostró calcificación y fibrosis de los velos válvula mitral y retracción de su aparato subvalvular (score de wilkins 11), el gradiente máximo de la válvula fue 20 mm Hg, el medio 9 mm Hg y el área de la válvula 1,0 cm2; en el doppler color se encontró insuficiencia mitral severa e insuficiencia tricuspídea moderada con anillo de la válvula tricúspide en 40 mm de diámetro antero posterior. El diámetro de la aurícula izquierda fue 94 mm medido en modo M, el área de 131 cm2 y el volumen de 480 cc. La fracción de eyección del ventrículo izquierdo se encontraba en 62% y los diámetros sitólico y diastólico del mismo eran normales. La ecocardiografía transesofágica confirmó los hallazgos antes mencionados.
En el cateterismo cardíaco la presión sistólica de la arteria pulmonar fue 48 mm Hg y la media 33 mm Hg, las arterias coronarias no tenían lesiones angiográficas significativas. El doppler carotídeo mostró irregularidades parietales con engrosamiento intima – media pero sin lesiones obstructivas de importancia quirúrgica.
El hemograma era normal con hemoglobina en 12,5 g/dl, glucosa, urea, creatinina, perfil hepático y de coagulación dentro de lo normal.
Con todo lo anterior se concluyó en los siguientes diagnósticos: Estenosis mitral severa con insuficiencia severa, aurícula izquierda gigante, Insuficiencia tricuspídea moderada, Hipertensión pulmonar moderada y Fibrilación auricular permanente.
Se planteó la cirugía de cambio de válvula mitral, reparación de válvula tricúspide y reducción de aurícula izquierda mediante técnica de autotrasplante.
Mediante esternotomía media con canulación de la aórta ascendente y canulación y cerclaje de ambas venas cavas para ingreso a circulación extracorpórea se realizó con la técnica de "autotrasplante", reemplazo de válvula mitral con preservación de velo posterior con una válvula mecánica de 31 mm; reparación de la válvula tricúspide (técnica de bicuspidización "de Kay") y reducción de la aurícula izquierda.
La protección miocárdica se realizó con solución de histidina/clorhidrato de histidina, triptófano, α-cetoglutarato, y el agente osmσtico manitol (Solución Custodiol® HTK) y se colocó al corazón en una bandeja con hielo molido.
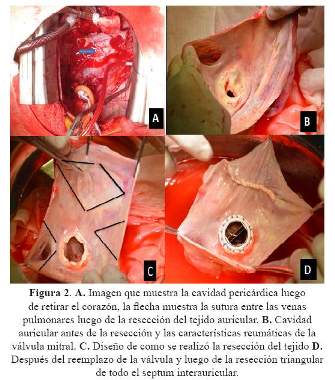
La reducción de la aurícula se realizó resecando un segmento de la pared inferior entre las venas pulmonares, otro segmento triangular que incluía la orejuela izquierda, otro segmento triangular entre el septum interatrial y el anillo de la válvula mitral y por último otro segmento que incluía parte del techo de la aurícula y todo el septum interatrial (Figura 2). La reparación de la válvula tricúspide se realizó através del septum. Luego de esto se implantó el corazón suturando con polipropileno 4.0 en primera instancia la aurícula izquierda, luego la aorta, arteria pulmonar, vena cava inferior y por último la vena cava superior.
El tiempo de isquemia fue de 3 horas 36 minutos y el de circulación extracorpórea de 4 horas 35 minutos.
La ecocardiografía transesofágica intraoperatoria, mostró que la válvula protésica estaba normofuncionante, la válvula tricúspide competente, la función sistólica del ventrículo izquierdo conservada y reducción significativa del tamaño de la aurícula izquierda.
En el postoperatorio, a las 2 horas de ingreso a la unidad de cuidados intensivos la paciente presentó sangrado de 1000 ml con alteración del perfil de coagulación, tiempo de protrombina y tiempo parcial de tromboplastina prolongados y fibrinógeno disminuido en forma importante. Por tal motivo reingresó a sala de operaciones para revisión de hemostasia, además de recibir transfusión de 5 unidades de paquete globular, 10 unidades de plaquetas, 4 unidades de plasma y 10 unidades de crioprecipitado. No se encontró punto de sangrado activo.
Al segundo día postquirúrgico la paciente presentó elevación de la creatinina de hasta 7 mg/dl y urea de 200 mg/dl, además oligoanuria y congestión pulmonar, por tal motivo se le realizó hemodiálisis 3 veces por semana, la cual se continuó hasta la tercera semana del postoperatorio en que la función renal se recuperó ad integrum.
El tiempo de intubación orotraqueal postoperatoria fue 15 días, la estancia en la unidad de cuidados intensivos 18 días y la estancia hospitalaria 31 días.
La ecocardiografía transtorácica en la primera semana del postoperatorio encontró el diámetro de la aurícula izquierda en 58 mm, el área en 50 cm2 y el volumen en 140 ml, la fracción de eyección del ventrículo izquierdo en 65% , los gradientes de la válvula mitral en 7mmHg el máximo y en 3 mm Hg el medio. Válvula tricúspide competente.
Al tercer mes postoperatorio la paciente realizó un programa de rehabilitación cardíaca, luego del cual se encuentra en clase funcional I (New York Heart Asociation).
DISCUSIÓN
La mayoría de autores concuerdan que la principal indicación de cirugía de reducción de la aurícula izquierda es la presencia de compresión a los órganos vecinos. Una segunda indicación es la presencia de trombo en la aurícula izquierda o historia de eventos tromboembólicos. La reducción del volumen de la aurícula izquierda puede en teoría prevenir la trombosis recurrente mediante la reducción de la estasis intraauricular. Sin embargo, esto puede ser difícil de percibir en pacientes que están en tratamiento con warfarina desde el principio. Por otra parte, un gran aumento de tamaño de la aurícula incrementa el riesgo tromboembólico y reduce la tasa de éxito de la cardioversión. Otros autores opinan que inclusive en pacientes asintomáticos existe indicación quirúrgica debido a lo observado en los resultados de los pacientes sometidos a cirugía de Maze (restablecimiento del ritmo sinusal) (3-6).
Los métodos actuales para la reducción del volumen de la aurícula izquierda se pueden clasificar en tres categorías: plicatura o resección parcial de la pared inferior del atrio izquierdo, plicatura o resección parcial de la pared inferior y superior del atrio izquierdo y el autotrasplante parcial del corazón (6).
Para la resección de la pared inferior se encuentran la técnica descrita por Danielson et al (8) en la década de 1960, la plastia a lo "Mercedes Benz" de Dzmeshkevich et al (9) y la resección triangular de la pared inferior descrita por Sinatra et al.(10). Para la resección de ambas paredes (superior e inferior) Sugiki et al (11), describieron la técnica de resección "en espiral" y por último la técnica de autotrasplante descrita por Lessana et al. en 1999 (12).
No hay duda que en nuestro caso la indicación de cirugía de reducción auricular izquierda es clara (diámetro de la aurícula: 94 mm y antecedente de accidente isquémico transitorio), ya hemos mencionado que hay suficiente prueba que sustenta la reducción del atrio izquierdo en conjunto con la cirugía de la válvula mitral. Sin embargo, también es cierto que la mortalidad y complicaciones pueden incrementarse al asociar estos procedimientos, debido al aumento del riesgo de sangrado, de bloqueo auriculo-ventricular y a la mayor disfunción ventricular observada en estos pacientes (esto último debido al incremento del tiempo de isquemia miocárdica) (6).
En nuestro caso decidimos realizar la técnica de autotrasplante total acompañada de resecciones triangulares de la pared inferior y posterior debido a que esto nos condicionaba mejor exposición de las paredes del atrio y avalados en la experiencia que tiene el grupo quirúrgico en la técnica de trasplante cardíaco. Como hemos visto, la evolución postoperatoria inicial no fue del todo buena, la paciente requirió de revisión de hemostasia, soporte dialítico y ventilatorio. Sin embargo y finalmente, la paciente se encuentra en CF I y en ritmo sinusal.
Este es el primer caso publicado en nuestro país del uso de la técnica de autotrasplante total para reducción de la aurícula izquierda acompañada de reemplazo de la válvula mitral, es por esto la importancia del mismo. Además recomendamos la realización de técnicas de reducción de aurícula izquierda según la indicación antes mencionada, pero las mismas deben ser realizadas por cirujanos entrenados y en centros con un buen soporte postoperatorio.
Declaración de financiamiento y de conflictos de intereses: Los autores declaran no tener conflictos de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Cox JL, Boineau JP, Schuessler RB, Kater KM, Lappas DG. Five-year experience with the maze procedure for atrial fibrillation. Ann Thorac Surg. 1993;56:814- 823. [ Links ]
2. Defauw JJ, Guiraudon GM, van Hemel NM, Vermeulen FE, Kingma JH, de Bakker JM. Surgical therapy of paroxysmal atrial fibrillation with the "corridor" operation. Ann Thorac Surg. 1992;53:564- 70. [ Links ]
3. Di Eusanio G, Gregorini R, Mazzola A, et al. Giant left atrium and mitral valve replacement: risk factor analysis. Eur J Cardiothorac Surg. 1988;2:151-9. [ Links ]
4. Kawazoe K, Beppu S, Takahara Y, et al. Surgical treatment of giant left atrium combined with mitral valvular disease. Plication procedure for reduction of compression to the left ventricle, bronchus and pulmonary parenchyma. J Thorac Cardiovasc Surg 1983; 85:885-92. [ Links ]
5. Plaschkes J, Borman J, Merin G, Milwidsky H. Giant left atrium in rheumatic heart disease: a report of 18 cases treated by mitral valve replacement. Ann Surg. 1971;174:194-201. [ Links ]
6. Apostolakis E, Shuhaiber J. The surgical management of giant left atrium. Eur J Cardiothorac Surg. 2008;33:182-90. [ Links ]
7. Benjamin E, DAgostino R, Belanger A,Wolf PA, Levy D. LA size and the risk of stroke and death: the Framingham Heart Study. Circulation. 1995;92:835- 41. [ Links ]
8. Johnson J, Danielson G, McVaugh H. Plication of the giant left atrium at operation for severe mitral regurgitation. Surgery. 1967;61:118-21. [ Links ]
9. Dzemeshkevich S, Korolev S, Frolova J, et al. Isolated replacement of the mitral leaflets and Mercedes-plastics of the giant left atrium: surgery for patients with left ventricle dysfunction and left atrium enlargement. J Cardiovasc Surg. (Torino) 2001;42:505-8. [ Links ]
10. Sinatra R, Pulitani I, Antonazzo A, Melina G. A novel technique for giant left atrium reduction. Eur J Cardiothorac Surg. 2001;20:412-4. [ Links ]
11. Sugiki H, Murashita T, Yasuda K, Doi H. Novel technique for volume reduction of giant left atrium: simple and effective spiral resection method. Ann Thorac Surg. 2006;81:378-80. [ Links ]
12. Lessana A, Scorsin M, Scheuble C, Raffoul R, Rescigno G. Effective reduction of a giant left atrium by partial autotransplantation. Ann Thorac Surg. 1999;67:1164-5. [ Links ]
Correspondencia:
Josías Ríos Ortega
Jr. Huiracocha 1416 dpto: 701, Jesús María, Lima.
Correo electrónico: jcrioso40@hotmail.com
Recibido: 29/09/2013
Aceptado: 25/11/2013