Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Medica Herediana
versión impresa ISSN 1018-130X
Rev Med Hered vol.26 no.3 Lima jul. 2015
Leucemia mieloide aguda en adultos: Estudio comparativo sobretratamiento y pronóstico por grupos etarios
Acute Myeloid Leukemia in adults: Acomparative study of treatment and prognosis by age groups
Pedro Eduardo Lovato1,a
1 Facultad de Medicina Alberto Hurtado, Universidad PeruanaCayetano Heredia, Sede Hospital Nacional Edgardo RebagliatiMartins, EsSalud. Lima,Perú.
a MédicoResidente.
RESUMEN
El tratamiento de la Leucemia mieloide aguda (LMA) está basado enadministración de quimioterapia (QT), que se asocia a importantetoxicidad en quienes la reciben. La elección del régimen de QT sebasa en edad, estado general y comorbilidades del paciente, empeorando elpronóstico en los adultos mayores. Objetivo: Comparar laevolución de pacientes menores de 60 años (adultosjóvenes) y de mayores de 60 años (adultos mayores) con LMA querecibieron QT. Material y métodos: Estudio descriptivo,retrospectivo en pacientes admitidos en el Hospital Edgardo Rebagliatientre enero de 1995 y diciembre de 2008. Los criterios de inclusiónfueron: Diagnóstico de LMA debut, mayor de 18 años, haberrecibido QT según Protocolo del Servicio de Hematología. Fueronexcluidos los pacientes con LMA promielocíticay los que fueron sometidos a trasplante de progenitores hematopoyéticos.Se determinó la tasa de remisión completa (RC), tasa depersistencia de enfermedad (PE) post QT, tasa de mortalidad asociada a QT (TM)y curvas de sobrevida libre de enfermedad (SLE) y sobrevida total (ST). Resultados:Se estudiaron 208 pacientes, 153 fueron adultos jóvenes y 55adultos mayores, los grupos tuvieron características similares. Lastasas de RC, TM y ST mostraron diferencias estadísticamentesignificativas a favor del grupo adultos jóvenes, mientras que las tasasde PE y SLE no mostraron diferencias. Conclusiones: Los pacientesadultos mayores que reciben QT tienen peor pronóstico encomparación con los pacientes adultos jóvenes. La decisiónde tratamiento con QT debe individualizarse, comparando riesgo –beneficio de la QT en cada caso.
PALABRASCLAVE: Leucemia mieloide aguda, quimioterapia, adulto joven, adulto mayor. (Fuente:DeCS BIREME).
SUMMARY
Treatment of acute myeloid leukemia(AML) is based on the administration of chemotherapy (CT), which is associatedwith significant toxicity. The selection of CT is based on age, generalcondition and presence of comorbidities in the patient, with poor prognosisassociated with advanced age. Objective: to compare the clinicaloutcomes of patients with AML treated with CT below 60 years of age with thatof patients above 60 years of age. Methods: A descriptive,retrospective study was carried-out from January 1995 to December 2008 atHospital Edgardo Rebagliaiti. Inclusion criteria wereage above 18 years and to have received CT based on standard protocols by thehospital. Patients with promyelocytic AML and thosein whom a bone marrow transplant had been performed were excluded. Completeremission rate (CRR), persistence rate (PR), mortality rates (MR) and diseasefree survival (DFS) and overall survival (OS) curves were obtained. Results:208 patients were included; 153 were young adults and 55 were older adults,both groups were comparable. CRR, MR and OS were better in young adults, whilePR and OS did not differ by age. Conclusions: Older adultpatients on CT had poor prognosis compared to younger patients. The decision onstaring CT should be individualized balancing the risks and benefits.
KEYWORDS: Acute myeloid leukemia, drugtherapy, young adult, senile adult. (Source:MeSH NLM).
INTRODUCCIÓN
La Leucemia mieloide aguda (LMA) es un grupo de desórdenes clonales de la célula madre hematopoyética,que resulta en la acumulación de células no funcionalesdenominadas mieloblastos (1). Afectapredominantemente a población de mayor edad sobre los jóvenes. Laincidencia de LMA en los Estados Unidos es 2,7 por 100 000 personas, 14,7 por100 000 en mayores de 65 años (2).
Los reportes en adultos mayores con LMA muestran bajas tasas de remisióncompleta (RC), contrastando con una mejor respuesta a la quimioterapia (QT) enjóvenes (3). Se asocian al mal pronóstico en adultos mayores, lasmutaciones genéticas adquiridas (4) o algún trastornohematológico previo (5).
La QT sigue siendo la piedra angular del tratamiento de LMA, sin embargo, latoxicidad secundaria en adultos mayores es un obstáculo para eléxito del tratamiento. Diferentes estudios han confirmado altas tasas demortalidad durante la terapia de inducción, la mayoría debido ainfección secundaria a hipoplasia medular por la QT (6). Toxicidadorgánica no fatal, como hiperbilirrubinemia,eventos cardiacos y toxicidad pulmonar, se aprecian en más del 10% depersonas (7). Asimismo, los resultados de terapia post remisión, cuandose logra en pacientes adultos mayores han sido desalentadores (8).
En Perú son pocos los estudios realizados sobre LMA. Uno realizado en elHospital Nacional E. Rebagliati Martins(HNERM) (9) encontró que no había ventaja significativa en laremisión completa (RC), sobrevida libre de enfermedad (SLE) y sobrevidaglobal (SG), al agregar Etopósido alrégimen de inducción usual de Citarabinay Daunorrubicina. No hay en el país estudioscomparativos sobre respuesta a tratamiento y pronóstico de LMAsegún grupos etarios.
El objetivo del estudio fue determinar la evolución (remisióncompleta, persistencia de enfermedad post QT, mortalidad asociada a QT,sobrevida libre de enfermedad -SLE-) de los pacientes con LMA sometidos QT,según el grupo etario.
MATERIAL Y MÉTODOS
Estudio descriptivo, retrospectivo y comparativo en pacientes con diagnóstico deLMA admitidos en HNERM desde el 1 de enero de 1995 al 31 de diciembre de 2008.Se incluyeron todos los pacientes con LMA mayores de 18 años querecibieron QT según el Protocolo del Serviciode Hematología del HNERM, no diagnosticados ni recibido previamenteterapia en otro hospital. Fueron excluidos los pacientes con LMA promielocítica y aquellos sometidos a trasplante deprogenitores hematopoyéticos (TPH).
El Protocolo consta de: a) Inducción: Esquema 7x3 (Ara-C 100 mg/m2/día,infusión continua de 24 horas por 7 días más Daunorrubicina 60 mg/m2/día EV 3 horaspor 3 días) con o sin Etopósido 100 mg/m2 infusión de 3 h por 3 días; b)Consolidación: Igual que inducción; c) Intensificación:Ara-C 1.5 g/m2 EV por 3 horas dos veces al día por 4días más Daunorrubicina 60 mg/m2o Etopósido 100 mg/m2 o Mitoxantrona 12 mg/m2 EV en 3 horas por dosdías.
Se conformaron dos grupos: Adultos jóvenes (menores de 60 años almomento del diagnóstico) y adultos mayores (pacientes de 60 añosa más). Se obtuvo información de la historia clínica delos pacientes y se registró en fichas individuales de recolecciónde datos, para luego confeccionar la base de datos en la hoja de cálculoMicrosoft Excel.
Se compararon la tasa de remisión completa (RC) definida como la presenciade menos de 5% de blastos en médulaósea durante la recuperación hematológica post QT deinducción; mortalidad relacionada a QT (MT) definida como la mortalidaddurante los 30 días post QT de inducción, la sobrevida libre deenfermedad (SLE) y la sobrevida total (ST). Se elaboraron curvas de sobrevidade Kaplan-Meier y se usó el Log-rank test para establecer diferencias entre los gruposutilizando el programa EpiInfo ver. 6. Seconsideró significativo un valor de p < 0,05.
El proyecto fue exonerado de revisión por el Comité de Éticadel Hospital Edgardo Rebagliati dado su diseñoretrospectivo descriptivo.
RESULTADOS
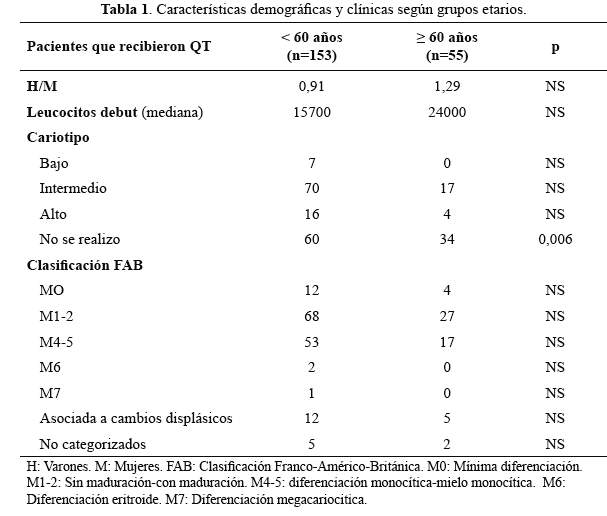
Se encontraron 474 pacientes con Leucemia mieloide aguda (LMA) en el periodo deestudio; 208 (44%) cumplieron los criterios de inclusión. Los pacientesfueron divididos en 2 grupos objeto del análisis: El primero constituidopor pacientes adultos jóvenes (n=153) y el segundo por el grupo de lospacientes adultos mayores (n=55). Ambos grupos fueron comparables y recibieronal menos 2 intensificaciones (Tabla 1).
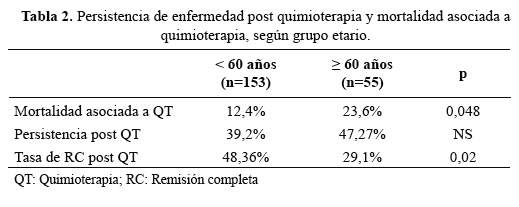
La mortalidad asociada a tratamiento de inducción y la tasa deremisión completa mostraron diferencias estadísticamentesignificativas entre el grupo adultos jóvenes y el grupo adultos mayores(p=0,048 y p=0,02, respectivamente) a favor del grupo de pacientes adultosjóvenes. No hubo diferencia significativa al comparar persistencia deenfermedad post QT de inducción entre ambos grupos (Tabla 2).
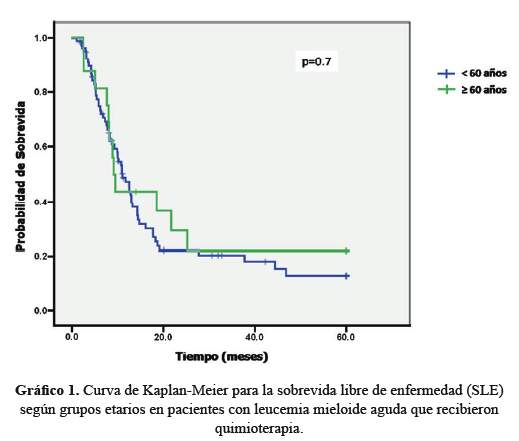
La SLE del grupo adultos jóvenes tuvo una mediana de 11,03 meses [IC 95%:8,61 – 13,45], mientras que en adultos mayores fue 9,13 meses [IC 95%:8,08 – 10,17] (p=0,74) (Grafico 1).
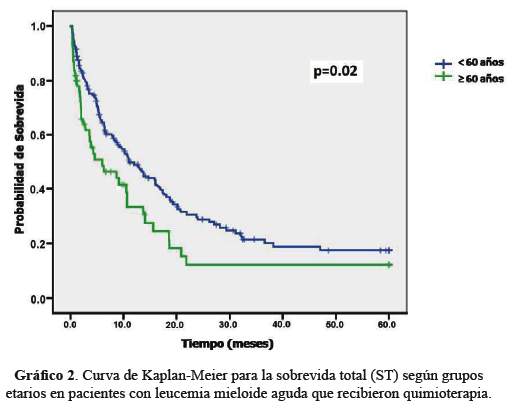
Hubo diferencias significativas en el análisis de la ST. La ST en el grupo deadultos jóvenes fue 17,85% a 5 años y la mediana fue de 11,03meses [IC 95%: 7,46 – 14,60], mientras que la ST en adultos mayores a 5años fue 12,14% y la mediana de 6,00 meses [IC 95%: 0,06 – 11,93](p=0,02) (Grafico 2).
DISCUSION
Un estudio retrospectivo (9) de 2 657 pacientes adultos mayores mostró quesólo el 30% de pacientes recibieron QT, porcentaje similar al encontradoen el presente estudio.
La mortalidad asociada a QT es históricamente superior en los grupos depacientes adultos mayores cuando se los compara con los jóvenes. Appelbaum (10) reportó una tasa de mortalidaddentro de los 30 días de iniciada la QT de inducción en pacientesentre 56 y 65 años fue 11% con SP (Status Performance) de 0, 18% con SPde 2, y 29% en pacientes con un SP de 3. Otros reportes han mostrado en adultos mayores tasas de mortalidad relacionada a QT de 15 a 30%(7,11,12). Si bien no se ha consignado el SP de los pacientesadultos mayores que han recibido QT en nuestro hospital, se ha administrado siempre y cuando tengan un SP de 0 a 2 como máximo, correspondiendo anuestros pacientes adultos mayores una tasa de mortalidad relacionada a QT de23,6%, similares a los reportes norteamericanos y superior a la mortalidad depacientes jóvenes de nuestro hospital.
Las tasas de mortalidad asociada a QT en jóvenes se encuentra entre 5 a 15%(13), rango en que se encuentra la mortalidad en menores de 60 años(12,5%) encontrada en nuestro estudio.
Se ha encontrado que la terapia convencional en pacientes adultos mayores lleva aRC en 35 a 40% (14) y 39% en mayores de 65años en comparación con 80% de RC en jóvenes (3). Un estudio de ECOG (15) mostró RC de 46% en pacientes de 55 a 70años con el esquema 3 x 7, mientras en mayores de 70 años la RCfue 27%.
Eastey (16), encontró que de 183pacientes adultos mayores con pobre SP, creatinina o bilirrubinas séricas elevadas, el 27% logró RC y el 62% tuvo muerte temprana(dentro de las 8 semanas). Así, la tasa de muerte temprana fuemás alta que la de remisión completa.
Si bien es cierto que las tasas de RC post QT han mostrado en nuestro estudiodiferencias estadísticamente significativas entre jóvenes y adultos mayores (48,3% vs 29%), la tasa de RC en jóvenes es inferior ala reportada en diferentes estudios (17,18). Sin embargo, en dichos estudios seconsidera el esquema 3 x 7 en dos fases: Una primera administración queproduce aplasia de 3 a 4 semanas de duración, seguida de RC en 50 a 60% de los casos. A los 7-10 días de finalizar la inducción serealiza un estudio medular, cuyo pronóstico es favorable si contiene menos de 5% de blastos. En los casos de persistencia blástica (> de 5% de blastos) serealiza una segunda administración con la que se consigue hasta un10 - 20% adicional de remisiones completas, de manera que se considera que latasa de RC del 3x7 (uno o dos ciclos) es del 60 a 80% (19).
En nuestro caso, de aquellos que presentaron persistencia de enfermedaddespués del primer esquema 3 x 7 (60 pacientes), solamente 14 pacientes recibieron altas dosis de ARA – C en forma de HAM (altas dosis de Ara-C + Mitoxantrona), HAE (altasdosis de Ara-C + Etopósido)o HAD (altas dosis de Ara-C + Daunorrubicina);presentando RC la mitad de ellos, con lo cual la tasa sube a 52%. Elnúmero de pacientes que fueron a una QT de rescate post PE fue escaso,sea por preferencias del propio paciente, de la familia o por complicaciones;contribuyendo para la pobre respuesta obtenida. En los casos de pacientesadultos mayores que no respondieron al primer esquema 3 x 7, no seintentó un segundo curso de QT debido a la alta tasa de mortalidad por tratamiento y por las comorbilidades de dicho grupo etario.
Un estudio del grupo CALGB (20) en 635 pacientes mayores de 60 añosencontró PE de 31,5%, mientras que el grupo italiano GIMEMA (21) en 470pacientes jóvenes encontró PE en 17%. Appelbaumy col (11)(10), mostraron PE en 37% en mayores de 56años. En nuestro estudio, la tasa de PE para ambos grupos (47,2% vs39,2%) no mostró diferencia estadísticamente significativa debido probablemente al tamaño reducido de pacientes adultos mayores.
En pacientes menores de 60 años, el grupo GIMEMA (21) reporta SLE en 24% alos 4 años, mientras el German AML CooperativeGroup (22) encontró 32% a 5 años. En mayoresde 60 años, un estudio del grupo HOVON (23) encontró SLE de 7 a13% a los 4 a 5 años; mientras que un grupo francés (24) queadministró QT a pacientes adultos mayores halló una SLE de 8,3meses. En nuestro estudio la SLE entre los dos grupos no mostró diferencia estadísticamente significativa, probablemente debido al número relativamente pequeño de casos de pacientes adultos mayores que recibieron QT.
LaST en pacientes jóvenes fue de 31% a los 5 años en el reporte del German AML Cooperative Group(22). En adultos mayores la ST es corta en diferentes estudios: 6% de sobrevidaa 2 años en mayores de 60 años (12), mediana de sobrevida de 7,5meses en un estudio de ECOG (15) y sobrevida de 8 meses en un estudio de Tilly (24).
Entre las limitaciones del estudio, tenemos que pese a ser un estudio en un periodode 14 años, el número de pacientes en ambos grupos de estudio no fue similar. Otra limitación fue la escasa información encontrada en algunos casos al revisar de manera retrospectiva las historias clínicas,lo cual impidió en pocos casos su inclusión en el análisis. Como limitación adicional se puede mencionar que lapoblación de estudio fue exclusivamente de EsSalud,cuya cobertura es de alrededor del 30% de la población peruana, siendo interesante saber si los resultados en la población de hospitales delMinisterio de Salud (MINSA) serían similares. Además, si bien es cierto los hallazgos descritos son similares al de otros estudios publicados,este es el primer estudio nacional que muestra datos comparativos enevolución entre los dos grupos etarios estudiados.
En conclusión, el pronóstico de los pacientes adultos mayores esmás ominoso que el de adultos jóvenes, con tasas de RC,mortalidad por QT y ST significativamente más adversas en los primeros. Ladecisión de iniciar QT o solamente tratamiento paliativo se debe estarbasar en un análisis individual de cada caso y dependerá no solodel status performance y de las comorbilidades del paciente, sino inclusotambién de la elección del mismo, previa información sobresu pronóstico y opciones terapéuticas.
REFERENCIAS BIBLIOGRÁFICAS
1. Stone R, ODonnell M, Sekeres M. Acute myeloid leukemia. Hematology Am Soc Hematol Educ Program. 2004; 98: 117-20. [ Links ]
2. Ries LAG, Eisner MP, Kosary CL, et al (eds). SEER Cancer Statistics Review: 1973-1998.Bethesda, MD: National Cancer Institute; 2001. [ Links ]
3. Vey N, Coso D, Bardou VJ, et al. The benefit of induction chemotherapy in patients age ≥75 years. Cancer. 2004; 101(2):325-31. [ Links ]
4. Schoch C, Haferlach T, Haase D, et al. Patients with de novo acute myeloid leukaemia and complex karyotype aberrations show a poor prognosis despite intensive treatment: a study of 90 patients. Br J Haematol. 2001; 112:118-126. [ Links ]
5.Passamonti F, Rumi E, Arcaini L, et al. Leukemic transformation of polycythemia vera. Cancer. 2005;104(5):1032-1036. [ Links ]
6. Goldstone AH, Burnett AK, Wheatley K, et al. Attempts to improve treatment outcomes in acute myeloid leukemia (AML) in older patients: The results of the United Kingdom Medical Research Council AML 11 trial. Blood. 2001;98(5):1302-1311. [ Links ]
7. Stone RM, Berg DT, George SL, et al. Granulocyte- macrophage colony-stimulating factor after initial chemotherapy for elderly patients with primary acute myelogenous leukemia: Cancer and Leukemia Group B. N Engl J Med.1995; 332(25):1671-1677. [ Links ]
8. Mayer RJ, Davis RB, Schiffer CA, et al. Intensive post remission chemotherapy in adults with acute myeloid leukemia: Cancer and Leukemia Group B. N Engl J Med.1994; 331(14):896-903. [ Links ]
9.Ríos DH. Comparación de dos esquemas de tratamiento con y sin etoposido (VP16) en las fases de inducción y consolidación en pacientes adultos con diagnóstico de leucemia mieloide aguda no promielocitica, de novo, que no fueron a trasplante de progenitores hematopoyéticos, en el periodo de enero de 1995 a diciembre de 2003 en el Hospital Nacional Edgardo Rebagliati Martins. Tesis para optar el Título de Especialista en Hematología. Lima, Perú: Universidad Peruana Cayetano Heredia; 2005. 16 páginas. [ Links ]
10.Appelbaum FR, Gundacker H, Head DR, et al. Ageand acute myeloid leukemia. Blood. 2006; 107(9):3481-5. [ Links ]
11. Rowe JM, Andersen JW, Mazza JJ, et al. A randomized placebo-controlled phase III study of granulocyte- macrophage colony-stimulating factor in adult patients (> 55 to70 years of age) with acute myelogenous leukemia: A study of the Eastern Cooperative Oncology Group (E1490). Blood.1995; 86 (2): 457-62. [ Links ]
12. Menzin J, Lang K, Earle CC, Kerney D, Mallick R. The outcomes and costs of acute myeloid leukemia among the elderly. Arch Intern Med. 2002; 162(14):1597-603. [ Links ]
13. Milanés MT, Losada R, Hernández P, et al. Aspectos clínicos y epidemiológicos de la leucemia mieloide aguda en el anciano. Rev Cubana Hematol Inmunoter. 2002; 18(1):25-33. [ Links ]
14. Fey MF. ESMO Minimum Clinical Recommendations for diagnosis, treatment and follow-up of acute myeloblastic leukaemia (AML) in adult patients. Annals of Oncology. 2003;14:1161-2. [ Links ]
15. Rowe JM, NeubergD, Friedenberg W, et al. A phase 3 study of three inductionregimens and of priming with GM-CSF in older adults with acute myeloid leukemia: a trial by the Eastern Cooperative Oncology Group. Blood.2004; 103(2): 479-85. [ Links ]
16. Estey E, Smith TL, Keating MJ, et al. Prediction of survival during induction therapy inpatients with newly diagnosed acute myeloblastic leukemia. Leukemia. 1989; 3: 257-263. [ Links ]
17. Bishop JF. The treatment of adult acute myeloid leukemia. Semin Oncol. 1997; 24(1): 57-69. [ Links ]
18. Stone RM, Mayer RJ. Treatment of the newly diagnosed adult with de novo acute myeloid leukemia. Hematol Oncol Clin North Am. 1993; 7(1):47-64. [ Links ]
19. Figuera A, Blazquez GC, Gómez GV. Tratamiento de la leucemia aguda mieloide: Terapia en oncohematologia.3ra edición. Madrid, España: Elsevier España S.A.; 2005. p. 73-106. [ Links ]
20.Farag SS, Archer KJ, Mrozek K, et al. Pretreatment cytogenetics add to other prognostic factors predicting complete remission and long-term outcome inpatients 60 years of age or older with acute myeloid leukemia: results from Cancer and Leukemia Group B 8461. Blood. 2006; 108:63-73. [ Links ]
21. Mandelli F, Vegna ML, Avvisati G, et al. A randomized study of the efficacy of postconsolidation therapy in adult acute non lymphocytic leukemia: a report of the Italian Cooperative Group GIMEMA. Ann Hematology. 1992; 64: 166-172. [ Links ]
22. Buchner T, Hiddemann W, Wormann B, et al. Double induction strategy for acute myeloid leukemia: the effect of high-dose cytarabine with mitoxantrone instead of standard-dose cytarabine with daunorubicin and6-thioguanine: a randomized trial by the German AML Cooperative Group. Blood. 1999; 93(12):4116- 24. [ Links ]
23. LowenbergB, Suciu S, Archimbaud E,et al. Mitoxantrone versus daunorubicinin induction- consolidation chemotherapy ± the value of low- dose cytarabine for maintenance of remission, and an assessmentof prognostic factors in acute myeloid leukemia in the elderly: Final report ofthe Leukemia Cooperative Group of the European Organization for the Researchand Treatment of Cancer and the Dutch- Belgian Hemato-Oncology Cooperative HOVON Group randomized phase III study AML-9. J Clin Oncol. 1998; 16: 872-881. [ Links ]
24. Tilly H, Castaigne S, Bordessoule D, et al. Low-dose cytarabine versus intensive chemotherapy in the treatment of acute nonlymphocytic leukemia in the elderly. J Clin Oncol.1990; 8: 272-279. [ Links ]
Declaración de financiamiento y de conflictos deinterés:
Elestudio fue financiado por el autor; declara no tener conflicto de intereses.
Correspondencia:
PedroEduardo Lovato
Avenida Manco Cápac 1103 Baños del Inca.
Cajamarca– Perú.
Correo Electrónico: pedrolovatorios@yahoo.com
Recibido:21/03/2015
Aceptado:26/06/2015