Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.22 n.1 Lima ene./mar. 2002
TRABAJOS ORIGINALES
Cuadro Clínico Patológico y Sobrevida en Carcinoma Gástrico operable
Juan Díaz-Plasencia1; Edgar Yan-Quiroz2; Othoniel Burgos-Chávez2; Thierry Balmaceda-Fraselle2; Germán Patrón-Ríos2; Juan Santillán-Medina2
1 Doctor en Medicina. Médico Jefe del Departamento de Cirugía del Hospital Belén de Trujillo. Coordinador del Curso de Cirugía I de la Universidad Privada Antenor Orrego de Trujillo.
2 Estudiante de Medicina de la Universidad Privada Antenor Orrego de Trujillo
RESUMEN
El presente estudio retrospectivo evaluó a 180 pacientes con carcinoma gástrico resecable (Grupo I) comparándolos con 128 pacientes con carcinoma gástrico irresecable (Grupo II) con respecto al cuadro clínico-patológico, la sobrevida actuarial y la morbimortalidad quirúrgica y que fueron atendidos en el Hospital Belén de Trujillo, Perú, desde 1966 a 1998. La edad media de la serie total fue de 58.3 + 14.8 años (Grupo I: 58.3 ± 14.0 años; Grupo II: 57.7 + 14.1 años). Tanto en el Grupo I como en el Grupo II, el síntoma más frecuente fue dolor abdominal (89.4% y 94.5% respectivamente) y el signo más común fue palidez (62.8% y 59.4% respectivamente). Los casos irresecables presentaron mayor frecuencia de masa palpable (p<0.0001), lesiones en los dos tercios superiores (p=0.0032), lesiones T4 (p<0.001), metástasis a distancia (p<0.001), estadío IV (p<0.001), metástasis hepática (p<0.001) y metástasis peritoneal (p<0.001), en comparación con los resecables. La mortalidad operatoria total fue de 19.5% (Grupo I: 12.1%, Grupo II: 28.9%). Las complicaciones más frecuentes fueron la neumonía (Grupo I: 8.9%, Grupo II: 7.8%) y la infección de herida operatoria (Grupo I: 10.6%, Grupo II: 3.9%). En el Grupo II, los procedimientos quirúrgicos efectuados fueron: laparotomía exploratoria (n=82), gastroenteroanastomosis (n=34), gastrostomía (n=6), gastrectomía por exclusión (n=5) e ileotransversoanastomosis (n=1). La sobrevida actuarial de los casos resecables a los 5 años fue de 18.5% y de la serie irresecable a los 12 y 36 meses fue de 9% y 0% respectivamente. El diagnóstico precoz de esta neoplasia sobre todo en pacientes de alto riesgo ofrecería mejores posibilidades de un tratamiento oportuno.
Palabras clave: Carcinoma gástrico. Tratamiento quirúrgico.
SUMMARY
The present retrospective study evaluated 180 patients with resectable (Group I) and 128 patients with unresectable (Group II) gastric carcinoma at Belen Hospital, Trujillo, Peru, from 1966 to 1998, with the aim to identify the clinical and pathological features, actuarial survival rate and surgical morbidity and mortality rates of both groups. The mean age of the total series was of 58.3 + 14.8 years (range, 18 to 85 years). The most frequent symptoms in both groups were abdominal pain (89.4% and 94.5% respectively) and the most common sign was pallor (62.8% and 54.5% respectively). The unresectable cases presented a higher frequency of palpable mass (p<0.001), upper two thirds neoplasms (p=0.0032), T4 lesions (p<0.001), distant metastasis (p<0.001), stage IV (p<0.001), hepatic metastasis (p<0.001) and peritoneal metastasis (p<0.001), compared with resectable gastric cancer patients. The total surgical mortality rate was of 19.5% (Group I: 12.1%, Group II: 28.9%). The most frequent complications were pneumonia (Group I: 8.9%, Group II: 7.8%) and surgical wound infection (Group I: 10.6%, Group II: 3.9%). In Group II, the exploratory laparotomy was carried out in 82 cases, whilst 46 cases underwent gastroenterostomy (n=34), gastrostomy (n=6), gastrectomy by exclusion (n=5) and ileotransversoanastomosis (n=1). The 5-year survival rate in resectable patients was of 18.5% and in unresectable cases the survival rate at 12 and 36 months was of 9% and 0% respectively. The early diagnosis of this neoplasm, mainly in high risk patients, would offer better possibilities of an opportune treatment.
Key words: Gastric cancer. Surgical treatment
INTRODUCCIÓN
El carcinoma gástrico es una de las enfermedades neoplásicas más frecuentes en el mundo, alcanzando cifras que sobrepasan el medio millón de muertes cada año(1). En Trujillo, la tasa de incidencia ajustada a la población mundial estándar por carcinoma gástrico es de 31.1 y 19.7 por 100000 habitantes, en varones y mujeres respectivamente(2). A pesar de su alta incidencia, el diagnóstico se determina, en la gran mayoría de casos, en estadíos avanzados, tanto así, que el 50% de pacientes que consultan al INEN no tienen posibilidad ni siquiera de ser explorados quirúrgicamente(1).
En nuestro país una alta frecuencia de pacientes con carcinoma gástrico acude a los centros hospitalarios para recibir tratamiento en estadíos avanzados de la enfermedad, de los cuales, en muchos de estos pacientes la cirugía es innecesaria porque presentan enfermedad metastásica locorregional o a distancia, lo que califica al paciente como irresecable o tributario de tratamiento paliativo, llámese gastroyeyunoanastomosis y gastro o yeyunostomía(3). En un estudio previo realizado en el INEN, Ruiz et al (4) refieren una tasa de resecabilidad de 49.2% en 2860 pacientes.
En el presente estudio analizamos la experiencia quirúrgica de un grupo de pacientes con carcinoma gástrico irresecable durante 33 años consecutivos con el objetivo principal de identificar el cuadro clínico-patológico, sobrevida y morbimortalidad de estos pacientes y compararlos con los casos resecables.
MATERIAL Y MÉTODOS
Un total de 308 pacientes con diagnóstico de adenocarcinoma gástrico histológicamente demostrado fueron admitidos al Hospital Belén, Trujillo, Perú, desde el 1 de enero de 1966 hasta el 31 de diciembre de 1998. De estos pacientes, 180 fueron considerados resecables (Grupo I) y 128 se consideraron irresecables (Grupo II). Fueron excluidos del presente estudio aquellos pacientes que presentaron diagnóstico diferente al de adenocarcinoma gástrico.
Las neoplasias se clasificaron por estadíos usando los criterios propuestos por la Unión Internacional Contra el Cáncer(5), macroscópicamente según la clasificación de Borrmann(6) y de las Reglas Generales para el Estudio de Cáncer Gástrico en Cirugía y Patología de la Sociedad de Investigación Japonesa para el Cáncer Gástrico(7) y por tipos histológicos de acuerdo a la clasificación de Laurén y Jarvi(8). Para propósitos del presente estudio, el material histológico fue reevaluado por un miembro del staff del Departamento de Patología de nuestra institución que desconocía la historia clínica, el diagnóstico previo y la evolución final del paciente.
El paciente con carcinoma gástrico fue considerado IRRESECABLE si presentó algún evento como S3 (cuando no fue posible extirpar en bloc el órgano comprometido), H1 o H2 (H1 no se puede efectuar segmentectomía hepática), P2 o N4. Estos criterios no constituyeron contraindicación de la resección quirúrgica cuando se efectuaron resecciones paliativas.
Los pacientes se consideraron RESECABLES cuando presentaron lesiones S0, S1 , S2 o S3 (cuando se extirpó en bloc el órgano removido); P0 o P1 ; H0 , H1 (cuando fue posible resecar la metástasis única); N0 o N(+).
Los pacientes fueron divididos de acuerdo a la extensión de la linfadenectomía en los siguientes grupos: D0, cuando no se efectuó o hubo remoción incompleta del grupo N1; D1, si la disección incluyó sólo los ganglios N1; D2, si incluyó los grupos ganglionares N1 y N2 ; D3 si además incluyó los ganglios linfáticos N3 y D4 cuando incluyó todos los grupos ganglionares hasta N4.
Se consideró RESECCIÓN CURATIVA, cuando no se encontró metástasis hepática, ni compromiso peritoneal, los límites de sección oral y caudal fueron efectuados a más de 10 mm de la infiltración macroscópica del tumor, el compromiso de la serosa fue S0 - S1 - S2 y la resección gástrica se acompañó de una disección y extirpación del grupo ganglionar siguiente o más allá al compromiso macroscópico. Además cuando cumplidas las condiciones antedichas, la resección ganglionar fue de todas las barreras con infiltración tumoral (N1 , N2 y N3) o cuando el tumor fue S3 pero se pudo resecar en bloc.
La resección fue PALIATIVA, si hubo compromiso de órganos por vecindad y no se pudo resecar en bloc el órgano invadido o la totalidad de los grupos ganglionares comprometidos o los márgenes fueron positivos.
El estado del seguimiento post-operatorio fue obtenido y determinado con la visita domiciliaria al paciente, sus familiares o cirujanos tratantes, del último control registrado en las historias clínicas hospitalarias o del Registro de Defunciones del Concejo Provincial de Trujillo. La información del seguimiento fue procesada hasta el 31 de Diciembre de 1999 (periodo de seguimiento mínimo de un año).
La información se obtuvo de las historias clínicas del Departamento del Estadística, Sala de Operaciones y Patología de nuestra institución. Para efectos del presente estudio se confeccionó una ficha clínica que incluyó datos demográficos, tiempo de enfermedad, síntomas principales, hallazgos clínicos al momento de la admisión, exámenes auxiliares (hematológicos, bioquímicos, radiográficos ecográficos, endoscópicos, biopsia, otros), extensión de la enfermedad, tipo de cirugía, fecha de la operación, hallazgos histopatológicos, localización y tamaño de la neoplasia.
Morbilidad quirúrgica. Cociente entre el número de complicados observados hasta los treinta días del postoperatorio después de la primera intervención y el número de pacientes operados por la misma causa.
Mortalidad quirúrgica. Cociente entre el número de muertos observados hasta los treinta días del postoperatorio después de la primera intervención y el número de pacientes operados por la misma causa.
Para el análisis estadístico se utilizó la prueba de Chi cuadrado o el test exacto de Fisher cuando las frecuencias esperadas fueron menores de cinco en tablas de contingencia de 2 x 2 para variables categóricas. Los datos numéricos fueron presentados en medias + DE. Se empleó la prueba t de Student para la comparación de dos medias para variables numéricas. Las tasas de sobrevida actuarial a 5 años fueron calculadas usando el método de Kaplan-Meier. Los decesos en el post-operatorio fueron considerados como muertos con enfermedad neoplásica. En el presente estudio no hubo perdidos de vista o fallecidos por enfermedades intercurrentes benignas. La evaluación de los efectos de las variables discretas en la sobrevida fue realizado usando el test de log-rank. Se consideró un valor p < 0.05 como estadísticamente significativo. En el análisis de los datos se utilizó el paquete estadístico SPSS versión 9.0 y EpiInfo 2000.
RESULTADOS.
Población de pacientes. La presente serie estuvo constituida por 308 pacientes, de los cuales 180 fueron resecables (Grupo I) y 128 fueron considerados irresecables (Grupo II). La edad promedio para la serie total fue de 58.3 + 14.8 años. La edad media fue de 53.3 + 12.4 años para el Grupo I y 58.7 + 14.1 años para el Grupo II (límites, de 33 a 78 años y de 18 a 85 años, respectivamente).
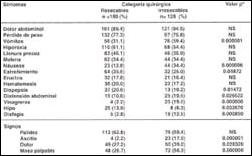
Cuadro clínico. En el Grupo I los síntomas más frecuentes fueron dolor abdominal (89.4%), pérdida de peso, (77.3%) e hiporexia (61.1%). Con relativa frecuencia los pacientes presentaron llenura precoz (46.1%), estreñimiento (35.6%), melena (34.4%) y náuseas (34.4%). Poco frecuentes fueron vómitos (31.1%), dispepsia (20.6%) y hematemesis (20.0%). El signo más común de los casos resecables fue palidez (62.8%), seguida de dolor (27.2%) y masa palpable (26.7%). En los pacientes del Grupo II, el dolor abdominal (94.5%), pérdida de peso, (75.8%) y vómitos (79.4%) fueron los síntomas más frecuentes. Con relativa frecuencia los pacientes presentaron hiporexia (54.4%), llenura precoz (35.9%), melena (34.4%) y náuseas (34.4%). Poco frecuentes fueron estreñimiento (25.0%), hematemesis (17.2%) y eructos (16.4%). El signo mas común fue palidez (59.4%), y masa palpable que se presentó en el 56.3% de los pacientes. Además fue mayor la detección de ascitis (p=0.000001) y dolor en el grupo considerado irresecable (p = 0.0283). La evaluación estadística demostró que hubo diferencia estadísticamente significativa en la presentación de los síntomas entre las diferentes categorías quirúrgicas de pacientes en cuanto a vómitos, náuseas, estreñimiento, dispepsia, distensión abdominal, vinagreras, hipo y disfagia (p<0.05) (Tabla I).
Tabla I. Síntomas y signos principales de acuerdo a
categorías quirúrgicas(1)Chi cuadrado o Test exacto de Fisher según
sea necesario
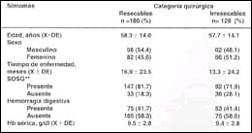
Parámetros clínico-patológicos. Las diferencias encontradas entre los parámetros clínicos de entrada con relación a edad, sexo, tiempo de enfermedad, síndrome de obstrucción de salida gástrica, hemorragia digestiva y hemoglobina sérica no fueron estadísticamente significativas entre los dos grupos, con excepción de la masa palpable que se presentó en un 56.3% de nuestros pacientes irresecables (p<0.0001) (Tabla II).
Tabla II. Párametros clínicos según categorías quirúrgicas
(1)Chi cuadrado, test exacto de Fisher o "T" de Student, según sea
adecuado; p> 0.05
(2)SOSG: Síndrome de Obstrucción de Salida Gástrica
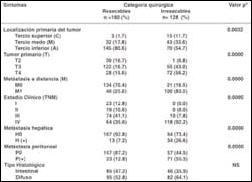
Al evaluar los parámetros patológicos los pacientes del Grupo II, en comparación con los del Grupo I, presentaron mayor frecuencia de lesiones en el tercio superior y medio del estómago (45.3% vs 19.5%, p=0.0032), lesiones T4 (56.2% vs 15.6%, p=0.0000), metástasis a distancia (83.5% vs 25.6%, p=0.0000), estadío clínico IV (92.2% vs 35.6%, p=0.0000), compromiso hepático (26.6% vs 7.2%, p=0.0000) y peritoneal (55.5% vs 12.8%, p=0.0000). No hubo diferencia estadísticamente significativa con respecto al tipo histológico (Tabla III).
Tabla III. Párametros patológicos según categorías
quirúrgicas
(1)Chi cuadrado, test exacto de Fisher o "T" de
Student, según sea adecuado
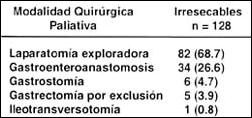
Modalidad quirúrgica en pacientes irresecables. Del total de pacientes irresecables, 34 (26.6%) se les realizó gastroenteroanastomosis, 6 (4.7%) fueron sometidos a gastrostomía, 5 (3.9%) se les practicó gastrectomía por exclusión y a un sólo paciente (0.8%) se le practicó ileotransversoanastomosis (Tabla IV).
Tabla IV. Modalidad quirúrgica paliativa en pacientes
irresecables.
Morbilidad quirúrgica. Las complicaciones encontradas en el Grupo I fueron: neumonía (n=16), atelectasia (n=6), infección de herida operatoria (n=19), dehiscencia de herida operatoria (n=6), dehiscencia de esófagoyeyunoanastomosis (n=2), dehiscencia de muñón deudenal, (n=8) dehiscencia de esófagoyeyunoanastomosis (n=2), obstrucción intestinal (n=4), absceso intraabdominal (n=2) y pancreatitis (n=1) (Tabla V). En el Grupo II las complicaciones incluyeron neumonía (n=10), atelectasia (n=2), infección de herida operatoria (n=5), fístula duodenal (n=1), dehiscencia de herida operatoria (n=1) y derrame pleural (n=1) (Tabla VI). La morbilidad quirúrgica de toda la serie fue de 18.2%.
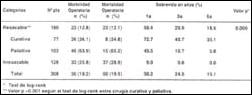
Sobrevida actuarial. Usando el test de log - rank, se encontró diferencia estadísticamente significativa con relación a la sobrevida quinquenal entre ambos grupos (p=0.0000). Los pacientes del Grupo I tuvieron una sobrevida actuarial a los 12 y 36 meses de 9% y 0% respectivamente. La sobrevida a 5 años para los pacientes del Grupo II fue de 18.5%. La tasa de sobrevida quinquenal de los pacientes resecables que tuvieron cirugía con intención curativa (n=77) fue mayor que aquellos que sólo tuviron resección paliativa (n=103) (35.1% vs 5.8%, p>0.001) (Tabla VII).
Tabla V. Morbilidad quirúrgica de pacientes resecables
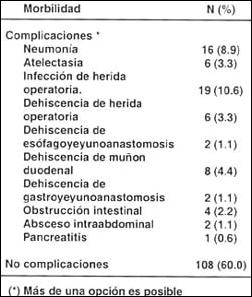
(1)Más de una opción es posible
Tabla VI. Morbilidad quirúrgica de pacientes irresecables

(1)Más de una opción es posible
Tabla VII. Morbilidad operatoria y sobrevida según categorías
quirúrgicas. Hospital Belén, 1966-1998
(1)Test de log-rank
(2)Valor p < 0.001 según el test de log-rank
entre cirugía curativa y paliativa.
DISCUSIÓN.
En nuestro estudio, no hubo diferencia estadísticamente significativa en ambos grupos con respecto a la edad. El mayor pico de frecuencia etárea en ambos grupos de pacientes estuvo en la sexta y séptima décadas de la vida lo que concuerda con un estudio realizado en el Hospital Edgardo Rebagliati Martins-ESSALUD(3). Algunos autores consideran que la edad per se tiene un valor pronóstico ya que se ha observado que pacientes jóvenes con carcinoma gástrico tienen un pronóstico sombrío(9,10) El bajo índice de sospecha por parte del clínico de catalogar a una enfermedad como maligna en pacientes jóvenes con sintomatología digestiva, ocasionaría que dichos síntomas progresen durante un largo periodo hasta que la enfermedad neoplásica sea considerada dentro del plan de evaluación. Además, el tipo histológico difuso, que predomina en los pacientes irresecables, tendría mayor actividad biológica que la del tipo intestinal(11)
En nuestra serie global, la distribución por sexo mostró un discreto predominio del sexo femenino sobre el masculino y la proporción varón a mujer fue de 1 a 1.1 aunque este hecho no fue estadísticamente significativo lo cual concuerda con Barboza(1). El tiempo promedio desde el inicio de los síntomas a la admisión hospitalaria fue de 16.9 ± 23.5 meses en el Grupo I y de 13.3 ± 24.2 meses en nuestros pacientes del Grupo II. Msika et al(12) muestran que pacientes con un tiempo de enfermedad menor de seis meses tienen un pobre pronóstico. Sin embargo, otro estudio(13) señala que el pronóstico es peor en pacientes con una larga evolución ya que existen síntomas digestivos que el médico pueden confundir con úlceras gástricas benignas pero que en realidad corresponde a lesiones gástricas ulceradas malignas, tipo Borrmann II y III, ocasionando un retardo en el diagnóstico(11).
La presentación clínica del carcinoma gástrico está influenciado por la extensión de la lesión y la presencia o no de metástasis(14). En países del hemisferio occidental, la mayoría de pacientes con carcinoma gástrico ya tienen metástasis en el momento de la primera consulta, por lo tanto, los síntomas y el curso clínico suelen corresponder a un cáncer avanzado(15).
El dolor al momento del diagnóstico, es el primer síntoma frecuente y se ha observado en el 89.4% y en el 94.5% de nuestros pacientes resecables e irresecables respectivamente, lo cual coincide con la literatura(16). Cuando el carcinoma está localizado en la región pilórica produce obstrucción y origina síntomas precoces de vaciamiento gástrico. Un 80.6% de nuestros casos resecables y el 54.7% de nuestros pacientes irresecables presentó lesiones que inicialmente se originaron en el antro gástrico. Las lesiones primarias de fondo y cuerpo gástrico de los casos irresecables se encontraron en un 11.7 % y 33.6% respectivamente (p=0.0032). Las lesiones del fondo gástrico, en nuestro estudio, se acompañaron de disfagia en el 12.5 % de los casos por compromiso del cardias. Las del cuerpo gástrico generalmente son asintomáticas hasta que la lesión se ulcere, ocasione dolor o hemorragia de magnitud variable(17). Por otro lado, al ocluir el tumor la luz gástrica o al comprometer la pared del mismo, se altera la capacidad de reservorio del estómago lo cual también explicaría la hiporexia con la consecuente pérdida de peso que encontramos en un gran porcentaje: 75.8% y 77.3 % de los casos irresecables y resecables respectivamente.
La palidez, causada por la anemia y encontrada en 62.8% en el Grupo I y en 59.4 % de los pacientes no resecables, se debería a la pérdida crónica de sangre por las lesiones gástricas ulceradas o a la malabsorción de hierro o folato. Sin embargo, la frecuencia de hemorragia digestiva en ambos grupos no fue un factor estadísticamente significativo. Por otro lado, esta misma pérdida crónica de sangre explicaría los bajos niveles de hemoglobina sérica encontradas en ambos grupos de pacientes tanto resecables como irresecables.
En nuestro estudio fue notoria la predominancia del tipo histológico difuso tanto en el Grupo I como en el Grupo II (52.8% y 64.1% respectivamente). Este tipo histológico es frecuente en poblaciones de bajo riesgo como Estados Unidos o Europa, se da más en mujeres, gente joven y tienden a tener un peor pronóstico. Así, hemos encontrado que este tipo histológico se dio en un 70.3 % en pacientes de sexo femenino con carcinoma gástrico irresecable, lo que concuerda con otros informes de áreas de bajo riesgo(18)(19) Hermanek y Wittekind(20) señalan con respecto a la localización del tumor que el tipo intestinal predomina en el antro y el tipo difuso puede incluso abarcar las tres áreas de la región gástrica con preferencia en el fondo y cardias. Sin embargo en la presente serie de carcinoma irresecable encontramos que ambos tipos histológicos ocupan más de una región gástrica. Esto se debe a que el carcinoma gástrico en estos pacientes es diagnosticado en un estadio avanzado con gran compromiso de la pared o cuando incluso compromete órganos adyacentes o más aún con presencia de metástasis a distancia.
La morbilidad operatoria en los resecables e irresecables alcanzó un 12.8% y 25.8 % de los casos respectivamente. La neumonía y atelectasia postoperatorias, dos de las complicaciones respiratorias más frecuentes, se la encontró en el 8.9% y 3.3% de casos del Grupo I y en 7.8 % y 1.6 % de los pacientes del Grupo II. Múltiples fenómenos perioperatorios contribuyen al desarrollo de complicaciones operatorias: los anestésicos disminuyen la eliminación mucociliar y secan las secreciones lo que aunado al mal estado general de estos pacientes irresecables, origina obstrucción de las vías respiratorias menores; el dolor por incisión quirúrgicas y sitios de drenaje restringe la movilidad del paciente, impide las excursiones respiratorias y evita la inspiración profunda; las sondas nasogástricas también pueden deteriorar la tos y la eliminación de secreciones(21)(22).
En nuestra serie encontramos una tasa global de infección de herida operatoria (IHO) de 10.6% de nuestros casos resecables y en el 3.9 % del total de pacientes irresecables. De los irresecables, 82 casos correspondieron a laparatomia exploradora más biopsia gástrica y en 34 casos se efectuó gastroenteroanastomosis. En el sujeto normal, el jugo gástrico es estéril por su pH bajo, sin embargo, en los casos con carcinoma gástrico y en aquellos en que éste se asocia a hemorragia digestiva, obstrucción a la salida gástrica o necrosis tumoral, a menudo el pH intragástrico aumenta por encima de 6 y hay colonización de bacterias(23). En un 26.6 % de nuestros casos se efectuó gastroenteroanastomosis con el objetivo de descomprimir la cámara gástrica y facilitar un adecuado vaciamiento gástrico condicionando de esta manera una mejor calidad de vida.
Al analizar las causas de irresecabilidad encontramos que la causa más frecuente fue el compromiso peritoneal (55.5%), lo cual coincide con Zapata Sánchez et al(3). Este tipo de metástasis no puede ser detectada por la ecografía, la tomografía computada (TAC) ni por la resonancia magnética nuclear (RNM), ya que estos métodos son poco sensibles si los nódulos neoplásicos miden menos de 0,5 centímetros en la cavidad peritoneal(4). El carcinoma gástrico es uno de los cánceres intraabdominales que con mayor frecuencia disemina a la cavidad peritoneal. Cuando el tumor invade la serosa gástrica, las células neoplásicas pueden desprenderse e implantarse en el peritoneo que en un estadio avanzado produce masas discretas como resultado de la carcinomatosis.
El examen ideal para determinar la metástasis peritoneal en su etapa inicial es la laparoscopia convencional. Por otro lado, la laparoscopia ha emergido también como un importante procedimiento diagnóstico en enfermedades hepáticas y la mayor parte de la superficie hepática puede ser vista y las biopsias pueden ser tomadas de las lesiones específicas(24). Dicha técnica nos sirve para propósitos de estadiaje y así planificar la estrategia a seguir evitándose realizar laparotomías innecesarias que acarrean una mayor morbimortalidad operatoria. Berrospi et al(25) además encuentran que en el análisis de los posibles factores relacionados con la morbilidad y mortalidad postoperatorias por cáncer gástrico, el compromiso tumoral de órganos vecinos y metástasis peritoneal son factores pronósticos de complicaciones postoperatorias. Así, el 68.8% de nuestros pacientes irresecables fueron sometidos sólo a laparatomía exploradora por encontrarse en el acto operatorio enfermedad con extensión a órganos adyacentes, compromiso hepático o carcinomatosis peritoneal. La mortalidad operatoria de la serie resecable fue de 12.1% y de la serie irresecable fue de 28.9% (n= 37). Rohde et al(26) señalan que la presencia de enfermedad avanzada y el mal estado general explicaría el alto índice de mortalidad en los pacientes irresecables.
Los hallazgos en el examen físico y la confirmación histológica de diseminación a distancia tales como el ganglio de Virchow, de Irish, el nódulo umbilical o el anaquel de Blummer entre otras, constituyen en la actualidad los datos más confiables que hacen poco recomendable la intervención quirúrgica. Sin embargo, Fink y Longmire(27) recomiendan la exploración con fines de paliación, aun cuando se observe extensión local o a distancia.
En nuestra serie, los pacientes sometidos a resección gástrica curativa y paliativa representaron el 42.8% y 57.2% del total de pacientes resecables respectivamente. La cirugía es la única modalidad con potencial curativo en pacientes con carcinoma gástrico y este potencial está directamente relacionado con la extensión de la enfermedad primaria(28). De otro lado, la forma paliativa más eficaz es también la intervención quirúrgica(29). El procedimiento paliativo consiste en evitar al paciente complicaciones como sangrado, obstrucción, necrosis o ulceración(30). La tasa de sobrevida a 5 años en nuestro grupo de pacientes con resección curativa y paliativa fue de 35.1% y 5.8% respectivamente pudiéndose concluir que, sin tener en cuenta otros parámetros, solamente los pacientes resecables con intención curativa tuvieron la perspectiva de sobrevivir más allá de 5 años y confirma que el tratamiento quirúrgico cambia la evolución natural de esta enfermedad(14).
La supervivencia media de los 128 pacientes con tumor irresecable fue de sólo 9% al año de la intervención . De los 106 pacientes, que presentaron metástasis a distancia al momento de la evaluación, tuvieron una sobrevida máxima de sólo 18 meses. Como hemos visto en nuestra revisión el pronóstico del carcinoma gástrico irresecable continua siendo sombrío. La sobrevida máxima de nuestra serie irresecable fue de 24 meses, alcanzada únicamente por un paciente. El resto de nuestros pacientes no sobrevivió mas de año y medio después de efectuado el diagnóstico definitivo.
Como es el caso de otras formas de neoplasias malignas, los mejores progresos vendrán solo con el diagnóstico temprano. Se hace necesario que el clínico tenga un alto índice de sospecha que permita un a detección precoz de esta neoplasia, sobretodo en pacientes de alto riesgo. Con este propósito a todo paciente mayor de 40 años con problemas gástricos debe indicársele una endoscopia alta. Estas medidas tendrían impacto no sólo en una disminución de la incidencia de esta neoplasia, sino también en un diagnóstico precoz y en un tratamiento oportuno.
REFERENCIAS BIBLIOGRAFICAS.
1. Barboza E. Cáncer de estómago. Rev Med Hered 1996; 7: 87-100. [ Links ]
2. Albújar P. El cáncer en Trujillo, 1984-1987. Estudio de incidencia y mortalidad. REGCAT. Monografía No 1. Trujillo 1992; 17. [ Links ]
3. Zapata Sánchez J, Vojvodic I, Avagon G, Tupía Garcia Godos C, Navarrete J. Factores pronósticos de irresecabilidad en pacientes con cáncer gástrico. Enfermedades del Aparato Digestivo 1999; 17: 135 – 142. [ Links ]
4. Ruiz E, Berrospi F, Morante C, Payet E, Celis J, Montalbeltti JA. Operabilidad y resecabilidad del cáncer gástrico: Análisis de 2280 casos en 15 años. Rev Gastroent Perú 1997; 17: 135 – 142. [ Links ]
5. International Union Against Cancer. TNM – Classification of malignant tumors. En: Sobin LH, Wittekind Ch, Eds. Stomach. 5th. ed. New York : Willy – Liss; 1997. p. 59 - 62. [ Links ]
6. Borrmann R. Gesch wulste des magens und duodenums. In : Honke F, Lubarsh O. Hanbuch der speziellen pathologischen anatomic und histologic. Berlin : J Springer; 1926. p. 812 - 1054. [ Links ]
7. Japanese Research Society for Gastric Cancer. Japanese Classification of Gastric Carcinoma. 1st ed. Tokyo: Kanehara and Co; 1995. [ Links ]
8. Lauren P. The two histology main types of gastric carcinoma: Diffuse and so-called intestinal type carcinoma: An attemp at histo-clinical classification. Acta Pathol Microbial Scand 1965; 64: 31-49. [ Links ]
9. Matley PJ, Dent DM, Madden MV, Price SK. Gastric carcinoma in young adults. Ann Surg 1998; 208: 593 – 596. [ Links ]
10. Maehara Y, Oshiro T, Iowa H, Oda S, Bba H, Akazawa K, et al. Gastric carcinoma in patient over 70 year of age. Br J Surg 1995; 82: 102 – 105. [ Links ]
11. Sánchez-Bueno F, García-Marcilla JA, Perez-Flores D, et al. Pronostic factors in a series of 297 patients with gastric adenocarcinoma undergoing surgical resection. Br J Surg 1998; 85: 255-260. [ Links ]
12. Msika S, Chastang C, Houry S, Lacaine F, Huguier M. Lymph node involvementas the only prognostic factor in curative resected gastric carcinoma: a multivariate análisis. World J Surg 1989; 13: 118-123. [ Links ]
13. Harrison JD, Fielding JWL. Prognostic factors for gastric cancer influencing clinical practice. World J Surg 1995; 19: 496-500. [ Links ]
14. Díaz J, Tantaleán E, Urtecho A, Guzmán C, Salinas-Alva E. Cáncer de estómago resecable: Análisis de 134 casos consecutivos. Rev Gastroent Perú 1995; 15: 265 – 272. [ Links ]
15. Rubin E, Farber E. El Aparato Digestivo: Neoplasias malignas en estómago. En: Rubin E. Patología. 1ª ed. México: Edit Panamericana SA; 1990. p. 592 – 596. [ Links ]
16. Kurtz R. Tumores del estómago. En: Stein J. Medicina Interna. 3ª ed. Barcelona: Salvat Ed SA; 1991. p. 344 – 348. [ Links ]
17. Torres F, Arrubarena VM. Carcinoma gástrico. En: Arrubarrena VM (ed). Fisiopatología quirúrgica del aparato digestivo. 2ª ed. México: Editorial Manuel Moderno 1996. p. 179 –194. [ Links ]
18. Cady B, Rossi RI, Silverman ML, Piccioni W, Heck TA. Gastric adenocarcinoma. A disease in transition. Arch Surg 1989; 124: 303 – 308. [ Links ]
19. Farley DR, Donohue JH, Nagorney DM, Carpenter HA, Katzmann JA, Ilstrup DM. Cáncer gástrico en fase inicial. Br J Surg 1992; 539 – 542. [ Links ]
20. Hermanek P, Wittekind C. Histological typing and grading of gastric carcinomas. En: Nishi M, Ichikawa H, Nakajima T, Maruyama K, Tahara E (eds). Gastric Cancer. 1ª ed. Tokyo: Springer Verlag; 1993.p. 40-52. [ Links ]
21. Akoh JA, Macintyre JMC. Mejora de la supervivencia en el cáncer gástrico: Revisión de las tasas de supervivencia a 5 años en publicaciones de lengua inglesa desde 1970. Br J Surg (ed esp) 1992; 79: 293-9. [ Links ]
22. Harris JD, Johanson WG, Pierce AK. Bacterial lung clearance in hipoxic mice. Am Rev Resp Dis 1975; 111: 910. [ Links ]
23. Sjostedt S, Kager L, Heimdahl A, et al. Microbial colonization of tumors in relation to the upper gastrointestinal tract in patients with gastric carcinoma. Ann Surg 1988; 207: 341- 346. [ Links ]
24. Mc Donald J, Gundersom L, Adson G. Tumores del sistema hepatobiliar. En: De Vita V, Helman S, Rosenberg S, eds. Cáncer: Principios y práctica de Oncología. Barcelona: Salvat Ed SA; 1984. p. 551 – 60. [ Links ]
25. Berrospi F, Ruiz E, Morante C, Celis J, Montalbelti JA. Morbilidad y mortalidad por gastroenteroanastomosis en cáncer gástrico avanzado. Rev Gastroent Perú 1995; 15: 43 – 18. [ Links ]
26. Rohde H, Rau E, Gebbensleben, et al. GAT causes in hospital mortality of surgical patients with cancer of the stomach? Scand J Gastroenterol 1987; 22 (Suppl 133): 76. [ Links ]
27. Fink AS, Longmire WP. Gastric Carcinoma. In: Sabiston DC. Texbook of Surgery. 15a ed. USA; 1997. p. 914 – 926. [ Links ]
28. Lawrence WJr. Gastric Cancer. Ca-A Cancer Journal for Clinicians 1986; 36: 216-236. [ Links ]
29. Yan C, Brooks JR. Surgical management of gastric adenocarcinoma. Am J Surg 1985; 149: 771-774. [ Links ]
30. Díaz-Plasencia J, Tantaleán E, Guzmán R, Urtecho F, Salinas E. Tratamiento quirúrgico del carcinoma gástrico. Acta Cancerológica 1997; 12: 47-56. [ Links ]