Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.24 n.1 Lima ene./mar. 2004
TRABAJOS ORIGINALES
Carcinoma avanzado del tercio proximal - medio del estómago: cuadro clínico-patológico y factores pronósticos de sobrevida
Othoniel Abelardo Burgos-Chávez1; Juan Alberto Díaz-Plasencia2; Edgar Fermín Yan-Quiroz1; Edwin Vilela-Guillén3; Adrián Manuel Rojas-Vergara4; Carlos Caffo-Mendo4; Juan Santillán Medina4
1 Médico Cirujano. Docente Jefe de Prácticas del Curso de Morfofisiología I de la Universidad Privada Antenor Orrego
2 Doctor en Medicina. Médico Jefe del Departamento de Cirugía del Hospital Belén de Trujillo. Coordinador del Curso de Cirugía I de la Facultad de Medicina de la Universidad Privada Antenor Orrego
3 Médico Cirujano. Docente del curso Informática Médica de la Universidad Privada Antenor Orrego.
4 Médico Cirujano
RESUMEN
OBJETIVOS: Identificar el cuadro clínico-patológico y factores pronósticos de sobrevida quinquenal de pacientes con carcinoma gástrico avanzado del tercio proximal-medio (U-M) sometidos a gastrectomía con linfadenectomía limitada y extendida
MATERIAL Y MÉTODOS: El presente estudio retrospectivo analizó información de una serie de 39 pacientes con diagnóstico histológico de adenocarcinoma gástrico avanzado del tercio superior y medio del estómago (U-M) y que fueron sometidos a gastrectomía con linfadenectomía limitada (D0-D1) y extendida (D2-D3) y en el Hospital Belén de Trujillo entre el 1° de enero de 1966 al 31 de diciembre del 2000.
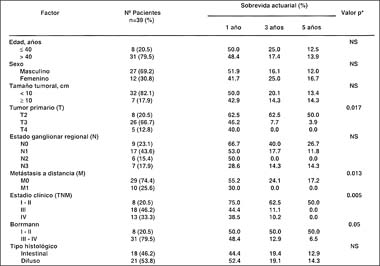
RESULTADOS. La edad promedio del grupo U-M fue de 55.56 + 16.24 años. Hubo 27 varones (69.2 %) y 12 mujeres (30.8 %) (proporción H:M= 2.3:1). Los síntomas más frecuentes fueron dolor abdominal (94.9%) y pérdida de peso (59.0%). El signo mas común fue la palidez (61.5%). Los factores pronósticos independientes estadísticamente relacionados con la sobrevida fueron: profundidad de la invasión T2 (p=0.017), presencia de metástasis a distancia (p=0.013), el estadío clínico I-II (p=0.005), lesiones Borrmann I- II(p=0.05)y la cirugía con intención curativa(p=0.003). La sobrevida actuarial en la serie total a los 5 años fue de 13.6%.
CONCLUSIONES. La detección temprana y la disponibilidad de una gastrectomía con preservación de la cola del páncreas tendrían que ser considerados en pacientes con carcinoma gástrico avanzado del tercio proximal y medio y así mejorar su sobrevida.
PALABRAS CLAVE. Carcinoma gástrico avanzado. Factores pronósticos.
SUMMARY
PURPOSE: To identify the clinical and pathological characteristics and prognosis factors for five-year survival in patients with advanced gastric carcinoma in the proximal third and half of the stomach undergoing gastrectomy with limited and extended lymphadectomy.
MATERIAL AND METHODS: This retrospective study analyzed information from 39 patients with histological diagnosis of advanced gastric adenocarcinoma in the upper third and half of the stomach (U-M) who underwent gastrectomy with limited (D0-D1) and extended (D2-D3) lymphadectomy at the Belén Hospital in Trujillo between January 1, 1966 and December 31, 2000.
RESULTS: The mean age of the U-M group was 55.56±16.24 years. There were 27 males (69.2%) and 12 females (30.8%) (M:F ratio was 2.3:1). The most frequent symptoms were abdominal pain (94.9%) and weight loss (61.5%). The most common evidence was pallor (61.5%). The independent prognosis factors statistically related to survival were: depth of T2 invasion (p=0.017), presence of remote metastasis (p=0.013), clinic stage I-II (p=0.005), Borrmann lesions I-II (p=0.05) and surgery with healing intention (p=0.003). The actuarial 5-year survival rate for all the series reached 13.6%.
CONCLUSIONS: Early detection and the feasibility of gastrectomy with preservation of the pancreas tail should be considered in patients with advanced gastric carcinoma in the proximal third and half of the stomach in order to improve their survival.
KEY WORDS: Advanced gastric carcinoma. Prognosis factors.
INTRODUCCIÓN
Las lesiones del tercio proximal (C) y medio (M) del estómago constituyen el 10-15% y el 30% de todos los adenocarcinomas de ese órgano respectivamente (1-4). Los cánceres mencionados a menudo han llegado a fase avanzada en la fecha del diagnóstico porque rara vez generan síntomas tempranos (5).
Los cánceres que abarcan el cardias y el tercio proximal del estómago pueden ser agrupados juntos porque tienen las mismas características histológicas y los métodos de tratamiento son similares (2). El tratamiento quirúrgico del adenocarcinoma del tercio superior tiene como metas: eliminar la masa tumoral, obtener bordes sin cáncer alrededor de la neoplasia y eliminar los ganglios linfáticos en peligro de presentar metástasis. Las lesiones de este tercio proximal pueden enviar metástasis a todos los ganglios regionales del estómago y por ello la única operación que podría alcanzar los tres objetivos mencionados sería la gastrectomía total y con linfadenectomía extendida (que incluye la esplenectomía y pancreatectomía distal); sin embargo, un argumento que a menudo se aduce es que el pronóstico de los sujetos con adenocarcinoma del cardías es tan insatisfactorio como el carcinoma pancreático o el cáncer anaplásico de pulmón. Se dice que el tratamiento quirúrgico es esencialmente paliativo y que sería mejor la gastrectomía subtotal proximal que es más sencilla y menos extensa (6-10). Así, el pronóstico para los tumores del cardías permanece pobre tal como lo señalan Allum et al. (11) con una la sobrevida quinquenal es a 9.8% para cáncer de estómago del tercio proximal resecable.
Las lesiones del tercio medio (M) a menudo son asintomáticas hasta que se vuelven muy voluminosas y los estudios histopatológicos demuestran que envían metástasis a todos los grupos de ganglios linfáticos. Por esta razón existe bases teóricas para pensar que en la mayoría de los casos con la gastrectomía radical total se logra mejor la eliminación completa de toda la neoplasia pero a pesar del mérito teórico de esta técnica no se han publicado datos convincentes que señalen mejoría en la supervivencia o disminución en las cifras de recidiva local (5).
Estudios exhaustivos (4,12,13,14) muestran indiscutiblemente que el pronóstico del cáncer gástrico está relacionado con la detección temprana. La importancia de evaluar en una serie de pacientes con carcinoma del tercio proximal y medio del estómago ciertos factores que influyen en la sobrevida a largo plazo, surge del interés de identificar dichos factores y para lo cual planteamos el siguiente problema de investigación:
¿Cuál es el cuadro clínico-patológico y que factores pronósticos predicen la sobrevida quinquenal de pacientes con carcinoma avanzado del tercio proximal -medio del estómago?
Los objetivos trazados fueron:
1. Identificar el cuadro clínico-patológico de pacientes con carcinoma gástrico avanzado resecable del tercio proximal-medio sometidos a gastrectomía con linfadenectomía limitada y extendida.
2. Determinar los principales factores pronósticos de sobrevida quinquenal en pacientes con carcinoma gástrico avanzado resecable del tercio proximal-medio.
3. Identificar los factores pronósticos independientes (edad, sexo, tamaño del tumor, forma macroscópica, compromiso de la pared, tipo histológico y estadio clínico) y dependientes del tratamiento quirúrgico (intención de la operación y tipo de linfadenectomía) en la sobrevida quinquenal de pacientes con carcinoma gástrico avanzado.
MATERIAL Y MÉTODOS
El presente estudio descriptivo, retrospectivo, longitudinal y observacional, analizó información de 39 pacientes que presentaron lesiones en el tercio superior y medio del estómago (U-M) y que fueron sometidos a gastrectomía con linfadenectomía limitada (D0-D1= 33) y extendida (D2-D3 = 6) en el Hospital Belén de Trujillo entre el 1° de enero de 1966 al 31 de diciembre del 2000. Durante ese período hubo 203 pacientes con carcinoma gástrico avanzado que tuvieron confirmación histológica de su enfermedad, de los cuales 164 (80.8%) presentaron lesiones en el tercio distal del estómago (L) y 39 (19.2%) presentaron lesiones motivo del estudio. Fueron excluidos del presente estudio aquellos que tuvieron diagnóstico diferente a adenocarcinoma (n= 13) y carcinoma gástrico precoz (n= 10).
Para la obtención de la información, los datos de cada paciente fueron incluidos en una ficha clínica que luego fue almacenada en una base de datos en el programa SPSS. Con los hallazgos clínicos al momento de la admisión, exámenes auxiliares (ecográficos, endoscopias, biopsias, otros), extensión de la enfermedad, fecha de la operación, tipo de cirugía, hallazgos histopatológicos, localización, tamaño de la neoplasia, y mortalidad postoperatoria.
DEFINICIONES OPERACIONALES
Las neoplasias se clasificaron por estadíos usando los criterios propuestos por la Unión Internacional Contra el Cáncer(15), macroscópicamente según la clasificación de Borrmann (16) y de las Reglas Generales para el Estudio de Cáncer Gástrico en Cirugía y Patología de la Sociedad de Investigación Japonesa para el Cáncer Gástrico (17) y por tipos histológicos de acuerdo a la clasificación de Laurén y Jarvi (18).
Los pacientes se consideraron RESECABLES cuando presentaron lesiones S0, S1, S2 o S3 (cuando se extirpó en bloc el órgano removido); P0 o P1; H0 , H1 (cuando fue posible resecar la metástasis única); N0 ó N(+).
Los pacientes fueron divididos de acuerdo a la extensión de la linfadenectomía en los siguientes grupos: D0, cuando no se efectuó o hubo remoción incompleta del grupo ganglionar N1; D1, si la disección incluyó sólo los ganglios N1; D2, si incluyó los grupos ganglionares N1 y N2; D3 si además incluyó los ganglios linfáticos N3. La gastrectomía radical convencional o estándar (D0/D1), incluyó a las denominadas gastrectomías subtotales radicales para los tumores distales (lesiones pilóricas o antrales), resecciones subtotales altas para las lesiones gástricas medias o pequeñas y gastrectomías totales para tumores gástricos proximales o en lesiones más grandes ubicados en el tercio medio. Estas operaciones incluyeron resección del omento mayor y menor y remoción de los ganglios acompañantes de la arteria gástrica izquierda hasta su origen en el tronco celíaco. La gastrectomía total también incluyó esplenectomía y pancreatectomía distal.
La gastrectomía radical con linfadenectomía extendida (D2/ D3), incluyó remoción hasta un grupo ganglionar por encima del macroscópicamente afectado tal como se consideró durante el acto operatorio. Así, si hubo compromiso ganglionar aparente del grupo N1 Se realizó una disección D2, y si se advirtió afectación del grupo N2 se efectuó una disección D3.
Se consideró RESECCIÓN CURATIVA, cuando no se encontró metástasis hepática, ni compromiso peritoneal, los límites de sección oral y caudal fueron efectuados a más de 10 mm de la infiltración macroscópica del tumor, el compromiso de la serosa fue S0 - S1 - S2 y la resección gástrica se acompañó de una disección y extirpación del grupo ganglionar siguiente o más allá al compromiso macroscópico. Además cuando cumplidas las condiciones antedichas, la resección ganglionar fue de todas las barreras con infiltración tumoral (N1 , N2 y N3) o cuando el tumor fue S3 pero se pudo resecar en bloc.
La resección fue PALIATIVA, si hubo compromiso de órganos por vecindad y no se pudo resecar en bloc el órgano invadido o la totalidad de los grupos ganglionares comprometidos o los márgenes fueron positivos.
ANÁLISIS ESTADÍSTICO
Los datos numéricos fueron presentados en medias + DE. Las tasas de sobrevida actuarial a 5 años fueron calculadas usando el método de Kaplan-Meier. Los decesos en el post-operatorio fueron considerados como muertos con enfermedad neoplásica. No hubo perdidos de vista durante el seguimiento y los decesos por causas intercurrentes fueron considerados como censurados a partir del último control registrado en la historia clínica o al momento del fallecimiento. Los fallecidos en el postoperatorio inmediato se consideraron como muertos con enfermedad neoplásica. La evaluación de los efectos de las variables discretas en la sobrevida fueron realizados usando el test de log-rank. Se consideró un valor p < 0.05 como estadísticamente significativo. En el análisis de los datos se utilizó el paquete estadístico SPSS versión 10.0 y EpiInfo versión 2000.
RESULTADOS
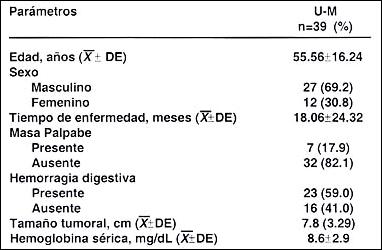
Población de pacientes. La población del presente estudio comprendió 39 pacientes con diagnóstico confirmado de adenocarcinoma gástrico, que presentaron lesiones en el tercio superior y medio del estómago (U-M). La edad promedio fue de 55.6 + 16.2 años con límites entre 20 a 78 años. Hubo 27 varones (69.2 %) y 12 mujeres (30.8 %) (proporción H:M= 2.3:1).
Cuadro Clínico. El tiempo medio de enfermedad en los pacientes con lesiones U- M fue de 18.1 + 24.3 meses (límites, 1 a 84 meses). El dolor abdominal (94.9%) y la pérdida de peso (59.0%) fueron los síntomas más frecuentes. Otras síntomas fueron: melena (43.6%), sensación de llenura precoz (33.3%), hiporexia (30.8%), vómitos (28.2%) y hematemesis (28.2%); poco frecuentes fueron náuseas (25.6%), dispepsia (10.3%), distensión abdominal (10.3%), estreñimiento (7.7%) y disfagia (7.7%). El signo más común fue la palidez (61.5%), seguido de masa palpable (17.9%) y la presencia de ascitis (7.7%). (Cuadro 1).
Cuadro 1. Síntomas y signos principales.
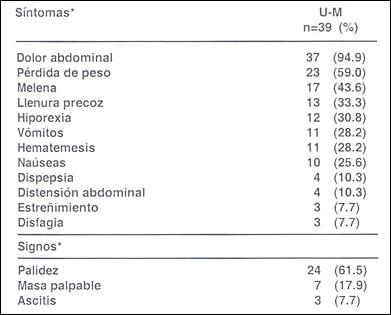
(*) Más de una opción es posible
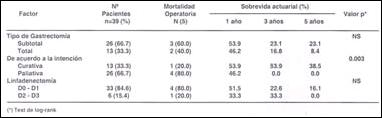
Parámetros clínicos, patológicos y quirúrgicos: Se encontró predominancia del sexo masculino (69.2%), la presencia de masa palpable sólo fue evidente en 17.9% de sujetos, hubo hemorragia digestiva en 59% y un tamaño tumoral medio de 7.8 + 3.29cm. La media de hemoglobina sérica en nuestros pacientes fue 8.6 + 2.9mg/dL. Los parámetros patológicos mostraron un mayor frecuencia de lesiones tipo Borrmann III (59%), tumores T 3 (66.7%), estado ganglionar N 1 (43.6%) y un gran porcentaje (74.4%) presentaron metástasis a distancia (M 1 ). Los pacientes mostraron estadíos avanzados de la enfermedad: 46.2% en estadío III y 33.3% en estadío IV, mayor porcentaje de metástasis hepática (89.7%). El tipo histológico predominante fue el difuso con 53.8% en contraposición 46.2% fueron del tipo intestinal. Dentro de los factores quirúrgicos, la gastrectomía subtotal predominó (66.7%) con respecto a la gastrectomía total (33.3%). La intención de la cirugía fue predominantemente paliativa (66.7%) y el tipo de linfadenectomía mayormente realizada fue la D0-D1 en el 84.6% de los pacientes. (Cuadros 2, 3 y 4)
Factores pronósticos de sobrevida. Se evidenció una relación inversa entre el tumor primario y la sobrevida quinquenal (p=0.017). Adicionalmente, los casos que presentaron metástasis a distancia (M1) tuvieron peor pronóstico que aquellos casos M0 (sobrevida actuarial a 5 años de 0% vs 17.2%; p=0.013). El estadío clínico III-IV comportó un ominoso pronóstico en comparación con los estadíos clínicos I - II (0% vs 50%; p<0.005). Los pacientes con formas macroscópicas tipo Borrmann I-II, III-IV tuvieron tasas de sobrevida actuarial a 5 años de 50% y 6.5%, respectivamente (p=0.05). En la evaluación de la sobrevida quinquenal según categorías quirúrgicas, los pacientes que fueron sometidos a cirugía con intención quirúrgica paliativa tuvieron peor pronóstico que aquellos con intención curativa (0.0% vs 38.5% respectivamente, p=0.003). Otros factores evaluados como, edad, sexo, tamaño tumoral, el compromiso ganglionar regional, tipo histológico, tipo de gastrectomía y de linfadenectomía no estuvieron relacionados con la sobrevida actuarial quinquenal (Cuadros 5 y 6).
Cuadro 2. Parámetros clínicos basales
en pacientes con carcinoma gástrico
localizados en el tercio medio-proximal
Cuadro 3. Parámetros patológicos
en pacientes con carcinoma Gástrico
localizados en el tercio proximal -medio.

Cuadro 4. Parámetros quirúrgicos
de pacientes con carcinoma gástrico
localizados en el tercio medio proximal

Cuadro 5. Factores pronósticos clínico
patológicos de sobrevida de pacientes
con carcinoma gástrico avanzado
del tercio superior-medio
(*) Test de long- rank.
Cuadro 6. Sobrevida según categorías quirúrgicas.
(*) Test de long- rank.
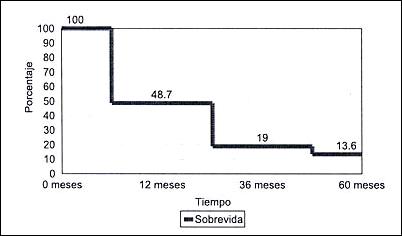
Sobrevida actuarial a 5 años. La sobrevida actuarial en la serie total a los 12, 36 y 60 meses fue de 48.7%, 19.0% y 13.6% respectivamente. (Fig 1).
Figura1. Curva de sobrevida actuarial de pacientes con carcinoma
gástrico avanzado del tercio proximal-medio.
DISCUSIÓN
En el presente trabajo, el promedio de edad de los pacientes con adenocarcinoma gástrico del tercio superior y medio fue de 55.56 + 16.24 años siendo la séptima década de la vida fue la más afectada (43.6%) lo cual coincide con lo informado por Matley et al (19) y Maehara et al (20). Además, hubo un discreto predominio del sexo masculino (69.2%) sobre el femenino (H:M, 2.3:1) tal como lo señalan otros autores (12) (21).
Las lesiones neoplásicas malignas del tercio proximal y medio del estómago muy a menudo son diagnosticadas en estadios avanzados, ya que raras veces presentan síntomas tempranos al no causar síntomas obstructivos contrariamente a lo observado en el carcinoma del tercio distal donde aparecen molestias incluso si la masa es relativamente pequeña (5). Dentro del cuadro clínico de los pacientes con adenocarcinoma del tercio proximal y medio el dolor al momento del diagnóstico fue el síntoma mas frecuente observado en el 94.9% de los casos, además de la pérdida de peso (59.0%) lo cual coincide con otros informes de la literatura (12) (13). Dicho síntoma se deberá al estadio tumoral avanzado ya que al haber una mayor profundidad de invasión hay por consiguiente mayor lesión de fibras nerviosas viscerales. Acorde con lo señalado por Smith y Brennan (5) la disminución de la capacidad de reservorio gástrica debido al mayor tamaño tumoral que presentan este tipo de pacientes guarda relación con la presencia de llenura precoz (33.3%), hiporexia (30.8%) y vómitos (28.2%) con la consiguiente pérdida de peso (59%). La disfagia, presente en el 7.7% de los casos por compromiso del cardías, es considerado por algunos estudios (5) (22) (23) como el síntoma temprano más frecuente en la mayoría de sujetos con carcinoma gástrico proximal. Las neoplasias del cuerpo gástrico, aunque generalmente son asintomáticas, se evidencia clínicamente cuando la lesión se ulcera, ocasionando dolor y/o hemorragia de magnitud variable lo cual se observó un 28.8% de los casos. La palidez, fue el signo más frecuente debido a la anemia (8.6 + 2.9mg/dL) lo que se correspondería a múltiples factores como son la pérdida crónica de sangre por las lesiones gástricas ulceradas, la malabsorción de hierro o folato por destrucción de la mucosa gástrica, una mayor frecuencia de hemorragia digestiva (59%), y una deficiente aporte de nutrientes (24). El tiempo de enfermedad promedio observado en nuestros pacientes fue de 18 meses atribuido probablemente al bajo índice de sospecha por parte del clínico para catalogar a una enfermedad como maligna en pacientes jóvenes con pobre sintomatología digestiva lo que ocasionaría que dichos síntomas progresen durante un largo periodo hasta que la enfermedad neoplásica sea considerada dentro del plan de evaluación y cuando se toma en cuenta esta posibilidad diagnóstica ésta se encuentra en estadios avanzados, lo cual es enfatizado como un gran obstáculo para el tratamiento exitoso (25-27). Este último acontecimiento también podría explicar el diámetro tumoral hallado en estos pacientes (7.8 + 3.3cm) hallado en un estadío clínico avanzado lo que provocaría un mayor compromiso de la pared gástrica y por consiguiente la erosión de mayor cantidad de vasos sanguíneos.
Wang et al (28) refieren que la incidencia del carcinoma gástrico se incrementa con la edad, comenzando a aumentar a la edad de 40 años y alcanza un pico máximo a los 50-70 años. Al agrupar y comparar la serie en pacientes con edad menor igual de 40 años y mayores de esta edad no se encontró asociación estadísticamente significativa con la sobrevida actuarial contrariamente a lo encontrado por muchos otros autores (19) (20) (29) quienes encuentran un peor pronóstico en pacientes jóvenes ya que al parecer existe correlación entre el grado de actividad biológica del tumor y la edad, es decir mientras más joven es el paciente mayor es la actividad biológica del tumor, la cual parecer además tener una relación con el tipo histológico difuso que predomina en estos pacientes. Grabiec y Owen (30) informan una sobrevida promedio de 20.3 meses en pacientes gastrectomizados con 40 años de edad o más jóvenes. Tanto la hemorragia digestiva como la hemoglobina sérica no constituyeron parámetros estadísticamente significativos en la sobrevida quinquenal, sin embargo la pérdida crónica de sangre explicaría los bajos niveles de hemoglobina sérica encontrados en este grupo de pacientes (31).
En el presente estudio univariado, el tamaño tumoral no fue un factor que influyó en la sobrevida, aunque algunos trabajos (32)(33) sugieren que los pacientes con tumores más pequeños tiene un pronóstico superior. Un análisis multivariado (34) indica que éste es un factor pronóstico independiente y plantea la probabilidad que el tamaño tenga alguna relación en la sobrevida como un factor independiente.
En la mayoría de tumores malignos, el tumor primario (T) está relacionado con el pronóstico, y también ocurre así en el carcinoma gástrico, existiendo correlación negativa entre éste y la sobrevida quinquenal. En nuestra serie, cuando se tomó este parámetro de manera aislada, se observó una progresiva disminución de la sobrevida al incrementarse el compromiso vertical de la pared gástrica, siendo estadísticamente significativo (T2: 50.0%, T3: 3.9% y T4: 0.0%; p= 0.017). Shiu et al (34) señalan que a mayor profundidad de invasión de la pared gástrica peor pronóstico y mayor posibilidad de metástasis a distancia , especialmente cuando hay una mayor área de la serosa comprometida. Varios autores (35-37) afirman que hay una relación inversa entre el grado de compromiso metastásico linfático por carcinoma de estómago y la sobrevida a 5 años. Con respecto al estado ganglionar regional hubo relación inversa con la supervivencia quinquenal evidenciándose notoriamente una mejor sobrevida en pacientes con N0: 26.7% y N1: 11.8% en comparación con aquellos pacientes con más de 6 ganglios metastásicos (N2 : sobrevida de 0.0%). Fujii et al (38) confirman que la clasificación del estado ganglionar basada en el sistema TNM para esta entidad representa el mejor indicador en el pronóstico de pacientes con carcinoma gástrico el cual se basa en el número de ganglios linfáticos metastásicos en especial en aquellos pacientes sometidos a gastrectomía radical con linfadenectomía extendida. Cuando el pronóstico del paciente fue correlacionado con el estadio clínico se encontró una mayor sobrevida en el estadio I-II (50.0%) en relación con los otros estadios III (0.0%) y IV (0.0%) (p<0.005), diferencias que son compatibles con las informadas por otros autores (39-41).
Al interrelacionar la sobrevida con la forma macroscópica, se observó una mejor sobrevida en pacientes con neoplasias tipo Borrmann I-II (50%) en comparación lesiones Borrmann tipo III - IV (6.5%) (p = 0.05). Es generalmente aceptado que el pronóstico para los pacientes con Borrmann tipo I y II es bueno, mientras que pacientes con linitis plástica (Borrmann IV) casi todos mueren de la enfermedad usualmente con una sobrevida corta y que la gastrectomía debe estar indicada cuando existe dolor intratable, obstrucción, perforación o sangrado (42).
El tipo histológico que predominó en las lesiones del tercio proximal y medio del estómago fue del tipo difuso, el cual se observó en el 53.8% de los pacientes y el intestinal en un 46.2%. En poblaciones de alto riesgo para carcinoma gástrico como nuestro medio, esta neoplasia se localiza generalmente en la región antropilórica, se da en adultos mayores de sexo masculino estando probablemente relacionado con la dieta y la acción del Helicobacter pylori (43).
La cirugía constituye la única modalidad con potencial curativo para pacientes con carcinoma gástrico avanzado (12). Sjstedt et al (43) no encuentran diferencias en la sobrevida a largo plazo ya sea en la gastrectomía total o subtotal aunque en el presente estudio los pacientes sometidos a gastrectomía subtotal alcanzaron una mayor tasa de sobrevida actuarial en comparación con los resecados por gastrectomía total (23.1% vs 8.4%; p=NS). Al 84.6% (n=33) de los pacientes con adenocarcinoma gástrico del tercio proximal y medio se les realizó linfadenectomía convencional D0-D1 y sólo a 6 (15.4)% linfadenectomía extendida D2-D3, no encontrándose diferencia estadísticamente significativa en la sobrevida actuarial pero debido al pequeño número de pacientes con linfadenectomía D2- D3, no es posible dar resultados concluyentes. Series occidentales (43-45) señalan que cuando la resección gástrica se acompaña de disección ganglionar D1 alcanza buenos resultados en comparación con la linfadenectomía D2 por el hecho de considerar a esta última técnica innecesaria y no recomendable por la alta morbimortalidad que acarrea. En contraparte, series orientales, y en especial japonesas, hacen hincapié sobre la gran eficacia de la disección ganglionar D2 e informan tasas de sobrevida quinquenal que alcanzan el doble con relación a la linfadenectomía limitada. Este hecho puede explicarse ya que la prevalencia e incidencia de esta neoplasia en Occidente no es elevada como lo es en otras latitudes incluyendo nuestro país, en que debido a la gran prevalencia se hecho una necesidad indispensable el conocimiento de esta patología y el refinamiento de las técnicas quirúrgicas para su tratamiento. La curva de aprendizaje obtenida en los trabajos occidentales arriba descritos no era adecuada ya que la frecuencia de operaciones tipo D2 era escasa a pesar de haber sido supervisados en el estudio Holandés por expertos japoneses (44). As, Siewert et al (46) refieren que la tasa de supervivencia a 5 años es significativamente más alta luego de disección ganglionar D2 en pacientes en quienes se realizó previamente resección D1 y es dependiente del estadio clínico (Estadio II: 55% vs 27%; Estadio III. 38% vs 25%; p= 0.01 y p=0.03 respectivamente). Aún así faltan estudios aleatorizados para verificar tales resultados.
Además el 66.7% de nuestros pacientes fueron sometidos a cirugía con intención paliativa debido al diagnóstico tardo y al avanzado estado de la enfermedad con una tasa de sobrevida a cinco años después de la intervención quirúrgica de 0.0%. en contraste con la tasa obtenida de 38.5% en aquellos que tuvieron resección curativa (p=0.003) diferencia que puede explicarse debido a que el primer procedimiento se efectuó mayormente en pacientes con estadios avanzados de la enfermedad. Se concluye que aquellos pacientes en quienes se planea efectuar resección gástrica curativa tienen en realidad mayor perspectiva de sobrevivir más de 5 años confirmando que el tratamiento quirúrgico realmente cambia la evolución natural de esta enfermedad (47).
Como es el caso de otras formas de neoplasias malignas, los mejores progresos vendrán solo con el diagnóstico temprano. Se hace necesario que el clínico tenga un alto índice de sospecha que permita una detección precoz de esta neoplasia sobre todo en pacientes de alto riesgo. En lo referente al tratamiento, cuando se realiza gastrectomía total por neoplasias del tercio medio y proximal, es recomendable realizar esplenectomía con preservación de la cola del páncreas ya que los resultados son similares a aquellos en que realiza pancreatectomía distal en términos de sobrevida con disminución de la frecuencia de diabetes postoperatoria y de la morbimortalidad quirúrgica.
REFERENCIAS
1. HARRISON JD, FIELDING JWL. Prognostic factors for gastric cancer influencing clinical practice. World J Surg 1995; 19: 496-500. [ Links ]
2. DE CALAN L, PORTIER G, PHILLIPPE OZOUX J, RIVALLAIN B, PERRIER M, BRIZON J. Carcinoma of the cardia and proximal third of the stomach. Am J Surg 1988; 455:481-5. [ Links ]
3. Cady B, Rossi R, Silverman ML, et al. Gastric adenocarcinoma: A disease in transition. Arch Surg 1989; 124: 303-8. [ Links ]
4. SONS HU, BORCHARD F. Cancer of the distal esophagus and cardia. Incidence, tumorous infiltration and metastatic spread. Ann Surg 1986; 203: 188- 95. [ Links ]
5. SMITH JW, BRENNAN MF. Tratamiento quirúrgico del cáncer gástrico. Porciones proximal, media y distal del estómago. En: Clínicas quirúrgicas de Norteamérica; 1992.p. 359-376. [ Links ]
6. OKAMURA T, TSUJITANI S, MARIN P, et al. Adenocarcinoma in the upper third part of the stomach. Surg Gynecol Obstet 1987; 65: 247-50. [ Links ]
7. CADY B, RAMSDEN DA, CHOE DS. Treatment of gastric cancer. Surg Clin North Am 1976; 56: 599. [ Links ]
8. CADY B, RAMSDEN DA, STEIN A. Gastric cancer: Contemporary aspects. Am J Surg 1977; 133: 413-9. [ Links ]
9. MICHELASSI F, TAKANISHI DM JR, PANLATONE D, HART J, CHAPELL R, BLOCK GE. Analysis of clinicopathologic prognostic features in patients with gastric adenocarcinoma. Surgery 1994; 116: 804-10. [ Links ]
10. SALVON-HARMAN JC, CADY B, NIKULASSON S, KHETTRY U, STONE MD, LAVIN P. Shifting proportions of gastric adenocarcinoma. Arch Surg 1994; 129: 381-9. [ Links ]
11. ALLUM W, ROGINSKI C, FIELDING J, et al. Adenocarcinoma of the cardia: a 10 year regional review. World J Surg 1986; 10:462. [ Links ]
12. BARBOZA BESADA E. Cáncer de estómago. Rev Med Hered 1996; 7: 87- 100. [ Links ]
13. KURTZ RC, SHERLOCK P. The diagnosis of gastric cancer. Semin Oncol 1985; 12: 11-8. [ Links ]
14. DOUGLAS HO JR,. Potentially curable cancer of the stomach. Cancer 1982; 50: 2582-9. [ Links ]
15. International Union Against Cancer. TNM – Classification of malignant tumors. En: Sobin LH, Wittekind Ch, Eds. Stomach. 5th. ed. New York : Willy– – Liss; 1997. p. 59 - 62. [ Links ]
16. BORRMANN R. Gesch wulste des magens und duodenums. In : Honke F, Lubarsh O. Hanbuch der speziellen pathologischen anatomic und histologic. Berlin : J Springer; 1926. p. 812 - 1054. [ Links ]
17. Japanese Research Society for Gastric Cancer. Japanese Classification of Gastric Carcinoma. 1st. ed. Tokyo : Kanehara and Co; 1995. [ Links ]
18. LAUREN P. The two histology main types of gastric carcinoma : Diffuse and so - called intestinal type carcinoma : An attempt at histo - clinical classification. Acta Pathol Microbial Scand 1965; 64 : 31 - 49. [ Links ]
19. MATLEY PJ, DENT DM, MADDEN MV, PRICE SK. Gastric carcinoma in young adults. Ann Surg 1998; 208; 593-596. [ Links ]
20. MAEHARA Y, OSHIRO T, IOWA H, et al. Gastric carcinoma in patient over 70 year of age. Br J Surg 1995; 82; 102-105. [ Links ]
21. THOMPSON GB, VAN HEERDEN JA, SARR MG. Adenocarcinoma of the stomach: are we making progress?. The Lancet 1993; 142: 713-717. [ Links ]
22. BATTISTA G, PACELLI F, CAPRINO P, et al. Palliative surgery for far advanced gastric cancer: A retrospective study on 305 consecutive patients. The American Surgeon 1999; 65: 352-355. [ Links ]
23. PACELLI F, PAPA V, CAPRINO P, et al. Proximal compared with distal gastric cancer: Multivariate analysis of prognostic factors. The American Surgeon 2001; 67: 697-703. [ Links ]
24. TORRES F, ARRUBARENA VM. Carcinoma gástrico. En: Arrubarena VM (ed). Fisiopatología quirúrgica del aparato digestivo. 2da ed. México: Editorial Manuel Moderno; 1996.p. 179-194. [ Links ]
25. SHIMOYAMA S, KAMINISHI M, JOUJIMA Y, et al. Lymph node involvement correlation with survival in advanced gastric carcinoma: univariate and multivariate análisis. Journal of Surgical Oncology 1994; 57: 164- 170. [ Links ]
26. MAEHARA Y, OSHIRO T, ADACHI Y, et al. Prognosis for surgically treated gastric cancer patients is poorer for women than men in all patients under age 50?. Br J Cancer 1992; 65: 417-420. [ Links ]
27. KUBOTA H, KOTOH T, KUMAR DHAR D, et al. Gastric resection in the aged (> 80 years) with gastric carcinoma: a multivariate analysis of prognostic factors. Aust NZJ Surg 2000; 70: 254-257. [ Links ]
28. WANG JY, HSIEH JS, HUANG CJ, HUANG YS, HUANG TJ. Clinicopathologic study of advanced gastric cancer without serosal invasión in young and old patients. Journal of Surgical Oncology 1996; 63: 36-40. [ Links ]
29. EGUCHI T, TAKASHASHI Y, YAMAGATA M, KASAHARA M, FUJII M. Gastric cancer in young patients. J Am Coll Surg 1999; 188: 22-26. [ Links ]
30. GRABIEC J, OWEN DA. Carcinoma of the stomach in young persons. Cancer 1985; 56: 388-396. [ Links ]
31. DÍAZ-PLASENCIA J, YAN-QUIROZ E, BURGOS-CHAVEZ O, BALMACEDA- FRASELLE T, PATRÓN-RÍOS G, SANTILLÁN MEDINA J. Cuadro clínico patológico y sobrevida en carcinoma gástrico operable. Rev Gastroenterol Perú 2002; 22: 19-27. [ Links ]
32. SÁNCHEZ-BUENO F, GARCÍA-MARCILLA JA, PÉREZ-FLORES D, PÉREZ- ABAD JM, VICENTE R, ARANDA F, RAMÍREZ P, PARRILLA P. Prognostic factors in a series of 297 patients with gastric adenocarcinoma undergoing surgical resection. Br J Surg 1998; 85 : 255 - 60. [ Links ]
33. CALPENA R, MEDRANO J, DEL FRESNO J, CANOLELA F, VATQUEZ J, DIEGO M, et al. Factores que influyen en la supervivencia de los pacientes diagnosticados de cáncer gástrico. Cirugía Española 1998; 43 : 560 -6. [ Links ]
34. SHIU MH, PERROTTI M, BRENNAN MF. Adenocarcinoma of the stomach: a multivariate analysis of clinical, pathologic and treatment factors. Hepatogastroenterology 1989; 36: 7 -12. [ Links ]
35. MARUYAMA K, GUNVÉN P, OKABAYASHI K, SASAKO M, KINOSHITA T. Lymph node metastases of gastric cancer. General pattern in 1931 patients. Ann surg 1988; 85: 831 – 834. [ Links ]
36. NODA N, SASAKO, YAMAGUCHI N, NAKANISHI Y. Ignoring small lymph nodes can be a major cause of staging error in gastric cancer. British Journal of Surgery 1998; 85: 831-834. [ Links ]
37. MAKINO M, MORIWAKI S, YONEKAWA M, OOTA M, KIMURA O, KAIBARA N. Prognostic significance of the number of metastatic lymph nodes in patients with gastric cancer. Journal of Surgical Oncology 1991; 47: 12-16. [ Links ]
38. FUJII K, ISOZAKI H, OKAJIMA K, et al. Clinical evaluation of lymph node metastasis in gastric cancer defined by the fifth edition of the TNM classification in comparison with the Japanese system. B J Surg 1999; 86: 685- 689. [ Links ]
39. PACELLI F, DOGLIETO G, BELLANTONE R, et al. Linfadenectomía ampliada o limitada en el cáncer gástrico : Estudio comparativo de 320 pacientes. Br J Surg 1993; 80: 1153- 56. [ Links ]
40. MARUYAMA K, OKABAYASHI K, KINOSHITA T. Progress in gastric cancer surgery in Japan and its limits of radicality. World J Surg 1987; 11 : 418 - 25. [ Links ]
41. NOGUCHI M, MIYAZAKI I. Prognostic significance and surgical management of lymph node metastasis in gastric cancer (Review). Br J Surg 996; 83: 156-61.
42. KIM DY, KIM HR, KIM YJ, KIM SK. Clinicopathological features of patients with Borrmann type IV gastric carcinoma. ANZ J Surg 2002; 72: 739-742. [ Links ]
43. SJÖSTEDT S, PIEPER R. Gastric cancer. Factors influencing long term survival and postoperative mortality. Acta Chir Scand 1986;530(Suppl:25-29). [ Links ]
44. BONENKAMP JJ, HERMANS J, SASAKO M, VAN DE VELDE CJH. Extended lymph node dissection for gastric cancer. N Engl J Med 1999; 340: 908 -14. [ Links ]
45. CUSCHIERI A, FAYERS P, FIELDING J, et al. Postoperative morbidity and mortality after D1 and D2 resections for gastric cancer: Preliminary results of the MRC randomized controlled surgical trial. The Surgical Cooperative Group. Lancet 1996; 347: 995-99. [ Links ]
46. SIEWERT JR, BOTTCHER K, STEIN HJ, et al. Relevant prognostic factors in gastric cancer 1998; Annals of surgery 1998; 228: 449-461. [ Links ]
47. MARTIN RCG, JAQUES DP, BRENNAN MF, KARPEH M. Extended local resection for advanced gastric cancer. Ann Surg 2002; 236: 159-165. [ Links ]