Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.24 n.1 Lima ene./mar. 2004
CONTRIBUCIÓN ESPECIAL
Pólipos epiteliales gástricos (Segunda Parte)
Luis Hernán Espejo Romero 1; Jesús Navarrete Siancas 2
1 Catedrático Principal de Clínica Médica de la UNMSM. Profesor de Propedéutica y Clínica de la Universidad San Martín de Porres.
2 Catedrático Principal de Anatomía Patológica de la UNMSM. Profesor contratado de la Universidad San Martín de Porres
RESUMEN
Se hace un recuento histórico en relación a los pólipos gástricos. La frecuencia mediante exámenes endoscópicos fue del 3.6%.
Para la clasificación de los pólipos epiteliales, se empleó los términos de pólipos hiperplásticos y adenomas, considerándose dentro de los primeros, a las hiperplasias suprafoveales, siempre y cuando estas hubiesen tenido el carácter de lesión elevada. De 2283 pólipos, 1959 fueron hiperplásticos (86%) y 324 adenomas (14%). Al analizar 780 pólipos, se encontró 86 (11%) de pólipos con la categoría Nakamura III. En cuanto a la topografía, en un análisis de 2253 pólipos, los hiperplásticos se situaron en la siguiente forma: 325 (17%) en el antro, 1402 (73%) en el cuerpo y 202 (10%) en el fondo. Los adenomas tuvieron una distribución diferente: 212 (65%) en el antro, 100 (31%) en el cuerpo y 12 (4%) en el fondo. De 371 pólipos hiperplásticos estudiados, 49% eran pedunculados y 51% sesiles; por el contrario, 86% de adenomas fueron sesiles. La edad promedio fue de 66.2 años en los portadores de adenomas y 58.5 en los que presentaron pólipos hiperplásticos 57.4 para las hiperplasias suprafoveales. En 287 adenomas el 94.1% de sus portadores la edad estuvo por encima de los 40 años.
En 92 adenomas estudiados, en el 21.7% se encontró metaplasia en el adenoma y 72.8% en zonas adyacentes. Sólo 5.5% no presentaron metaplasia. En 105 pólipos hiperplásticos se encontró metaplasia intestinal en el 16.7% en el pólipo y 60% en zonas adyacentes; en el 23.3% no se encontró metaplasia. El tamaño promedio de los adenomas fue de 14mm, y la de los pólipos hiperplásticos 11mm. 195 adenomas tuvieron un tamaño menor de 10mm. El porcentaje de malignización en 288 adenomas analizados guardó una estrecha relación con su tamaño: 214 (66%) de tamaño menor a los 20mm, presentaron un porcentaje de malignización del 7%. 74 (34%) de un tamaño mayor a los 20mm. presentaron una malignización de 51%. El 86.2% de malignización se encontró en adenomas de más de 40mm. El porcentaje global de malignización de los adenomas fue del orden de 18%, pero si consideró los adenomas con displasia de alto grado de la categoría 4.1 de la clasificación de Viena (neoplasia no invasiva de alto grado) este porcentaje se elevó al 26%.
La malignización de los pólipos hiperplásticos fue del orden del 0.8%. Cuando se determinó la acidez gástrica por el método de la máxima estimulación, en 77 casos de portadores de pólipos hiperplásticos, 55 (60%) presentaron aclorhidria verdadera, 10(18%) hipoclorhidria, 11 (20%) normoclorhidria y sólo 1 (2%) hiperclorhidria. En 26 portadores de adenomas, 18 (69%) presentaron aclorhidria 4 (15%) hipoclorhidria, 3 (12%) normoclorhidria y sólo 1 (4%) hiperclorhidria. El débito de acidez basal ( DAB) para los hiperplásticos fue 1.97 mEql y para los adenomas 1.60mEql. El débito de acidez máxima (DAM) 6.05mEql para los hiperplásticos y 5.49mEql para los adenomas. En nuestra experiencia en los normales fue de 2.5mEqh ±1.2 y de 22mEqh ±6 respectivamente para el DAB y el DAM.
PALABRAS CLAVES: Pólipos Epiteliales Gástricos. Clasificación
SUMMARY
The following is a statistical report regarding gastric polyps:
Frequency determined through endoscopic examinations was 3.6%. The terms hyperplastic polyps and adenomas were used for the classification of epithelial polyps, considering the suprafoveal hyperplasias within the hyperplastic polyps, provided they were elevated lesions.
Out of 2,283 polyps, 1,959 were hyperplastic (86%) and 324 were adenomas (14%). When analyzing 780 polyps, 86 (11%) were found to have the Nakamura III category. With regard to topography, in an examination of 2253 polyps, hyperplastic polyps were located as follows: 325 (17%) in the antrum, 1402 (73%) in the body and 202 (10%) in the fundus. Adenomas had a different distribution: 212 (65%) in the antrum, 100 (31%) in the body and 12 (4%) in the fundus.
Out of 371 hyperplastic polyps examined, 49% were pediculate and 51% were sessile; on the contrary, 86 % of adenomas were sessile.
The average age was 66.2 years in adenoma carriers, 58.5 in those having hyperplastic polyps, and 57.4 for suprafoveal hyperplasias.
In 287 adenomas, 94.1% of carriers were over 40 years old.
Out of 92 adenomas examined, 21.7% evidenced adenoma metaplasia and 72.8% evidenced metaplasia in adjacent areas. Only 5.5% had no metaplasia. In 105 hyperplastic polyps studied, intestinal metaplasia was found: 16.7% in the polyp and 60% in adjacent areas. No metaplasia was found in the remaining 23.3%.
Average size of the adenomas was 14 mm and of hyperplastic polyps, 11 mm. A total of 195 adenomas were smaller than 10 mm.
The percentage of malignization in 288 adenomas examined was closely related to their size: 214 (66%) smaller than 20 mm, had a malignization percentage of 7%; 74 (34%) larger than 20 mm, had 51% malignization, and 86.2% malignization was found in adenomas of over 40 mm.
Global malignization percentage of adenomas was 18%. However, when adenomas with high grade dysplasia in the 4.1 category of the Viena classification (non-invasive high grade neoplasia) were considered, this percentage rose to 26%.
Malignization of hyperplastic polyps was 0.8%.
When gastric acidity was determined using the maximum stimulation method, out of 77 cases of patients with hyperplastic polyps, 55 (60%) had real achlorhydria, 10 (18%) hypochlorhydria, 11 (20%) normochlorhydria, and only 1 (4) hyperchlorhydria. D.A.B. was 1.97 mEql for hyperplastics and 1.60 mEql for adenomas. D.A.M. was 6.05 mEql for hyperplastics and 5.49 mEql for adenomas. Our experience as to normal cases showed 2.5 mEqh ± 1.2 and 22 mEqh ± 6, respectively, for D.A.B and D.A.M.
KEY WORDS: Gastric epithelial polyps, classification
RESULTADOS: PROPORCIÓN ENTRE PÓLIPOS HIPERPLÁSICOS Y ADENOMAS
En la Tabla (5) nosotros llegamos a estudiar 1075 pólipos hiperplásticos y 324 adenomas con la proporciones de 77% y 33% pero si consideramos en la Tabla (6) a las 884 hiperplasias suprafoveales (Hiperplasias focales) la proporción es de 86 y 14 % respectivamente, proporción que esta dentro de lo esperado. Los pólipos de glándulas fúndicas no han sido numeroso en nuestra casuística y de hecho, pueden ser considerados como formaciones hiperplásticas. Su posibilidad de malignización es baja.
Tabla 5.- Proporción en 1399 adenomas y pólipos hiperplásico
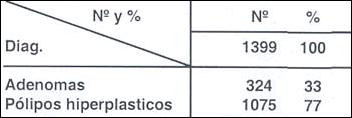
Tabla 6.- Proporción de 2283 formaciones elevadas

Tabla 7.- Número de pólipos hiperplástico e hiperplasias
Suprafoveales
1913 Hiperplasias suprafoveales y pólipos hiperplastico en 960 pacientes

Los pólipos hiperplásticos, los adenomas y los canceres son lesiones en muchos casos, no aisladas y que pueden presentarse concomitantemente.
En 266 pacientes se encontró una hiperplasia supra-foveal única y en 408 pacientes un pólipo hiperplástico único. En relación al número de pólipos de esta categoría, un número considerable de pacientes presentó más de un pólipo, habiéndose encontrado casos con innumerables pólipos, de ahí que nosotros solamente consignamos casos con menos de 10 pólipos o con más de 10 pólipos, llamándolos a estos últimos como pólipos múltiples de estómago y no como poliposis.
Tabla 8.- Número de adenomas en 291 pacientes.
324 adenomas en 291 pacientes
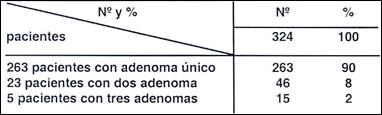
La Tabla ( 8 ) muestra que 28 pacientes presentaron más de un adenoma, que constituyen el 10%. Y el 90% presentaron adenoma único. Watanabe (13) en su serie de su 75 adenomas encontró en 50 pacientes un 66% de adenomas únicos. En general debe considerarse que el adenoma es una lesión solitaria, pero que puede presentarse junto con otros, con pólipos hiperplásticos y aún con cáncer. En otros estudios como lo señala Ming (4) el adenoma es generalmente una lesión solitaria. En la serie de Watanabe, de 75 adenomas, formaciones simples fueron vistas en 50 pacientes, 2 adenomas en 19 pacientes, 3 adenomas en 5 pacientes y 5 adenomas en un paciente.
Es diferente emplear términos como Pólipos múltiples de estómago y poliposis ya que esta última categoría está relacionada generalmente a procesos con base genética, tales como la poliposis familiar múltiple, síndrome de Peutz Jeghers entre otros.
Por eso señalamos, que cuando se diagnóstica o se observa cualquier tipo de estas lesiones, es necesario buscar otras en el mismo estómago, pues la mucosa gástrica reacciona con diversas alteraciones: gastritis atrófica metaplásia intestinal, pólipos hiperplásticos, adenomas y aún cánceres, que no siempre son secuenciales en su evolución, sino generalmente concomitantes; nosotros, las denominamos como marcadores de alteraciones preneoplásicas.
Tabla 9.- Pólipos de tipo Nakamura III en 780 pólipos estudiados.
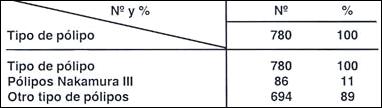
El porcentaje de malignización fue muy bajo, 2%, como el mismo Nakamura lo señala.
Tabla 10.- Forma de presentación de pólipos hiperplásticos y adenomas.
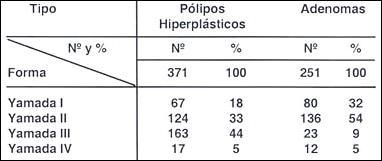
Para el estudio comparativo de estas 2 formas de pólipos se tomaron números relativamente iguales de ambas entidades Tabla (10 ) apreciándose claramente, como también lo encuentran la mayoría de autores, aunque con pequeñas variantes, que los pólipos hiperplásticos adquieren generalmente proporciones iguales de las formas Yamada I y II, y las III y IV, a diferencia de lo que se observa con los adenomas en los que el 86% fueron formas no pedunculadas (Yamada I y II).
Llorens (38) en 41 adenomas, 84% presentaron formas pedunculadas.
Nagayo (39) reporta que el 6.3% de los pólipos hiperplásticos tenían formas pedunculadas y que los adenomas en el 93.7% presentaban forma sesil (Yamada I y II) y sólo 6.3% pedunculados.
En el área occidental, como lo señala Whitehead las formas pedunculadas son las que priman. En nosotros como ocurre en el Japón las formas sesiles y pequeñas tienen una mayor proporción.
La polipeptomia en los pólipos hiperplásticos es muy fácil, por que tienen un claro pedículo en cambio la biopsia puede resultar más difícil por la misma movilidad de la formación. En los adenomas las biopsias múltiples son muy fáciles por que la mayoría son formaciones más bien planas, no móbiles. Pedículo la polipeptomia igualmente es fácil, por que inclusive, la mayor parte de ellos se sitúa en el antro.
En pequeñas formaciones, la llamada Jumbo biopsia nos ha sido muy útil porque puede removerse completamente pólipos de pequeño tamaño y obtener muestras muy representativas. Cuando no se puede realizar este tipo de biopsia es necesario efectuar otras sesiones.
Tabla 11.- Localización de 1929 pólipos hiperplasticos e Hiperplasias suprafoveales
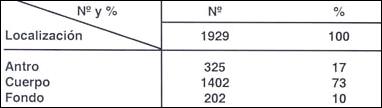
Tabla 12.- Localización de 324 adenomas
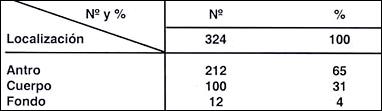
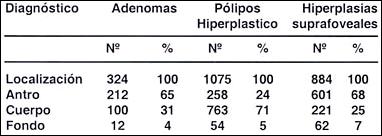
Tabla 13.- Localización de 2283 formaciones elevadas: 324 adenomas
(en 291 pacientes): 1075 pólipos hiperplásticos (en 574 pacientes)
y 884 hiperplasias suprafoveales (en 370 pacientes)
Es claramente conocido que la localización de los pólipos es diferente si se trata de pólipos hiperplásticos o adenomas. Kozuka (40) encuentra que los pólipos hiperplásticos se reparten por igual en todo el estómago y los adenomas fundamentalmente en el antro con proporciones para antro y cuerpo de 66% y para el fondo y cardias de 33.7%; en cambio los adenomas se localizaron en el 63.5% en el antro.
Llorens (35) empleando la terminología topográfica más simplificada de antro, cuerpo y fondo, señala que el 53.7% se localizaban en antro, 39% en cuerpo y 7.3% en el fondo.
Como observamos en las Tablas ( 11, 12 y 13 ) 1926 pólipos hiperplásticos e hiperplasias suprafoveales (83%) tuvieron una localización fundamentalmente en el cuerpo y fondo; en cambio los 212 adenomas se localizaron en el 96% en antro y cuerpo y sólo el 4% en el fondo.
Observamos que las hiperplasias suprafoveales tienen una mayor tendencia a localizarse en antro y esto es explicable porque las alteraciones inflamatorias y por lo tanto sus reacciones epiteliales (congestión, erosión, regeneración y metaplasia) son más frecuentes en esta zona.
Tabla 14.- Distribución de 2887 adenomas por grupo etario
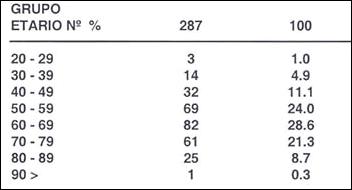
Promedio: 67.7 años
La presencia de pólipos guarda una estrecha relación con la edad Tabla ( 14 ). En el caso de los adenomas el 94.1% correspondían a personas mayores de 40 años, encontrándose el pico máximo por encima de los 70 años. El promedio de edad en los portadores de adenomas fue: en los hombres 69.1 años, en las mujeres 63.3 años, con un promedio general para ambos sexos de 67.7%.
En los pólipos hiperplásticos el promedio de edad para hombres fue de 62.8 y el de mujeres el 53.3 con promedio general de 58.5 la edad de las hiperplasias suprafoveolar en 60.1% para hombre y 54.3 % para mujeres, con un promedio de 57.2%. Para Llorens el 95% de esta formaciones estaban en personas mayores de los 40 años, el promedio de edad fue en el rango de 65.26.
Hirota (41) señala un promedio de 62.6 años.
Kozuka (42) en un estudio de 151 adenomas encuentra que 99% estaba por encima de los 40 años con el pico máximo entre los 60 y 69.
Para McNeer (43) el promedio de los portadores de adenoma se situó en los 58.4 años.
Laxén (44) encuentra promedios de 60, 64 y 72 años respectivamente para las hiperplasias suprafoveales, pólipos hiperplásticos y adenomas respectivamente.
Nuestro promedio de edades están expresadas en la Tabla (15) y en principio no se alejan de los autores mencionados.
Ming (10) da un promedio de 62.6 años para los adenomas, siendo el promedio de los muestra de 66.2% conforme se observa en la tabla (15)
Tabla 15.- Edad promedio en portadores de hiperplasia suprafoveales,
pólipos hiperplasticos y adenomas (años)
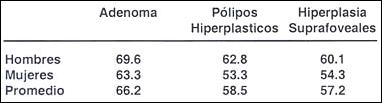
Tabla 16.- Sexo en portadores de adenomas.
Relación hombre mujer = 1.54 1
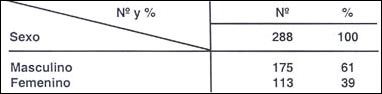
Los adenomas se encontraron con mayor frecuencia en hombres, constituyendo el 61%, con una relación hombre mujer de 1.54:1 Tabla ( 16 ).
Ming (10) señala una relación de 2:1 hombre: mujer.
Llorens (34) un porcentaje diferente, 15 hombres y 24 mujeres, probablemente por el tipo de población estudiada.
Tabla 17.- Metaplasia intestinal en 105 polipos hiperplásicos
y en áreas de mucosa adyacente
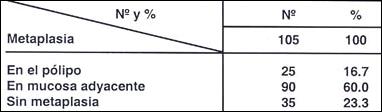
Tabla 18.- Metaplasia intestinal en 92 adenomas
y en área de mucosa adyacente
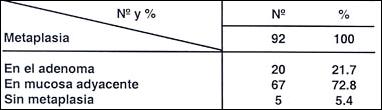
La existencia de metaplasia en el pólipo, sea en el hiperplástico como en el adenoma (16.7% y 21.7%) no es un fenómeno prominente, pero si en la mucosa adyascente, especialmente en caso de los adenomas Tablas ( 17 y 18).
En nuestro protocolo de trabajo se recomienda efectuar biopsias en las zonas adyascentes a los pólipos. En 105 pólipo hiperplásticos, se encontró solamente 16.7% de metaplásia en el mismo pólipo, 60% en la mucosa adyascente y no se halló esta alteración en el 23.3%. Whitehead (18) encuentra el 15% pero no señala la metaplasias en zona adyascentes y por eso el considera que la metaplasma intestinal no es un factor prominente en los pólipos hiperplásticos de allí la recomendación de tomar muestras en zonas adyascentes. En los adenomas, en la lesión se observó en 21.7% y en la mucosa adyascente en 72.8% y sólo en el 5.4% no se encontró metaplasia.
Estos hallazgos demuestran que los pólipos, especialmente los adenomas, se forman en mucosa modificada y de ahí que se les denominen por algunos autores como pólipos metaplásticos y cuando ellos se malignizan dan lugar a cánceres tempranos de tipo I y IIa diferenciados.
Como comentaremos en un artículo posterior, en nuestra casuística de cáncer temprano, nosotros tenemos un porcentaje mayor de este tipo de cánceres, probablemente por la abundancia de adenomas en nuestro medio.
Hirota en su serie reporta el 4.2% de adenomas de tipo gástrico. En nuestro estudio han sido muy raros.
Tabla 19.- Porcentaje de malignización de acuerdo
al tamaño en 876 polipos hiperplásticos
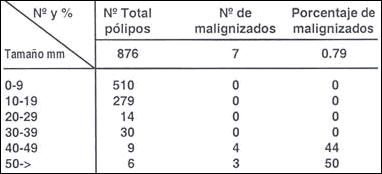
Tamaño promedio = 11
Tabla 20.- Porcentaje de malignización de acuerdo
al tamaño en 288 adenomas gástricos
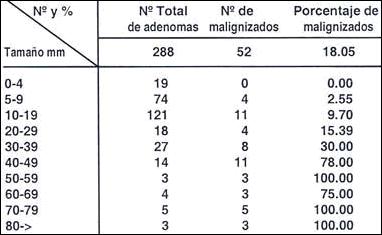
Tamaño promedio de los adenomas = 14 mm
Tamaño promedio de los adenomas malignizados = 38
Máximo tamaño 70 mm
Mínimo tamaño 5 mm
Tabla 21.- Porcentaje de malignizacion de acuerdo al tamaño:
Adenomas de menos de 20 mm y de más de 20 mm

Tabla 22.- Incidencia de cambios malignos en pólipo
hiperplasticos y adenomas
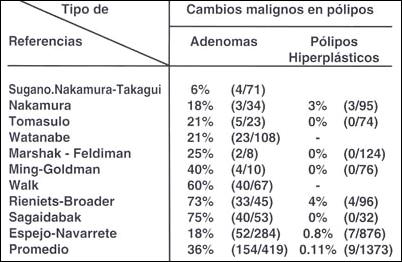
El porcentaje de malignización en los pólipos hiperplásticos es evidentemente bajo. Para Kamiya (45), Hizawa ( 23 ) los pólipos hiperplásticos no son lesiones que tengan significado precanceroso. En un seguimiento de 5 y 12 años ellos encontraron algunos casos de desaparición de lesiones pequeñas. Se debe considerar algunas formas mixtas con algún componente adenoma-toso. En casos raros se desarrolla la malignización, igual consideración la tienen Nakamura (46) Hatori T (47) Daibo y colaboradores ( 48).
Los adenomas gástricos tienen una alta incidencia de trasformación maligna especialmente en las lesiones papilares y vellosas y menos en las formas planas de los adenomas tubulares.
El índice de malignización es muy amplio, que va del 6% al 72% (Ming). (10 )
En el Japón en general las cifras se señalan entre el 5 y 13% Ming (49) Hay cifras muy bajas, del 5.1% como las reportadas por Nagayo (23) por el contrario hay series de mas de 76%, como la de Kozuka (42) que reportó el 72.7% de malignización en 44 adenomas metaplásicos, una alta incidencia para el Japón. Estas grandes variaciones están dadas por:
a) Tamaño
Esquema 3.-
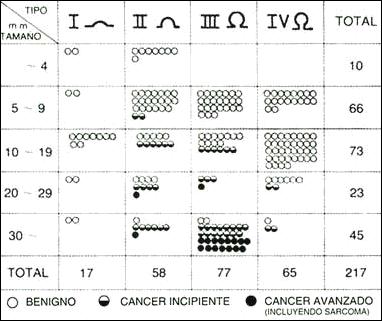
Relación en el tipo de lesión polipoidea. Su tamaño y grado de malignización según Yamada.
a) Aunque en el esquema del Dr. Yamada no se precisa la naturaleza histológica de los pólipos, se señala claramente la relación del tamaño y el pedicúlo
b) Existencia de pedicúlo
c) Número en el mismo estómago
d) Características morfológicas:
Vellosos
Papilares
Tubulares simples
Adenomas planos
Adenomas Nakamura III
Con relación al índice de malignización hay una diferencia porcentual de autor a autor, por ejemplo, Sugano, Nakamura y Takagui señalan un porcentaje de malignización (50) del 6%, pero el mismo Nakamura en un estudio posterior encuentra en 18%.
En una recopilación de diversos autores, en una referencia relativamente antigua, señalada en el libro de Bockus (33), entre los años 1926 y 1966 se estudiaron 1326 adenomas en los que se determinó un índice de malignización de 16.2%. Cabe mencionar que en la lista de 14 autores no figura ningún autor Japonés. Para autores como Papa, Kolodziejczyk y Goldstein (51, 52, 53). También existe una clara posibilidad de malignización de los adenomas.
En una recopilación de 14 autores entre los años de 1946 a 1985, señalada por Ming, en la que si figuran 9 autores Japoneses, el promedio se sitúa el 36%. El grado de malignización en nuestra serie se sitúa en el 18%, pero si consideramos adenomas con displasia de alto grado, es decir, dentro de la categoría 4.2 (Carcinoma no invasivo, insitu o intraepitelial de la clasificación de Viena) (54) este índice se sitúa el 26%.
El porcentaje de malignización, guarda una estrecha relación con el tamaño Tablas (19, 20, 21). En el esquema 3, en nuestra casuística el 74% tenían un tamaño menor de 20mm, debido a que nuestra preocupación era extirpar todo adenoma aún de tamaño menos menor de 5mm, a pesar en los que el porcentaje de malignización prácticamente no existe.
En los pólipos hiperplásticos la malignización es señalada por todo los autores como muy bajo, con un promedio de 0.11 % y 0.8% observado por nosotros Tabla ( 22).
Foto 17 a)

Foto17 b)
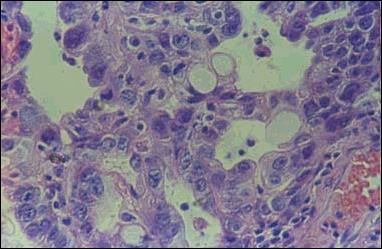
Un raro caso de pólipo hiperplástico en el que se aprecia foco de
neoplasia maligna intraepitelial de tipo intestinal señalado por las
flechas en la fotografía superior. (cortesía de los Doctores (Yabar y Palomino))
Es interesante que señalemos que por encima de los 20mm, el índice de maligización es 50%. Aún conociendo que la malignización de los adenomas de tamaño por debajo de 20mm es de sólo 7%, la ablación de todo adenoma es imperativo.
Consideramos que todo adenoma de más de 40mm, especialmente si no se cuenta con endoscopia ecográfica, debe ser sometido a tratamiento quirúrgico por su alto índice de malignización que supera el 78%.
Tabla 23.- Acidez gástrica en pólipos
hiperplásticos y adenomas
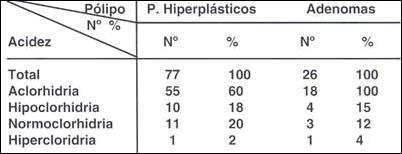
Tabla 24.- Promedio de acidez gátrica expresado en mEqh.
En pólipos hiperplásticos y adenomas

* En mEqh
** Débito Ácido Basal
*** Débito Ácido Máximo
Asunto de gran importancia para nosotros ha sido investigar la acidez gástrica en pacientes con esta patología Tablas ( 23 y 24 ).
Cuando se realizó el estudio por el método de la máxima estimulación, el debito ácido basal en los portadores de pólipos hiperplásticos y adenomas las cifras fueron de 1.97 mEqh y 1.60 mEqh en los pólipos hiperplásticos y los adenomas respectivamente, por debajo de los 2.5mEqh de los normales.
El debito ácido máximo fue de 6.05mEqh y 5.49mEqh para los pólipos hiperplásticos y los adenomas respectivamente, cifras también muy por debajo de las cifras normales establecidas por nosotros ( 55 ) de 22 mEqh ± 6. Esta observación para nosotros es muy importante y explicable, porque la mayoría o casi la totalidad de estas formaciones, como lo señala Abraham ( 56 ) asientan en mucosas gástricas atróficas y metaplásticas con pobre o nula capacidad secretora, inclusive, si comparamos con lo observado en los cánceres tempranos, esta baja acidez es mayor, ya que muchos cánceres tempranos (57) son de tipo indiferenciado, ulcerados y por lo tanto con capacidad secretoria mayor.
En un caso raro de pólipos en enfermedad de Peutz– Jeghers en mujer de 22 años con pólipos múltiples de tipo hamartamatoso, 2 de ellos con degeneración maligna, por lo demás situación muy rara, tratándose de este síndrome se encontró una inusitada hiperclorhidria; Lo interesante del caso es que la mucosa tenía muy poco carácter atrófico y no existía metaplásia intestinal; en el caso del adenoma con hiperclorhidria, estaba situado en la región cardial y concomitante tenia una úlcera duodenal.
Han existido poco estudios al respecto, uno de los cuales como hemos señalado es de McNeer el que manifiesta que la hipoclorhidria y la aclorhidria están frecuentemente asociadas con los fenómenos adenomatosos. De 15 pacientes, 9 (60%) presentaron aclorhidria, (2) 13% hipoclorhidria y 4 (3%) normoclorhidria.
Como los pólipos hiperplásticos ocurren frecuentemente en asociación con varias formas de gastritis atrófica, especialmente metaplásica, la erradicación del helicobacter pilory, que frecuentemente se asocia a estas formas reacciónales, debe efectuarse su erradicación, como lo señala algunos autores ( 24 )
Esta conducta nos parece relativa, puesto que como lo hemos comprobado, estas formas asientan en gastritis atrófica generalmente con aclorhidria o por lo menos con hipoclorhidria marcada, que en todo caso son consecuencia de la acción del germen, que no esta mayormente presente por serle un medio ya no favorable. Tal vez si se encuentra presencia del helicobacter cabria su erradicación. Nosotros en algunos casos hemos observado regresión de las hiper-plasias y de los pólipos hiperplásticos cuando estos han sido pequeños.
Muchos otros autores también asocian a los pólipos con un bajo contenido ácido del estómago. Haruma ( 58 )
SÍNTOMAS
La sintomatología de estos pacientes no es específica; los fenómenos dispépticos están presentes en más ó en menos, situación explicable porque todos son portadores de gastritis. La hemorragia fue observada en 11 pacientes (0.48%), generalmente en lesiones muy grandes y erosionadas. Solamente se observó un caso con obstrucción, cuando se trato de un gran pólipo hiperplástico en región pilórica desplazado al duodeno.
DIAGNÓSTICO
Los datos clínicos han contribuido poco.
La Radiología no ha sido un método sobre el cual hemos basado este trabajo.
El diagnóstico endoscópico con la biopsia ha sido el método fundamental, entendiéndose que este método ha sido complementado con gran frecuencia por la polipep-tomia endoscópica.
Igualmente muchos casos fueron detectados en piezas operatorias.
La endoecografia en algunos casos, ha sido un método muy útil.
La secreción gástrica ha sido un procedimiento básicamente de estudio.
Foto 18.-
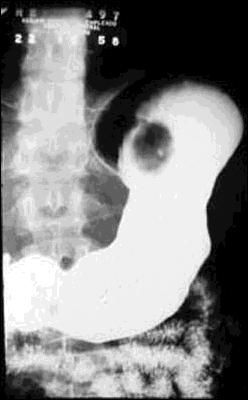
Gran pólipo hiperplástico en la que se aprecia el pedículo,
en una antigua radiografía convencional
Foto 19.-
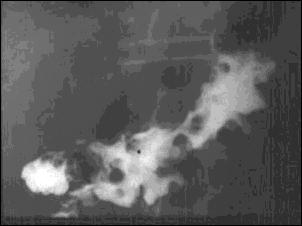
Grandes formaciones polipoideas (polyadenome polypeux)
en una enfermedad de Ménétrier.
Foto 20.-
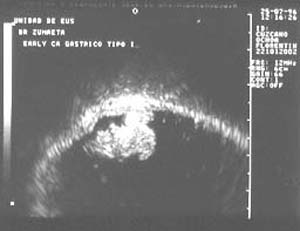
Imagen de un gran adenoma velloso con degeneración maligna en su cúpula
(Early tipo I) en el que se aprecia que la lesión ni siquiera invade la mucosa.
Utilizando un Equipo Olympus.
CONDUCTA
En relación a los pólipos hiperplásticos, en principio una vez que se les ha diagnosticado, deben ser extirpados, aunque su índice de malignización sea muy bajo. Como los pólipos hiperplásticos ocurren frecuentemente en asociación con varías formas de gastritis, especialmente atrófica y metaplásica, la erradicación del helicobacter pilory, que frecuentemente se asocia a estas formas reaccionales, si el germen esta presente su erradicación.
El germen produce alteraciones inflamatorias, las cuales a su vez devienen en fenómenos hiperplásticos reaccionales. No es difícil entender, que en nuestro medio, con alto índice de infección, se encuentre toda categoría de pólipos epiteliales.
También es explicable que en países desarrollados el porcentaje de reacciones epiteliales con evolución metaplástica sea menor y por lo tanto también sean menos frecuentes los pólipos hiperplásticos y especialmente los adenomas.
BIBLIOGRAFÍA
1.- MING SC, the classification and significance of gastric polyps. In JH Yardley, BM. Morson, (eds). Baltimore, The Gastrointestinal Tract. Williams and Wilkins, 1977: 149-175. [ Links ]
2.- VALDES DAPENA A. Gastric Polyposis (Polyadenome Polypeux): Antonio Valdes Dapena and Giorge Stein (eds) Morphologic Pathology of the Alimentary Canal, Philadelphia: London, 1970: 229. [ Links ]
3.- SCHINDLER R. Benign Tumors. In Rudolf Schindler 2nd. Ed., Gastroscopy: the Endoscopic Study of Gastric Pathology. Philadelphia: J. B. Lippincott Company, 1950:265-279. [ Links ]
4.- MING SC, Tumors of the esophagus and stomach. In Atlas of tumor Pathology, 2 nd ed, series, fascicle 7. Washington: Armed Forces Institute of pathology, 1973:124-143. [ Links ]
5.- ESPEJO H. Endoscopia Gástrica I: galeno I, 1971; 3: 12-15. [ Links ]
6.- ESPEJO H. Experiencia endoscópica con el sistema de la fibrogastrocamara. Tesis Doctoral UNMSM, 1973. [ Links ]
7.- CASTILLO T. Lesiones elevadas de estómago: evaluación endoscópica e histológica. Tesis Doctoral UNMSM, 1974. [ Links ]
8.- GUTIÉRREZ O Y GÓMEZ M, Tumores benignos del estómago. En Gastroenterología, (eds) Albis Hani, Oscar Gutiérrez, Jaime Alvarado. Bogota: McGraw – Hill Interamericana, 2001: 110-114. [ Links ]
9.- TOMASULO J. Gastric polyps. Histologic types their relationship to gastric carcinoma. Cancer 1971; 1346 – 1355. [ Links ]
10.- MING SC, Epithelial polyps of the Stomach. In Pathology of the Gastrointestinal tract, eds. Si – Chun Ming and Harvey Goldman. Philadelphia, WB Saunders, 1992:547-569. [ Links ]
11.- KOZUCA S: Gastric polyps. In MI Filipe, JR Jass (eds). Gastric Carcinoma. London: Churchill Livigston, 1986:132-15.
12.- GOLMAN DS, APELMAN HD: Gastric mucosal polyps. Am J Clin Pathol, 1972; 58:434-444. [ Links ]
13.- WATANABE H.: Argentafin cells in adenoma of the stomach. Cancer 30: 1267 – 1264, 1972. [ Links ]
14.- NAGAYO T. Precursors of Early Gastric Cancer. In Human Gastric Cancer (ed). Takeo Nagayo. Springer -Verlag Berlin, 1986: 103-152. [ Links ]
15.- SEIFERT E, ELSTER K., New classification of Gastric Polyps, Base don the Experiences in Polypectomy. In Surgial Endoscopy; (ed) E. –Seifert. Baden – Baden, Verlag Gerhard Witzstrock GmbH, 1975:35-40. [ Links ]
16.- ESPEJO H, NAVARRETE J. Pólipeptomia endoscopica. Resúmenes del VI congreso peruano de Gastroenterología Lima; 1978: 48. [ Links ]
17.- NAKAMURA T. Nakamura type III gastric polyp: History of the study in IST International Gastric Cancer Congress. Eds. Mitsumasa Nishi, Haruo Sugano and Toshio Takahashi, Bologna: Monduzzi ed. International Proceedings Division, 1995: 209-212. [ Links ]
18.- WHITEHEAD R. Mucosal Hyperplasias and Polyps: The Whitehead (ed) Mucosal Biopsy of the Gastrointestinal Tract, Philadelphia: W. Saunders Company, 1990: 101-130. [ Links ]
19.- KOVAËEVIÊ I, LJUBICIE N AND MAKITAN M. Clinical approach to the benign epithelial gastric polyps. Acta clin Croat 2002, 41: 65-68. [ Links ]
20.- KOGA S, WATANABE H, ENJOJI M: Stomal polypoid hypertrophic gastritis: A polypoid gastric lesion at gastroenterostomy site. Cancer, 1979; 43: 647 – 657. [ Links ]
21.- KOCH HK, LESCH R, CREMER M, et. al: Polyp and polypoid foveolar hyperplasia in gastric biopsy specimens and their precancerous prevalence. Front Gastrointest Res, 1979; 4: 183-191. [ Links ]
22.- KAMIYA T, MORISHIHITA T, ASAKURA H, et. al: Long term follow – up on gastric adenoma and its relation to Gastric protruded carcinoma. Cáncer, 1982; 50: 2493 - 2503. [ Links ]
23.- NAGAYO T. Precursors of Early Gastric Cancer. In Human Gastric Cancer (ed). Takeo Nagayo. Springer – Verlag Berlin, 1986:103 – 152. [ Links ]
24.- ORLOWSKA J, JAROSZ D, PACHLEWSKI J, BUTRUK E. malignant transformation of benign epithelial gastric polyps. Am J Gastroenterol 1995; 90: 2152-21593. [ Links ]
25.- HIZAWA K, FUCHIGAMI T, IIDA M. et al. Possible neoplastic trasformation within gastric hyperplastic polyps. Application of endoscopic polypectomy. Surg Endosc 1995; 9: 714-718. [ Links ]
26.- DEBONGNIE JC. Gastric polyps. Acta Gastroenterol Belg 1999; 62: 187-189. [ Links ]
27.- DEMLING L. Kilinik und Therapie der Magerkrankheiten. In Ludwig Demling, (ed ). Ger Kranke Magen. München: Urban & Schwarzen Berg,; 1970:109-129. [ Links ]
28.- KOZUKA S. Gastric Polyps. In Isabel Filipe and Jeremy Jass (ed) Gastric Carcinoma, Endinburgh: Churchill Livingstone, 1986: 132 – 151. [ Links ]
29.- GINSBERG GG, AL- KAWAS FH, FLEISCHER DE, et al. Gastric polyps: relationship of size and histology to cancer risk. Am J Gastroenterol 1996; 91:714-717. [ Links ]
30.- MAC NEER G, PACK GT. Neoplasms of the Stomach. Philadelphia. Lippineott, 1978: 518. [ Links ]
31.- ARENAS J. MONTALVO I. Y TEJADA A. Carcinoma gástrico y otros tumores malignos del Estómago. In Gastroenterología y Patología (3 era ed.) Madrid: Ediciones Harcourt, S.A, 2002: 204-215. [ Links ]
32.- MING SC, Epithelial polyps of the Stomach. In Pathology of the Gastrointestinal tract, eds. Si – Chum Ming and Harvey Goldman. Philadelphia, WB Saunders, 1992:547-561. [ Links ]
33.- DEBRAY, MARTÍN E. Benign Gastric Tumors. In Henry L. Bockus, (ed). Gastroenterology. 2 nd edition., Philadelphia: WB Saunbers company, 1974: 1018- 1040. [ Links ]
34.- BERENGUER ARENAS J, MONTALVO I Y TEJADA A. Carcinoma Gástrico otros tumores malignos del estómago. En Joaquín Berenguer, (ed) Gastroenterología y Hepatología, 2 nd ed., Madrid: Elsevier Science, 2002: 204-215. [ Links ]
35.- SAMUEL B. HO, Tumors of the Stomach and Small Intestine. In Current Diagnosis and treatment in Gastroenterology. Eds. James Grendell, Keneth R. and Scott L. Stanford Appleton and Lange, 1996: 350- 362. [ Links ]
36.- GORDÓN Gastrointestinal and Liver Disecase 6° Edición 1998 en Sleisenger and fortrau; 1998; 1:733-757. [ Links ]
37.- STAMM B, SULSER H, STAHL BERG AND BUCHER R: Pathology of gastric mucosa Polyps. Schweiz Med Wochenschr 115: 1120-1127, 1985. [ Links ]
38.- LLORENS Capítulos escogidos en Gastroenterología Lesiones gástricas Pre cancerosa; 53-69. [ Links ]
39.- NAGAYO Human Gastric Cancer ; 103-142. [ Links ]
40.- KOZUCA S, MASAMOTO K, SUZUKI S, et al: Histogenetic types and size of polypoid lesion of the stomach, with special reference to cancerous changes. Gann. 1977; 68: 267-274. [ Links ]
41.- HIROTA T, OKADA T, ITABASHI M, KITAOKA H , et. al: Histogenesis of human gastric cancer – with special to the significance of adenoma as a precacerous lesion. In SC Ming, (ed): Precursors of Gastric Cancer. New York, Praeger, 1984: 233-252. [ Links ]
42.- KOZUKA S. Gastric Polyps. In Isabel Filipe and Jeremy Jass (ed) Gastric Carcinoma, Endinburgh: Churchill Livingstone, 1986: 132-151. [ Links ]
43.- MCNEER G. AND JOLY J. The Problem Posed by the Small Polypoid Gastric Tumor. Gordon McNeer and Daniel J. Joly, eds. Neoplasms of the Stomach, Philadelphia: J.B. Lippincott Company, 1967:238-243. [ Links ]
44.- LAXEN F, SIPOONEN P, IHAMAKI T, et. al: Gastric polyps: the morphological and endoscopical characteristics and relation to gastric carcinoma. Acta Pathol Microbiol Immunol Scand [A], 1982:221-228. [ Links ]
45.- KAMIYA T, MORISHITA T., ASAKURA H., NUNAKATA Y el at (1981) Histoclinical long-standing follow-up study of hiperplastic polyps of the stomach. American Journal of Gastroenterology, 75: 275-281. [ Links ]
46.- NAKAMURA T. Phatohistologische Einteilung der Magen polypen mit spezifische Betrachtung ihrer Malignen Entartung. Schirurg , 1970: 41:122-130. [ Links ]
47.- HATORI T, Morphogical range of hierplastic polyps an carcinoma arising in hiperplastic polyps of the stomach. Journal of Clinical pathology, 1985: 38: 622-630. [ Links ]
48.- DAIBO M., ITABACSHI M, AND HITROTA T . 1987 Malignant trasformation of gastric hiperplastic polyps. American Journal Gastroenterology 82: 1016-1025. [ Links ]
49.- MING S.C Malignant Potential of Epithelial polyps stomach in precursors of gastric cancer ed. Si- Chun Ming praeged N.Y, 1986: 228-261. [ Links ]
50.- NAKAMURA T, NAKANO G: Histopathological classification and malignant change in gastric polyps. J Clin Pathol, 1985; 38: 754-764. [ Links ]
51.- PAPA A, CAMMAROTA G, TURSI A, et al. Histologic types and surveillance of gastric polyps: a seven year clinico – pathological study. Hepatogastroenterology 1998; 45: 579-582. [ Links ]
52.- KOLODZIEJCZYK P, YAOT T, OYA M, et al. Long term follow – up study of patients with gastric adenomas with malignant transformation. Cancer 1994; 74: 2896- 2907. [ Links ]
53.- GOLDSTEIN NS, LEWIN KJ. Gastric epithelial dysplasia and adenoma: historical review and histological criteria for grading Hum Pathol 1997; 26: 127-133. [ Links ]
54.- SCHLEMPER RJ, RIDELL RH, KATO Y, et al: The Viena classification of gastrointestinal epithelial neoplaia Gut 2000; 47: 251-255. [ Links ]
55.- CHAHUD A Y ESPEJO H, El Debito Ácido Máximo con estímulo al Histalog. Comparación del Débito Ácido Máximo empleando el Histalog y la insulina como estimulantes. An. de la Facultad de Medicina. 1967: 279-301. [ Links ]
56.- ABRAHAM SC, SINGH VK, YARDLEY JH, WUTT. Hyperplasic polyps of the stomach: associations with histologic patterns of gastritis and gastric atrophy. Am J Surg Pathol 2001; 25: 500-5007. [ Links ]
57.- ESPEJO H, NAVARRETE S, Cáncer Gástrico Temprano. Gastrum 1996; 122: 14-34. [ Links ]
58.- HARUMA K, el al. Gastric acid secretion, serum pepsinogen I, and serum gastrin en Japanse with gastric hyperplastic polyps or polypoid-type early gastric carcinoma scand j, gastroenterol 1993; 25: 633-637.













