INTRODUCCIÓN
El cáncer colorrectal (CCR) es el tercer cáncer más frecuente en el mundo y la segunda causa de muerte de origen neoplásico, con más de 1,8 millones de casos nuevos al año y aproximadamente 881 000 muertes anuales 1. El adenocarcinoma es la histología más frecuente, representando el 95% de todos los CCR 2.
Las neoplasias neuroendocrinas (NNE) actualmente comprenden a los tumores neuroendocrinos (TNE) y carcinomas neuroendocrinos (CNE); estos últimos son neoplasias raras, reportadas entre el 0,1 al 0,6% de los CCR 3-5.
La coexistencia de NNE del tracto gastrointestinal (TGI) y CCR no es una condición frecuente, y a diferencia del CCR típico el pronóstico no es bueno, debido a su agresiva biología tumoral y la falta de pautas establecidas de manejo 6,7.
Presentamos un caso de neoplasia sincrónica colorrectal (CNE de células pequeñas de recto y adenocarcinoma de colon) y una revisión de la actual literatura disponible.
CASO CLÍNICO
Varón de 83 años, procedente de Lima-Perú con antecedente de hipertensión arterial y cirugía por hiperplasia prostática benigna hace 40 años. Tres meses antes del ingreso presenta, diarrea sin moco, en ocasiones con rasgos de sangre, dolor perianal y pérdida de peso de 10 kg. La última semana se agrega urgencia rectal y hematoquezia, lo que motivó el ingreso a emergencia.
Al examen físico: funciones vitales estables; abdomen globuloso, ruidos hidroaéreos presentes, dolor a la palpación profunda en hipogastrio, en flanco derecho se palpa masa indurada de 8 cm; al tacto rectal no se palpan masas, dedo de guante con restos hemáticos.
La analítica reveló una hemoglobina en 9,6 gr/dL, leucocitos 17 010 cel/mm3, sin abastonados; el hierro sérico 13 ug/dL, saturación de transferrina 6,4%, ferritina 179,2 ng/mL, LDH 244 (120-246 U/L), B2-
microglobulina 3 638 (607-2454 ng/mL); el antígeno carcinoembrionario (CEA) fue 1,87 ng/mL.
La videocolonoscopía, describe hasta 10 cm de íleon terminal, ciego y colon ascendente proximal de aspecto conservado; en colon ascendente distal, se observa lesión proliferativa, de superficie irregular, de aproximadamente 11 cm de longitud, que compromete el 60% de la circunferencia, se extiende hasta ángulo hepático y permite el paso del equipo sin dificultad, friable y deleznable a la toma de biopsias. Resto de mucosa de colon transverso, descendente y sigmoides de aspecto conservado. En recto, desde los 10 cm del margen anal, se observa otra lesión proliferativa con superficie irregular, friable, de aproximadamente 10 cm, que compromete el 50% de la circunferencia, sin estenosarla; canal anal sin alteraciones (Figura 1).
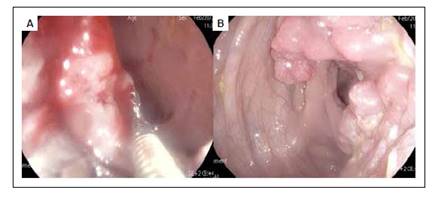
Figura 1 Ambas lesiones no obstructivas A. Lesión proliferativa de recto con friabilidad. B. Lesión proliferativa en colon ascendente.
El estudio tomográfico describe, una lesión sólida heterogénea de 17,5x8,5x9,4 cm, de aspecto infiltrante, no obstructiva, compromete recto medio y distal con extensión de 11,5 cm, mala interfase con el piso vesical e infiltra pared anterior de la pelvis; asociado a linfonodos de tamaño y morfología patológica, en cadena ilíaca externa, interna y común izquierda; además, una segunda lesión con aspecto de invaginación y engrosamiento de la pared a nivel del ángulo hepático del colon ascendente, de 7,5 cm asociado a pequeños linfonodos pericolónicos (Figura 2).
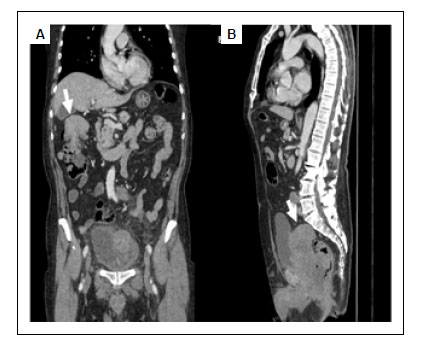
Figura 2 A. Imagen coronal, muestra invaginación colo-colónica en ángulo hepático (flecha blanca) con engrosamiento parietal asociado a pequeños linfonodos pericolónicos (no visibles en imagen) (T3N1MO). B. Imagen sagital, muestra extensa lesión sólida heterogénea de aspecto ulcerado (flecha blanca), infiltrante y no obstructiva, compromete recto medio y distal con extensión hacia región prostática con mala interface con el piso vesical (T4N2M1).
El estudio anatomopatológico de las biopsias de colon ascendente revela un adenocarcinoma tubular bien diferenciado in situ; y en recto un carcinoma neuroendocrino de células pequeñas. La inmunohistoquímica de este último fue: pánqueratina(-), S-100(-), sinaptofisina(+) y Ki-67 >95% (Figura 3).
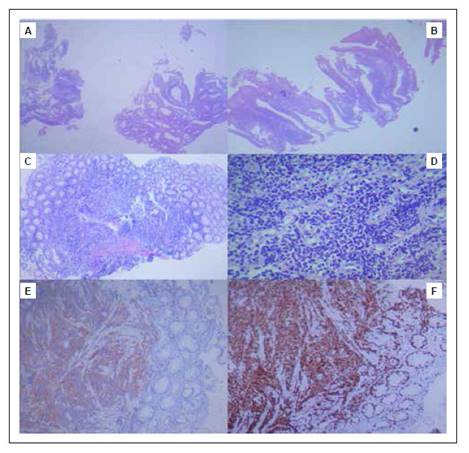
Figura 3 A-B. Tinción H-E, corresponden a neoplasia túbulopapilar de alto grado, al parecer intraepitelial, con escaso estroma. C-D. Tinción H-E, corresponde a tumor de recto, carcinoma neuroendocrino de células pequeñas (CNECP), E: sinaptofisina (+), y F: Ki67 +de 95%.
El PET/CT con radiofármaco F18/FDG, evidencia actividad marcadamente metabólica en colon ascendente, compatible con proceso neoformativo activo indiferenciado, con SUVmax hasta 44,8 y actividad hipermetabólica heterogénea que se extiende desde sigmoides hasta la región rectoanal e infiltra vejiga, próstata, con un SUVmax hasta 12,3; asociada a múltiples adenopatías perirrectales, cadenas ilíacas, y retroperitoneales, SUVmax entre 6,5-10,3; sin observar áreas de actividad metabólica sospechosas en otros órganos (Figura 4).
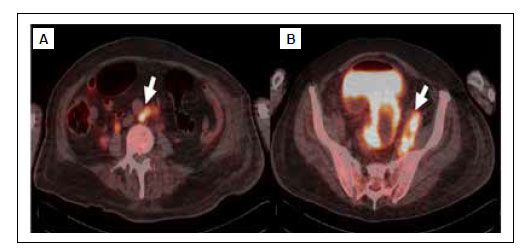
Figura 4 Imagen de PET/CT con F18-FDG, muestra. A. Ganglio paraaórtico hipermetabólico (flechas blanca). B. Conglomerado adenopático hipermetabólico en cadena ilíaca interna, externa, y común izquierda.
El caso fue sometido a evaluación multidisciplinaria (oncología, coloproctología y gastroenterología), el estadiaje del carcinoma neuroendocrino y adenocarcinoma fue T4N2M1a y T3N1MO respectivamente.
Ambas neoplasias no tenían riesgo de obstrucción intestinal, ni hemorragia digestiva no controlada, al momento; no obstante, por ser la neoplasia neuroendocrina, más agresiva y avanzada, se inició quimioterapia sistémica a base de platino. De manera paliativa se planteó colocar un stent autoexpandible en recto, sin embargo, no se realizó por el alto riesgo de perforación. Tres semanas después el paciente falleció.
DISCUSIÓN
Las definiciones de tumor primario múltiple (TPM) ha cambiado en el tiempo. Por TPM se entiende la presencia de más de un cáncer en un mismo paciente, ya sea simultáneamente (sincrónico) o después de un tiempo del diagnóstico de una primera neoplasia (metacrónico) 8. Las dos terminologías más utilizadas actualmente fueron emitidas por Surveillance Epidemiology and End Results (SEER) Project y la International Association of Cancer Registries and International Agency for Research on Cancer (IACR/ IARC). La SEER toma en cuenta la histología, sitio, lateralidad, el tiempo desde el diagnóstico inicial para identificar cánceres primarios múltiples; y considera tumores únicos de diferentes partes del mismo órgano (colon) como de múltiples sitios. Las reglas de la IACR / IARC son más exclusivas; solo se registra un tumor para un órgano, independientemente del tiempo, a menos que haya diferencias histológicas. El periodo para distinguir entre primarios múltiples sincrónicos y metacrónicos también difiere utilizando un punto de corte de 2 (SEER) y 6 meses (IACR/IARC) 8,9.
En el 2019 la OMS divide las NNE en TNE y CNE en función de sus diferencias moleculares, estos últimos se subdividen en el tipo de células pequeñas y grandes 5. Histológicamente los CNE de células pequeñas tienen un patrón de crecimiento difuso o anidado, compuestas por células de pequeño-mediano tamaño, citoplasma mínimo, núcleo fusiforme con cromatina granular, discreto nucléolo y tasas de mitosis muy alta. Típicamente expresan cromogranina A, sinaptofisina y CD56, y alrededor del 95% al menos uno de estos tres 10. En contraste, el CNE de células grandes, está compuesto de células de mayor tamaño con patrón como de anidación, trabeculares, en forma de roseta y empalizadas. Las células tumorales tienen formas poligonales u ovales, núcleos hipercromáticos con nucléolos prominentes y citoplasma ligeramente eosinofílico con límites celulares mal definidos. Al menos dos marcadores neuroendocrinos deben ser difusamente positivos para el diagnóstico 10.
Los TNE gastrointestinales, representan dos tercios de todos los TNE, y comprenden menos del 2% de los tumores del TGI (11). Reportados con mayor frecuencia en la mucosa gástrica, intestino delgado, recto y páncreas. Los TNE de recto y colon representan el 14% y 8% respectivamente 11.
Una serie norteamericana, reportó CNE colorrectales en el 0,6% 3. Lai et al., en 15 años, encontró menos del 0,1% de 11 000 CCR (4). Los CNE de células pequeñas, son más frecuentes en colon (44,7%) y recto (36,8-43%) 3,12.
La incidencia global de TPM varía ampliamente, reportadas hasta en 6,1% 9. Los TNE colorrectales tienen mayor riesgo de otras neoplasias malignas (TGI, pulmón y próstata) 10; de estas, mayormente las del TGI son sincrónicas, mientras que las ajenas a este son metacrónicas 13.
La coexistencia de NNE del TGI y cáncer de colon no es muy frecuente, Medina et al, reportó que de un 80% de los segundos cánceres primarios hallados en el TGI, 27% se localizaban en colon, el adenocarcinoma (97,6%) fue la histología más frecuente y la coexistencia en el mismo segmento fue del 68,4% 6. La patogenia sigue sin estar clara. Existen diversas teorías como la existencia de un efecto cancerígeno común que estimula el crecimiento de ambas neoplasias 14 o una célula madre común que sufre mutaciones genéticas similares (c-kit o p53) y da lugar a diferentes tipos de neoplasias malignas gastrointestinales 15. Otras teorías proponen el efecto de crecimiento paracrino o autocrino por péptidos secretados por células neuroendocrinas (bombesina, glucagón, somatostatina, gastrina) o factores de crecimiento (PDGF, EGF, IGF- 1 y FGF); provocando crecimiento del tejido con la posterior transformación neoplásica 6.
Respecto al tratamiento de los CNE colorrectales, no existe pautas bien establecidas, los regímenes actuales se extrapolan de la evidencia sobre el cáncer de pulmón de células pequeñas y el adenocarcinoma colorrectal 7.
Wu et al., reportó que ningún régimen de quimioterapia basados en 5-FU ni regímenes de etopósido asociado a platino mejoraron la supervivencia global (SG) de pacientes en estadio I-III. Para el estadio IV, la quimioterapia es un factor pronóstico independiente y la cirugía al parecer no mejora la SG 16. Smith et al., informó que la resección del tumor primario no se asoció con un resultado superior en pacientes con enfermedad localizada o metastásica 17. Contrariamente Conte et al., obtuvo una mayor SG (20,4 meses) en enfermedad localizada, en aquellos que recibieron terapia perioperatoria (quimioterapia neoadyuvante, adyuvante o ambas) asociado a cirugía, comparada con cirugía sola o quimioradioterapia/ quimioterapia sola (15,4 y 17,4 meses respectivamente).
Los esquemas utilizados de quimioterapia fueron basados en platino, cisplatino más etopósido, cisplatino más irinotecan 18. Estos resultados compartidos por Wang et al. que, de 72 pacientes, 34 de 35 (97,1%) con enfermedad localizada recibieron cirugía radical, y la quimioterapia sistémica se consideró el pilar para el tratamiento de pacientes con enfermedad metastásica. Así mismo se demostró que los CNE colorrectales eran significativamente más sensibles a quimioterapia basada en platino que en 5-FU 7.
Por otro lado, el valor del PET/CT con FDG/F18 es de gran importancia, pues ha demostrado exceder el valor pronóstico de marcadores tradicionales como Ki-67, cromogranina y las metástasis hepáticas. Así, un estudio positivo se asocia con un significativo riesgo de muerte comparado a pacientes con estudio negativo, sobre todo con un valor de captación estandarizado SUVmax >3 19, como nuestro caso.
La colocación de un stent metálico autoexpandible es una opción de tratamiento paliativo en estos casos, sin embargo, el crecimiento invasivo de la neoplasia hacia órganos circundantes, puede conducir a la ruptura del tumor después de su colocación, por lo tanto, una valoración cuidadosa es esencial para tomar una decisión clínica correcta 20.
En conclusión, presentamos un caso poco frecuente de sincronismo colorrectal y su pobre pronóstico debido al estadio avanzado al diagnóstico, el tipo histológico concurrente, hallazgos en PET/CT como factor pronóstico y la pobre respuesta a la quimioterapia.















