INTRODUCCIÓN
Digestiva Alta (HDA), definida como cualquier sangrado gastrointestinal por encima del ligamento de Treitz, se El sangrado gastrointestinal es considerado una clasifican en variceal y no variceal, siendo esta última la emergencia médica y representa la causa más común más frecuente (cerca del 80% de casos de HDA), mientras de hospitalizaciones de tipo gastroenterológicas a nivel que la del tipo variceal es una complicación frecuente mundial. Su tasa de incidencia anual va de 48-160 por 100.000 adultos por año y presenta una mortalidad y severa en pacientes con hepatopatía crónica (>50% aproximada del 10% en diversos países 1,2. Estudios casos) 5-7. La endoscopía es el método estándar, útil tanto realizados en hospitales de Lima- Perú hallaron tasas de para el diagnóstico como para el tipo de tratamiento en mortalidad y resangrado similares 3,4. La Hemorragia caso de presentarse una HDA activa 7.
Respecto a las causas de HDA en Perú, estudios realizados en hospitales a nivel de Lima Metropolitana señalan que la Hemorragia Digestiva Alta No Variceal (HDANV) es más frecuente, y que la úlcera péptica representa cerca del 50% de los casos, pues se ha visto relacionado con el creciente uso de AINES, sobre todo en la población geriátrica 8,9; mientras, que la Hemorragia Digestiva Alta Variceal (HDAV), por varices gastroesofágicas, se ha encontrado en una menor proporción (alrededor del 15%), donde señalan la relación de su presentación como la expresión de la cirrosis hepática e hipertensión portal en los pacientes con esta patología 8-10.
Las guías de práctica clínica y la literatura recomiendan administrar tratamiento empírico 7,8, así por ejemplo, si se tiene alta sospecha clínica de HDAV se debe iniciar tratamiento vía parenteral con antibióticos y agentes vasoactivos como terlipresina (análogo de la vasopresina), vasopresina y somatostatina (y sus análogos, octreotide y vapreotide) 6,9, pues tienen la capacidad de inducir vasoconstricción esplácnica, reduciendo el gasto cardiaco, el flujo y la presión portal, teniendo así una función importante en el control del sangrado (disminuyéndolo hasta en un 80% de los casos) 10-12.
Para la sospecha de HDANV, se recomienda el tratamiento con un inhibidor de la bomba de protones (IBP) 10-14, los cuales ayudan a la resolución de las úlceras, promueven la agregación plaquetaria y, la formación de coágulos al elevar el pH gástrico 15,16. Asimismo, en la literatura se han descrito diversas escalas que son utilizadas en el manejo inicial del paciente con HDA; las más usadas en la actualidad son las de Glasgow-Blatchford, Rockall y AIMS65; cuya finalidad es estratificar el riesgo del sangrado (riesgo alto o bajo) 15,17-19, pues de acuerdo con el tipo de riesgo dependerá su manejo. Estas escalas han demostrado una buena precisión en la predicción del riesgo en pacientes con HDA no variceal; sin embargo, en los que presentan sangrado de tipo variceal, su utilidad no está bien definida 17,20,21.
La bibliografía relacionada a la identificación precisa del tipo de HDA planteó el uso de marcadores no invasivos y sistemas de puntuación para evaluar los cambios dinámicos de la fibrosis hepática (recuento de plaquetas, la relación AST/ALT, índice APRI, índice de Lok, índice de Forn, índice de King´s, índice FIB-4, etc.) 22,23, los cuales utilizan valores de laboratorio y datos clínicos de la evaluación inicial del paciente, de manera que son prácticos para su utilización. Estudios han correlacionado el uso de estos marcadores no invasivos con la predicción de presencia de várices en pacientes ambulatorios estables; sin embargo, hay limitada información sobre el uso en pacientes con HDA aguda 24-28
En la búsqueda de publicaciones similares se encontró 2 estudios (realizados en Rumania y Tailandia) donde postulan score predictivos de HDA en base a parámetros clínicos/laboratoriales, y se presentan factores predictivos de sangrado variceal similares y detallan una sensibilidad y especificidad significativa 29,30; sin embargo, cabe resaltar que estos estudios se hicieron en otras poblaciones (europea y asiática) por lo cual existen diferencias geográficas, étnicas y culturales en cuanto a las causas y/o frecuencias de la HDA, también, el tamaño de la muestra en los estudios no fueron considerablemente grandes y los resultados pueden variar en entornos de hospitales diferentes, de manera que se tendría que validar sus resultados y la precisión de la puntuación de sus scores en otras poblaciones.
El objetivo del presente estudio fue desarrollar una escala para predecir la etiología de Hemorragia Gastrointestinal Superior, previo a la endoscopia, mediante la construcción de un modelo predictivo de HDAV utilizando marcadores no invasivos (exámenes de laboratorio y parámetros clínicos) en pacientes que acuden a la emergencia por HDA.
MATERIALES Y MÉTODOS
Se realizó un estudio de cohorte retrospectivo, que comprende la revisión de historias clínicas de los pacientes que ingresaron por el Servicio de Emergencia del centro de atención terciaria Hospital Cayetano Heredia (HCH) de Lima- Perú por sangrado gastrointestinal superior, durante el periodo de 2019 al 2022. En este estudio longitudinal se hizo 2 mediciones, cuando ingresa el paciente a emergencia, y, al final de la endoscopia. Se incluyó a pacientes mayores de 18 años con diagnóstico de HDA, quienes presentaron signos y síntomas gastrointestinales altos compatibles con tal patología, y, quienes contaron con un resultado de endoscopia hasta las 72 horas posteriores a su ingreso al servicio de emergencia del HCH. Se excluyeron a los pacientes cuya causa de HDA fue indeterminada o no concluyente luego de la endoscopia digestiva alta; también, a quienes no se sometieron a tal procedimiento, o los que tenían una fuente de sangrado fuera del tracto digestivo superior. En base a los resultados de endoscopia se evaluaron las exposiciones registradas en la historia clínica (datos clínicos y de laboratorio). Cabe resaltar, que no se evaluó la causa-efecto, sino los signos y síntomas que predicen el tipo de hemorragia digestiva.
Los datos recolectados se vertieron en el programa Microsoft Excel 16 (desarrollado por Microsoft Corporation, Redmond, Washington, EUA), confeccionándose una base de datos, cuya fuente primaria la constituye las recolecciones de los datos de las historias clínicas, y finalmente analizada utilizando el programa Stata 17 (desarrollado por StataCorp LLC, College Station, Texas, EUA).
Las variables independientes fueron clasificadas en demográficas: edad, sexo, antecedente de cirrosis, historial de comorbilidades, antecedente de HDA, antecedente farmacológico (uso de AINEs, anticoagulantes, antiplaquetarios y corticoides en los últimos meses); clínicas: tipo de vómito (presencia de hematemesis o vómito rojo, presencia de vómito borráceo y ausencia de vómito), evaluación de heces (presencia o ausencia de melena), presencia de dolor abdominal, taquicardia (FC > 100 latidos/min), hipotensión (PA< 90/60 mmHg), presencia de palidez, signos de enfermedad hepática crónica (angiomas, eritema palmar, glándula parótida agrandada, ginecomastia, atrofia testicular, hepatomegalia, esplenomegalia, edema, ascitis o encefalopatía hepática), aspirado de sonda nasogástrica (presencia o ausencia de hemorragia), y bioquímicas: hemoglobina, hematocrito, leucocitos, urea, creatinina, plaquetas, alanina aminotransferasa (ALT), fosfatasa alcalina (FA), gamma-glutamil transpeptidasa (GGT), aspartato aminotransferasa (AST), tiempo de protrombina (TP), bilirrubina, albúmina; cada parámetro bioquímico expresado en su unidad de medida respectiva, recolectando su valor descrito en la historia clínica.
Las variables independientes del estudio fueron características clínicas, demográficas y bioquímicas de los pacientes y la variable dependiente constituyo la hemorragia digestiva. Se definió la HDA de acuerdo con el informe del diagnóstico endoscópico, categorizándose como HDANV y HDAV. Se describen las características clínicas y demográficas de la población de estudio. Se realizó el análisis bivariado exploratorio con la finalidad de seleccionar las variables relacionadas con la presencia de HDAV. Las variables categóricas fueron comparadas con χ² exact, en variables continuas de distribución normal se usó la prueba de T de Student, para comparar variables sin distribución normal se usó la prueba de suma de rangos de Wilkoxon, y, para la comparación más de dos medias se usó la prueba de ANOVA.
Se aplicó una Regresión Logística Múltiple para construir un modelo predictivo de HDAV con las variables mencionadas. Para evaluar la capacidad predictiva del modelo se construyó una curva ROC y se aplicó la prueba de Bondad de Ajuste; cabe precisar que la aplicación de la regresión logística múltiple permite el ajuste de las variables confusoras y de las variables modificadoras de efecto. Con los resultados del modelo predictivo creado, se asignó un puntaje a las variables que mejor predijeron la probabilidad de HDAV, con el cuál se construyó una escala de medición en salud. Los puntajes del score fueron asignados en base a los valores de los Odds Ratio hallados en el modelo final. Posteriormente, se validó la escala predictiva asignando el valor total de los puntajes a cada paciente que participó en el estudio (validación interna), y, se halló el punto de corte que mejor predice el diagnóstico de HDAV en el grupo de estudio. Con estos resultados se halló el área bajo la curva ROC de la escala predictiva y se calcularon la sensibilidad (S), especificidad (E), valores predictivos positivo (VPP), valores predictivos negativo (VPN), cociente de probabilidades positivo (CPP) y cociente de probabilidades negativos (CPN) de la escala predictiva.
Respecto al tamaño de muestra del presente estudio, éste no aplica su cálculo debido a que las variables fueron seleccionadas en base a un modelo predictivo hallado con una regresión logística múltiple. El diseño de estudio que constituye una cohorte retrospectiva nos permitió explorar las variables que se relacionaban en forma directa con la hemorragia digestiva alta variceal. El cálculo del tamaño de la muestra aplicaría para el proceso de validación externa de la escala propuesta aplicándose a pacientes en el escenario de la emergencia.
El trabajo de investigación fue aprobado por el Comité Institucional de Ética e Investigación (CIEI) de la Universidad Peruana Cayetano Heredia, con fecha 23 de noviembre del 2019.
RESULTADOS
Se incluyeron 197 pacientes, de los cuales, 128 (65%) fueron varones, y 69 (35%) mujeres; 38 (19%) pacientes refirieron el antecedente de cirrosis, 67 (35%), el antecedente de HDA; 74 (38%) presentaron hematemesis (vómito rojo), mientras que 50 (25%), vómito borráceo; 142 (72%) pacientes presentaron melena; 89 (45%) presentó hipotensión, y, en 40 (27%) pacientes se hallaron signos de enfermedad hepática crónica. En relación con las variables laboratoriales, el valor promedio de la hemoglobina fue de 8,16 ± 2,73 gr/dl, creatinina; 1,6 ± 2,42 mg/dl, plaquetas; 224 682,14 ± 97 050,72 #células/ μL, TGO; 59,01 ± 77,49 UI/ml, INR; 1,35 ± 0,439, bilirrubina total; 1,65 ± 3,146 mg/dl. Los resultados de la endoscopía alta mostraron que 127 (64%) pacientes tuvieron HDANV y 70 (36%) HDAV. Las causas de HDANV fueron úlcera gástrica (n=49) (39%), úlcera duodenal (n=22) (17%), gastropatía erosiva (n=5) (4 %), cáncer gástrico (n=13) (10 %), desgarro de Mallory- Weiss (n=6) (5%), esofagitis (n=10) (8%) y misceláneas (n=22) (17%). Las causas de HDAV fueron várices esofágicas (n= 67) (96%), y, várices gástricas (n=3) (4%).
Características demográficas y antecedentes de enfermedad
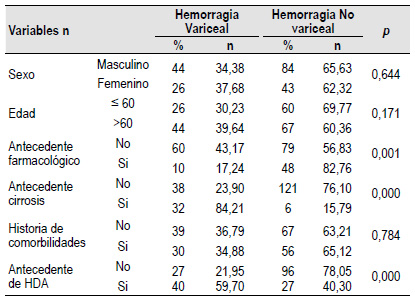
Dentro de las características demográficas sólo el antecedente farmacológico (p=0,001), el antecedente de cirrosis (p=0,000) y el antecedente de HDA (p=0,000) estuvieron asociado a la presencia de HDAV. La edad (p=0,644), el sexo (p=0,171) y la historia de comorbilidades (p=0,784) no se asociaron a la presencia de HDAV. (Tabla 1)
Características clínicas
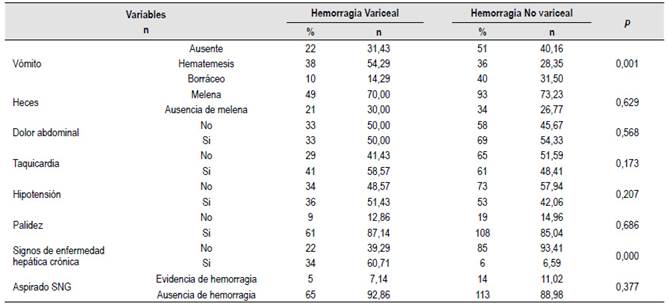
En el análisis bivariado las variables clínicas que estuvieron asociados a la presencia de HDAV, fueron: hematemesis (vómito rojo) (p=0,001) y los signos de enfermedad hepática crónica (p=0,000). El color de las heces (melena) (p=0,629), el dolor abdominal (p=0,568), la taquicardia (p=0,173), la presencia de hipotensión (p=0,207), la palidez (p=0,686) y las características del aspirado por la sonda nasogástrica, no estuvieron asociados a la presencia del HDAV. (Tabla 2)
Hallazgos de laboratorio
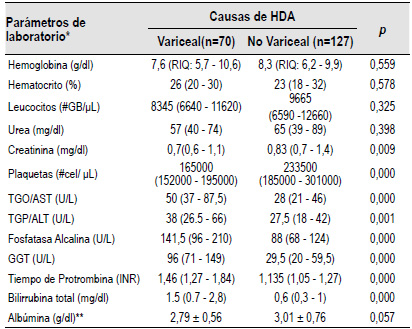
Dentro de las variables de laboratorio evaluadas, se halló que los niveles bajos de plaquetas (p=0,000), niveles elevados de TGO y TGP (p=0,000; p=0,001), fosfatasa alcalina elevada (p=0,000), gamma-glutamil transpeptidasa elevado (p=0,000), un INR prolongado (p=0,000), niveles elevados de bilirrubina total (p=0,000) y los valores elevados de la creatinina (p=0,009) estaban asociados a la presencia de HDAV. Los niveles de la hemoglobina (p=0,559), hematocrito (p=0,578), nivel de leucocitos (p=0,325), urea (p=0,398) y albumina (p=0,057) no estuvieron asociados a la presencia de HDAV (Tabla 3).
Análisis multivariado
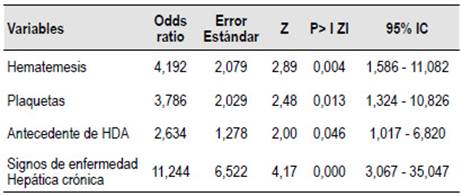
En el análisis multivariado, solo la hematemesis (vómito rojo) [OR: 4,192 IC 95% (1,586 - 11,086); p = 0,007], el menor número de plaquetas [OR: 3,786 IC 95% (1,324 - 10,826); p = 0,001], el antecedente de HDA [OR: 2,634 IC 95% (1,017 - 6,820); p = 0,034] y la presencia de signos de Enfermedad Hepática Crónica [OR: 11,244 IC 95% (3,607- 35,047); p = 0,000) fueron las variables que predicen en forma independiente la probabilidad de HDAV (Tabla 4).
Tabla 4 Factores predictivos independientes de HDA variceal *
*Regresión logística múltiple
Prueba de Bondad de ajuste: p = 0,43
Con los resultados del modelo de regresión logística múltiple, utilizando los coeficientes logit, se construyó la siguiente formula predictiva: Y = -2,6192 + 1,4333(hematemesis) + 1,3315(plaquetas) + 0,9688(HDA) + 2,4198 (signos enfermedad hepática crónica).
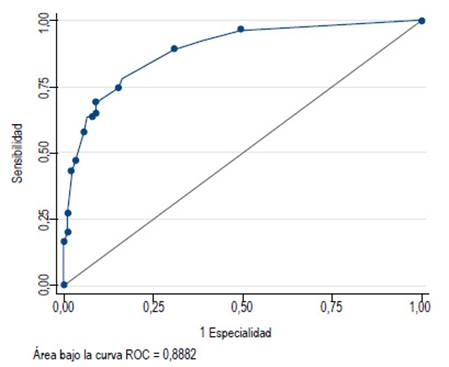
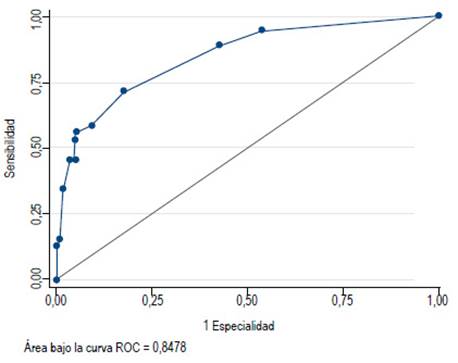
Este modelo mostró una prueba de bondad de ajuste de 0,43 (capacidad predictiva de un 43%). La capacidad predictiva del modelo tiene un área bajo la curva (ROC) de 0,88 (Figura 1).
Con los resultados del modelo predictivo creado en el análisis multivariado se construyó una escala donde a cada variable se le asignó un score en base su OR ajustado a su número entero más cercano. (Tabla 5). Luego de ello, se realizó la validación de la escala predictiva a partir de los datos de los pacientes del estudio, y, se halló que los pacientes con HDANV tenían una mediana de score de 3 con un RIQ [0 - 4], y los pacientes con HDAV tenían una mediana del score de 11 con un RIQ [4 - 18]. Asimismo, se halló el mejor punto de corte de los valores de la escala; correspondiendo a un score > 7 y ≤ 7, que se determinó de acuerdo con el mejor valor de sensibilidad y especificidad.
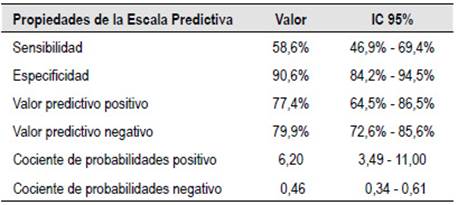
Las propiedades diagnósticas de la escala predictiva fueron sensibilidad de 58,6% [IC 95%; 46,9%-69,4%], especificidad de 90,6% [IC 95%: 84,2%-94,5%], valor predictivo positivo (VPP) de 77,4% [IC 95%; 64,5%-86,5%], valor predictivo negativo (VPN) de 79,9% [IC 95%; 72,6%- 85,6%], Cociente de probabilidades positivos (CPP+) de 6,20 [IC 95%; 3,49- 11,00%] y Cociente de probabilidades negativos (CPN-) de 0,46 [IC 95%; 0,34-0,61] (Tabla 6). El área bajo la curva ROC para la escala es de 0,84 [IC 95%; 0,78-0,89]. (Figura 2).
DISCUSIÓN
Este el primer estudio que se ha realizado para determinar la etiología de la HDA, mediante el uso de variables clínicas y laboratoriales en un hospital de referencia de Lima. Dentro del periodo en el cual se incluyeron las historias clínicas para el desarrollo del presente estudio, de enero 2019 a marzo de 2022, se halló que 70 (35,5%) pacientes con HDA fueron de causa variceal, y 127 (64,5%) fueron de etiología no variceal. Estudios realizados en otros países revelan que la etiología variceal oscila entre el 18 a 30%, mientras que, la causa no variceal se encuentra entre el 70 a 82% 29,30. A nivel nacional, un estudio realizado en el Servicio de Medicina Interna del Hospital Nacional Hipólito Unanue reportó que, de los casos de HDA, el 24,3% fue de causa variceal, y el 75,7% fue de causa no variceal 31. Los resultados que hallamos en nuestro estudio revelan una mayor frecuencia de HDAV en comparación con la literatura internacional, lo que se podría deber a las características de nuestra población de estudio ya que el Hospital es un centro de referencia para pacientes de mayor complejidad de una gran población del Cono Norte de la ciudad de Lima.
Un estudió que incluyó 517 pacientes con HDA, concluyó que los factores asociados a la HDAV incluyen el diagnóstico de cirrosis hepática, el antecedente de hemorragia variceal, presencia de ascitis, trombocitopenia, niveles elevados de INR y bilirrubina total, mientras que, para la HDANV, los factores predictivos fueron el uso de AINES, y, anticoagulantes. Con estos datos, el modelo propuesto por Matei et al. predice el sangrado digestivo variceal y no variceal con un área bajo curva ROC de 0,968 30.
Otro estudio prospectivo realizado por Pongprasobchai et al. encontró que los factores asociados a HDAV fueron diagnóstico previo de cirrosis, signos de enfermedad hepática crónica, hematemesis, variables que fueron incluidas en el modelo propuesto para la predicción del sangrado variceal 29.
En nuestro estudio, el análisis multivariado determinó que los factores que se encontraron asociados a la HDAV fueron Hematemesis (vómito rojo) [OR: 4,192, IC 95% (1,586-11,082); p=0,007], el recuento de plaquetas < 170000 [OR: 3,786 IC 95% (1,324-10,826); p=0,001], el antecedente de HDA [OR: 2,634 IC 95% (1,017-6,82); p = 0,034] y la presencia de signos de Enfermedad Hepática Crónica [OR: 11,244 IC 95% (3,607- 35,047); p=0,000), estos hallazgos son concordantes con lo descrito en los estudios previos de Matei et al. y Pongprasobchai et al. Como se puede apreciar la diferencia que se establece entre los modelos propuestos por Matei et al., Pongprasobchai et al., y, el nuestro es la cantidad de factores identificados en cada modelo. Por una parte, los dos primeros usaron seis y tres respectivamente, mientras que el nuestro propone cuatro, lo que podría modificar la capacidad predictiva de cada modelo propuesto 29,30.
En nuestro estudio se encontró que el factor predictor más fuerte para la predicción de HDAV fue el hallazgo de signos de enfermedad hepática con un OR de 11, ello se respalda en la bibliografía, en las que este factor posee valores de OR entre 22 29 y 10 30. Desde el punto de vista demográfico, Matei et al. describieron que la edad media de los pacientes con HDA se encontraban entre 61,9 ± 15,1, dato muy similar al valor de edad media hallado en nuestro estudio 62,036 ± 17,225. Además, dicho estudio reportó una mayor frecuencia de pacientes varones con un 67% para ambos tipos de HDA, dato igualmente similar a nuestros resultados en un 65%. Pero ambas variables, edad y sexo no resultaron ser estadísticamente significativas para determinar la etiología de la HDA y fueron variables que no se incluyeron en las escalas predictivas 30. Respecto a la HDANV, Matei et al. reportaron que los factores asociados eran el consumo de AINES y anticoagulantes, lo cual concuerda con los resultados de nuestro estudio, en el cual se determina que los factores asociados a este tipo de sangrado son el antecedente farmacológico de uso de AINES, anticoagulantes y corticoides 30.
En referencia a la escala predictiva propuesta por nuestro estudio, el proceso de validación interna mostró un score con un punto de corte > 7 y ≤ 7; punto de corte que permitió hallar una sensibilidad, especificidad, VPP Y VPN que fueron de 58,6%, 90,6%, 77,4%, 79,9% respectivamente; valores diferentes a la escala propuesta por Pongprasobchai et al., cuyos valores de sensibilidad, especificidad, VPP, VPN fueron 85%, 81%, 79%, 97%, con un punto de corte en 3,1; estas características de esta escala podrían ser diferentes al nuestro ya que su validación se llevó a cabo en otro grupo de pacientes y con mayor número de variables 29, por lo que una puntuación < 3,1 permite descartar el sangrado de tipo variceal con confianza. El rendimiento de la escala propuesta por Matei et al., reporta también valores diferentes a nuestros resultados con una sensibilidad, especificidad, VPP Y VPN fueron 88,9%, 87,8%, 72,7%, 95,3% respectivamente 30. Se puede apreciar en forma general que existen diferencias importantes entre cada una de las escalas predictivas mencionadas y diferencias importantes con nuestra escala propuesta. Las diferencias más resaltantes existen sobre todo en los valores de la sensibilidad y en los VPN, ello se puede deber al número de pacientes incluidos en cada estudio, la cantidad de variables usadas en cada escala predictiva, y, la validación externa que realizaron ambos estudios en un diferente grupo de pacientes donde se construyó la escala predictiva. Hay que resaltar que en el proceso de construcción de nuestra escala solo se llevó a cabo un proceso de validación interna de la herramienta, estando pendiente un proceso de validación externa. En contraste, nuestro estudio contempla el cálculo de los cocientes de probabilidad positivo (CPP) y negativo (CPN) cuyos valores fueron 6,2 y 0,46 respectivamente. En base a la interpretación clínica de los cocientes de probabilidad, el CPP de 6,2 nos muestra que la escala es un instrumento bueno; ya que tiene la capacidad de producir importantes cambios en la probabilidad pre-test y posttest; Por lo tanto, un punto de corte > de 7 tendrá utilidad en la práctica clínica, discriminando al paciente entre la probabilidad de HDANV o HDAV. Sin embargo, el CPN de 0,46 no produciría grandes cambios en la reducción de las probabilidades diagnósticas entre el pre-test y post-test.
Dentro de las limitaciones identificadas en el presente estudio; fueron la inclusión de un reducido número de pacientes, además, durante la recolección de datos, se revisaron historias clínicas en forma retrospectiva de manera que las mediciones de las variables pueden estar sesgadas (sesgo de medición), siendo limitaciones inherentes al modelo del estudio, por ello la confiabilidad, calidad de información, y medición de valores de estas, no son las ideales, además, de carecer de criterios de uniformidad, por lo que disminuye la precisión de los resultados. Asimismo, se debe considerar el sesgo de selección ya que en el estudio ingresaron solo pacientes con diagnóstico clínico evidente de sangrado digestivo.
En conclusión, la escala predictiva formulada a partir de los cuatro factores predictores mencionados en este estudio, al obtener un punto de corte mayor de siete, nos permitiría predecir el diagnóstico de HDAV, y, podría ser usada en las emergencias para iniciar su manejo médico convencional previo a la endoscopía, pero previamente se recomienda realizar una validación externa de la escala propuesta en otro grupo de pacientes en los escenarios de emergencia en pacientes con HDA, para evaluar la consistencia de estos resultados.