INTRODUCCIÓN
El 6 de marzo de 2020, la enfermedad producida por el coronavirus 2 del síndrome respiratoria agudo severo (SARS-CoV-2) apareció en el Perú 1. Como se describió en los primeros casos reportados en China, la mayoría de los pacientes desarrollaban un cuadro leve (81%), con neumonía leve o sin ella; un 14% enfermedad severa, con hipoxemia o más del 50% del parénquima pulmonar comprometido en imágenes; y un 5% enfermedad crítica con falla respiratoria, shock o disfunción multiorgánica 2.
Los casos con criterios de severidad como disnea progresiva, frecuencia respiratoria más de 30 respiraciones por minuto, saturación de oxígeno menor de 93% y presión parcial de oxígeno en relación a soporte de oxígeno (PaO2/FiO2) menor a 300, o cualquier signo de estado crítico que requiera ser transferido a cuidados intensivos para soporte ventilatorio, traducen un fenómeno de respuesta inflamatoria sistémica del SARS-CoV-2, donde se liberan un gran número de citoquinas proinflamatorias, de las cuales la interleucina 6 (IL-6) es la protagonista de la inflamación aguda 3,4.
Se tiene evidencia que los antagonistas de los receptores de IL-6, como el tocilizumab (TCZ), que es un anticuerpo monoclonal recombinante humanizado, logra inhibir las señales de esta citoquina multiefectiva y por ende disminuye la respuesta inflamatoria exagerada denominada tormenta citoquínica 4, demostrando en algunos reportes de pacientes COVID-19 hospitalizados un efecto positivo en reducir la mortalidad 4,5.
Presentamos el reporte del uso de TCZ en paciente con criterios de severidad de infección por COVID-19.
REPORTE DE CASO
Paciente varón de 44 años, personal de salud, con antecedentes de hipertensión arterial (HTA), dislipidemia mixta leve, intolerancia a los carbohidratos y esteatosis hepática. En el 2012 tuvo infección respiratoria alta por virus A H1N1. Niega tabaquismo y abuso de alcohol.
Once días antes de su hospitalización tuvo contacto con paciente COVID-19 en el entorno hospitalario. 8 días antes del ingreso, recibió vacuna contra influenza. Cuatro días antes del ingreso hospitalario, presentó tos seca, odinofagia y sensación de alza térmica. Tres días antes del ingreso se agregó "cansancio" y "falta de aire". Al día siguiente acudió a emergencia y presentó leucocitos en 6370/uL con linfopenia (590/uL) y proteína C reactiva (PCR) elevada (140 mg/dL). Se realizó prueba molecular para el SARS-CoV-2 y se le indicó aislamiento domiciliario, sintomáticos y vigilancia de signos de alarma. Dos días después, refiere disnea más intensa, por lo que acude y fue admitido por emergencia con una saturación de oxígeno (SatO2) de 90%. El resultado de primera prueba molecular fue negativa. Se le indicó una segunda muestra para prueba molecular.
Al examen físico ingresó con PA 120/60 mmHg, FC 88x', FR 28x', temperatura 37,8 °C; en regular estado general, somnoliento, y se auscultaban crépitos finos en bases pulmonares. El resto del examen no presentaba alteraciones.
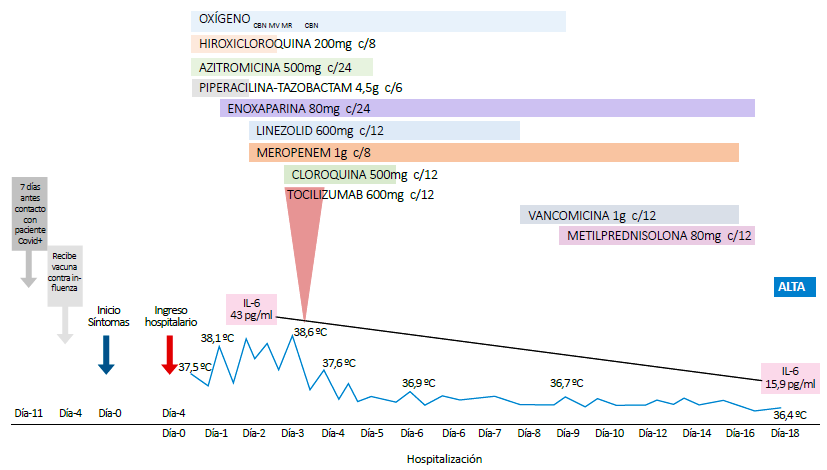
Los exámenes de laboratorio mostraron leucopenia, linfopenia, PCR continuó elevado, transaminasas y dímero D elevados; los gases arteriales mostraron SatO2 94% con PO2 68,7 y PaFi 166 (Tabla 1). La tomografía de tórax sin contraste mostró opacidades bilaterales en vidrio esmerilado en los dos tercios inferiores (Figura 1), las serologías para VIH, hepatitis B y C fueron no reactivas. En hospitalización se inició tratamiento con hidroxicloroquina 200mg VO c/8h y azitromicina 500mg VO cada 24h, además de cobertura antibiótica para neumonía bacteriana con piperacilina/tazobactam 4/0,5 gr EV cada 8h y oxigenoterapia por cánula binasal a 5 L por minuto, además enoxaparina 40mg SC c/24h.
Tabla 1 Resultados de exámenes de laboratorio según días de hospitalización, en paciente con neumonía severa por COVID-19 y uso de tocilizumab.
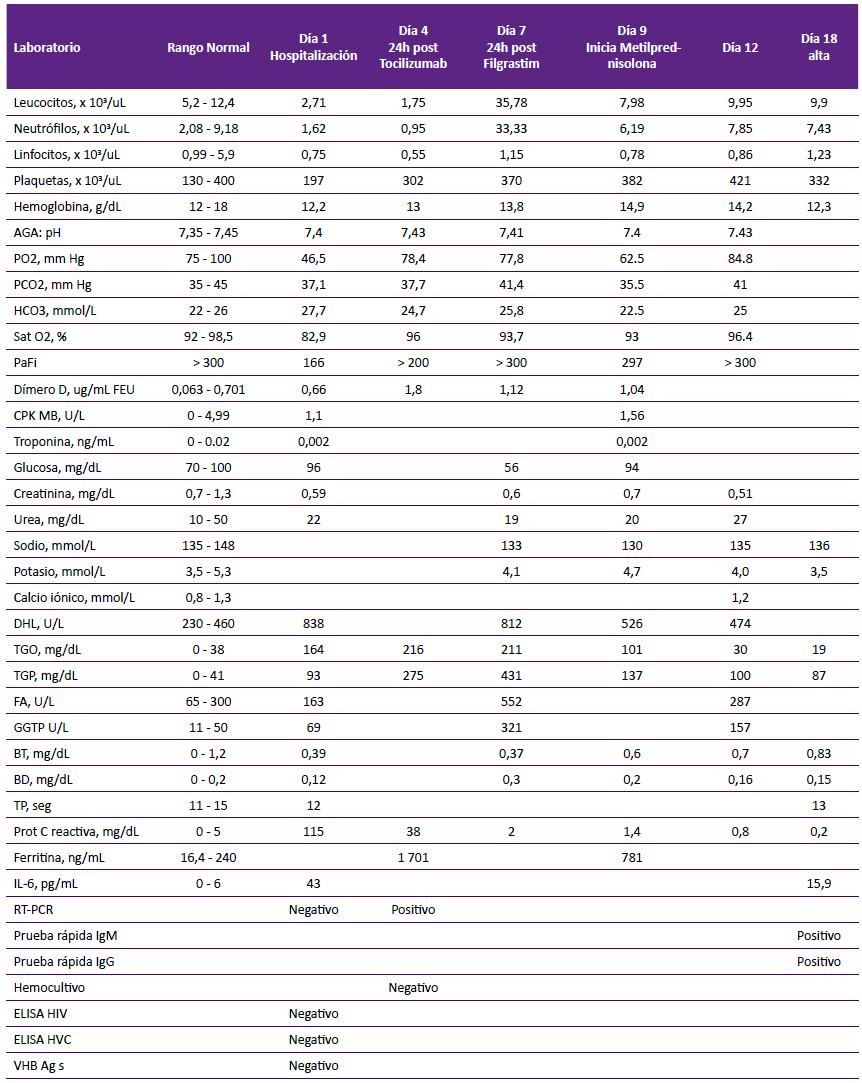
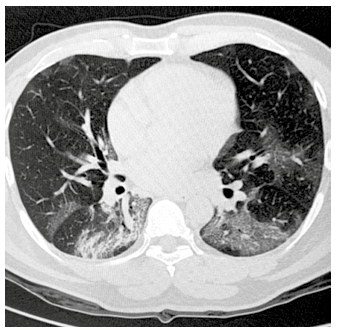
Figura 1 Tomografía de tórax sin contraste, obtenida el día de la admisión del paciente con neumonía severa por COVID-19. Se observan imágenes bilaterales en vidrio esmerilado distribuidas en bases, a predominio de región posterior.
El segundo día de hospitalización presentó fiebre (38,5°C), taquipnea (FR 32x'), SatO2 92%, PaFi 92, más somnolencia, por lo que se cambió a máscara de Venturi (MV) al 35%. Los exámenes de laboratorio de control mostraron mayor compromiso inmunológico y empeoramiento del cuadro respiratorio: la PO2 disminuyó a 46, SatO2 82% incluso con MV 50%, siendo necesaria máscara de reservorio; el dosaje de IL-6 salió elevado (43 pg/mL). Se indicó el uso compasivo de tocilizumab a dosis de 600 mg cada 12 horas (2 dosis en total) a 8mg/k, previa firma de consentimiento informado, y rotación de antibióticos a meropenem 1gr c/8h más linezolid 600mg c/12h.
Al siguiente día de haber recibido TCZ no volvió a presentar fiebre, mejoró la hipoxemia y disminuyó la PCR. Sin embargo, hubo mayor leucopenia por lo que recibió factor estimulante de colonias granulocíticas (Filgrastim) 300 μg/d (3 dosis) con lo que revirtió la leucopenia. La segunda prueba molecular resultó positiva para SARS CoV-2.
Seis días post tocilizumab, ante la remisión clínica, se realizó control tomográfico que no mostró gran mejoría, por lo que se inició metilprednisolona 80mg cada 12h por 8 días. Hacia el día 13 de hospitalización el paciente se encontraba sin requerimiento de oxígeno, afebril y un último control tomográfico (Figura 2), evidenció escasas lesiones pulmonares. Se indicó alta y aislamiento domiciliario por 14 días.
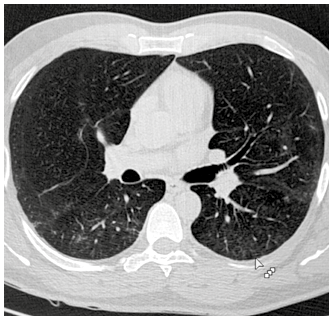
Figura 2 Tomografía de tórax sin contraste, obtenida al alta del paciente con neumonía severa por COVID-19 y uso de tocilizumab. Se aprecian escasas opacidades en vidrio deslustrado de la región posterior de ambos campos pulmonares.
DISCUSIÓN
Se describe que la tormenta de citoquinas comienza entre la primera y segunda semana de la enfermedad, momento en el que un paciente presenta una neumonía severa por SARS-CoV-2 4,6. En el caso descrito, el cuadro se presentó con deterioro respiratorio antes de los 7 días y se asumió que se había desencadenado una exagerada respuesta inflamatoria, por los marcadores inflamatorios séricos, incluyendo la IL-6 elevados y las imágenes tomográficas; así como, criterios para soporte ventilatorio en cuidados intensivos.
El tratamiento con inhibidores de IL6 está sustentado en la inhibición de la tormenta de citoquinas que a la postre desencadena el daño en células epiteliales alveolares, especialmente por la salida de células a la circulación de linfocitos T helper tipo 1 patógenos, monocitos inflamatorios CD14+, CD16+ e IL-6 7. También se plantean mecanismos de linfohistiocitosis hemofagocítica secundaria como causante de esta 8.
En un estudio chino con 21 pacientes que recibieron TCZ en un solo brazo, hubo mejoría en el 75% (15/21) de ellos, incluyendo dos pacientes que salieron de ventilación mecánica en pocos días 9. Existen reportes de casos de pacientes que llegando o no a la intubación recibieron anti-IL6 y mejoraron, teniendo patologías asociadas como mieloma múltiple 10 o insuficiencia renal crónica en hemodiálisis 11. Durante la evolución de nuestro paciente se apreció disminución de la fiebre, disnea y de la saturación de oxígeno; lo que evitó que el paciente fuera intubado, como se ha reportado 9.
Las agencias reguladoras de salud de China, Italia y USA han autorizado el uso de agentes anti-IL6 en pacientes con síndrome de distrés respiratorio (SDRA) asociado a COVID-19 6,9. En Perú, el Ministerio de Salud emitió el documento técnico de manejo de pacientes críticos, incluido TCZ, después del alta de nuestro caso 12. Además, algunos estudios también han reportado una disminución de muertes con el uso de TCZ 4,5,13; sin embargo, actualmente los resultados preliminares del estudio SMACORE no evidencia disminución de la mortalidad 14.
Debemos remarcar que al día siguiente de la administración de TCZ, nuestro paciente estuvo afebril (Figura 3); eso es algo que otros reportes de casos también lo han comprobado 3,6,13. Sin embargo, el control de la tomografía pulmonar al sexto día del TCZ mostró una discordancia con la clínica; había compromiso igual o más que al ingreso, optándose por el uso de corticoides, según lo reportado en otros estudios 3,13, pero que a la fecha son de uso controversial 15.
El uso de TCZ en el caso presentado, estuvo asociado a una evolución favorable en un paciente con COVID-19 severo. Durante el curso de su hospitalización no se observaron efectos adversos al fármaco, salvo la leucopenia que fue revertida.