Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.29 no.1 Lima ene./mar. 2018
http://dx.doi.org/10.15381/rivep.v29i1.14186
REVISIÓN DE LITERATURA
Revisión sobre aspectos farmacológicos a considerar para el uso de antibióticos en la camaronicultura
Review on pharmacological aspects to be considered for the use of antibiotics in shrimp farming
Alexander Varela-Mejías1,3, Ramsés Alfaro-Mora2,4
1 Laboratorio de Patologías y Parasitología de Crustáceos, Laboratorio externo adscrito al Servicio Nacional de Salud Animal, Costa Rica
2 Catedra de Química Medicinal, Escuela de Farmacia, Universidad Latina de Costa Rica, Costa Rica
3 E-mail: alexander.varela@gmail.com
4 E-mail: ramses.alfaro@ulatina.net
RESUMEN
La incidencia de enfermedades infecciosas en camarones ha incrementado el uso de antibióticos como parte de la respuesta de los productores, buscando reducir las pérdidas causadas por los brotes bacterianos. Estos tratamientos carecen, muchas veces, de los conocimientos sobre las propiedades farmacológicas de los productos. Se presentan por ello, datos referentes a estas propiedades para la oxitetraciclina en camarones, al ser uno de los antibióticos de mayor uso, además de datos sobre otros antibióticos.
Palabras clave: camarón; infecciones bacterianas; antibióticos; farmacología; resistencia; residuos
ABSTRACT
The incidence of infectious diseases in shrimp has increased the use of antibiotics as part of the response of producers, seeking to reduce losses caused by bacterial outbreaks. These treatments often lack knowledge concerning the pharmacological properties of the products. Data for these properties for oxytetracycline in shrimp are presented, being one of the most used antibiotics, in addition to data for other antibiotics.
Key words: shrimp; bacterial infections; antibiotics; pharmacology; resistance; residues
INTRODUCCIÓN
La producción acuícola mundial alcanzó 90.4 millones de toneladas en 2012, correspondiendo 66.6 millones de toneladas a especies comestibles, incluyendo la producción de camarones de cultivo. Esta última representó el 9.7%; es decir, 6.4 millones de toneladas (FAO, 2016; Morales y CuéllarÁnjel, 2014).
Datos más recientes indican que la oferta mundial per capita de peces y mariscos, incluyendo capturas y cultivos, alcanzó un máximo histórico de 20 kg en 2014, logrado gracias al intenso crecimiento de la acuicultura, que en la actualidad proporciona la mitad de todos los mariscos destinados al consumo humano (FAO, 2016).
Este incremento se debe en parte al cultivo de camarones, el cual ha logrado importantes niveles de producción. Se trata de animales ampliamente investigados, no solo por estar presentes en múltiples ambientes acuáticos, sino además, por su rol histórico e importancia en la nutrición humana. El grupo comprende al menos 14,750 especies, tanto marinas como dulceacuícolas, siendo en la actualidad el camarón blanco del Pacífico, Penaeus vannamei, el más cultivado a nivel mundial, especie perteneciente a la familia Penaeidae (Morales-Covarrubias, 2010; Vogt, 2012; Morales y Cuéllar-Ánjel; 2014; FAO, 2016).
Este tipo de producción acuícola, paralelo al incremento de su intensificación, ha dado lugar a una creciente incidencia e impacto de patologías. Las empresas y granjas camaroneras son constantemente afectadas por enfermedades infecciosas, causadas por diversos agentes etiológicos, incluyendo virus, bacterias, parásitos y hongos (Lightner, 1996; Bondad-Reantaso y McGladdery, 2001; Lightner y Pantoja, 2001; MoralesCovarrubias, 2010, 2103; Cuéllar-Ánjel et al., 2014; Peña y Varela, 2016).
Como es de esperar, en estos ambientes acuáticos coexisten habitualmente numerosas especies de bacterias, que son constituyentes de la microflora normal del agua, así como de los fondos de los estanques y de los camarones. Algunas de ellas son consideradas como patógenos facultativos u oportunistas. Como consecuencia de ello, las patologías bacterianas en el camarón son comúnmente causadas por especies propias de su ambiente acuático (Prieto y Rodríguez, 1993; Morales y Cuéllar-Ánjel; 2014).
Se han reportado múltiples especies bacterianas con niveles variables de virulencia asociadas a eventos patológicos en camarones, que incluyen tanto especies intracelulares como extracelulares. Este hecho, en muchos casos, se traduce en altas mortalidades (Frelier et al., 1992; Lightner, 1996; Martin et al., 2004; Aguirre-Guzmán et al., 2005; Morales-Covarrubias, 2010; Soto et al., 2010; Gomez-Gil et al., 2015; Morales-Covarrubias et al., 2015; OIE, 2016; Peña y Varela, 2016), generando efectos negativos en la productividad.
El impacto por infecciones bacterianas adquirió especial relevancia y gravedad desde 2009, donde se presentaron altas mortalidades de camarones en China, inicialmente idiopáticas, para demostrarse posteriormente que eran causadas por una cepa altamente patogénica de Vibrio parahaemolyticus, la cual es portadora de un plásmido toxigénico (Tran et al., 2013). Posteriormente se reportó, además, una cepa de V. harveyi en Vietnam como portadora del mismo plásmido (Kondo et al., 2015). Esta enfermedad se propagó a otros países de Asia (NACA, 2012; Tran et al., 2013; Cuéllar-Ángel et al., 2014;
Joshi et al., 2014; Pantoja y Lightner, 2014; Han et al., 2015a,b), causando grandes mortalidades en los camarones. La enfermedad pasó al continente americano, para ser reportada en México en 2013 (Nunan et al., 2014; Pantoja y Lightner, 2014; SotoRodríguez et al., 2015; Varela y Peña, 2016) y en Centroamérica (Jun et al., 2016; Shrimp News, 2015), siendo probable que continúe su dispersión hacia América del Sur.
Abordaje de las Infecciones Bacterianas
Como respuesta a la problemática bacterial, se ha incursionado en diferentes alternativas terapéuticas. Entre ellas, el uso de sustancias naturales, tales como extractos vegetales con propiedades antibacteriales (Villamar, 2000; Curiquén y González, 2006; Morales-Covarrubias, 2013; Peña et al., 2013), así como el uso de antibióticos adicionados al alimento (Prieto y Rodríguez, 1993; Lightner, 1996; Prescott et al., 2000; Errecalde, 2004; Prieto et al., 2005; Rodgers y Furones, 2009; Morales-Covarrubias, 2013; Han et al., 2015c).
Como ocurre con otras especies de producción, los antibióticos han sido utilizados para el tratamiento de animales enfermos, e incluso, cuando se considera necesario, para tratar animales asintomáticos que conviven con los enfermos, siendo esto un tratamiento de tipo grupal profiláctico (Errecalde, 2004). El uso de fármacos antimicrobianos ha dado resultados inconsistentes y erráticos, abriendo la puerta al desarrollo de resistencia por parte de las comunidades bacteriales (Prieto y Rodríguez, 1993; Errecalde, 2004; Santiago et al., 2009; Acar y Moulin, 2012; FloresMiranda et al., 2012; Han et al., 2015c).
La resistencia a los agentes antimicrobianos es un tema amplio y complejo, que está asociado a la capacidad de las bacterias de adaptarse a las condiciones ambientales. La resistencia es una herramienta natural de la que se sirven las bacterias para sobrevivir y reproducirse en el medio (Errecalde, 2004; García, 2004; Acar y Moulin, 2012; Martínez, 2012).
Cuando la causa de estas resistencias es genética, los genes que la confieren pueden transmitirse de un organismo a otro por mecanismos de transferencia horizontal, en el que pueden intervenir tres procesos: conjugación, transducción y transformación. De este modo, en cualquier ambiente, cuando las condiciones son propicias, pueden surgir bacterias resistentes (Errecalde, 2004; García, 2004; Acar y Moulin, 2012; MoralesCovarrubias, 2013; Han et al., 2015c). Por ejemplo, se ha reportado que la resistencia que generan las bacterias a las tetraciclinas se debe a una modificación enzimática codificada por transposones, pero el mecanismo de resistencia más común en bacterias Gram (+) es por expulsión activa (Santiago et al., 2009).
Ante ello, el uso de fármacos requiere de un abordaje cuidadoso, con el fin de no incurrir en la generación de nuevas resistencias. El hecho de que una gran variedad o cantidad de bacterias sea aislada de camarones enfermos, no significa necesariamente, que estas sean las causantes de la enfermedad. Para establecer esta causa-efecto se requiere demostrar la relación del agente con la patología presente, cumpliendo con los postulados de Koch. En estos casos, es necesario aislar el patógeno en el organismo enfermo, reproducirlo en un cultivo puro, replicar la enfermedad cuando es inoculado en organismos sanos y reaislar el patógeno de los organismos enfermos (García, 2004; GomezGil et al., 2015).
El tratamiento de las infecciones, así como el diseño de las terapias aplicables, deben estar respaldados por demostraciones firmes de las etiologías, así como de la susceptibilidad de las bacterias a los fármacos seleccionados, a las concentraciones requeridas y al tiempo de aplicación (Prieto y Rodríguez, 1993; Lightner, 1996; Errecalde, 2004; Han et al., 2015c). Las antibioterapias requieren establecer el agente causal, la respuesta a diferentes fármacos aprobados, la selección del óptimo, la determinación de la dosis, la duración del tratamiento y el cumplimiento del periodo de retiro necesario para le eliminación del fármaco de los tejidos; proceso que debe ser realizado por un profesional calificado (Morales-Covarrubias, 2013; Cuéllar-Ángel, 2014). Adicionalmente, dicha decisión debe considerar una serie de aspectos farmacológicos. La farmacodinámica y farmacocinética de los antibióticos en los organismos suele marcar la diferencia entre el éxito o el fracaso terapéutico. Los resultados in vitro no necesariamente se mantienen in vivo (Katzung et al., 2016). Los estudios farmacodinámicos y farmacocinéticos en camarones no son abundantes, y sus conclusiones deben acoplarse a los ensayos in vitro, principalmente los datos de concentraciones máximas logradas, tiempo medio, tiempos de eliminación y áreas bajo la curva obtenidos para administraciones orales o intra sinus.
Por ello, se presentan algunos resultados obtenidos de estudios que se han realizado para la oxitetraciclina (OTC) y otros antibióticos de uso en acuicultura. Se debe tener presente que estos fármacos no están necesariamente aprobados para uso acuícola en todos los países o regiones y, por lo tanto, se deben seguir los lineamientos y reglamentos legales locales para su uso.
Oxitetraciclina (OTC)
La oxitetraciclina es sintetizada por bacterias del género Streptomices. Es un antibiótico de amplio espectro cuyo uso en crustáceos no es nuevo. Se ha utilizado en aplicaciones orales para el tratamiento de infecciones por la bacteria Aerococcus viridans en la langosta Homarus americanus (Bayer y Daniel, 1987). También se usa en el tratamiento de infecciones causadas por especies Gram (-) y Gram (+), rickettsias, micoplasmas y otras (Santiago et al., 2009; MoralesCovarrubias, 2013; OIE, 2016). Ha sido recomendado en el tratamiento de infecciones por la bacteria Hepatobacter penaei, causante de la enfermedad de la hepatopancreatitis necrotizante (Lightner, 1996; Rodgers y Furones, 2009; MoralesCovarrubias et al., 2012; MoralesCovarrubias, 2013; Morales-Covarrubias y Gómez-Gil, 2014; OIE, 2016).
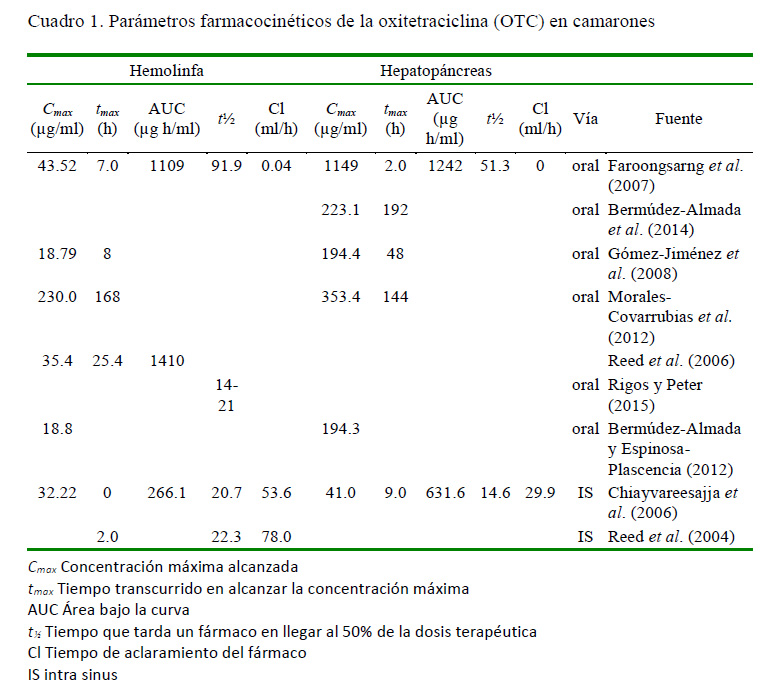
Su mecanismo de acción consiste en la inhibición de la síntesis proteica. La molécula se une a la subunidad ribosomal 30s, que impide la unión de la aminoacil-tRNA al complejo ribosomal de la bacteria; bloqueando así la incorporación de los aminoácidos y el crecimiento de la cadena polipeptídica (Santiago et al., 2009; Bermúdez-Almada y EspinosaPlascencia, 2012; Morales-Covarrubias, 2013; Katzung et al., 2016). En el Cuadro 1 se presentan los valores determinados para algunos parámetros farmacocinéticos, así como sus respectivas vías de aplicación y fuentes.
Gómez-Jiménez et al. (2008) reportaron, asimismo, que la concentración mínima inhibitoria (MIC) para 49 cepas de Vibrio sp para la OTC varió entre 0.1 y 12.5 ppm. Por su parte, Montoya y Reyes (2001) indican que la acumulación de la OTC en el músculo de camarones alcanza límites cercanos a las 16 ppm, no pudiendo ser aumentada, así se aumente la dosis de aplicación. Esto indica que la biodisponibilidad de este fármaco no es dosis-dependiente una vez lograda la C . Este dato concuerda con los resultados de Reed et al. (2004), quienes indican que los parámetros farmacocinéticos no varían significativamente con la dosis.
Se pueden inferir algunos datos importantes con base al Cuadro 1. Por ejemplo, la concentración máxima alcanzada, independientemente a la ruta de aplicación, es mayor en el hepatopáncreas que en la hemolinfa, indicando que este órgano acumula al fármaco. Asimismo, la vida media del antibiótico en el tejido hepatopancreático es también mayor que el determinado en la hemolinfa, siendo un antibiótico cuya efectividad está ligada al tiempo del área bajo la curva.
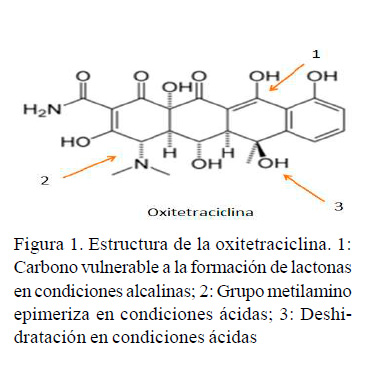
Debe destacarse que las condiciones del medio en que se utilice la oxitetraciclina juegan un papel de importancia en referencia a la estabilidad de la droga, ya que en situaciones de alcalinidad cabe la posibilidad de que se forme un metabolito de tipo lactona que es inactivo. Así mismo, los medios ácidos pueden llevar a la formación de subproductos en los que se den procesos de epimerización o deshidratación, capaces de inhabilitar la actividad farmacológica del antibiótico (ver Figura 1) (Delgado et al., 2003).
Se ha sugerido que la oxitetraciclina mejora la conversión alimenticia y actúa como promotora del crecimiento. Esto se supone que es debido a un mejor aprovechamiento de la síntesis de vitaminas, el adelgazamiento de la pared intestinal y el mejoramiento de la permeabilidad, con lo que también podría facilitar la absorción de los alimentos. Además, se propone que mejora la utilización del nitrógeno aumentando la biosíntesis de tejidos nitrogenados (Sumano y Ocampo, 2006).
La resistencia bacteriana hacia la familia de tetraciclinas se relaciona a tres mecanismos principales: la expresión de bombas de eflujo, la inactivación enzimática del antibiótico y la expresión de proteínas TET (del inglés ten-eleven translocation) de protección ribosomal, para las cuales existe reporte de 11 genes tet que codifican para estas proteínas, siendo las proteínas Tet (O) y Tet (M) las más estudiadas (Jara, 2007; Done et al, 2015).
Florfenicol (FFC)
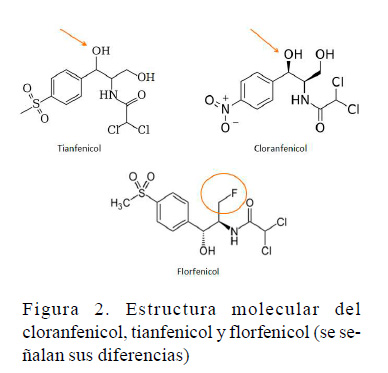
Antibiótico derivado del tiamfenicol. Incluye un grupo flúor en la posición del carbono 3, lo cual hace a este antibiótico menos
susceptible a la inactivación bacteriana por acetilación en el grupo hidroxilo, como si ocurre en el tieanfenicol o el cloranfenicol (ver Figura 2). Su efecto es considerado bacteriostático y de amplio espectro (Sumano y Ocampo, 2006; USP, 2007). El mecanismo de acción es por bloqueo de la subunidad ribosómica 50S dentro de las bacterias susceptibles, imposibilitando la acción de la peptidil trasferasa y, por ende, evitando la síntesis proteica adecuada. Su utilidad radica en la eficacia que posee para el tratamiento de Pasteurella piscicida, Aeromonas salmonicida, Vibrio anguillarum y Edwardsiella tarta.
Su estructura química es muy similar a la del cloranfenicol de uso humano, pero su uso no acarrea los efectos adversos a nivel hematológico de este último. Se ha determinado que presenta un 95% de biodisponibilidad, basada en datos de otras especies como el salmón, teniendo un excelente volumen de distribución que le permite una adecuada penetración en los tejidos. Al igual que otros antibióticos, se requiere llevar a cabo estudios adecuados de farmacocinética para predecir el comportamiento de la droga en el cuerpo de los crustáceos (USP, 2007; Santiago et al., 2009; Plumb, 2011).
La resistencia a este fármaco se puede atribuir a mecanismos de eflujo, como mutaciones a nivel ribosómica que impidan su correcto accionar (Hilal-Dandan y Bruton, 2014).
Ciprofloxacino (CIPRO)
Se trata de una fluoroquinolona y pertenece a la segunda generación de quinolonas. Su mecanismo de acción está enfocado en la inhibición de la ADN girasa y la Topoisomerasa IV en las bacterias. A través de esto consigue impedir una correcta expresión del material genético, así como repercutir sobre la capacidad de duplicación del ADN (Brugueras et al., 2005; Santiago et al., 2009; Lemke y Williams, 2013).
Su espectro de actividad es bastante amplio, ya que incluye bacterias Gram (-) aerobias y Gram (+), y algunos patógenos entéricos como Pseudomonas y Serratia marcescens. La actividad contra bacterias de tipo anaerobias es nula (Brugueras et al., 2005; Santiago et al., 2009).
Enrofloxacino (ENRO)
Es un fármaco que se desarrolló en la década de los ochenta para uso exclusivo en veterinaria. Es una pro-droga, ya que a través de un proceso metabólico de fase 1 sufre una desalquilación que lleva a la formación de CIPRO. Es así que su mecanismo de acción se asume idéntico e incluye el mismo espectro de actividad (Otero et al., 2001).
La principal variación entre estas dos drogas son los parámetros farmacocinéticos, ya que la biodisponibilidad de una pro-droga es mayor que la de su metabolito activo. A pesar de ello, los estudios cinéticos en camarones son escasos, siendo necesario para un mejor entendimiento del comportamiento de esta droga, así como la de su metabolito activo (Bent, 2006). Su uso es extra-etiqueta, lo cual genera la necesidad de una adecuada monitorización de residuos en el producto que llega a consumo humano (Soto-Rodríguez et al., 2006; Plumb, 2011).
Según muestra Soto-Rodríguez et al. (2006), el uso de enrofloxacino y florfenicol sobre larvas de Litopenaeus vannamei disminuye la carga bacteriana de Vibrio campbellii de forma significativa, teniendo una LD50 para enrofloxacino de 46.47 µg/ml y para floranfenicol de 32.42 µg/ml.
La resistencia a las fluorquinolonas por parte de las bacterias se relaciona con alteraciones en las enzimas diana, y se origina en mutaciones espontáneas de los genes gyrA y gyrB que codifican las subunidades de la ADN girasa y en los genes parC y parE que codifican las subunidades de la topoisomerasa IV. También se reporta en algunas Gram (-) la existencia de alteraciones en las porinas de entrada, debido a una disminución en su expresión. Además, puede existir sobreexpresión del gen norA, que codifica a la proteína de membrana que interviene en el mecanismo de eflujo activo de las fluorquinolonas y algunas otras drogas (Otero et al., 2001; Santiago et al., 2009; HilalDandan y Bruton, 2014).
Actualmente se reporta resistencia cruzada entre las fluorquinolonas usadas en animales y en aquellas de uso humano, lo cual es un aspecto de importancia para la Salud Pública (Otero et al., 2001).
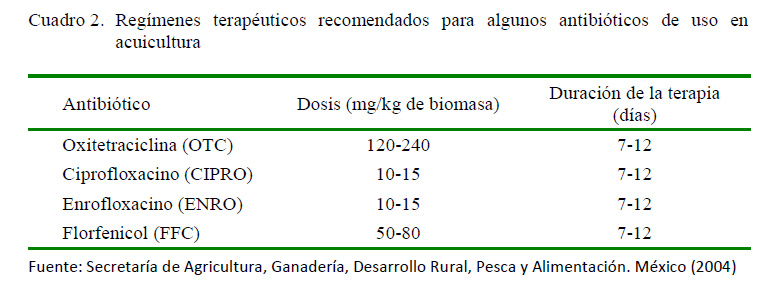
La utilización de antibióticos en camarones requiere del cumplimiento de condiciones que permitan obtener sus efectos terapéuticos, reduciendo los efectos indeseados, minimizando la generación de resistencias. Se han desarrollado algunas guías para su uso (Cuadro 2), donde se lista las dosis recomendadas para algunos de estos fármacos, que han demostrado su eficacia en brotes de enfermedades.
Reglas Básicas para el Manejo de Antibióticos en Camaronicultura
Se han publicado algunas reglas que marcan las pautas a seguir al momento de elegir un antibiótico y utilizarlo en camaronicultura (Chanratchakool et al., 1995). Dentro de estas normas básicas de usos se pueden enumerar las siguientes:
-
Antes de optar por aplicar terapias de antibióticos, deben mejorarse las condiciones del ambiente de los estanques en que se cultivan los animales.
-
La aplicación de antibióticos debe realizarse únicamente cuando sea indispensable, y de forma exclusiva ante infecciones bacterianas.
-
Se deben utilizar antibióticos a los cuales las bacterias implicadas sean sensibles, por lo cual es necesario realizar análisis previos de laboratorio.
-
Los antibióticos deben ser de reciente preparación, de fuentes de confianza y diseñados para uso en acuicultura.
-
Las dosis de antibióticos deben utilizarse cumpliendo con los días de aplicación recomendados para cada uno de ellos.
-
El tratamiento debe concluirse con suficiente tiempo de retiro antes de la cosecha, a fin de asegurar la eliminación de los antibióticos de los tejidos del camarón.
Residuos de Antibiótico en Productos de Consumo y su Impacto en la Salud Humana y Ambiental
La falta de estudios cinéticos pone en tela de juicio la cantidad de antibiótico que llega al consumidor, así como la cantidad que queda en el ambiente. Los límites máximos de residuos (MRL) son un marco de referencia que debe ser acatado en pro de garantizar la seguridad (Hernández, 2005).
La presencia de antibióticos en los alimentos puede conllevar a la aparición de cepas resistentes como consecuencia de una exposición a estos fármacos en dosis subterapéuticas. Es claro que la presión selectiva que se ejerce sobre los microorganismos presentes en la flora gastrointestinal humana puede llevar a la aparición de infecciones de difícil control, debido principalmente a la presencia de resistencia cruzada a los diferentes antibióticos de las categorías terapéuticas de uso en acuicultura, los cuales también son de uso humano (Hernández, 2005; Santiago et al., 2009).
En el estudio de Roque et al. (2001) se muestra a la OTC como el antibiótico con mayor resistencia por parte de bacterias del género Vibrio en producciones acuícolas en el noroeste del Pacífico mexicano. Otros estudios reportan la presencia de plásmidos de resistencia en cepas de Vibrio parahaemolyticus causantes de AHPND, aisladas en México (Han et al., 2015c).
El impacto a nivel ambiental también es un factor de interés, ya que parte de los antibióticos puede permanecer en el sedimento, ya sea porque no es consumido por el camarón o porque a pesar de ser ingerido, parte del mismo es eliminado sin cambio a través de las excretas (Capone et al., 1996). La acumulación de antibióticos en el sedimento es dependiente de las características del sustrato y las condiciones hidrográficas del medio. Existen estudios que demuestran que las concentraciones de OTC disminuyen conforme aumenta la profundidad, quedando mayores concentraciones a nivel de superficie (Samuelsen et al., 1992).
Un aspecto importante que debe señalarse es que la presencia de medios donde abunde una alta cantidad de cationes como Ca+2, Mg+2, Al+2 o Fe+3 puede llevar a la formación de quelatos en presencia de OTC y acomplejar a las quinolonas, llevando a la inactivación de las mismas o imposibilitando su correcta absorción por parte del crustáceo (Delgado et al., 2003; Sumano y Ocampo, 2006; Lemke y Williams, 2013; Hilal-Dandan y Bruton, 2014).
Sosa et al. (2013) indican que las metodologías utilizadas para la determinación de antibióticos en camarones deben ser específicas, sensibles, exactas, precisas, prácticas y rápidas. Las revisiones publicadas generalmente no siguen protocolos similares, lo que dificulta la comparación entre diseños experimentales y sus resultados. Las metodologías de aplicación, por ejemplo, utilizan rutas orales e intra sinus (Chiayvareesajja et al., 2006; Faroongsarng et al., 2007), lo que incrementa la dificultad de comparación.
CONCLUSIONES
- Existe la necesidad de estudios farmacocinéticos en camarón para establecer los tiempos correctos de uso de antibióticos, así como el retiro adecuado dependiendo del producto y su formulación.
- La aplicación de antibióticos debe ser supervisada por profesionales calificados, ya que se requiere una clara comprensión de los aspectos farmacodinámicos y farmacocinéticos implicados.
- Las terapias deben ser diseñadas de modo que se optimice su absorción y distribución.
- Los tiempos de retiro de los productos tratados deben ser estrictamente vigilados y cumplidos para evitar el ingreso de productos con residuos de antibióticos a las cadenas de distribución de consumo.
LITERATURA CITADA
1. Acar J, Moulin G. 2012. La resistencia a los agentes antimicrobianos, un tema complejo. Rev Sci Tech Off Int Epiz 31: 23-31. [ Links ]
2. Aguirre-Guzmán G, Ascencio F, Saulnier D. 2005. Pathogenicity of Vibrio penaeicida for white shrimp Litopenaeus vannamei: a cysteine protease-like exotoxin as a virulence factor. Dis Aquat Org 67: 201-207. doi: 10.3354/dao067201 [ Links ]
3. Bayer R, Daniel P. 1987. Safety and efficacy of oxytetracycline for control of gaffkemia in the American lobster (Homarus americanus). Fisheries Res 5: 71-81. doi: 10.1016/0165-7836(87)-90016-6 [ Links ]
4. Bent O. 2006. Pharmacokinetics of quinolones in fish: a review. Aquaculture 255: 55-75. doi: 10.1016/j.aquaculture.2005.12.008 [ Links ]
5. Bermúdez-Almada MC, EspinosaPlascencia A, Santiago-Hernández ML, Barajas-Borgo CJ, Acedo-Félix E. 2014. Comportamiento de oxitetraciclina en camarón de cultivo Litopenaeus vannamei y la sensibilidad a tres antibióticos de bacterias de Vibrio aisladas de los organismos. Biotecnia 16(3): 29-37. doi: 10.18633/bt.v16i3.138 [ Links ]
6. Bermúdez-Almada MC, EspinosaPlascencia A. 2012. The use of antibiotics in shrimp farming. In: Carvalho E, Silva G, Silva R (eds). Health and Environment in Aquaculture. Open Access: InTech. p 199-214. [ Links ]
7. Bondad-Reantaso MG, McGladdery SE. 2001. Asia diagnostic guide to aquatic animal diseases. FAO Fisheries Technical Paper No. 402/2. Rome: FAO. 240 p. [ Links ]
8. Brugueras M, Morejón M, Salup R. 2005. Actualidad de las quinolonas. Rev Cubana Farm 39: 1. [ Links ]
9. Capone D, Weston D, Miller V, Shoemaker C. 1996. Antibacterial residues in marine sediments and invertebrates following chemotherapy in aquaculture. Aquaculture 145: 55-75. [ Links ]
10. Chanratchakool P, Turnbull JF, Funge-Smith S, Limsuwan C. 1995. Health management in shrimp ponds. 2nd ed. Bangkok: Aquatic Animal Health Research Institute. 111 p. [ Links ]
11. Chiayvareesajja S, Chandumpai A, Theapparat Y, Faroongsarng D. 2006. The complete analysis of oxytetracycline pharmacokinetics in farmed Pacific white shrimp (Litopenaeus vannamei). J Vet Pharmacol Ther 29: 409-414. doi: 10.1111/j.1365-2885.2006.00785.x [ Links ]
12. Cuéllar-Ángel, J. 2014. Métodos para el diagnóstico de enfermedades en camarones Penaeidos. En: Morales V, Cuéllar-Ánjel J (eds). Guía técnica–Patología e inmunología de camarones Penaeidos. Panamá: OIRSA. p 21-96. [ Links ]
13. Cuéllar-Ánjel J, Morales V, Lara C, García O. 2014. Buenas prácticas y bioseguridad para el cultivo del camarón blanco Penaeus (Litopenaeus) vannamei (Boone, 1931) En: Morales V, Cuéllar-Ánjel J (eds). 2014. Guía técnica – Patología e inmunología de camarones Penaeidos. Panamá: OIRSA. p 331-360. [ Links ]
14. Curiquén E, González H. 2006. Uso de manano oligosacáridos como una alternativa a los antibióticos. Circular de Extensión Técnico Ganadera 32: 41-50. [ Links ]
15. Delgado A, Miguillón C, Joglar J. 2003. Introducción a la química terapéutica. 2 ° ed. España: Diaz de Santos. 536 p. [ Links ]
16. Done H, Venkatesan A, Halden R. 2015. Does the recent growth of aquaculture create antibiotic resistence threats different from those associated with land animal production in agriculture? AAPS J 17: 513-524. doi: 10.1208/s12248-015-9722-z [ Links ]
17. Errecalde JO. 2004. Estudio: uso de antimicrobianos en animales de consumo. Incidencia del desarrollo de resistencias en la salud pública. Roma, Italia: FAO. 61 p. [ Links ]
18. [FAO] Organización de las Naciones Unidas para la Alimentación y la Agricultura. 2016. El estado mundial de pesca y la acuicultura. Departamento de Pesca y Acuicultura. Contribución a la seguridad alimentaria y la nutrición para todos. Roma. Italia. 224 pp [ Links ]
19. Faroongsarng D, Chandumpai A, Chiayvareesajja S, Theapparat Y. 2007. Bioavailability and absorption analysis of oxytetracycline orally administered to the standardized moulting farmed Pacific white shrimps (Penaeus vannamei). Aquaculture 269: 89-97. doi: 10.1016/j.aquaculture.2007.04.019 [ Links ]
20. Flores-Miranda B, EspinosaPlascencia A, Gómez-Jiménez S, López-Zavala A, González-Carrillo H, Bermúdez-Almada C. 2012. Accumulation and elimination of enrofloxacin and ciprofloxacin in tissues of shrimp Litopenaeus vannamei under laboratory and farm conditions. ISRN Pharm 2012: 374212. doi: 10.5402/2012/374212 [ Links ]
21. Frelier PF, Sis RF, Bell TA, Lewis DH. 1992. Microscopic and ultrastructural studies of necrotizing hepatopancreatitis in Pacific white shrimp (Penaeus vannamei) cultured in Texas. Vet Pathol 29: 269-277. doi: 10.1177/030098589-202900401 [ Links ]
22. García V. 2004. Introducción a la microbiología. 2ª ed. San José, Costa Rica: EUNED. 240 p. [ Links ]
23. Gomez-Gil B, Roque A, SotoRodríguez S. 2015. Vibriosis en camarones y su diagnóstico. En: Ruiz-Luna A, Berlanga-Robles C, Betancourt-Lozano M (eds). Avances en acuicultura y manejo ambiental. México. p 137-150. [ Links ]
24. Gómez-Jiménez S, EspinosaPlascencia A, Valenzuela-Villa F, Bermúdez-Almada MC. 2008. Oxytetracycline (OTC) accumulation and elimination in hemolymph, muscle and hepatopancreas of white shrimp Litopenaeus vannamei following an OTCfeed therapeutic treatment. Aquaculture 274: 24-29. doi: 10.1016/j.aquaculture.2007.11.017 [ Links ]
25. Han J, Mohney L, Tang K, Pantoja C, Lightner DV. 2015c. Plasmid mediated tetracycline resistance of Vibrio parahaemolyticus associated with acute hepatopancreatic necrosis disease (AHPND) in shrimps. Aquaculture Rep 2: 17-21. doi: 10.1016/j.aqrep.-2015.04.003 [ Links ]
26. Han J, Tang K, Lightner DV. 2015a. Genotyping of virulence plasmid from Vibrio parahaemolyticus isolates causing acute hepatopancreatic necrosis disease in shrimp. Dis Aquat Organ 115: 245-251. doi: 10.3354/dao02906 [ Links ]
27. Han JE, Tang K, Tran L, Lightner DV. 2015b. Photorhabdus insect-related (Pir) toxin-like genes in a plasmid of Vibrio parahaemolyticus, the causative agent of acute hepatopancreatic necrosis disease (AHPND) of shrimp. Dis Aquat Organ 113: 33-40. doi: 10.3354/dao02830 [ Links ]
28. Hernández P. 2005. Responsible use of antibiotics in aquaculture. Fisheries Technical Paper 469. Rome, Italy; FAO. 97 p. [ Links ]
29. Hilal-Dandan R, Bruton L. 2014. Goodman y Gilman Manual de farmacología y terapéutica. 2° ed. México: McGraw-Hill. 1270 p. [ Links ]
30. Jara M. 2007. Tetraciclinas: un modelo de resistencia antimicrobiana. Av Cienc Vet 22: 49-55. [ Links ]
31. Joshi J, Srisala J, Truong VH, Chen IT, Nuangsaeng B, Suthienkul O, Lo CF, et al. 2014. Variation in Vibrio parahaemolyticus isolates from a single Thai shrimp farm experiencing an outbreak 32. of acute hepatopancreatic necrosis disease (AHPND). Aquaculture 428-429: 297-302. doi: 10.1016/ j.aquaculture.2014.03.030 [ Links ]
32. Jun JW, Han JE, Tang K, Lightner DV. Kim J. Seo SW, Park SC. 2016. Potential application of bacteriophage pVp-1: agent combating Vibrio parahaemolyticus strains associated with acute hepatopancreatic necrosis disease (AHPND) in shrimp. Aquaculture 457: 100-103. doi: 10.1016/j.aquaculture.2016.02.018 [ Links ]
33. Katzung B, Brunton L, Hernández A. 2016. Farmacología general. México: McGraw-Hill. 1678 p. [ Links ]
34. Kondo H, Van PT, Dang LT, Hirono 2015. Draft genome sequence of nonVibrio parahaemolyticus acute hepatopancreatic necrosis disease strain KC13.17.5, isolated from diseased shrimp in Vietnam. Genome Announc 3(5): e00978-15. doi: 10.1128/genomeA.00978-15 [ Links ]
35. Lemke T, Williams D. 2013. FOYE´S Principles of medicinal chemistry. 7th ed. Philadelphia, USA: Lippincott Williams and Wilkins. 1500 p. [ Links ]
36. Lightner DV, Pantoja C. 2001. Manual para el diagnóstico de enfermedades del camarón. United States Department of Agriculture Programa de Reconstrucción Huracán Mitch. USDA/CSREES/ USAID/UAZ). 92 p. [ Links ]
37. Lightner DV. 1996. A handbook of shrimp pathology and diagnostic procedures for diseases of cultured penaeid shrimp. Baton Rouge, Louisiana, USA: World Aquaculture Society. 304 p. [ Links ]
38. Martin G, Rubin N, Swanson E. 2004. Vibrio parahaemolyticus and V. harveyi cause detachment of the epithelium from the midgut trunk of the penaeid shrimp Sicyonia ingentis. Dis Aquat Org 60: 21-29. doi: 10.3354/dao060021 [ Links ]
39. Martínez JL. 2012. Natural antibiotic resistance and contamination by antibiotic resistance determinants: the two ages in the evolution of resistance to antimicrobials. Front Microbiol 3: 1. doi: 10.3389/fmicb.2012.00001 [ Links ]
40. Montoya N, Reyes E. 2001. Acumulación/eliminación de oxitetraciclina en camarón blanco Litopenaeus vannamei y su residualidad en dietas artificiales. En: VI Congreso Ecuatoriano de acuicultura. Ecuador. [ Links ]
41. Morales V, Cuéllar-Ánjel J (eds). 2014. Guía técnica – Patología e inmunología de camarones Penaeidos. Panamá: OIRSA. 382 p. [ Links ]
42. Morales-Covarrubias MS, CuéllarÁnjel J, Varela-Mejías A, ElizondoOvares C. 2015. Principales enfermedades bacterianas de camarones en Latinoamérica. En: FAO-OIRSA Seminario-Taller 1, EMS/AHPND Reducción y gestión del riesgo de la enfermedad de la necrosis aguda del hepatopáncreas (AHPND) en cultivos de camarones. Panamá [ Links ].
43. Morales-Covarrubias MS, Gómez-Gil B. 2014. Enfermedades bacterianas de camarones. En: Morales V, Cuéllar-Ánjel J (eds). 2014. Guía técnica Patología e inmunología de camarones Penaeidos. Panamá: OIRSA. p 167-194. [ Links ]
44. Morales-Covarrubias MS, TlahuelVargas L, Martínez-Rodríguez IE, Lozano-Olvera R, Palacios-Arriaga JM. 2012. Necrotising hepatobacterium (NHPB) infection in Penaeus vannamei with florfenicol and oxytetracycline: a comparative experimental study. Rev Científ FCV-LUZ 22: 72-80. [ Links ]
45. Morales-Covarrubias MS. 2010. Enfermedades del camarón: detección mediante análisis en fresco e histopatología. México: Ed Trillas. 180 p. [ Links ]
46. Morales-Covarrubias MS. 2013. Camaronicultura en aguas de baja salinidad. México: Ed Trillas. 136 p. [ Links ]
47. [NACA] Network of Aquaculture Centers in Asia-Pacific. 2012. Regional Consultation on the Emerging Shrimp Disease: Early Mortality Syndrome (EMS) / Acute Hepatopancreatic Necrosis Syndrome (AHPNS). [Internet]. Available in: https://enaca.org/?id=719 [ Links ]
48. Nunan L, Lightner DV, Pantoja C, Gómez-Jiménez S. 2014. Detection of acute hepatopancreatic necrosis disease (AHPND) in Mexico. Dis Aquat Org 111: 81-86. doi: 10.3354/dao02776 [ Links ]
49. [OIE] Organización Mundial de Sanidad Animal. 2016. Manual de diagnóstico en animales acuáticos. Paris, Francia. [Internet]. Disponible en: http://www.oie.int/es/normas-internacionales/ manual-acuatico/ [ Links ]
50. Otero J, Mestorino N, Errecalde J. 2001. Enrofloxacina: una fluorquinolona de uso exclusivo en veterinaria parte I: química, mecanismo de acción, actividad antimicrobiana y resistencia bacteriana. Analecta Vet 21: 31-41. [ Links ]
51. Pantoja C, Lightner DV. 2014. EMS/ AHPND descripción de la enfermedad en Asia y América. P.172-177. En: Morales V, Cuéllar-Ánjel J (eds). 2014. Guía técnica Patología e inmunología de camarones Penaeidos. Panamá: OIRSA. [ Links ]
52. Peña N, Varela A. 2016. Prevalencia de las principales enfermedades infecciosas en el camarón blanco Penaeus vannamei cultivado en el Golfo de Nicoya, Costa Rica. Rev Biol Mar Oceanogr 51: 553-564. doi: 10.4067/ S0718-19572016000300007 [ Links ]
53. Peña N, Vargas R, Varela A. 2013. Productos naturales como estimuladores del sistema inmunológico de Litopenaeus vannamei, infectado con Vibrio parahaemolyticus. Agron Mesoam 24: 133-147. [ Links ]
54. Plumb D. 2011. Veterinary drug handbook. 7th ed. Iowa, USA: WileyBlackwell. 1187 p. [ Links ]
55. Prescott JF, Baggott JD, Walker RD. 2000. Terapia antimicrobiana en medicina veterinaria. 3a ed. Iowa State University: Blackwell Publishing. 812 p. [ Links ]
56. Prieto A, Auro A, Fernández A, Pérez MB. 2005. El empleo de medicina natural en el control de enfermedades de organismos acuáticos y potencialidades de uso en Cuba y México. Tip Rev Esp Cienc Quím Biol 8: 38-49. [ Links ]
57. Prieto A, Rodríguez MC. 1993. Diagnóstico y control de enfermedades bacterianas en camarón de cultivo. Roma, Italia: FAO. 66 p. [ Links ]
58. Reed LA, Siewick TC, Shah JC. 2004. Pharmacokinetics of oxytetracycline in the white shrimp, Litopenaeus setiferus. Aquaculture 232: 11-28. doi: 10.1016/S0044-8486(03)00451-4 [ Links ]
59. Reed LA, Siewick TC, Shah JC. 2006. The biopharmaceutics and oral bioavailability of two forms of oxytetracycline to the white shrimp, Litopenaeus setiferus. Aquaculture 258: 42-54. doi: 10.1016/j.aquaculture.2006.03.029 [ Links ]
60. Rigos G, Peter S. 2015. A critical approach on pharmacokinetics, pharmacodynamics, dose optimization and withdrawal times of oxytetracycline in aquaculture. Rev Aquaculture 7: 77106. doi: 10.1111/raq.12055 [ Links ]
61. Rodgers CJ, Furones MD. 2009. Antimicrobial agents in aquaculture: practice, needs and issues. In: Rogers C, Basurco B (eds). The use of veterinary drugs and vaccines in Mediterranean aquaculture. Zaragoza: CIHEAM. p. 41-59. [ Links ]
62. Roque A, Molina AA, Bolán MC, Gomez GB. 2001. In vitro susceptibility to 15 antibiotics of vibrios isolated from penaeid shrimps in Northwestern Mexico. Int J Antimicrob Agents 17: 383–387. [ Links ]
63. Samuelsen O, Torsvick V, Ervick A. 1992. Long-range change in oxytetracycline concentration and bacterial resistance toward oxytetracycline in fish farm sediment after medication. Sci Total Environ 114: 2536. doi: 10.1016/0048-9697(92)90411-K [ Links ]
64. Santiago M, Espinosa A, Bermúdez M. 2009. Uso de antibióticos en la camaronicultura. Rev Mex Cienc Farmac 40: 22-32. [ Links ]
65. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. 2004. Norma Oficial Mexicana de Emergencia NOM-EM-006-PESC2004. México. [ Links ]
66. Shrimp News International. 2015. Belize recovers from EMS. [Internet]. Disponible en: https://www.shrimpnews.com/FreeReportsFolder/NewsReportsFolder/MexicoAndBelizeElNinoAndEMS.html [ Links ]
67. Sosa D, Escobar A, Faure R. 2013. Empleo de la oxitetraciclina en el cultivo del camarón con énfasis en la especie Litopaneaus.vannamei y alternativas que favorecen la disminución o sustitución de su aplicación. REDVET 14(7). [Internet]. Disponible en: http://www.veterinaria.org/revistas/redvet/n070713/071309.pdf [ Links ]
68. Soto SA, Gómez-Gil B, Lozano R. 2010. ‘Bright-red’ syndrome in Pacific white shrimp Litopenaeus vannamei is caused by Vibrio harveyi. Dis Aquat Org 92: 11-19. doi: 10.3354/dao02274
69. Soto-Rodríguez S, Armenta M, Gomez-Gil B. 2006. Effects of enrofloxacin and florfenicol on survival and bacterial population in an experimental infection with luminescent Vibrio campbellii in shrimp larvae of Litopenaeus vannamei. Aquaculture 255: 48-54. doi: 10.1016/j.aquaculture.2005.11.035 [ Links ]
70. Soto-Rodríguez SA, Gomez-Gil B, Lozano-Olvera R, Betancourt-Lozano M, Morales-Covarrubias MS. 2015. Field and experimental evidence of Vibrio parahaemolyticus as the causative agent of acute hepatopancreatic necrosis disease of cultured shrimp (Litopenaeus vannamei) in northwestern Mexico. Appl Environ Microbiol 81: 1689-1699. doi: 10.1128/AEM.03610-14 [ Links ]
71. Sumano H, Ocampo L. 2006. Farmacología veterinaria. 3° ed. México. McGraw-Hill. 1082 p. [ Links ]
72. Tran L, Nunan L, Redman R, Mohney L, Pantoja C, Fitzsimmons K, Lightner DV. 2013. Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp. Dis Aquat Organ 105: 45-55. doi: 10.3354/dao02621 [ Links ]
73. [USP] The United States Pharmacopeia Convention. 2007. Veterinary Monographs Florfenicol: Veterinary-Systemic. Port City Press. Baltimore, USA. [Internet]. Available in: http://www.aavpt.org/?48 [ Links ]
74. Varela A, Peña N. 2016. Histopatología diferencial de tres enfermedades bacteria-nas que afectan el hepatopáncreas de camarones peneidos. Rev Agron Mesoam 27: 73-80. doi: 10.15517/am.v27i1.21887 [ Links ]
75. Villamar CA. 2000. Acuicultura orgánica-ecológica: aplicación de productos naturales en sustitución de químicos en los procesos de cría de camarones en cautiverio. AquaTIC 10: 27-30. [ Links ]
76. Vogt G. 2012. Ageing and longevity in the Decapoda (Crustacea): a review. J Comp Zool 251: 1-25. doi: 10.1016/ j.jcz.2011.05.003 [ Links ]
Recibido: 15 de mayo de 2017
Aceptado para publicación: 12 de octubre de 2017