Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta Médica Peruana
versión On-line ISSN 1728-5917
Acta méd. peruana v.28 n.1 Lima ene./mar. 2011
Artículo de revisión
Disturbios del estado ácido-básico en el paciente crítico
Acid-base disturbances in critically ill patients
Mónica Meza García1
1 Médico especialista en Medicina Intensiva. Magíster en Gerencia de Servicios de Salud. Profesora invitada de la Universidad Peruana Cayetano Heredia (UPCH). Jefa del Servicio de Cuidados Intensivos del Hospital Nacional Cayetano Heredia (HNCH). Miembro Titular de la Sociedad Peruana de Medicina Intensiva (SOPEMI). Instructora acreditada del curso Fundamental Critical Care Support (FCCS) de la Society of Critical Care Medicine (SCCM).
RESUMEN
El entendimiento actual de la fisiología ácido-base considera que todos los cambios en la sangre, en el pH, en la salud y en la enfermedad ocurren a través de cambios en 3 variables: (a) Dióxido de carbono (CO2), (b) concentración relativa de electrolitos y (c) concentración de ácidos débiles. Los disturbios del medio interno y ácido-base generan alteraciones a 3 niveles: a) Daño directo del disturbio a nivel multiorgánico (b) Respuesta compensatoria ante el disturbio generado que puede ser adecuada o incompleta (c) Alteración funcional de la células del sistema inmune. Clásicamente se emplea la ecuación Henderson-Hasselbalch para la clasificación de los desórdenes acido-base en respiratorio (CO2 anormal) y metabólico (Bicarbonato anormal) y el cálculo del anión gap pero esta última ecuación de equilibrio asume una concentración de albúmina y fosfato muy cerca a lo normal, condición que no aplica necesariamente en la mayoría de los pacientes críticos por lo que el anión gap debe ser corregido. El modelo de Stewart propone que el pH varía en función a 3 variables independientes: la diferencia de iones fuertes (DIF), Ácidos débiles no volátiles (Atot) y pCO2. Así el mérito de esta aproximación es fusionar el estado ácido-base con los cambios en los electrolitos en una misma interpretación.
El tratamiento de los disturbios ácido-base en el paciente crítico se centra en la detección precoz de los mismos mediante un enfoque integral que involucre tanto la teoría clásica como la teoría de Stewart de manera que se logre obtener el manejo de la causa de fondo.
Palabras clave: Acidosis, Alcalosis, Concentración de Iones de Hidrógeno.
ABSTRACT
The current understanding of acid-base physiology states that all changes in the blood, pH, as well as variations in a healthy state and during disease occur through changes in 3 variables: (a) Carbon dioxide (CO2), (b) electrolyte relative concentration, and (c) weak acid concentration. Internal milieu and acid-base disturbances generate alterations in three areas: a) direct damage in multiple organs and systems, (b) a compensatory response to the disturbance, which may be suitable or incomplete, and (c) functional alterations in immune cells. The classically used Henderson-Hasselbalch equation for the classification of acid-base disorders in respiratory (abnormal CO2) and metabolic (abnormal bicarbonate) and for the anion gap calculation, but this equilibrium equation assumes that albumin and phosphate concentrations are very close to normal, a condition that is not necessarily certain in most critically ill patients, so the anion gap must be corrected. The Stewarts model proposes that pH varies according to 3 independent variables: the strong ion difference (DIF), non-volatile weak acids (Atot), and pCO2. Consequently, the merit of this approach is to merge acid-base status and electrolyte changes in a single interpretation. Therapy of acid-base disturbances in critically ill patients is focused on early detection of such conditions, using a comprehensive approach involving both the classical theory and Stewarts theory so that adequate management of the underlying condition may be achieved.
Key words: Acidosis, alcalosis, hydrogen-ion concentration.
DEFINICIÓN DE TÉRMINOS
pH: Potencial de hidrógeno. Medida convencional que permite expresar la concentración de iones hidrógeno de manera simplificada, consiste en obtener el log de la inversa de la concentración de iones hidrógeno, la cual es 0,00004 meq/lt = 40 neq/lt, entonces pH= 7,40. El pH varía según el fluido corporal analizado, así el valor de 7,40 corresponde a sangre arterial, pH= 7,35 a sangre venosa, pH= 6,0-7,4 líquido intracelular, pH = 4,5 a 8,0 a nivel urinario. El pH arterial varía de 7,35 a 7,45, el pCO2 varía de 35 a 45 mmHg.
Ácido: Una sustancia es ácida cuando al añadirla a una solución esta genera un incremento en la concentración de hidrogeniones y todas las otras variables independientes en la solución permanecen constantes. El concepto de ácido como dador de protones puede mal interpretarse pues consideraría que sólo añadiendo iones hidrógeno se generaría una sustancia ácida.
Base: Una sustancia es base cuando al añadirla a una solución esta genera una disminución en la concentración de iones hidrógeno y todas las otras variables independientes son constantes.
Electrolitos o iones fuertes: Sustancias que están siempre completamente disociadas en una solución. La mayoría de los iones fuertes en las soluciones biológicas son Na+, K+, Cl-, Mg+2, S04-2, Ca+2 y unos cuantos aniones ácidos orgánicos como el lactato.
Electrolitos o iones débiles: Sustancias que están parcialmente disociadas cuando son disueltos en agua. Para propósitos biológicos cualquier sustancia cuya disociación constante es mayor de 10-4 Eq/lt funcionará como un electrolito fuerte en soluciones biológicas y cualquiera con una disociación constante menor de 10-12 Eq/lt no se comporta como electrolito efectivo. Así cualquier sustancia que se encuentre entre estos extremos es un electrolito débil.
Principio de electroneutralidad: En cualquier solución acuosa macroscópica la suma de la concentración de iones cargados positivamente siempre será igual a la suma de la concentración de los iones cargados negativamente.
Principio de conservación de masa: La cantidad de cada sustancia en una solución acuosa permanece constante a menos que cumpla con alguna de las siguientes condiciones: Condición 1: La sustancia es añadida o removida de la solución Condición 2: La sustancia es generada o destruida por reacciones químicas dentro de la solución. La clásica teoría ácido-base considera que sólo la condición 1 aplica para los iones hidrógeno.
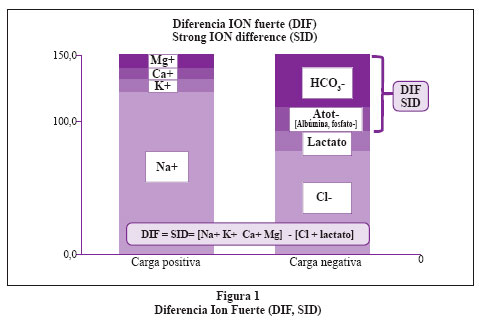
DIF: Diferencia de iones fuertes o diferencia de electrolitos fuertes, sus siglas en inglés es SID= Strong ion difference. Su valor normal es de 42 meq/lt en plasma normal.
SIG: Siglas en inglés de Strong Ion Gap. Se calcula restando del SID el nivel de albúmina y bicarbonato.
Toma de muestra correcta: Para la correcta interpretación ácido-base se debe considerar que una vez tomada la muestra de sangre debe ser analizada en tiempo real debido a que el pCO2 aumenta 3 a 10 mm Hg/hora generando una modesta caída en el pH. El pO2 permanece estable por 1 ó 2 horas esto en muestra conservada en hielo. Una excesiva cantidad de heparina también puede afectar una interpretación correcta de la muestra al generar pseudo-acidosis por neutralizar el bicarbonato. El pH y el pCO2 son medidos directamente por el equipo analizador de gases arteriales, mientras que el bicarbonato es calculado usando un nomograma derivado de la ecuación Henderson – Hasselbalch.
IMPACTO DEL TRASTORNO ÁCIDO-BASE EN EL PACIENTE CRÍTICO
El entendimiento de la fisiología ácido-base actualmente introduce la aplicación de principios físicos y químicos de soluciones acuosas hasta el plasma sanguíneo y sus diferentes componentes. Todos los cambios en la sangre, en el pH, en la salud y en la enfermedad ocurren a través de cambios en 3 variables: (a) Dióxido de carbono (CO2), (b) concentración relativa de electrolitos y (c) concentración de ácidos débiles1.
En el contexto de un paciente en estado crítico los desórdenes del medio interno y ácido base pueden desarrollarse rápidamente y no admiten retardos en su reconocimiento ni en su manejo por sus consecuencias, las cuales se manifiestan a 3 niveles: (a) Daño directo del disturbio a nivel multiorgánico expresado como edema cerebral, convulsiones, disminución de la contractilidad miocárdica, arritmias cardiacas, vasoconstricción pulmonar y vasodilatación sistémica. Este daño es generado por alteración en la función de proteínas de los órganos y tejidos (b) Respuesta compensatoria generada ante el disturbio, como agotamiento respiratorio e insuficiencia respiratoria secundaria a incremento del volumen minuto asociado a derivación del flujo sanguíneo de órganos vitales hacia los músculos respiratorios lo que genera daño de estos órganos y (c) Alteración funcional de la células del sistema inmune promoviendo la inflamación como ocurre en la acidosis hiperclorémica2.
El impacto más negativo sobre el organismo lo tenemos con la acidemia severa, así con un pH < 7,20 podemos tener3:
Trastorno cardiovascular: alteración de la contractilidad miocárdica, dilatación arteriolar, venoconstricción, incremento de la resistencia vascular pulmonar, reducción del gasto cardiaco, sensibilización para arritmias de entrada, reducción del umbral para fibrilación ventricular y atenuación de la respuesta a catecolaminas.
Trastorno respiratorio: disminución de la fuerza de los músculos respiratorios lo que lleva a fatiga de los mismos, disnea, hiperventilación.
Trastorno metabólico: resistencia a la insulina, hiperkalemia, reducción de la síntesis de ATP.
Trastorno neurológico: inhibición del metabolismo y regulación del volumen celular.
El impacto de la alcalemia también es importante y consiste en:
Trastorno metabólico: disminuye el potasio (0,5 mEq/L por cada 0,1 de aumento en el pH). Disminuye el calcio ionizado y el magnesio de 4 a 8% por cada 0,1 de aumento en el pH.
Trastorno neurológico: inhibición del sistema simpático, irritabilidad neuromuscular.
Trastorno respiratorio: reduce la disponibilidad de oxígeno en un 10% por cada aumento de 0,1 en el pH. Esto por el incremento de afinidad a la hemoglobina y desplazamiento de la curva de saturación de hemoglobina hacia la izquierda.
Trastorno cardiovascular: Predisposición a arritmias probablemente en relación a los trastornos metabólicos y también predisposición a isquemia miocárdica por los trastornos respiratorios.
INTERPRETACIÓN DEL ESTADO ÁCIDO-BASE DEL PACIENTE CRÍTICO
Clásicamente se emplea la ecuación Henderson- Hasselbalch para la clasificación de los desórdenes ácido-base en respiratorio (CO2 anormal) y metabólico (bicarbonato anormal) y define además una serie de cambios compensatorios, propiciando la utilización de reglas como el exceso de base para cuantificar la magnitud de la anormalidad. Finalmente emplea un método de equilibrio de carga limitado denominadoanión gap para definir el diagnóstico diferencial cuando en realidad el anión gap asume una concentración de albúmina y fosfato muy cerca a lo normal, condición que no necesariamente se aplica en la mayoría de los pacientes críticos por lo que el anión gap debe ser corregido. Así, por la disminución de cada gramo de albúmina el anión gap se reduce en 2,5 a 3 mmol.4,5
1. Evaluación de la concentración del ión hidrógeno:
(a) Generación y excreción de ion H+: Cada día 15 000 mmoles de CO2 son producidos por el metabolismo endógeno y luego excretados por el pulmón. De manera semejante la dieta normal produce de 50 a 100 mEq de H+ por día, estos iones son amortiguados por el HCO3-, el buffer celular y óseo para minimizar la caída del pH extracelular. El balance es restaurado por la excreción urinaria de H+.
(b) Exceso de base (EB): Es un número que cuantifica la anormalidad metabólica y que permitiría corregir el pH ajustando el pCO2 a 40 mmHg, permitiendo una comparación con el HCO3- corregido. Un EB negativo significa que el almacenamiento de HCO3- está depletado. El cálculo de EB es especialmente de ayuda cuando el HCO3- observado es cercano al nivel normal. A desviaciones más extremas el cálculo es improbable que genere más datos.
EB= HCO3- + 10(pH-7,4) - 24.
(c) Relación HC03-/ [0,03*PC02]: Para mantener el pH en 7,40 la relación debe ser de 20:1.
(d) Rol de electrolitos en el balance ácido-base: De acuerdo al principio de electroneutralidad en los fluidos corporales el número de cargas positivas y negativas debe ser igual. Así los cationes séricos [sodio + potasio + calcio + magnesio] deben igualarse a los aniones [cloro + bicarbonato + proteínas + sulfato + fostato + aniones ácidos orgánicos]. Este balance entre electrolitos influye en el estado ácido-base y constituye el Enfoque Stewart. La evaluación del estado ácido-base sin valorar el contexto clínico y los electrolitos es incompleta de ahí la importancia de efectuarla como análisis complementario al clásico.
2. Acidosis metabólica: Existen 4 mecanismos para su generación: (a) consumo de bicarbonato por excreción disminuida de iones H+; (b) consumo de bicarbonato por producción de H+ incrementada; (c) pérdida de producción de HCO3- y (d) dilución de bicarbonato. En todo paciente con este trastorno debe medirse el anion gap para tipificar la acidosis.
3. Anión Gap: Brecha existente entre la concentración de cationes y aniones séricos medidos. Se basa en el principio de electroneutralidad.
AG = Na+ – [HCO3- + Cl-]. Su valor normal es de 8 a 12 mmol/lt, pero es dependiente del tipo de analizador usado. Si AG > 25 entonces una acidosis orgánica está casi siempre presente. (Tabla 1).
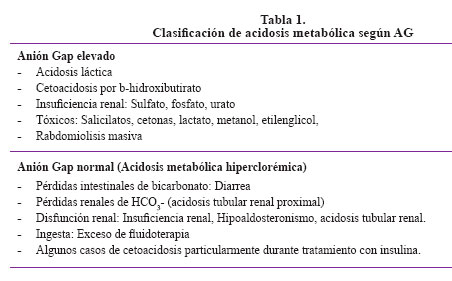
4. Acidosis láctica: Es la causa más común de AG elevado. Existen 2 tipos:
Tipo A: Por hipoperfusión, envenenamiento con monóxido de carbono y enfermedad pulmonar, generando hipoxia hística. Ocurre por alteración de la cadena oxidativa mitocondrial que no regenera NAD+. Se inhibe la glucogénesis. Tiene una mortalidad elevada hasta del 80%.
Tipo B: A su vez puede ser de tres tipos: B1 = Relacionada con trastornos sistémicos graves como falla hepática, diabetes mellitus, neoplasias, convulsiones, sepsis severa; B2 = Relacionada con fármacos o toxinas: biguanidas, nutrición parenteral (por presencia de fructuosa, sorbitol), etanol, uso de salicilatos, metanol y etilenglicol, uso de catecolaminas sobre todo adrenalina por incrementar la glucólisis hepática y B3 = Relacionada con errores congénitos del metabolismo.
5. El Modelo de Stewart propone que el pH varía en función a 3 variables independientes: (a) la diferencia de iones fuertes (DIF), (b) Ácidos débiles no volátiles (Atot) y (c) pCO2. Así el mérito de esta aproximación es fusionar el estado ácido-base con los cambios en los electrolitos en una misma interpretación. En este modelo la DIF es regulada por el riñon, la concentración Atot lo es por el hígado y la pCO2 por el pulmón. Todas las variables independientes están presentes en la concentración expresada en milimoles (mMol) o miliequivalentes (mEq) y su interacción con el agua determina la cantidad de iones hidrógeno libres cuya concentración se expresa en nanomoles (nMol) 4.
CONCEPTO ACTUAL DEL ANÁLISIS ÁCIDO-BASE EN EL PACIENTE CRÍTICO: ENFOQUE DE STEWART
El Enfoque de Stewart considera dos principios: la ley de electroneutralidad y el principio de conservación de masas, bajo los cuales tenemos un esquema de 3 variables independientes capaces de cambiar las concentraciones de iones hidrógeno en el agua.
Las tres variables independientes son: (a) Diferencia Ion Fuerte (DIF), (b) Ácidos débiles no volátiles (Atot); y (c) Nivel de pCO2. Las tres variables dependientes que dependen de las tres anteriores son: (a) pH, (b) HCO3- y (c) H+.
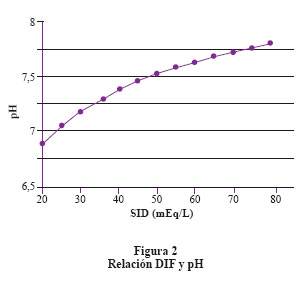
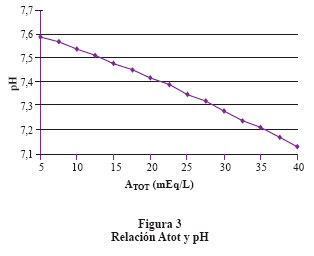
Se debe considerar el histograma con 2 columnas (Figura 1), una contiene todos los iones fuertes con carga positiva y la otra todos los iones fuertes con carga negativa; la diferencia eléctrica entre ambas columnas es llamada DIF. En el plasma normal el DIF es igual a 42 mEq/lt. Esto significa que para lograr la electroneutralidad requiero de 42 mEq de iones de carga negativa diferente de los iones fuertes. La DIF está compuesta principalmente por HCO3- y los ácidos débiles (Atot). Forman parte de los Atot la albúmina y el fosfato. El efecto que tiene el DIF sobre el pH es directo, es decir, al aumentar el DIF aumenta el pH y por lo tanto disminuye el componente ácido. El efecto que tienen los Atot sobre el pH es inverso es decir aumentan los Atot y se reduce el pH. Finalmente la relación entre la PCO2 y el pH es inversa6 (Figura 2 y figura 3). El valor del Atot se puede calcular con las siguientes fórmulas:
a) Atot = 2 (Albúmina gr/dl) + 0,5 (P04-) mg/dl y su valor normal oscila entre 17 y 19 meq/lt.
b) Atot = 2,43 * [Proteínas totales].
c) Atot = [Albúmina (0,123*pH – 0,631] – [Fosfato (0,309*pH – 0,469)]
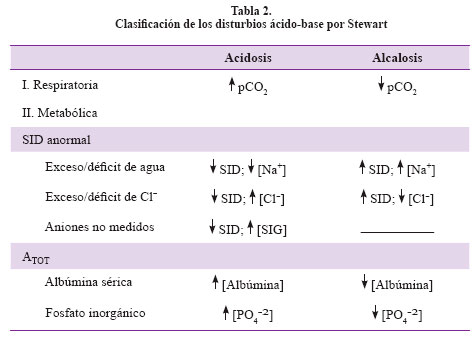
La composición en porcentaje es albúmina 78%, fosfato 20% y otras proteínas 2%. La clasificación de los disturbios ácido-base por Stewart se representa en la Tabla 27. Finalmente se introduce el término de gap de ion fuerte con sus siglas en inglés SIG.
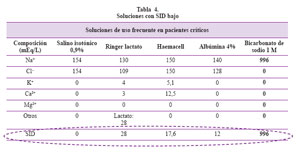
Las causas de DIF disminuido (acidosis metabólica) son: (1) Acidosis tubular renal: Distal tipo 1 (pH urinario >5,5), Proximal tipo 2 (pH urinario <5,5, K+ sérico bajo); deficiencia de aldosterona tipo 4 (ph urinario < 5,5, K+ sérico alto) (2) Causas no renales: Gastrointestinal (diarrea, drenaje pancreático, intestino corto); Iatrogénica (nutrición parenteral, salino, resina de intercambio aniónico). Además también deberá calcularse el SIG: (a) SID bajo con SIG normal: uso de soluciones con SID < 24 meq/ lt8; hiperlactacidemia (b) SID bajo con SIG > 2: aniones no medidos presentes en acidosis láctica, cetoacidosis diabética, intoxicación por salicilatos, intoxicación por metanol.
Es de importancia práctica conocer las soluciones que tienen por sí mismas un SID bajo que pueden conllevar a una acidosis metabólica con SIG normal (Tabla 4).
Las causas de DIF aumentado (alcalosis metabólica) son:
1. Pérdida de sodio > pérdida de cloro: (a) Cloro urinario < 10 mmol/lt: pérdidas gastrointestinales (vómitos, drenaje gástrico, diarrea perdedora de cloro = adenoma velloso); (b) Cloro urinario > 20 mmol/lt: exceso de mineralocorticoide, uso de diuréticos.
2. Carga de sodio exógena (Cloro sérico elevado): Administración de sales de sodio (acetato, citrato): transfusión masiva de sangre, nutrición parenteral, expansores de volumen de plasma, lactato de Ringer.
3. Deficiencia severa de catión intracelular: Calcio, Magnesio9.
SISTEMAS DE COMPENSACIÓN ANTE UN DISTURBIO DEL ESTADO ÁCIDO-BASE
Sistemas químicos amortiguadores: Respuesta inmediata en fracción de segundos. El HCO3- representa el 50% de la capacidad amortiguadora del plasma. La hemoglobina proporciona el 30% y el restante 20% lo comparten las proteínas (13%) y el fosfato (7%). Como vemos en casos de anemia severa este sistema se vería mermado significativamente.
Sistema respiratorio: Se inicia en pocos minutos. 50% de la compensación por acidosis metabólica se obtiene antes de las 2 horas y el 75% de la compensación en 24 horas. El 30% de la compensación por alcalosis metabólica se da a las 12-24 horas y el 60% posterior a las 48 horas. Es importante considerar la eficiencia de este sistema, dado que un paciente con compromiso de: (a) parénquima pulmonar (típico paciente con injuria pulmonar o edema pulmonar de cualquier etiología) o con (b) compromiso de caja torácica (cifoescoliosis de los adultos mayores) o de (c) los músculos respiratorios (agotamiento respiratorio, predisposición a debilidad muscular en determinadas patologías, desnutrición aguda durante hospitalización o en el destete de ventilador mecánico posterior a uso de sedantes, etc.) lamentablemente tendrá problemas en compensar un trastorno metabólico y su mecanismo compensatorio respiratorio será deficiente.
Sistema renal: La respuesta la tenemos en horas a días. Es el sistema más potente (2- 4 horas). El túbulo proximal del nefrón tiene gran responsabilidad en la homeostasis del HCO3- , por lo cual pacientes con injuria renal tubular aguda pueden ver afectado este sistema de compensación10,11. El control del equilibrio se logra excretando la orina ácida o alcalina. La concentración de hidrogeniones [H+] se regula mediante 3 mecanismos: Secreción de iones H+, Reabsorción de los iones HCO3- filtrados y producción de nuevos iones HCO3- .
En este aspecto es importante recordar que la relación entre el nivel de pCO2 y el nivel de HCO3- es directa, por lo tanto si uno de ellos se reduce la compensación viene dada por la reducción del otro componente y viceversa, esto debido a la fórmula que relaciona ambos:
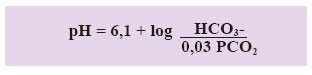
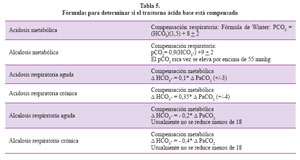
Las compensaciones están dadas dependiendo si el problema es agudo o crónico y las fórmulas se presentan en la Tabla 5.
ANÁLISIS PRÁCTICO DEL ESTADO ÁCIDO-BASE A LA CABECERA DEL PACIENTE
La presente revisión tiene por objetivo promover un análisis moderno de los disturbios del estado ácido - base a la cabecera del paciente críticamente enfermo sin perder la práctica de un análisis preliminar clásico Henderson- Hasselbalch.
Este esquema práctico consta de los siguientes pasos:
I. Valoración clínica del paciente y correlación con el estudio de gasometría arterial.
II. Enfoque Henderson-Hasselbalch clásico: determinar el trastorno primario.
II. Determinar mecanismo compensador y eficiencia del mismo: determinar trastorno asociado, uso de exceso de base.
IV. Enfoque integral Stewart basado en 3 variables independientes que consideran no sólo la concentración. de hidrogeniones sino los electrolitos: Cálculo de DIF, Atot y pCO2. Cálculos adicionales: SIG.
Para tal fin partiremos de la evaluación de un caso que se presentó por emergencia y luego fue admitido a la unidad de cuidados intensivos. Se trata de una paciente de 56 años, ama de casa, fumadora (10 cigarrillos/día desde los 20 años) con antecedente de artritis reumatoide en tratamiento crónico con corticoides, el cual suspendió 6 meses antes de su ingreso al hospital. Dos meses antes de su ingreso presentó edema de manos y miembros inferiores asociado a disnea e ictericia. Dos semanas antes presenta edema palpebral y se incrementa la disnea. Tres días antes cursa con ictericia marcada y un incremento de la disnea. El día de su ingreso por Emergencia adicionalmente a los síntomas mencionados presenta alteración del estado mental y reportan como antecedente melena. Al examen físico encontramos una presión arterial de 130/70mmhg, con una frecuencia cardiaca de 70 /min y una frecuencia respiratoria de 30 /min, Afebril, SpO2 96% con FiO2 de 21%. Palidez generalizada con edema palpebral bilateral, edema de miembros inferiores con fóvea, soplo sistólico multifocal, rangos articulares disminuidos con leve dolor a la movilización. Abdomen sin alteraciones. Glasgow score de 14 por desorientación en las 3 esferas. Se efectuaron los exámenes de laboratorio que se muestran en la Tabla 6.
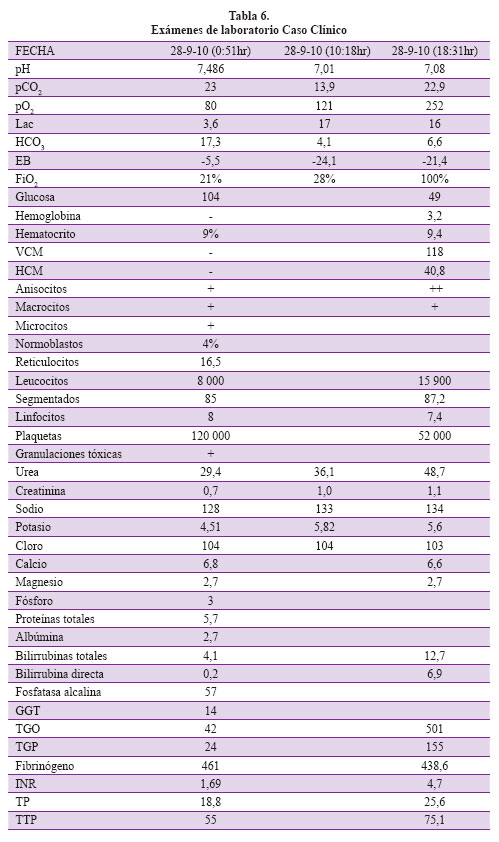
En la evaluación inicial primero buscamos los trastornos fisiopatológicos y luego las causas que han llevado a la paciente a dichos trastornos. Nuestra paciente presenta taquipnea como indicador específico más importante de enfermedad crítica, la cual se asocia a alteración del estado mental manifestado por desorientación con saturación de oxígeno aceptable para una paciente fumadora crónica que determina la búsqueda de causas extrapulmonares del origen del problema. Para tal efecto uno de los primeros exámenes auxiliares que evaluamos en la paciente en emergencia son los gases arteriales y electrolitos, cuya interpretación depende de seguir primero el algoritmo de análisis de gases arteriales clásico de Henderson Hasselbalch que se describirá a continuación en una serie de pasos para luego de ello terminar con el análisis basado en Stewart que permita explicar mejor los problemas de la paciente y que ayude a resolver las incongruencias posibles en el enfoque diagnóstico y de manejo, en caso no se puedan efectuar con el enfoque clásico.
Paso 1: Correlacionar siempre la gasometría arterial en tiempo real con la clínica del paciente, pues a veces se pretende analizar una gasometría arterial tomada con mucha anterioridad a la descompensación del paciente y por lo tanto puede que no guarde relación con la situación clínica actual y ello conlleva a errores de interpretación. Es importante para la valoración el tener también los siguientes exámenes de laboratorio: lactato, sodio, potasio, cloro, calcio, magnesio, fosfato, proteínas totales, albúmina sérica, creatinina, hemoglobina y radiografía de tórax.
Paso 2: Determinar si estamos ante un estado de alcalemia o acidemia siguiendo el algoritmo. Si el pH es > 7,40 entonces es un estado de alcalemia. Si el pH es < 7,40 entonces estamos frente a una acidemia. En el caso de nuestra paciente estamos frente a una alcalemia.
Paso 3: Luego identificamos el trastorno primario o dominante, en el caso de nuestro paciente es una alcalemia y analizamos el pCO2 que es un valor medido por la máquina de gases arteriales, a diferencia del bicarbonato que es calculado, si el pCO2 es < 40 mmhg será una alcalosis respiratoria, si por el contrario el pCO2 es > 40 mmhg será una alcalosis metabólica. Concluimos que el trastorno dominante en nuestra paciente es una alcalosis respiratoria.
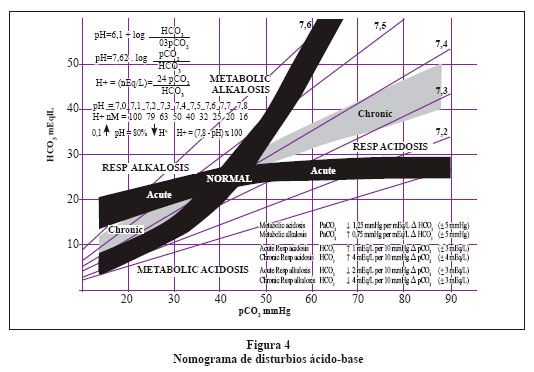
Paso 4: Determinar si el trastorno es agudo o crónico. El caso es una alcalosis respiratoria crónica por la variación de pH encontrada más cercana a 7,44 que a un 7,53 utilizando la fórmula correspondiente de la Tabla 3.

Paso 5: Determinar si el disturbio se encuentra compensado o no. Para lo cual utilizamos la fórmula de compensación de la alcalosis respiratoria crónica, con lo que obtenemos un nivel de compensación con HCO3- de 17,2 mEq. Como nuestra paciente tiene 17,3 diremos que el trastorno dominante está compensado y en este momento no hay un trastorno metabólico asociado. También podemos prescindir de las fórmulas y ubicar en un nomograma la intercepción de nuestro pH, pCO2 y HCO3- y si dicha intercepción está dentro de la franja negra o gris el trastorno está compensado (Figura 4).
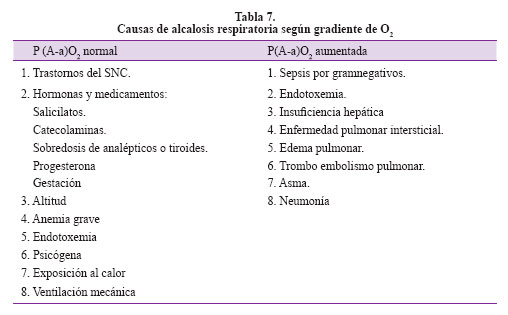
Paso 6: Teniendo nuestro trastorno dominante revisamos las causas que conllevan a esta alcalosis respiratoria compensada en nuestra paciente revisando la lista de la Tabla 7. Esta es quizás la parte más importante del análisis pues en este momento integramos la historia clínica, hallazgos adicionales en los exámenes auxiliares y las posibles causas del trastorno con la lista de causas según nuestro hallazgo y deducimos también en esta fase qué incongruencias se presentan en el análisis tradicional. En el contexto de nuestra paciente con gradiente alveólo arterial de 41,25 levemente elevada podríamos considerar la insuficiencia hepática. Si consideramos que en realidad la gradiente es alta por su antecedente pulmonar entonces también podríamos contemplar como posibilidades diagnósticas: anemia grave y trastornos del sistema nervioso central. Finalmente con los demás exámenes auxiliares podemos ratificar los siguientes problemas médicos: anemia severa y sospecha de falla hepática pues se tiene alteración del estado mental y TP discretamente prolongado. Esto podría explicar la palidez, ictericia y edemas de la paciente, además y ante una anemia severa con evidencia de melena el origen podría encontrarse en el tracto digestivo alto. Pero evidenciamos que existe LDH incrementada e hiperbilirrubinemia a predominio indirecto que nos definen un patrón de anemia hemolítica que en el contexto de enfermedad inmunológica es factible con manifestación severa que genere falla cardiaca de gasto alto y explique los edemas.
Paso 7: Sin embargo con el análisis Henderson-Hasselbach quedan algunos asuntos pendientes por analizar, por ejemplo el componente metabólico de HCO3- reducido. Aún si asumiéramos una acidosis metabólica de fondo con anión gap (AG) calculado inicial en 6,7 el que corregido para el nivel de albúmina debe estar en 11,6, nos resulta un AG de valor normal. Pero evidenciamos lactato elevado y más aún, en las próximas horas esto es mucho más evidente. Por estas incongruencias es necesario en algunos casos efectuar nuestro análisis Stewart. Sin embargo, es importante evaluar también las causas de anión gap alterado.
Paso 8: Evaluación de incongruencias. Cuando no es tan evidente evaluar algún componente del medio interno necesitamos de otro enfoque diagnóstico de los disturbios del estado ácido-base. Así, analizar un resultado de gasometría arterial luego de casi 10 horas de manejo es muy fácil según se ve en la Tabla 6 en donde es evidente una acidosis metabólica con anión gap elevado y de ahí es posible encontrar las causas del disturbio. Pero la pregunta es si este enfoque lo habríamos podido detectar desde las 00:58 hr y la respuesta es sí, con el enfoque de Stewart.
Paso 9: Comenzamos con los cálculos básicos: DIF = Na+ + K+ + Mg + Ca -Cloro-Lactato = 34,4 es decir un DIF bajo (ver Figura 1) lo cual indica la presencia de una acidosis metabólica (ver Tabla 6). En segundo lugar, calculamos el Atot = 13,8, es decir un Atot bajo lo cual se relaciona en sentido inverso con el pH implicando el mecanismo compensador de la acidosis metabólica corroborado con el nivel bajo de pCO2. Finalmente calculamos el SIG el cual resulta en 14,4 (mayor de 2), probablemente en relación a una acidosis láctica cuyo monitoreo de depuración es necesario para valorar el pronóstico del paciente. Pero también debe considerarse -dado el nivel tan alto- consumo de medicamentos como salicilatos (recordemos que la paciente sufre de artritis reumatoide y por tanto pudiera haber consumido este fármaco). Estos datos extra y anticipados obtenidos con el análisis Stewart son de vital importancia en el manejo oportuno de los pacientes críticos.
PUNTOS CLAVE EN EL MANEJO DE LOS TRASTORNOS DEL ESTADO ÁCIDO-BASE
Acidosis metabólica
1. Dirigido a tratar la causa de fondo que originó el trastorno ácido-base.
2. Las indicaciones para tratamiento directo de la acidosis metabólica con bicarbonato son: (a) pH < 7,10 (b) Manifiesto compromiso fisiológico atribuible a la acidosis (c) Exceso de trabajo respiratorio para mantener un pH > 7,20.
3. Si el bicarbonato es necesario, el cálculo del déficit requerido se basa en el 60% del agua corporal total. Déficit de HCO3 = 0,5 [agua corporal total] * [24 - HCO3]. Se indica el 50% de la dosis y luego de controles se repone el resto.
4. Considerar enfoque ampliado de Stewart para evitar omisiones en la causa del problema metabólico.
Alcalosis metabólica
1. Enfocar si el trastorno es respondedor de sal (NaCl) o no y determinar la causa de fondo.
2. Corregir los niveles séricos de potasio para evitar perpetuar el trastorno.
3. En caso de edemas por falla cardiaca, falla hepática o síndrome nefrótico es usual el abuso de diuréticos, el tratamiento en estos casos no radica en la hidratación pues el edema podría empeorar, se recomienda la reducción del diurético o el uso de acetazolamida (250-375mg una o dos veces al día).
Acidosis respiratoria
1. Soporte ventilatorio no invasivo o invasivo (si hay contraindicación para no invasivo). El objetivo es aumentar la ventilación alveolar a través del incremento de la ventilación minuto, asegurando una frecuencia respiratoria y un volumen tidal que permitan normalizar el pH. Mantener una adecuada oxigenación.
2. Tratar la causa de fondo.
3. Cuidado con administrar oxígeno con máscara de reservorio a los pacientes retenedores crónicos de CO2.
Alcalosis respiratoria
1. Tratar la causa de fondo.
2. Controlar los síntomas neuromusculares (tetania, espasmos carpopedales) evitando la hiperventilación.
3. Cuidado con el riesgo de isquemia miocárdica en estos pacientes por aumento de la afinidad del oxígeno a la hemoglobina.
PUNTOS CRÍTICOS
-
La interpretación del estado ácido-base requiere de la valoración en tiempo real del estado clínico del paciente y un enfoque integrado clásico y actualizado basado también en el equilibrio electrolítico a fin de evitar omisiones en la etiología del problema.
-
El disturbio más peligroso es la acidosis metabólica y requiere un enfoque dual basado en la interpretación del anión gap y la diferencia de iones fuertes que contempla la valoración de la albúmina, fosfato, entre otros electrolitos.
-
Las soluciones utilizadas para fluidoterapia también pueden generar mayores disturbios como la acidosis metabólica hiperclorémica y pueden reducir el SID a nivel sérico. Recordar que la identificación de este trastorno obliga a evitar mayor sobrehidratación por su relación con un peor pronóstico de sobrevida en los pacientes críticos.
-
La eficiencia de los sistemas compensatorios de los disturbios ácido-base dependen del estado basal de los órganos responsables como el nivel de hemoglobina, estado de la función respiratoria y estado de la función renal. Es importante considerar ello porque de encontrarse afectados la compensación se retrasa y es incompleta requiriendo instalar un soporte intensivo con mayor precocidad.
-
Los disturbios del estado ácido-base tienen consecuencias a nivel multiorgánico por lo que se deben identificar de manera precoz en pacientes con factores de riesgo y/o con sistemas compensatorios deficientes.
-
El tratamiento de los disturbios ácido-base en el paciente crítico se centra en la detección precoz de los mismos mediante un enfoque integral que involucre tanto la teoría clásica como la teoría de Stewart de manera que se logre obtener el manejo de la causa de fondo.
REFERENCIAS BIBLIOGRÁFICAS
1. Kellum J. Disorders of acid-base balance. Crit Care Med 2007; 35:2630–2636.
2. Kellum J, Song M, Almasri E: Hyperchloremic acidosis increases circulating inflammatorymolecules in experimental sepsis. Chest 2006; 130:962–967
3. Adrogué H, Madias N. Management of Life Threatening Acid-Base Disorders. Review Articles. N Engl J Med 1998; 338:26-34.
4. Kellum J, Elbers P. Stewart´s Textbook of Acid-Base. Segunda Edición. Impreso en USA. 2009
5. McLean B, Zimmerman J, Dellinger P. Fundamentos de cuidados críticos en soporte inicial. Society of Critical Care Medicine. Tercera edición en español. 2008.
6. Morgan J. The Stewart Approach – One Clinicians Perspective. Clin Biochem Rev 2009;30:41-54.
7. Fencl V. Diagnosis of Metabolic Acid–Base Disturbances in Critically Ill Patients. Am J Respir Crit Care Med 2000; 162:2246–2251.
8. Story DA. Intravenous Fluid Administration and Controversies in Acid-Base Crit Care Resuscit 1999; 1:151-156.
9. Kellum. Acid Base and electrolyte analysis in critically ill patients. Current Opinion in Critical Care 2003:9: 468- 473
10. Metabolic acidosis in icu. Crit Care Clin 2002
11. Carrillo Esper et al. Equilibrio ácido base. Rev Asoc Mex Med Crit y Ter Int 2006;20(4):184-192
12. Kellum. Determinants of blood pH in health and disease. Crit Care 2000:4;6-14.
13. Marini J, Wheeler A. Critical Care Medicine. The Essentials. Lippincott Williams & Wilkins. Philadelphia USA. 2006.
CORRESPONDENCIA
Mónica Meza García