Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú vol.79 no.2 Lima abr./jun. 2013
TRABAJOS ORIGINALES
Efecto del procesamiento de puré de aguaymanto (Physalis peruviana L.), sobre los compuestos bioactivos y la capacidad antioxidante
Effect of golden berry (Physalis peruviana L.) puree process on bioactive compounds and antioxidant capacity
Rosella Málaga Barredaa*, Américo Guevara Pérezb, Miguel Araujo Vargasc
a* Mg.Sc. Ingeniero en Industrias Alimentarias. E-mail: rosella_malaga@hotmail.com
b Dr. Ingeniero en Industrias Alimentarias. Profesor principal del Departamento de Tecnología de Alimentos. Facultad de Industrias Alimentarias. Universidad Nacional Agraria La Molina (UNALM), Lima.
c Mg.Sc. Ingeniero en Industrias Alimentarias. Profesor principal de la Facultad de Industrias Alimentarias. Universidad Nacional Agraria La Molina (UNALM), Lima.
RESUMEN
En esta investigación se evaluó el efecto del proceso de obtención del puré de aguaymanto, sobre los compuestos bioactivos (vitamina C, compuestos fenólicos totales y carotenoides totales) y la capacidad antioxidante. Mediante el análisis de muestras en cada etapa del proceso, se obtuvo retenciones finales, en comparación con la composición inicial del aguaymanto, en vitamina C de 52,85±1,32% b.s., en compuestos fenólicos totales de 56,45±1,92% b.s. y en carotenoides totales de 38,91±3,29% b.s. En la capacidad antioxidante hidrofílica y lipofílica, las retenciones fueron de 62,75±2,00 y 49,15±1,44% b.s., respectivamente. El aporte de cada compuesto bioactivo a la capacidad antioxidante, fue establecido mediante coeficientes de correlación.
Palabras clave: Vitamina C, compuestos fenólicos totales, carotenoides.
SUMARY
In this investigation, the effect of golden berry puree process on the bioactive compounds (vitamin C, total phenolic compounds and total carotenoides) and antioxidant capacity was evaluated. Through analysis of samples in each process stage, the final retentions, in comparison to golden berry initial composition, were obtained, in vitamin C 52,85±1,32% d.b., in total phenolic compounds 56,45±1,92% d.b. and in total carotenoids 38,91±3,29% d.b. In the hydrophilic and lipophilic antioxidant capacities, the retentions were 62,75±2,00 and 49,15±1,44% d.b., respectively. The contribution of each bioactive compound to the antioxidant capacity was established through correlation coefficients.
Key words: Vitamin C, total phenolic compounds, carotenoids.
INTRODUCCIÓN
Los vegetales son ricos en compuestos de interés funcional; sin embargo, éstos tienden a cambiar durante el procesado y el almacenamiento. El procesado de frutas puede derivar en la degradación de sus compuestos bioactivos, resultando en pérdida de actividad antioxidante1,2,3. La exposición de los componentes de los alimentos al procesado con calor es una de las causas de cambios detectables, no sólo en la calidad nutricional, sino también en la actividad antioxidante4.
La ingesta constante de alimentos ricos en antioxidantes naturales como las frutas, se correlaciona bien con una reducción del riesgo de padecer ciertas enfermedades. En particular se ha observado una correlación inversa entre el consumo de alimentos ricos en compuestos biológicamente activos como polifenoles, con las enfermedades cardiovasculares. Además, esos alimentos pueden ejercer efectos anticarcinogénicos y se asocian con un menor riesgo de padecer enfermedades degenerativas como la arterioesclerosis. Hay una creciente evidencia de que la vitamina C y los carotenoides puedan proporcionar efectos protectores contra enfermedades como el cáncer4.
En el Perú se produce varias frutas que en función a la composición química se consideran dentro del grupo de alimentos funcionales; una de ellas es el aguaymanto5. Las exportaciones del fruto fresco se ha incrementado de 6,9 TM en el 2007 a 59,2 TM en el 2011, principalmente a Estados Unidos (40%) y Alemania (20%)6.
El aguaymanto contiene compuestos fenólicos, posee capacidad antioxidante y es fuente vitamina C7. Asimismo, contiene importantes cantidades de carotenoides8. El aguaymanto está considerado dentro del grupo de moderada actividad antioxidante9,10. Sin embargo, no se tienen referencias de las variaciones en el contenido de compuestos bioactivos y en la capacidad antioxidante durante el procesado para la obtención de un producto tipo puré.
De acuerdo con lo expresado se consideró conveniente llevar a cabo un trabajo de investigación, planteando como objetivo, la determinación de la influencia del procesamiento de puré de aguaymanto sobre la variación de los compuestos bioactivos (vitamina C, compuestos fenólicos totales y carotenoides totales) y de la capacidad antioxidante hidrofílica y lipofílica.
PARTE EXPERIMENTAL
Materiales y métodos
Lugar de ejecución
El trabajo de investigación se llevó a cabo en la planta piloto de Tecnología de Alimentos y Productos Agropecuarios (TAPA) y en los laboratorios de físico química, biotecnología e investigación, instalaciones pertenecientes a la Facultad de Industrias Alimentarias de la Universidad Nacional Agraria La Molina (UNALM), Lima.
Materia prima e insumos
-
Aguaymanto (Physalis peruviana L.) proveniente de la provincia de Cajamarca.
-
Azúcar blanca refinada industrial (sacarosa).
-
Almidón modificado ELIANE: Fosfato de di-almidón hidroxipropilado (1442).
-
Envases de vidrio de una capacidad nominal de 156 cm3, con tapa metálica.
Reactivos
-
Estándares: ácido ascórbico, ácido gálico 100%, SIGMA-ALDRICH, β-caroteno 99%, SIGMA-ALDRICH y TROLOX (6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxilic acid), 97% SIGMA-ALDRICH.
-
Los indicados en los métodos de análisis.
Equipos y materiales
DATA TRACE TEMP SYSTEM ®, computadora COMPAQ PRESARIO CQ-50-103LA, estufa eléctrica digital MEMMERT 100-800. Beschickung – Loading model, espectrofotómetro UNICO® UV-2100; centrífuga digital HETTICH, D-78522, potenciómetro HANNA INSTRUMENTS, modelo HI8424, refractómetro digital ATAGO® Pocket PAL-1, 0-53%. d = 0,01.
Análisis físico químico
-
Vitamina C (mg/100g): Método adaptado11.
-
Compuestos fenólicos totales (mg AGE/ 100g): Método adaptado12.
-
Carotenoides (mg β-caroteno eq./ 100g): Método adaptado13.
-
Capacidad antioxidante ABTS (umol TROLOX eq./ g): Método adaptado14.
Análisis estadístico
Los análisis estadísticos para evaluar el efecto del proceso en los compuestos bioactivos, se realizaron usando el programa Statgraphys Centurion XV.II.
El proceso y los análisis se realizaron por triplicado. Los resultados se expresaron como la media ± error estándar. Los resultados de cada etapa se compararon entre sí y con respecto a la materia prima.
Las diferencias estadísticamente significativas entre las medias, con un intervalo de confianza del 95%, se analizaron en base a un DCA, considerando un solo factor categórico (proceso de producción del puré de aguaymanto) con cuatro niveles (etapas del proceso). Se realizó el análisis de varianza y las correspondientes pruebas de comparación múltiple DLS.
Se estableció la correlación entre cada compuesto bioactivo y la capacidad antioxidante, en base a los coeficientes de determinación y de correlación, obteniéndose modelos matemáticos que describen la relación entre dichas variables (p < 0,05).
Diseño experimental
Se determinó la variación de los compuestos bioactivos y de la capacidad antioxidante por efecto del proceso de elaboración del puré de aguaymanto (materia prima, pulpeado, estandarizado y pasteurizado), calculando los porcentajes parciales y acumulados en cada etapa. Asimismo, se determinó la retención de dichos compuestos, en comparación con la composición inicial del fruto fresco.
Se evaluó el grado en que cada compuesto bioactivo contribuye a la capacidad antioxidante, evaluando la correlación existente y estableciendo los modelos matemáticos correspondientes.
RESULTADOS Y DISCUSIÓN
Compuestos bioactivos y capacidad antioxidante del aguaymanto
En la tabla 1 se presentan los resultados de los compuestos bioactivos y la capacidad antioxidante de la materia prima.
Se obtuvo 24,21±0,81 mg/ 100 g b.h. (131,10±4,38 mg/ 100 g b.s.) de vitamina C, menor a 28,55 mg/100 g b.h.15; se encuentra dentro del rango 20 a 43 mg/ 100 g b.h.8. Las variaciones, son atribuidas al estado de madurez y el tiempo transcurrido entre la cosecha y el momento del análisis.
En cuanto a compuestos fenólicos totales (mg AGE/ 100 g) se obtuvo 58,60±1,96 b.h. (317,28±10,63 b.s.), dentro del rango de 39,15 a 40,45 y 8710 (b.h.).
Se obtuvo un contenido de carotenoides totales (mg β-caroteno eq./ 100 g) de 2,94±0,43 b.h. (15,93±2,31 b.s.), cercano a 2,64 b.h.16. Las diferencias en composición en cuanto a carotenoides, son debido a factores como la variedad, el estado de madurez, clima (la luz solar incrementa la producción de carotenoides en la planta), geografía del lugar de producción y prácticas agrícolas (uso de ciertos herbicidas, afectarían negativamente)17.
La capacidad antioxidante ABTS (umol TROLOX eq./ g) hidrofílica de 3,62±0,14 b.h. (19,56±0,78 b.s.) y lipofílica de 0,50±0,06 b.h. (2,73±0,35 b.s.), siendo la capacidad antioxidante total, 4,12±0,18 b.h. (22,29±1,00 b.s.), valor que está dentro del rango 3,89 y 4,44 b.h., para índices de madurez de 5 y 6, respectivamente16.
Variación de los compuestos bioactivos por efecto del proceso de obtención de puré de aguaymanto
En el pulpeado se observó un aumento aparente de los compuestos bioactivos y la capacidad antioxidante hidrofílica, debido a la modificación de la proporción de sólidos, como consecuencia de la separación de semillas y fibra durante el refinado.
Ácido ascórbico
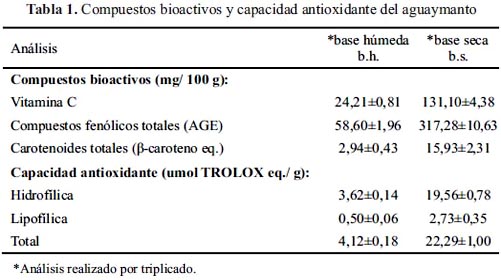
En la figura 1 se muestra la variación del contenido y del porcentaje de retención del ácido ascórbico durante el proceso de obtención del puré de aguaymanto.
En el pulpeado, se observó un aumento aparente del contenido de ácido ascórbico (20% b.s.); sin embargo, ocurrió una pérdida (8% b.h.). En presencia de oxígeno, el ácido ascórbico se degrada a ácido deshidroascórbico, el cual es menos estable y sufre una reacción rápida e irreversible, formándose el ácido 2,3-dicetogulónico, que carece de actividad vitamínica; esto se da como consecuencia de la lesión mecánica que sufren los tejidos vegetales, que da lugar a la liberación y acción de la ascórbico oxidasa, al oxígeno, la luz, la presencia de trazas metálicas y la actividad de agua, que también incrementan la velocidad de reacción1,2.
En la estandarización se tuvo una pérdida 4% b.h. (60% b.s.), como consecuencia de que la pulpa continuó en contacto con el oxígeno del aire, produciéndose la oxidación catalizada por las enzimas liberadas en el pulpeado.
Durante la pasteurización el ácido ascórbico se redujo en 10% b.h. (7% b.s.). La reacción de degradación del ácido ascórbico es lenta en productos con pH ácido1. Adicionalmente, en esta etapa se fueron inactivando las enzimas a medida que avanzaba el tratamiento térmico.
La retención total fue 78,11±1,95% b.h. (52,85±1,32% b.s.), teniendo el puré de aguaymanto 18,91±0,36 b.h. (69,25±1,30 mg/ 100 g b.s.). El ácido ascórbico es estable a pHs menores a 5.52.
Compuestos fenólicos totales
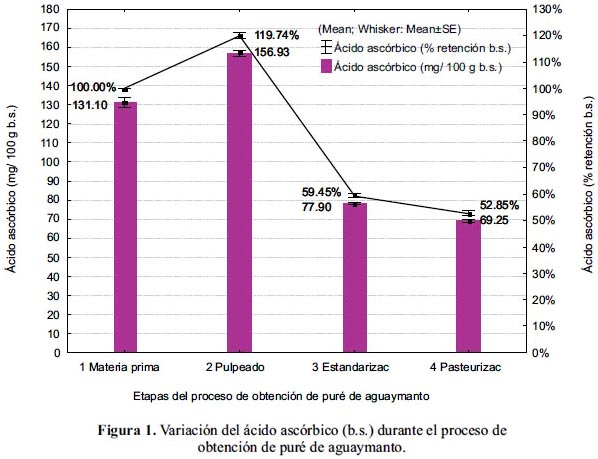
En la figura 2, se muestra la variación del contenido y del porcentaje de retención de los compuestos fenólicos totales durante el proceso de obtención del puré de aguaymanto.
En el pulpeado, se observó un aumento aparente del contenido de compuestos fenólicos en 22% b.s; sin embargo, al ser evaluados los resultados en base húmeda, ocurrió una pérdida de 6%. Al respecto, se puede mencionar que, operaciones como el pulpeado pueden derivar en actividad de la polifenoloxidasa (PPO) y la subsecuente degradación de los compuestos fenólicos3.
En la estandarización se tuvo una pérdida 7% b.h. (64% b.s), como consecuencia de que la pulpa continuó en contacto con el oxígeno del aire, produciéndose la oxidación catalizada por las enzimas liberadas en el pulpeado. La oxidación después del pulpeado, puede ser sustancial y proporcional al período de tiempo antes de la inactivación de la enzima PPO3; además, se tiene información sobre el efecto adverso de la luz y el oxígeno sobre los polifenoles18.
Durante la pasteurización, se produjo una pérdida no significativa (p<0,05) de 4% b.h. (2% b.s.). Los tratamientos a altas temperaturas y tiempos cortos, realizados inmediatamente después del pulpeado, protegen los compuestos fenólicos de la oxidación y en el caso de jugos y dulces de fruta, el tratamiento puede mejorar la biodisponibilidad de los compuestos fenólicos3.
La retención total de los compuestos fenólicos fue de 83,43±2,84% b.h. (56,45±1,92% b.s.), teniendo el puré de aguaymanto 48,93±3,26 mg AGE/ 100 g b.h. (179,22±11,94 mg AGE/ 100 g b.s.).
Carotenoides totales
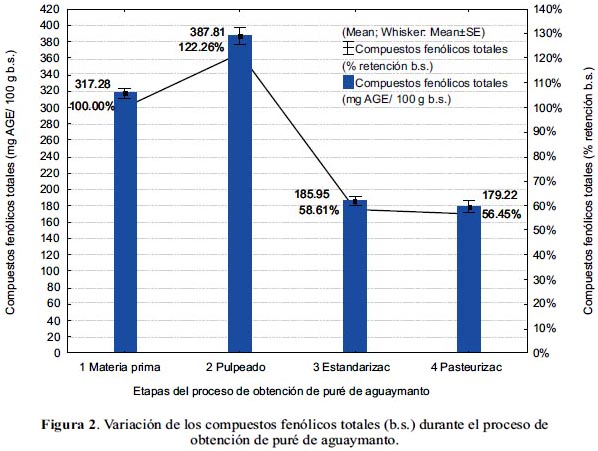
En la figura 3 se muestra la variación del contenido y del porcentaje de retención de los carotenoides totales durante el proceso de obtención del puré de aguaymanto.
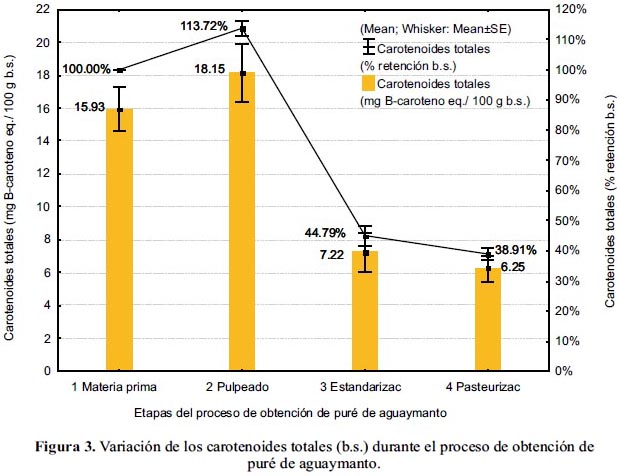
En el pulpeado se observó un aumento aparente del contenido de carotenoides (14% b.s.); sin embargo, al ser evaluados los resultados en base húmeda, ocurrió una pérdida de 12%, atribuida a que la separación de la cáscara resulta en una pérdida de carotenoides, ya que estos se encuentran más concentrados en la cáscara que en la pulpa17. Asimismo, a consecuencia del procesado, las membranas celulares quedan destruidas, quedando expuestos los carotenoides, a sufrir el efecto de la luz y el oxígeno4.
En la estandarización se tuvo una pérdida de 20,29% b.h. (69% b.s), como consecuencia de que la pulpa continuó en contacto con el oxígeno del aire, produciéndose la oxidación catalizada por las enzimas liberadas en el pulpeado. La retención de los carotenoides decrece con el tiempo de proceso y el pulpeado del alimento que los contiene17. Tanto las lipooxigenasas como las peroxidasas participan en la degradación de los carotenoides19.
Durante la pasteurización se produjo una pérdida no significativa (p<0,05), de 9% b.h. (6% b.s.). La causa mayor de destrucción es la oxidación enzimática (lipooxigenasas), la no enzimática y la isomerización de trans a cis durante el tratamiento térmico17. Sin embargo, los carotenoides son relativamente estables durante el procesado térmico, no produciéndose cambios significativos en productos a base de frutas20. Al respecto, el β-caroteno puede ser estable aun después de tratamientos térmicos como la esterilización18.
Se observó una retención total de carotenoides de 57,51±4,86% (38,91±3,29% b.s.), teniendo el puré de aguaymanto, 1,70±0,39 mg β-caroteno eq./ 100 g b.h. (6,25±1,44 mg β-caroteno eq./ 100 g b.s.).
Capacidad antioxidante ABTS
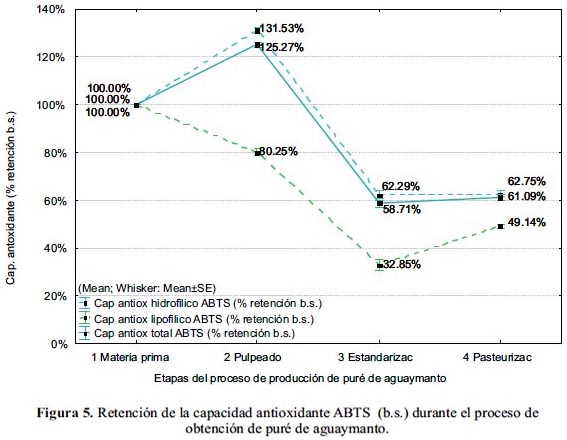
En las figuras 4 y 5 se muestra la variación del contenido y la retención de la capacidad antioxidante, respectivamente, durante el proceso de obtención del puré de aguaymanto.
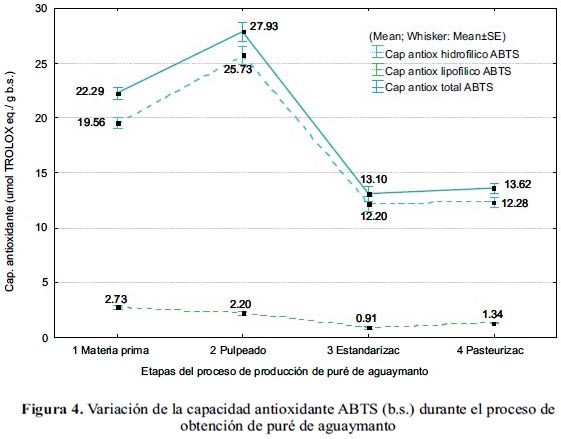
En el pulpeado, la actividad antioxidante hidrofílica tuvo un aumento de 32% b.s. Esto puede deberse a que la actividad antioxidante de los compuestos fenólicos puede incrementar, ya que pueden estar atrapados en células de pared resistente, como la fibra y ser liberados21. Asimismo, el mejoramiento de las propiedades antioxidantes estaría relacionado a la presencia de polifenoles con un estado de oxidación intermedio, que pueden exhibir una mayor extinción de radicales18.
En el estandarizado se dio una pérdida de 9% b.h. (69% b.s.). La pérdida registrada no se atribuye solamente a la estandarización per se (la adición de almidón y sacarosa, varió la proporción de sólidos), sino también, a que en la pulpa aún se tiene actividad enzimática y oxígeno disponible.
Luego de la pasteurización, la actividad antioxidante hidrofílica permaneció constante (p<0,05), esto puede deberse a que la temperatura inactivó enzimas como la ácido ascórbico oxidasa y PPO, causantes del deterioro oxidativo. La disminución de capacidad antioxidante en frutas tratadas térmicamente, se da debido al consumo de acido ascórbico y polifenoles como reactantes en el pardeamiento; los productos de estas reacciones, pueden exhibir tanto propiedades antioxidantes, como pro oxidantes18.
El puré de aguaymanto tuvo un valor final de capacidad antioxidante hidrofílica de 3,42±0,12 umol TROLOX eq./ g b.h. (12,28±0,73 umol TROLOX eq./ g b.s.), equivalente a una retención de 95% b.h. (63% b.s.), con respecto al fruto fresco.
En el pulpeado, la capacidad antioxidante lipofílica se redujo en 40% b.h. (19% b.s.) Este comportamiento se daría en la mayoría de los casos, debido a que el procesado de frutas es causa de pérdidas significativas de los antioxidantes naturales, ya que estos son relativamente inestables, dándose la isomerización del β-caroteno18.
En el estandarizado se redujo la capacidad antioxidante lipofílica en 11% b.h. (47% b.s.). Se asume que sería debido a que los antioxidantes se oxidan por la acción de los productos de la oxidación lipídica (hidroxiperóxidos) o por acción directa del oxígeno4.
La capacidad antioxidante lipofílica se incrementó en la pasteurización en un 23% b.h. (16% b.s.); indicando que en esta etapa, no hubo pérdida significativa de carotenoides. Al respecto, cabe indicar que durante el proceso térmico, los carotenoides pueden liberarse de la matriz celular20. El tratamiento térmico tiene la capacidad de incrementar la biodisponibilidad de los carotenoides contenidos en vegetales22.
El puré de aguaymanto tiene una capacidad antioxidante lipofílica de 0,37±0,04 umol TROLOX eq./ g b.h. (1,34±0,14 umol TROLOX eq./ g b.s.), equivalente a una retención de 73 % b.h. (49% b.s.) con respecto al fruto fresco.
La capacidad antioxidante total del puré de aguaymanto fue 3,78±0,15 umol TROLOX eq./ g b.h. (13,62±0,75 umol TROLOX eq./ g b.s.), equivalente a una retención de 92% b.h. (61% b.s.).
Correlación entre los compuestos bioactivos y la capacidad antioxidante
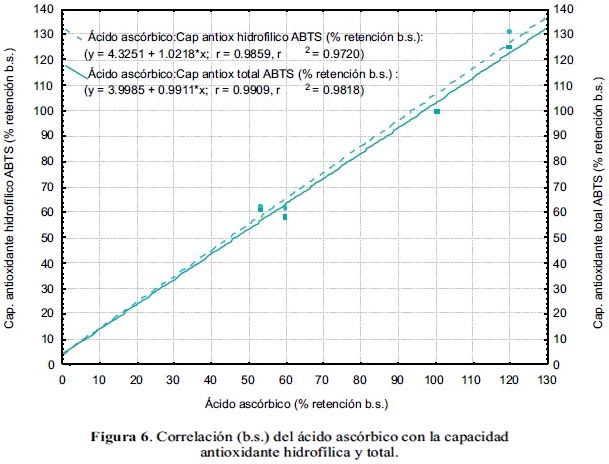
En la figura 6 se observa la correlación lineal entre el ácido ascórbico y la capacidad antioxidante hidrofílica y total, con coeficientes R de 98,59 y 99,09% b.s, respectivamente.
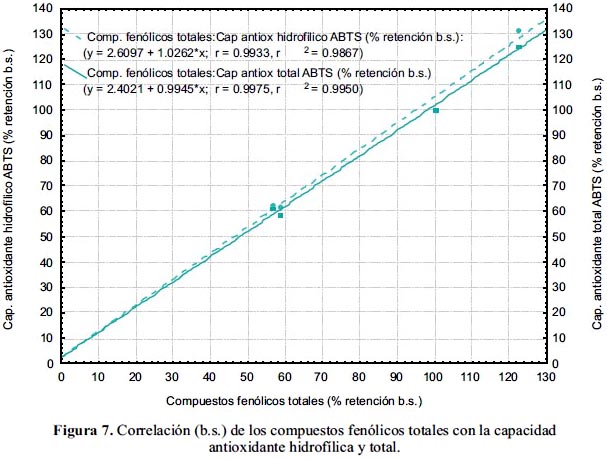
En la figura 7 se tiene la correlación lineal entre los compuestos fenólicos totales y la capacidad antioxidante hidrofílica y total, con coeficientes R de 99,33 y 99,75% b.s., respectivamente. Se encontró una correlación positiva entre el contenido de fenoles totales y la capacidad antioxidante en vegetales21.
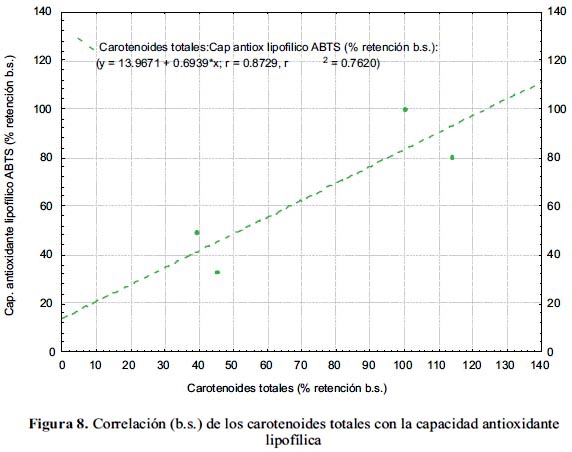
En la figura 8 se observa la correlación lineal entre la retención de los carotenoides totales con la capacidad antioxidante lipofílica, con un coeficiente R de 87,29, lo que indica un aporte positivo de los carotenoides en la capacidad antioxidante lipofílica.
CONCLUSIONES
El contenido de ácido ascórbico del aguaymanto fresco, 131,10±4,38 mg/ 100 g b.s., aumentó durante el pulpeado en 19,70% y disminuyó en la estandarización y la pasteurización en 60,28% y 6,60%, respectivamente. La retención total con respecto al fruto fresco fue de 52,85±1,32%, conteniendo el puré 69,25±1,30 mg/ 100 g b.s.
El contenido de compuestos fenólicos totales del aguaymanto fresco, 317,28±10,63 mg AGE/ 100 g b.s., aumentó durante el pulpeado en 22,23%, disminuyó en la estandarización en 63,62% y permaneció constante (p<0,05) en la pasteurización. La retención total con respecto al fruto fresco fue de 56,45±1,92%, conteniendo el puré 179,22±11,94 mg AGE/ 100 g b.s.
El contenido de carotenoides totales del aguaymanto fresco, 15,93±2,31mg β-caroteno eq./ 100 g b.s., aumentó durante el pulpeado en 13,93% y disminuyó en la estandarización y pasteurización en 68,57% y 6,16%, respectivamente. La retención total con respecto al fruto fresco fue de 38,91±3,29%, conteniendo el puré 6,25±1,44 mg β-caroteno eq./ 100 g b.s.
La capacidad antioxidante (umol TROLOX eq./ g b.s.) hidrofílica del fruto fresco, 19,56±0,78, se incrementó en el pulpeado en 31,58%, decreció en la estandarización en 69,20% y permaneció constante (p<0,05) en la pasteurización, teniendo el puré 12,28±0,73, equivalente a una retención de 62,75±2,00%. La capacidad antioxidante lipofílica del fruto fresco, 2,73±0,35, varió decreciendo durante el pulpeado y la estandarización en 19,74% y 47,32%, respectivamente y se incrementó en la pasteurización en 15,90%, teniendo el puré 1,34±0,14, equivalente a una retención de 49,15±1,44%. La capacidad antioxidante total del aguaymanto fue 22,29±1,00, la cual disminuyó durante el proceso, quedando el puré con 13,62±0,75, equivalente a una retención de 61,09±2,07%.
Se obtuvo una correlación lineal entre el porcentaje de retención (con respecto a la materia prima), del ácido ascórbico y de las capacidades antioxidantes hidrofílica y total, con coeficientes de 98,59% y 99,09% b.s., respectivamente. La correlación lineal de los compuestos fenólicos totales y de las capacidades antioxidantes hidrofílica y total, estuvo determinada por los coeficientes 99,33% y 99,75% b.s., respectivamente. Asimismo, la correlación de los carotenoides totales con la capacidad antioxidante lipofílica, fue lineal con un coeficiente de 87,29% b.s.
AGRADECIMIENTO
Al Ing. Mg. Sc. Francisco Salas.
BIBLIOGRAFÍA
1. Coultate T. P. Manual de química y bioquímica de los alimentos. 3 ed. Zaragoza, España: Acribia; 2007.
2. Fennema, O. Química de los alimentos. Zaragoza, España: Acribia; 2010.
3. Tomás-Barberán, F.A.; Ferreres, F. y Gil, M.L. Antioxidant phenolic metabolites from fruit and vegetables and changes during fostharvest storage and processing. Department of Food Science and Technology. Murcia, España. Studies in Natural Products Chemistry 2000; 23: 739-795.
4. Pokorny, J.; Yanishlieva, N.; Gordon, M. 2001. Antioxidantes de los alimentos. Aplicaciones prácticas. Zaragoza, España: Acribia; 2001.
5. Araujo, G.E. El cultivo de aguaymanto o tomatillo (Physalis peruviana L.): Manejo Técnico en los Andes del Perú. Cultivos Andinos. Guía técnica de recopilación bibliográfica. Cajamarca, Perú. 2009. Disponible en http://aguaymanto.blog.galeon.com
6. SIICEX (Sistema Integrado de Información de Comercio Exterior). Exportación del Producto Aguaymanto según sus Principales Mercados en Kg. período 2007-2012. Consultado 25 jun. 2012. Disponible en http://www.siicex.gob.pe
7. Pantelidis, G.E.; Vasilakakis, M.; Manganaris, G.A. y Diamantidis G. Antioxidant capacity, phenol, anthocyanin and ascorbic acid contents in raspberries, blackberries, red currants, gooseberries and Cornelian cherries. Faculty of Agriculture. Aristotle University. Grecia, Francia. Food Chemistry 2007; 102:777-783. Consultado 10 oct. 2010. Disponible en http://www.sciencedirect.com
8. Puente, L.A., Pinto, C., Castro, E. y Cortes, M. Physalis peruviana Linnaeus, the multiple properties of a highly functional fruit: A review. Santiago, Chile. Food Research International 2011; 44: 1733-1740.
9. Muñoz Jáuregui, A.M.; Ramos-Escudero, D.; Alvarado-Ortiz Ureta, C. y Castañeda, B. Evaluación de la capacidad antioxidante y contenido de compuestos fenólicos en recursos vegetales promisorios. Lima, Perú. Revista de la Sociedad Química del Perú 2007; 73(3): 142-149.
10. Vasco, C.; Ruales, J. y Kamal-Eldin, A. Total phenolic compounds and antioxidant capacities of major fruits from Ecuador. Quito, Ecuador. Food Chemistry 2008; 111(4): 816-823.
11. AOAC International (Association of Analytical Communities, USA). Official Methods of Analysis. 18th edition. Current through revision 2, 2007.
12. Swain, T. and Hillis, W. E. The phenolic constituents of Prunus domestica. The quantitative analysis of phenolic constituents. Melbourne, Australia. Journal of Science of Food and Agriculture 1959; 10: 63-68.
13. Talcott S. T. and Howard L. R. Phenolic Autoxidation Is Responsible for Color Degradation in Processed Carrot Puree. Texas, USA. Journal of Agricultural and Food Chemistry 1999; (5): 2109-2115.
14. Arnao, M.; Cano, A. y Acosta, M. The hidrophilic and lipophilic contribution to total antioxidant activity. Department of plant biology. University of Murcia. Murcia, España. Food Chemistry 2001; 73: 239-244.
15. Encina CH. Influencia del descerado y composición del almíbar en la optimización del tratamiento térmico de la conserva de aguaymanto (Physalis peruviana Linnaeus, 1753.) para la mayor retención de ácido ascórbico. [Tesis Mg. Sc.]. Lima, Perú. Universidad Nacional Agraria La Molina; 2006.
16. Repo De Carrasco, R. y Encina Zelada, C. Determinación de la capacidad antioxidante y compuestos bioactivos de frutas nativas peruanas. Lima, Perú. Revista de la Sociedad Química del Perú 2008; 74(2): 108-124.
17. Dutta, D.; Chaudhuri, U.R. y Chakraborty, R. Review. Structure, health benefits, antioxidant property and processing and storage of carotenoids. Department of Food Technology and Biochemical Engineering. Jadavpur University. Kolkata-700032, India. African Journal of Biotechnology 2005; 4 (13): 1510-1520. Disponible en http://www.academicjournals.org/AJB
18. Nicoli, M.C.; Anese, M. y Parpineli, M. Infuence of processing on the antioxidant properties of fruit and vegetables. Italia. Trends in Food Science & Technology 1999; 10: 94-100.
19. Koh, E.; Charoenprasert, S. y Mitchell, A. Effects of industrial tomato paste processing on ascorbic acid, flavonoids and carotenoids and their stability over one-year storage. USA. Society of Chemical Industry. Journal Science Food Agricultural 2011; 92: 23-28.
20. Barrett, D. M. And Lloyd, B. Advanced preservation methods and nutrient retention in fruits and vegetables. California, USA. Journal of the Science of Food and Agriculture 2012; 92: 7-22.
21. Adefegha, S.A. y Oboh, G. Cooking enhances the antioxidant properties of some tropical green leafy vegetables. Biochemistry Department. Federal University of Technology. Akure, Nigeria. African Journal of Biotechnology 2011; 10(4): 632-639.
22. González-Cebrino, F., García-Parra, J., Contador, R., Tabla, R. and Ramírez, R. Effect of High-Pressure Processing and Thermal Treatment on Quality Attributes and Nutritional Compounds of "Songold" Plum Purée. Badajoz, España. Journal of Food Science 2012; 77: C866-C873.
Recibido el 12-03-2013
Aprobado el 14-04-2013













