Introducción
En la actualidad, la contaminación del suelo por metales pesados se está convirtiendo en uno de los problemas ambientales más graves provocados principalmente por la actividad humana, sin embargo, algunas especies vegetales han formado mecanismos fisiológicos y bioquímicos para reducir su impacto controlando la acumulación en las raíces y la traslocación de estos a los diferentes órganos vegetativos (Mendieta & Taisigüe, 2014). Los “metales pesados" se relacionan a un grupo de elementos con propiedades metálicas y semimetálicas, que no son esenciales y son tóxicos para los organismos. (Jadia & Fulekar, 2009) Tanto en su forma elemental y de sal soluble; los metales como el cadmio, níquel, plomo, mercurio, zinc, cromo y cobre son altamente tóxicos (Robinson et al., 1997). Su existencia en el suelo, en el agua y en la atmósfera e incluso en mínimas cantidades puede ocasionar graves problemas en la salud animal y vegetal (Hettiarchchi & Pierzynski, 2002).
Los metales pesados una vez que se encuentran en el suelo pueden permanecer en él, así mismo también pueden fluir en la solución de los suelos a través de distintos mecanismos biológicos y químicos. De igual forma, pueden bioacumularse en distintos cultivos, provocando un incremento de la concentración de estos metales pesados en los tejidos vegetales, y al ser absorbidos por las plantas se incorporarán a la cadena de nutrientes, provocando graves daños al ecosistema (Prieto et al., 2009). La presencia de metales pesados en el suelo tendría efectos negativos en las plantas, no obstante, las plantas muestran una secuencia de mecanismos de resistencia a dichos contaminantes. Entre los efectos negativos que ocasionan los metales pesados se encuentran; la inhibición del crecimiento de las plantas incluidas las raíces y otros órganos (Navarro-Aviñó et al., 2007). De manera similar, la existencia de metales pesados en las células puede conducir a la presencia de especies reactivas del oxígeno (ROS), causando estrés oxidativo y, por lo tanto, se producirá inestabilidad de la membrana celular (Truchado, 2014).
La planta usa este mecanismo de tolerancia en el interior de la célula para detoxificar los metales pesados. De esta manera, el metal se sumerge en interacciones químicas, y durante el proceso metabólico la planta no elimina el metal, sino más bien lo bioacumula en el citoplasma de la célula, por lo que sigue siendo potencialmente tóxico (Navarro-Aviñó et al., 2007). Se realizaron estudios en Brassica oleracea “col”, concluyendo que esta especie acumula menor concentración de plomo en las raíces, a diferencia que a las partes aéreas la acumulación es mayor la concentración de plomo (Hoyos & Guerrero, 2013). En ciertas especies, a medida que la dosis acumulada de plomo aumenta en el suelo, tiende a aumentar rápidamente a los órganos de las plantas, provocando su muerte (Rodríguez et al., 2006). El mecanismo de fitotoxicidad del Pb está relacionado con la permeabilidad de la membrana celular, la reacción del sulfhidrilo (-SH) con los cationes y la afinidad de la reacción con los grupos fosfato (Prieto et al., 2009).
Estudios realizados en Lactuca sativa “lechuga” se concluyó que tiene la capacidad de acumular plomo en sus hojas cuando es expuesta en diferentes tiempos y concentraciones de plomo, así como morfológicos (Madueño, 2017).Asimismo, se determinaron la absorción de metales pesados (cadmio, níquel y plomo) en Coriandrum Sativum L. “cilantro” obteniendo como resultado la presencia de los tres metales en las hojas en diferentes concentraciones, el cilantro es una especie que puede tolerar diferentes metales y grados de concentración albergando una mayor cantidad en sus hojas comparada con sus otras partes como tallo y raíces (Cahuasqui, 2011). Las plantas al mismo tiempo que absorben y bioacumulan también tienen efectos fitotóxicos en su crecimiento causados por diferentes factores.
La fitotoxicidad se utiliza para describir el grado de efectos tóxicos de los factores fisicoquímicos, biológicos o abióticos, que pueden expresarse en diferentes órganos de las plantas. Por lo general, se manifiesta como síntomas que van desde quemaduras en la punta de las hojas hasta clorosis parcial o total (Delgadillo et al., 2011). Las consecuencias incluyen un crecimiento reducido o un retraso en la pérdida de la cosecha (Fernández et al., 2021). La genotoxicidad es la capacidad relativa de una sustancia para dañar el material genético y causar efectos biológicos adversos. El daño al material genético implica no solo el ADN, sino también todos los componentes celulares involucrados con el comportamiento y la función de los cromosomas en las células (Cumpa & Zavala, 2013). La presencia de anomalías celulares depende del aumento de la concentración del mutágeno, si aumenta la concentración de estos agentes, las mutaciones genéticas aumentarán directamente y las anomalías aumentarán exponencialmente. Esto muestra que cuanto menor es la concentración, mayor es el grado de toxicidad (Hemachandra & Pathiratne, 2015).
Se han realizado estudios de genotoxicidad en Allium cepa “cebolla” frente a diferentes concentraciones de metrotexato (Causil et al., 2017), encontrando que cuanto mayor es la concentración de metotrexato, el índice de división celular de A. cepa “cebolla” es menor, lo que demuestra su citotoxicidad, resultados coincidentes de citotoxicidad generado por cobre (Roca-Guzmán & Guerrero-Padilla, 2021). Carriquiborde (2021) señaló el uso de Allium cepa L. "cebolla", Oriza sativa L. "arroz", Raphanus sativus L. "rábano" y Beta vulgaris L. "remolacha", para evaluar el riesgo y el potencial de toxicidad de las sustancias químicas en el medio ambiente. No obstante, el impacto de los metales pesados en las plantas vasculares aún no está claro. Desde entonces, por el acelerado crecimiento de sus raíces y la respuesta inmediata de su material genético a la presencia de potenciales agentes citotóxicos algunos agentes químicos y físicos que causan daño a nivel del ciclo celular podrían tener un efecto tóxico en el proceso de división celular en cualquier tipo de célula eucariota. El motivo es la naturaleza cuasi universal del código genético (Silva, 2003).
Surge la preocupación de realizar estudios debido a que Meseguer (2016) realizó evaluaciones toxicológicas in vitro de los efectos producidos por cadmio, plomo, cromo y selenio en células renales hepáticas a diferentes concentraciones en tres especies de pingüinos de la Antártica en Pygoscelis antárctica “pingüino barbijo”, Pygoscelis papua “pingüino” y Pygoscelis adeliae “pingüino”, el efecto a nivel celular sobre el ciclo celular mostró que los rasgos más característicos celulares y a la vez la sobreexpresión de genes relacionados con la protección y el estrés celular, asimismo se encontró formación de cuerpos de inclusión, fuerte vacuolización, condensación mitocondrial y células con un alto grado de degeneración o necrosadas cuando son tratadas con cadmio (Waisberg et al., 2003).
Solanum lycopersicum L. (Solanaceae) “tomate” es la hortaliza más cultivada y de mayor valor económico en todo el valle de Moche, Santa Catalina, cuya demanda ha incrementado, así como su cultivo, producción y comercio; no obstante, aún no se conoce la concentración real de plomo que puede dañar las células y el crecimiento de las plantas y/o causar daños graves a la salud humana, por lo que este estudio tuvo como objetivo determinar los efectos citotóxicos en células meristemáticas de Solanum lycopersicum L. “tomate” a diferentes concentraciones de plomo.
Material y métodos
Se realizó la germinación de las semillas de Solanum lycopersicum L. (Solanaceae) “tomate” de la variedad Río Grande, teniendo humus como sustrato. El estudio se llevó a cabo con cuatro tratamientos y el control o testigo.
2.1. Diseño experimental
Se utilizaron semillas de Solanum lycopersicum L. “tomate” de la variedad Río Grande, las concentraciones de plomo para los tratamientos fueron: 0.5, 1, 3 y 5 mg/l y el control o testigo, en la preparación de las concentraciones se empleó la fórmula: C1 V1= C2 V2 (Chang & College, 2002). A los 21 días de iniciada la aplicación de los diferentes tratamientos se procedió a realizar observaciones en todas las plántulas de los 4 tratamientos tomando en consideración los indicadores morfométricos y fisiológicos (García, 2006).
2. 2. Observaciones microscópicas
Para observar mitosis se cortó la parte apical de la raíz entre uno y dos cm, posteriormente se trasladó a una luna de reloj, se añadió orceína acética al 2 % y ácido clorhídrico 1N para ser coloreados durante 25 minutos (Fiskesjö, 1997; Urteaga & Lallana, 2005; Muñoz-Solarte & Guerrero-Pepinosa, 2012).
2. 3. Análisis microscópico
Se realizó el conteo de 100 células meristemáticas por campo con un total de 1250 a 3260 células por lámina observadas a través de un microscopio óptico binocular a 400 x. (Latoure et al., 1995). Se determinó el índice mitótico (im), evalúa el número de células en mitosis presentes en el tejido, el cual es una medida de su potencial proliferativo, permite conocer si existe inhibición en el proceso de división celular. Si el valor obtenido es menor que el valor de la solución de control, se puede afirmar que está inhibido. Por el contrario, si el valor obtenido es mayor, significa que existe inhibición que aumenta la división celular. Para el cálculo de las figuras mitóticas anormales se dividió al total de alteraciones de cada fase entre el total de cada fase normal (Latoure et al., 1995).
2. 4. Análisis estadístico
Considerando que se trata de una prueba estandarizada, para el análisis de datos se consideró el protocolo descrito y se empleó estadística descriptiva para la determinación de la frecuencia celular en cada una de las fases del ciclo celular. Con los datos adquiridos se elaboró el análisis de varianza (ANAVA) (Wackerly et al., 2010).
Resultados y discusión
Al realizar las mediciones morfológicas en cada planta se observó que tuvieron crecimiento normal en los diferentes tratamientos (Tabla 1)
Tabla 1: Variables morfométricas de las plántulas de Solanum lycopersicum L. “tomate” sometidas a las concentraciones 0.5, 1, 5 mg/l de plomo
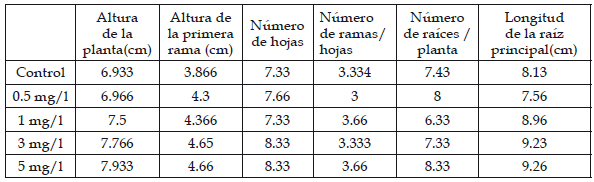
El efecto más resaltante en las plántulas de Solanum lycopersicum L. “tomate” durante la aplicación de las diferentes concentraciones de plomo fue la marchitez en las hojas en las concentraciones de 3 y 5 mg/l de plomo y en las concentraciones de 0.5 y 1mg/l fue menor. Asimismo, se presentó el debilitamiento en las ramas, marchitamiento en las puntas de las hojas; notándose un color amarillo-marrón en los tejidos de las plántulas que se aplicaron concentraciones de 3 y 5 mg/l de plomo.
Durante el tiempo de aplicación de las diferentes concentraciones de plomo a las plántulas de Solanum lycopersicum L. “tomate”, se observó que no afectó en su crecimiento (Tabla 1), el crecimiento fue normal, tal vez debido al tiempo de aplicación y a las diferentes concentraciones de plomo, el nivel de alteración en las raíces depende de la toxicidad de la sustancia y del tiempo que éstas se mantengan expuestas. (Khanna & Sharma, 2013). El síntoma que tuvo efecto rápido en las plántulas fue la marchitez, debido a que el plomo es un metal tóxico que ocasiona la disminución del potencial hídrico en las hojas y del contenido en la clorofila, así como también, el cierre estomático causando la falta de CO2 en la planta, evitando que realice una correcta fotosíntesis (Reyes et al., 2013).
Al evaluar el efecto citotóxico inducido por plomo en las células del meristemo de las raíces de Solanum lycopersicum L. se detectó que existió inhibición en el proceso de división celular, presentó diferentes valores en el índice mitótico en las concentraciones 5, 3, 1 y 0.5 mg/l inferiores al grupo control, relacionado a la mayor concentración de plomo en los tratamientos (Tabla 1).
Estas variaciones en las actividades mitóticas, como en el índice mitótico y los índices de fase mitótica aparecieron dependiendo de las concentraciones de plomo (Fig. 2), al aumentar la concentración del tratamiento, el aumento del índice de profase se correlaciona con la disminución del índice mitótico (Tabla 2), atribuyéndose a la prolongación de la profase que afecta al eje de formación metafásica. Coincidiendo con el resultado de Berrocal et al. (2013) que refirió que la intoxicación de las células ocurre en la etapa en que entran en mitosis.
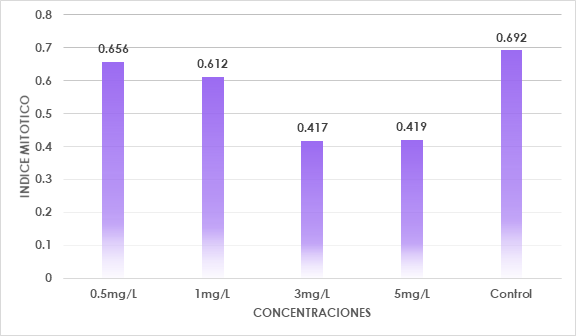
Fig. 2 Índice mitótico en Solanum lycopercicum L. en relación en las diferentes concentraciones de plomo
Tabla 2: Índice mitótico general e índices por fases mitóticas en Solanum lycopercicum L. en las concentraciones 0.5, 1, 3 y 5 mg/l de plomo
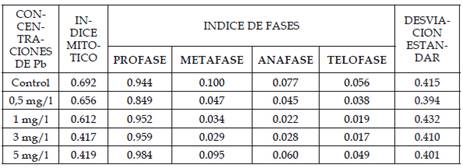
Tabla 3: Análisis de varianza (ANAVA) para los datos del índice mitótico y de fases para las diferentes concentraciones de plomo
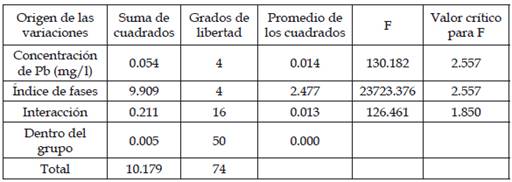
Como F=130 > F (Tabular)=2.557 por lo cual se rechaza la H0: αi=0 al 0.05 de significancia, por lo tanto, la prueba es significativa.
En la figura 3 se observa todas las etapas de la división celular (profase, metafase, anafase y telofase) y en la figura 4 se observa la descondensación del núcleo en la profase, la separación de los cromosomas en el anafase y la formación de 2 nuevos núcleos en la telofase del testigo o control. En la tabla 2 presenta los promedios de cada fase de la división celular y la desviación estándar donde las concentraciones de 3 y 5mg/l de plomo donde se observó que hubo mayor división celular durante las 3 veces que las raicillas estuvieron expuestas a las distintas concentraciones de plomo. En el análisis estadístico (ANAVA) los resultados demostraron que si existe diferencia significativa entre cada tratamiento (P> 0.05). Lo que podría significar que hubo inhibición en el índice mitótico y de fases dependiendo la concentración de plomo.
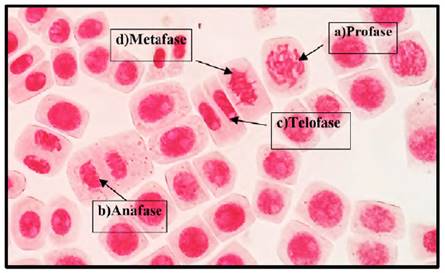
Fig. 3 Fases del ciclo celular del control a 40 x, en Solanum lycopersicum L. “tomate” a) Profase; b) Anafase; c) Telofase; d) Metafase.
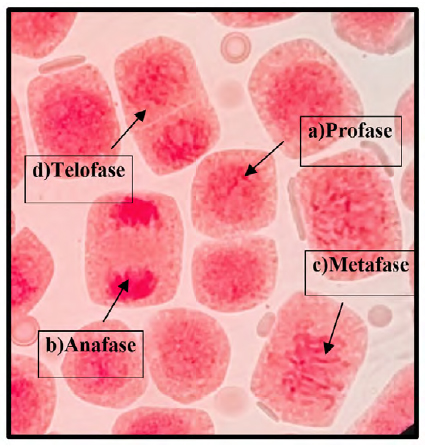
Fig. 4 Fases del ciclo celular del control a 100x, en Solanum lycopersicum L. “tomate” a) Profase; b) Anafase; c) Metafase; d) Telofase.
Las fases del ciclo celular expuestas a la concentración de 0.5, 1, 3 y 5 mg/l de plomo a 40x en Solanum lycopersicum L. “tomate” (Fig. 5 - Fig. 9).
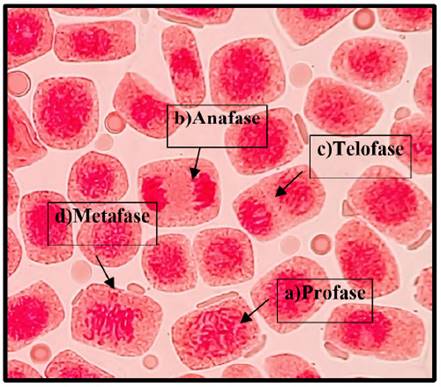
Fig. 5 Fases del ciclo celular expuestas a la concentración de 0.5 mg/l de plomo a 40x, en Solanum lycopersicum L. “tomate”. a) Profase; b) Anafase; c) Telofase; d) Metafase.
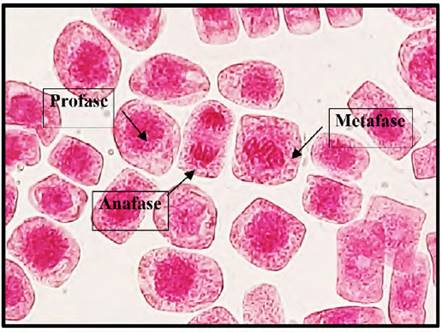
Fig. 6 Profase, anafase y metafase expuestas a la concentración de 1 mg/l de plomo a 40x, en Solanum lycopersicum L. “tomate”
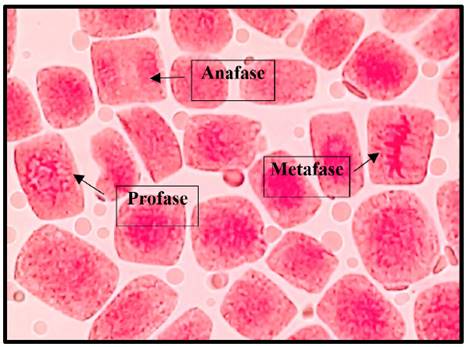
Fig. 7 Profase, anafase y metafase expuestas a la concentración de 3 mg/l de plomo a 40x, en Solanum lycopersicum L. “tomate”
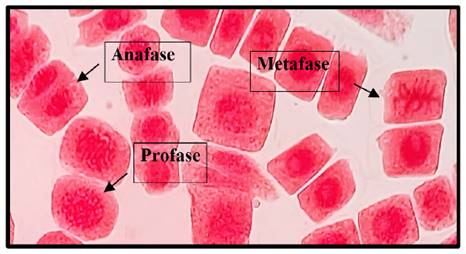
Fig. 8 Profase, anafase y metafase expuestas a la concentración de 5 mg/l de plomo a 40x, en Solanum lycopersicum L. “tomate”
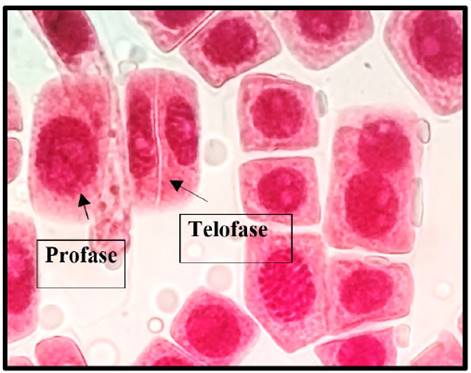
Fig. 9 Telofase y profase expuestas a la concentración de 5 mg/l de plomo a 100x, en Solanum lycopersicum L. “tomate”
La variación del índice se debe a la interferencia del tóxico en el proceso normal de mitosis, reduciendo el número de células que se dividen; la inhibición mitótica también puede ser debido a la inhibición de la síntesis de ADN que es un requisito para que la célula se divida. Estos resultados coinciden con Restrepo et al. (2012) donde concluyen que la presencia de sustancias orgánicas o inorgánicas tóxicas ocasionan en la división celular, los meristemos radiculares pueden inhibirse destruyendo las células o retrasando el proceso de división celular.
Resultados similares obtuvo (Malca et al., 2020) donde concluye que, a mayor era la concentración de metotrexato, disminuía la tasa de división celular de Allium cepa “cebolla”; porque, a mayor concentración de metotrexato, menor era el índice mitótico (Roca-Guzmán & Guerrero-Padilla). La reducción de la actividad mitótica podría ser por el bloqueo de la fase G2 del ciclo celular o por la inhibición de la síntesis de ADN, que evita que la célula entre en su ciclo de división. También puede deberse a cambios en la síntesis de proteínas nucleares y niveles reducidos de ATP que proporcionan energía para el alargamiento de los microtúbulos que forman las fibras del huso, lo que puede reducir la dinámica y el movimiento de los cromosomas (Haq et al., 2016).
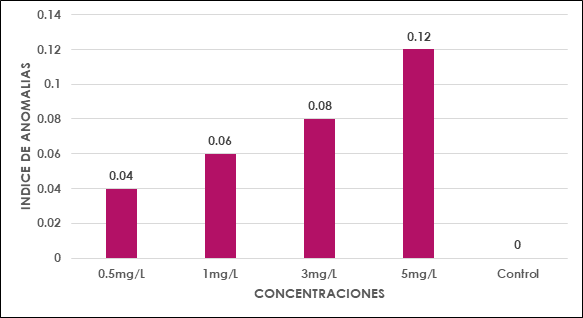
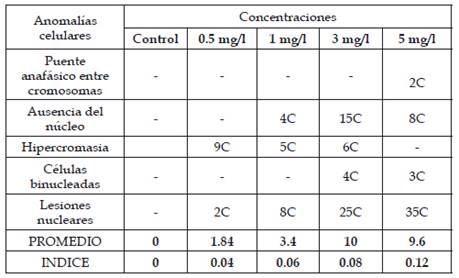
Se reportó anomalías celulares en todas las concentraciones de plomo a 0.5, 1, 3 y 5 mg/l a excepción del control, siendo la más frecuente la hipercromasia y las lesiones nucleares como espacios vacíos dentro de los núcleos (Tabla 4). Se observó que en las concentraciones 3 y 5mg/l presentaron anomalías celulares más altas y a concentraciones de 0.5 y 1 mg/l presentan anomalías como la hipercromasia, lesiones nucleares y ausencia de núcleo.
Tabla 4: Anomalías celulares y número de células anómalas halladas en las concentraciones 0.5, 1, 3 y 5 mg/l de plomo, donde “C” indica células anómalas
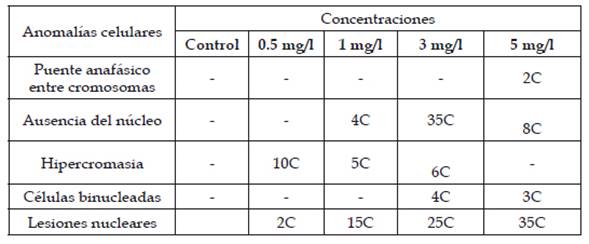
La figura 10 presenta los índices de las anomalías celulares para cada concentración donde los valores más elevados corresponden a las concentraciones de 3 y 5 mg/l seguido por 1 y 0.5 mg/l. En las figuras 11, 12, 13, 14, 15 y 16 se muestran algunas de las células que presentan anomalías celulares en las distintas concentraciones de plomo como células binucleadas, células alargadas, hipercromasia, células sin núcleo y puente en anafase. Se determinó en las diferentes concentraciones de plomo el promedio y el índice mitótico obteniendo el mayor índice de anomalías en las concentraciones 3 y 5 mg/l (Tabla 5).
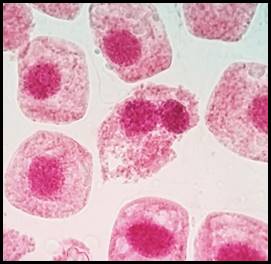
Fig. 11 Células binucleadas expuestas a la concentración de 3 mg/l de plomo a 100 x, en Solanum lycopersicum L. “tomate”
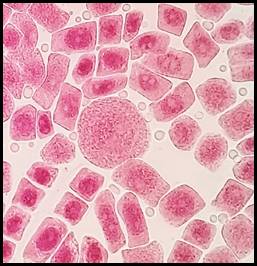
Fig. 13 Célula sin núcleo expuestas a la concentración de 5 mg/l de plomo a 100x, en Solanum lycopersicum L. “tomate”
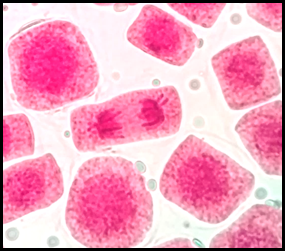
Fig. 14 Puente anafásico entre cromosomas en células expuestas a la concentración de 5 mg/l de plomo a 100x, en Solanum lycopersicum L. “tomate”
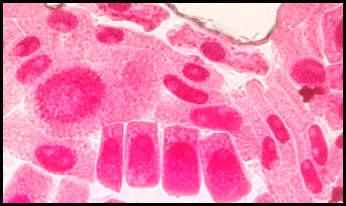
Fig. 15 Lesiones nucleares en células expuestas a la concentración de 5 mg/l de plomo a 100x, en Solanum lycopersicum L. “tomate”
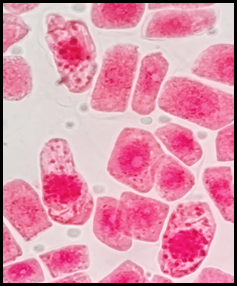
Fig. 16 Hipercromasia en células expuestas a la concentración de 3 mg/l de plomo a 100x, en Solanum lycopersicum L. “tomate”
Tabla 5: Promedio y índice de las anomalías celulares halladas en las concentraciones 0.5, 1, 3 y 5 mg/l de plomo
Las anomalías cromosómicas se distinguen por cambios en el número o en la estructura total de los cromosomas, que pueden suceder de forma espontánea o por efecto ante la exposición de agentes químicos o físicos (Causil et al., 2017). En la presente investigación, con mayor frecuencia se hallaron anomalías cromosómicas en la concentración de 5 mg/l de plomo. El índice de anomalías fue aumentando progresivamente conforme aumentó la concentración del tratamiento (Tabla 5). Este resultado indica que el plomo causa cambios citológicos e induce una amplia gama de anomalías mitóticas en las células del ápice de la raíz de Solanum lycopersicum L. como células alargadas, células binucleadas (Fig. 11), células con micronúcleos (Fig. 12), células sin núcleo (Fig. 13), puente en anafase (Fig. 14), lesiones nucleares (Fig. 15) e hipercromasia (Fig. 16).
Las anomalías halladas en la presente investigación coincidieron con las reportadas por varios investigadores, quienes manifestaron la presencia de sucesos como retrasos en la citocinesis, formación de puentes, metafase con cromosoma retrasado, citocinesis desigual y células binucleadas en interfase, (Berrocal et al., 2013) así como también se han obtenido resultados similares después de utilizar a células meristemáticas de raíz de Vicia faba “haba” usando plomo y cadmio, donde se presentó la mayor cantidad de anomalías celulares en las concentraciones de 5 y 3 mg/l (Mogollón & Plasencia, 2019). La aparición de células binucleadas (Fig.11) se encontró a las concentraciones de 3 y 5 mg/l de plomo y pueden ser producidas a causa de procesos de interferencia que ocurren tarde en la división celular y los cromosomas que no se integraron al núcleo principal a lo largo del ciclo de división celular causan estas alteraciones (Haq et al., 2016). El puente anafásico entre cromosomas (Fig. 14), se encontró en la concentración de 5 mg/l de plomo y se pueden producir por la descomposición de los brazos cromosómicos durante la división celular (telofase) debido a que los dos centrómeros se desplazan a los polos opuestos y pueden permanecer estables formando “puentes” a causa de la resistencia física que estos ofrecen. (Gonzales & Díaz, 2015). En este estudio también se encontró ausencia de núcleo, hipercromasia, daño nuclear y micronúcleos. La formación de micronúcleos indica que los errores mitóticos conducen a roturas del ADN (Causil et al., 2017).
En consecuencia, Solanum lycopersicum L. “tomate” se ha convertido en una de las hortaliza más cultivadas y de mayor valor económico en todo el valle Moche, Santa Catalina, siendo producido y destinado para el consumo humano, en forma directa o cocida, por lo cual se podría inferir, que a grandes concentraciones de plomo dañan las células, el crecimiento de la planta y podría afectar la salud humana (Londoño et al., 2016), por la concentración de los metales pesados como el plomo a grandes concentraciones causan anomalías mitóticas, originando índices de división celular con alto porcentaje de anomalías celulares; el grado de alteración en las células meristemáticas en la raíz dependerá del tiempo y del grado de exposición.
Conclusiones
El plomo generó anomalías cromosómicas en todas las concentraciones empleadas en los tratamientos del presente estudio; el mayor número de lesiones nucleares se presentó en la concentración de 5 mg/l de plomo. La tasa de división celular (inhibición de la división celular) en Solanum lycopersicum L. “tomate” fue menor en 0.5 mg/l y fue en aumento a medida que se incrementó las concentraciones de plomo en los tratamientos.
Solanum lycopersicum L. “tomate” es una especie que brinda un modelo experimental posible de implementar para evaluaciones de efectos citotóxicos. El plomo, es un metal pesado sumamente tóxico que daña las células, el crecimiento de la planta y podría ocasionar daños a la salud del hombre, debido a que el metal pesado se bioacumula en el organismo.












 uBio
uBio