Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta Médica Peruana
versión On-line ISSN 1728-5917
Acta méd. peruana vol.33 no.1 Lima ene./mar. 2016
REVISIÓN
Alimentos con efecto anti-inflamatorio
Foods with anti-inflammatory effect
Lidia Caballero-Gutiérrez1,2,a, Gustavo F. Gonzáles2,3
1 Facultad Ciencias de la Salud, Universidad Nacional del Altiplano. Puno, Perú.
2 Círculo de Investigación en Plantas con Efecto en la Salud. Lima, Perú.
3 Facultad de Ciencias y Filosofía, Universidad Peruana Cayetano Heredia. Lima, Perú.
a Nutricionista.
RESUMEN
El Perú, es considerado como uno de los 12 países del mundo de gran diversidad biológica en plantas y animales, constituyéndose en uno de los centros mundiales de la agricultura y ganadería. Según el Ministerio de Agricultura, la inmensa flora está compuesta por más de 25 000 especies, que equivalen al 10% del total mundial, de las cuales más de 4 000 son plantas alimenticias y medicinales. La alimentación funcional, permite incorporar al organismo alimentos con propiedades no solo nutricionales, sino también quimio preventivas. Actualmente y con el avance del conocimiento es posible la ingesta de fitoquímicos, capaces de reducir el riesgo de desarrollar diversas condiciones patológicas, entre ellas las enfermedades de base inflamatoria; siendo éste un factor de riesgo que puede modificarse con la ingesta de alimentos modulatorios del proceso. La presente revisión se basa en la búsqueda de evidencias asociadas a los principios activos con efecto antiinflamatorio encontrado en los alimentos de uso habitual.
Palabras clave: Alimentos; Antiinflamatorios; Fitoquímicos; Productos naturales (fuente: DeCS BIREME).
ABSTRACT
Peru is considered as one of the 12 countries in the world with great biological diversity in plants and animals, making it one of the world centers for agriculture and livestock. According to the local Ministry of Agriculture, Peruvian exotic flora consists of more than 25,000 species, equivalent to 10% of the world total, and more of 4,000 of them are edible and medicinal plants. Functional feeding allows the incorporation of foods not only with nutritional properties, but also with chemopreventive action. Nowadays, with the advances in knowledge, it is possible to ingest phytochemicals, which are substances capable to reduce the risk for the development of some pathological conditions, including diseases with an inflammatory basis; being this a risk factor that may be modified with foods that may modulate these processes. This review is based in searching for evidenceassociated with the active ingredients with an anti-inflammatory effect of compounds found in commonly used foods.
Key words: Food; Anti-Inflammatory agents; Phytochemicals; Biological products (source: MeSH NLM).
INTRODUCCIÓN
Los alimentos forman parte importante en el mantenimiento de la salud no solo porque proveen de metabolitos primarios, minerales y vitaminas necesarias y esenciales para las funciones del organismo sino porque muchos de sus metabolitos secundarios proveen actividad anti-inflamatoria los que podrían favorecer la homeostasis al mantener un balance entre la inflamación y la anti-inflamación y además de servir de complemento en eltratamiento deenfermedades inflamatorias como las crónicas no transmisibles.
Existe evidencia de que losprocesosinflamatoriossonmodulables antelaingestaregular dealimentos y dietas ricas en fitoquímicos de probado efecto antiinflamatorio. Se ha documentado por ejemplo el efecto de los ácidos grasos poliinsaturados tipo ácido docosahexaenoico (DHA), ácido eicosapentaenoico (EPA), y ácido araquidónico (AA) en la síntesis de prostaglandinas, tromboxanos y leucotrienos anti y proinflamatorios, en los que alcanza una enorme relevancia metabólica el equilibrio que debe darse entre estos 3 ácidos grasos; si predomina AA, la situación proinflamatoriapredomina[1]. Estudios dirigidos con pacientes de alto riesgo y dietas con alto contenido de frutas, vegetales y granos enteros, suplementadas con aceites ricos en EPA, pueden reducir significativamente la producción de biomarcadores inflamatorios [2].
Varios mecanismos han sido propuesto para explicar los efectos antiinflamatorios de los alimentos, y se estima que los efectos pueden darse por modulación de la expresión génica de citoquinas proinflamatorias, modulación de las actividades celulares relacionadas a la inflamación, de la actividad de enzimas proinflamatorias y de la producción de otras moléculas proinflamatorias [3].
Los alimentos por su naturaleza se constituyen en vehículos de un amplio rango de compuestos, que reciben diversas denominaciones: fitoquímicos, fitonutrientes, nutracéuticos, y otros referidos a las sustancias activas que tienen un rol en la modulación de la respuesta antiinflamatoria. Los que inducen estas funciones son entre otros, los compuestos fenólicos [3,4], alcaloides [3], terpenoides [3], flavonoides [5], isotiocianatos como el sulforafano [6], carotenoides [4], y los ácidos grasos poli-insaturados [1], que a su vez representan subgrupos con una amplia gama de metabolitos con reconocida actividad antiinflamatoria. Mucho se ha avanzado en el conocimiento de sus efectos, sin embargo aún se requiere implementar intervenciones dietarias con un enfoque más científico e integral, de tal forma que efectivamente se constituyan en una herramienta preventiva, de práctica simple y accesible a todas las personas.
El presente artículo cumple con el objetivo de realizar una revisión de la información generada sobre el contenido de fitoquímicos de naturaleza antiinflamatoria en los alimentos y su efecto en la salud, utilizando medios electrónicos (PUBMED,SCOPUS, tablas de composición de alimentos) yrevistas de divulgación científica. Para una mejor comprensión se han dividido en cuatro secciones que incluyen el mecanismo proinflamatorio; la alimentación y la Alimentos con efecto anti-inflamatorio antiinflamación; la actividad anti-inflamatoria de los alimentos; y los comentarios finales y conclusiones.
MECANISMO PROINFLAMATORIO
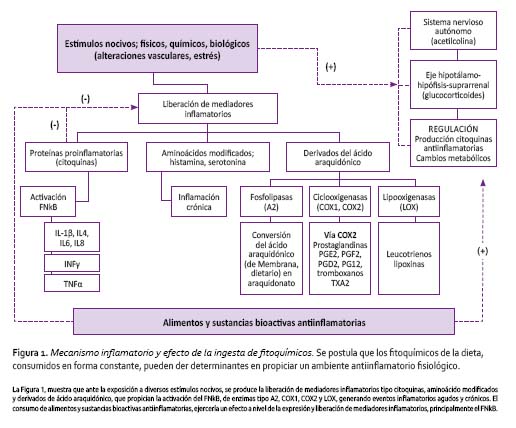
La inflamación, es un mecanismo de defensa del organismo frente a la agresión, y por lo tanto es necesaria. La inflamación constituye una respuesta inespecífica del sistema inmunológico a agentes causales de diversa índole, que determinan cambios fisiológicos que incluyen incremento del flujo sanguíneo y permeabilidad vascular con la liberación de mediadores derivados del ácido araquidónico, aminoácidos modificados y citoquinas, que amplifican el proceso [7], siendo las moléculas antiinflamatorias (IL10,IL4,TGFβ,IL13,GC)reguladoras de estos eventos. Si bien es cierto, el proceso inflamatorio es esencial para la supervivencia de los organismos, dada la enorme cantidad de patógenos ambientales existentes, muchas veces esta capacidad de reacción puede estar exacerbada, generando morbilidad y mortalidad por la generación de una serie de enfermedades. Por ello es importante mantener un balance entre la inflamación y la anti-inflamación y la alimentación pueda coadyuvar a ello.
En este proceso participan una gran variedad de moléculas de señalización; aminas biógenas, proteínas y péptidos, especies reactivas de oxígeno y lípidos para inducir la actividad de una enorme variedad de sustancias de efecto pro y antiinflamatoriodependiendode su participaciónenla respuesta inmunoespecífica [8].
En este contexto, las investigaciones han centrado su atención en el factor de transcripción nuclear kappa B (FNkB), como mediador de los procesos antiinflamatorios inducidos por fitoquímicos; éste es un factor de transcripción implicado en más de 150 genes de sustancias que median la respuesta inmune en diversas vías de señalización [9]. A diferencia de otros factores de transcripción, que generalmente se encuentran en el núcleo, el FNκBse localiza enel citoplasma enunestadoinactivoynecesita un estímulo específico para que pueda formar un complejo con una proteína inhibidora (IkB) para traslocarse al compartimiento nuclear e inducir la transcripción de genes proinflamatorios.
La traslocación incluye procesos de fosforilación, ubiquitinación y degradación en el proteosoma de IkB para que el FNkB llegue al núcleo. Diversos fitoquímicos como los flavonoides, terpenoides, isotiocianatos, y otros polifenoles, pueden ejercer sus efectos antiinflamatorios, inhibiendo, modulando o modificando la vía de traslocación del FNkB [6], en las vías dirigidas por MAPK y Nrf2 que fuertemente inhiben su unión a IkB [5]. Los sulforafanos, que derivan de los isotiocianatos, y estos a su vez de los glucosinolatos, actuarían inhibiendo las subunidades FNkB, ligándose a residuos de cisteína o interactuando con GSH u otros reguladores redox, induciendo efecto antiinflamatorio y antioxidante [6].
Todalafamiliadelos r-Toll,las citoquinas inflamatorias tipo IL-1β, TNFα, y la proteína kinasa tipo JNK, son reconocidos inductores de la traslocación del FNkB. Los genes activados, incluyen aquellos que codifican los mismos factores responsables de su activación, es decir, activan la transcripción de los genes tipo IL- 1β y TNF-α, citoquinas inflamatorias como IFN-γ, IL-6, IL-2, IL-8, moléculas de adhesión como I-CAM, Selectina-E, VCAM, enzimas como sON, LPOX, COX y el receptor de tromboxano, vías muy activas en la inflamación crónica [10]. La Figura 1 nos muestra la vía por la cual los fitoquímicos de los alimentos podrían generar un efecto antiinflamatorio.
LA ALIMENTACIÓN Y LA ANTIINFLAMACIÓN
La alimentación, se constituye en un factor en la modulación de la respuesta inflamatoria. Los fitoquímicos presentes en los alimentos, en su forma original o al ser metabolizados, pueden formar metabolitos activos y comportarse como mensajeros intracelulares activando o inhibiendo la expresión de genes involucrados en los procesos inflamatorios. Uno de los regímenes que cumple esta característica es la dieta mediterránea, rica en vegetales, legumbres, frutos frescos y secos, cereales, bajo en grasas saturadas, constante en vino, aceite de oliva y pescado [11], la cual promueve la reducción de eventos cardiovasculares [12], cáncer y enfermedades crónicas.
Lo importante es que con el consumo adecuado de alimentos es posible generar un ambiente antiinflamatorio al aumentar el consumo de fitoquímicos, controlando la ingesta de alimentos ricos en AGPI-6, aumentando las fuentes de AGPI-3, restringiendo alimentos que conviertan el AA en prostaglandinas E2 y LTB4, y evitando ingestas grandes de hidratos de carbono que causen picos de insulina [1]. Todo ello se logra recomendando una ingesta regular, continua y cotidiana de frutos y verduras, para generar efectos quimiopreventivos en la salud a corto y largo plazo [13] y un adecuado estado de nutrición.
Clasificación de los fitoquímicos activos de los alimentos
Las familias de los principales fitoquímicos con propiedades anti-inflamatorias son los carotenoides, compuestos fenólicos, alcaloides, compuestos nitrogenados y órganosulfurados [3].
Los compuestos fenólicos, se constituyen en el grupo más abundante de sustancias bioactivas, presentes en alimentos con pigmentos principalmente oscuros y coloridos [11] en una amplia variedad de frutos, vegetales y especias, capaces de interferir en procesos bioquímicos y metabólicos asociados al desarrollo y progresión de enfermedades inflamatorias, pudiendo inhibir la actividad mutagénica y activar procesos detoxificantes [12], antivirales y antioxidantes [14]. Se estima que la ingesta diaria de ácidos fenólicos totales provenientes de la naturaleza no debe exceder los 100 mg/día. Sin embargo, las bacterias colónicas pueden transformar las antocianinas, proantocianidinas, flavanonas, flavonoles, taninos e isoflavonas, a metabolitos fenólicos, aumentando su capacidad funcional [14].
Según Bellik y col. [3], los fenoles pueden subdividirse en ácidos fenólcios, flavonoides, estilbenos, cumarinas y taninos. Entre estos los flavonodies se constituyen en una subfamilia importante donde se encuentran los flavonoles, las flavonas, flavanoles, flavanonas, antocianidinas, e isoflavonoides.
ACTIVIDAD ANTI-INFLAMATORIA DE LOS ALIMENTOS
Las frutas, vegetales, tubérculos, aceites y oleaginosas son los alimentos con mayor proporción de fitoquímicos y fuente de nutrientes principales. En las Tablas 1, 2, 3 y 4 se muestran evidencia de su uso en la dieta, la forma de ingesta y el mecanismo antiinflamatorio que pueden inducir.
FRUTAS
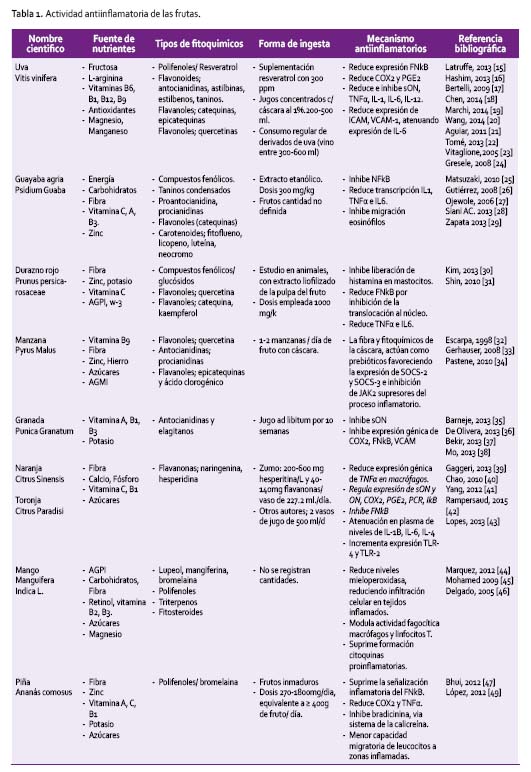
Las frutas y verduras son componentes esenciales de una dieta saludable y un consumo diario suficiente podría contribuir en la prevención de enfermedades, principalmente aquellas relacionadas a procesos inflamatorios. El consumo de frutas y verduras variadas garantiza un consumo suficiente de la mayoría de los micronutrientes, de fibra dietética [13] y de una serie de fitoquímicos con efecto antioxidante y antiinflamatorio. En la Tabla 1 se destacan las fuentes de nutrientes, los fitoquímicos, la forma de ingesta y los mecanismos antiinflamatorios de varias frutas.
Existe una amplia variedad de fitoquímicos como carotenoides, flavonoides y otros polifenoles decomprobadafunción orgánica, que se encuentran ampliamente distribuidos en los frutos [48], que llevan a caracterizar a los alimentos como funcionales, porque además de su contenido nutricional actúan como poderosos agentes antiinflamatorios, pudiendo interferir en algunos procesos bioquímicos y metabólicos asociados con el desarrollo y progresión de enfermedades inflamatorias. Más de 5000 de estos compuestos polifenólicoshansido caracterizados. Muchos flavonoides pueden suprimir la sON y neutralizar RON y ROS implicados en la expresión génica inflamatoria [49].
Las uvas, vino, moras son ricos en un polifenol, el resveratrol, importante por sus propiedades asociadas a la inmunidad, reducción del estrés oxidativo [20] y efecto antinflamatorio, asociado a la reducción de mediadores proinflamatorios [18]. Las intervenciones nutricionales son numerosas y son los jugos concentrados de uva, al 1% los que mejor efecto han demostrado en la reducción del TNFα y la expresión del mRNA de la sON [50], mediadores capaces de reducir la severidad del daño inflamatorio; inclusive se ha reportado que las proantocianidinas de las semillas de la uva fresca, pueden prevenir la inflamación colónica [19] al reducir la expresión de genes implicados en el proceso [51]. Se establece que el efecto parece depender del tiempo y línea celular en la cual actúe; se ha demostrado que 5g de resveratrol puede incrementar los niveles de TNFα en monocitos e inhibir IL-10, hasta 48 horas después del consumo [52].
Las investigaciones sobre el consumo de uva y vino de forma regular, sugieren propiedades preventivas de enfermedad. La evidencia muestra que el consumo de 200-500 ml de jugo de uva, presenta moderada a fuerte evidencia de efectos positivos [21]. Aunque el contenido de resveratrol depende de la situación de estrés al cual haya sido sometida la planta, encontrándose una mayor producción debido a infecciones, radiación solar y daño mecánico; igualmente, se encuentran, considerables diferenciasenrelacióna la regióngeográfica, altitud, condiciones de crecimiento y tecnologías empleadas en la elaboración del vino [16].
La guayaba amarga y rosa y diferentes variedades, tanto en pulpa y piel, presentan más cualidades fitoquímicas, de olor y sabor que las de color más claro; se han identificado numerosos taninos, flavonoides, aceites esenciales, saponinas, carotenoides, lectinas, ácido elágico, triterpenoides, guajaverina, quercetina, vitamina C y otros fenoles que ejercerían la función antiinflamatoria y antioxidante [27,53,54]. La guayaba, se constituye en un fruto de excelentes condiciones nutricionales por su bajo contenido de carbohidratos, grasas y proteínas, alto contenido de agua, importante contenido de vitaminas hidrosolubles: B1, B2, B3 y C (3-6 veces más que la naranja), además de vitamina A [48], sin embargo, el estudio en intervenciones nutricionales no es determinante.
En forma similar, los duraznos rojos, son los que mayor contenido de fenoles. Contiene más flavonoides que los duraznos y melocotones blancos y amarillos. Sin embargo, el contenido de estos principios se reduce con las técnicas de procesamiento, determinando cambios en sus características químicas; por tanto son los duraznos frescos con piel, los que ejercen un mejor efecto. El mecanismo implicado se asocia a la inhibición del proceso de glicación, reducción de la capacidad de producir ROS y menor liberación de mediadores inflamatorios [55].
En las manzanas, los principios activos (quercetina, antocianidinas, procianidinas, epicatequinas y ácido clorogénico), se concentran en la cáscara (40 a 50% del contenido), siendo su concentración 3 veces superior a la pulpa [45]. Su consumo en forma de jugo o natural (1-2 manzanas/día), ejerce efectos antiinflamatorios y moduladores del metabolismo carcinógeno y antioxidante [46]. Estudios en animales infectados con helycobacter pylori, utilizando extractos de cáscara, en 20 días produjo un efecto protector del daño inflamatorio en la mucosa gástrica por interferencia en la colonización de la bacteria. La fibra actuaría como prebiótico, disminuyendo la inflamación, por expresión de moléculas supresoras de la señalización antiinflamatoria (SOCS-2, -3 e inhibición de JAK2) [47].
A la granada, se han atribuido diversas propiedades tanto antiinflamatorias, antioxidantes como antitumorígenas por su contenido de antocianinas y elagitaninos. El consumo como jugo ad libitum por 10 semanas, inhibe la liberación de sON, expresión del RNA COX2, FNkB y VCAM, contribuyendo a los mecanismos anti-inflamatorios [56] y actividad antioxidante [57]. Las antocianinas, son compuestos bioactivos, presentes en una gama de frutos y vegetales de color, capaces de actuar en diferentes células y sistemas, ejerciendo un efecto protector contra TNFα, induciendo la secreción de MCP1, mediadora del reclutamiento de macrófagos a los sitios de infección o inflamación como el endotelio vascular [58], previniendo procesos inflamatorios sistémicos. Son diversas las fuentes alimentarias, por lo que de la variedad del consumo depende la capacidad protectora de la dieta.
Los cítricos: naranja, y toronja, son fuente del flavonoide naringenina, que a concentraciones utilizadas en la dieta habitual reduce la expresión génica de TNFα en macrófagos [39]. A nivel cardiovascular y cerebrovascular, ejercen efectos protectores, reduciendo la expresión de la sON y COX2 [40]. Otro de los principios activos es la hesperetina, que junto a la naringenina de la cáscara y zumo de naranja (200 y 600 mg de hesperidina/L y entre 40 y 140 mg de flavanonas glicosiladas/vaso) [14], inducen un efecto regulatorio negativo del FNkB con reducción de PGE2, COX2 y ON, en macrófagos de las células del músculo liso, importante a nivel vascular [41].
En este grupo, el limón, a través del eriodictiol, ejerce sus propiedades antiinflamatorias bloqueando la expresión del FNkB, reduciendo la actividad del ON, aunque con baja actividad fagocítica de los macrófagos [59]. Se ha establecido, que el consumo de concentraciones dietéticas, determinan niveles plasmáticos bajos, pero ejerce modificaciones hepáticas (metabolismo, glucuronidación y sulfatación), pudiendo generar diversos efectos sistémicos [60].
El lupeol, la mangiferina (mango) y la bromelaina, son los compuestos activos [44] del mango y piña, además de polifenoles, triterpenos, fitosteroides, ácidos grasos y microelementos. El lupeol, se encuentra en varios frutos y verduras (fresas, higos, uvas rojas, repollo, pepino, tomates, aceitunas, zanahorias, pimientos verdes). In vitro e in vivo, reducen los niveles demieloperoxidasa,reduciendo lainfiltración celular en tejidos inflamados, modulando la actividad fagocítica de macrófagos y linfocitos T y suprime la generación de citoquinas proinflamatorias [45]. El extracto de la corteza del tallo delmango,en alteraciones asociadas alestrés,tieneefectos preventivos en neuroinflamación y daño oxidativo [44],asociado al contenido de mangiferina, zinc, cobre y selenio [48].
La piña, contiene la bromelaína de efecto analgésico, antitrombótico, antifibrinolítico y antiinflamatorio en dosis desde 270 a 1800 mg/día [49], equivalentes a ingestas ≥ 400g de fruto. Sus efectos se producen por supresión de la señalización inflamatoria del FNkB, con reducción de COX2 y TNFα. A nivel local el efecto antiinflamatorio se produciría por inhibición de la bradikinina vía supresión del sistema de la calicreína, con reducción de la fibrina por modulación de los intermediarios Alimentos con efecto anti-inflamatorio de la cascada de coagulación y menor migración y adhesión de leucocitos en las zonas inflamadas [47].
Las paltas son alimentos de gran interés nutricional, contiene moléculas lipídicas poliinsaturadas, de importancia, como sustrato en la formación de citoquinas antiinflamatorias. Se ha estudiado su efecto en la reducción del daño inducido por rayos ultravioleta e inflamación local en piel, constituyéndose en fotoprotector de queratinocitos, reparador del ADN y reductor de IL-6 y PGE2 [61].
VEGETALES
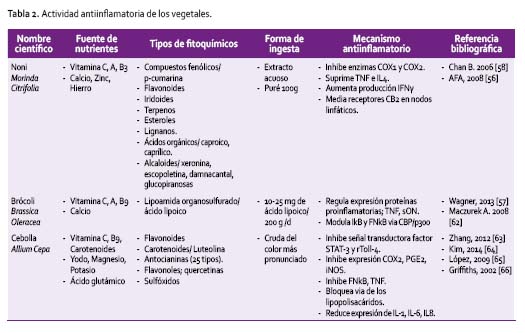
Los vegetales, constituyen un gran grupo de alimentos cuyo consumo forma parte de la estrategia mundial que propende el consumo de frutas y verduras; son las únicas fuentes naturales de vitaminas, minerales y fibra y tienen una baja densidad energética. Considerando las recomendaciones de consumo >500g/d, se han diseñado diversos estudios, demostrando la eficacia del consumo en una serie de variables, perfil lipídico, glucosídico, antropométrico [67], antioxidante y antiinflamatorio. Pese a que el conocimiento es amplio al respecto aún la adherencia a las recomendaciones no se logra en todas las poblaciones del mundo [13]. En la Tabla 2 se muestran detalles del Noni, cebolla y Brócoli.
El Noni; es una de las plantas tropicales más cultivadas en el mundo, crece en todas las altitudes y contiene cerca de 160 fitoquímicos, entre ellos los compuestos monoterpénicos del geraniol, denominados iridoides y la quercetina ejercen un rol importante en los procesos antiinflamatorios [68]. La pulpa es jugosa, gelatinosa y amarga, con fuerte olor y sabor a ácido butírico.
Es utilizado en el tratamiento de muchas enfermedades, entre ellas las inflamatorias, pues actúa inhibiendo las enzimas COX1 y COX2 comparable al efecto de antiinflamatorios comerciales [58]. También se ha demostrado que suprime TNF e IL4, aumenta la producción de IFNγ, y se constituye en un mediador de los receptores canabinoides CB2 en nodos linfáticos, contrarrestando la respuesta proinflamatoria en tejidos periféricos como bazo, células hematopoyéticas y sistema inmunológico [56]. Aunque algunos estudios han reportado un efecto hepatotóxico ante ingestas en extractos que parecen estar asociadas al contenido de antraquinonas, aspecto que no se ha reportado en el noni fresco [69].
La cebolla, uno de los productos más utilizados en la cocina, es fuente de una vasta gama de fitoquímicos como la luteolina, glucósidos de luteolina y flavonoles. Estas flavonas, ejercen propiedades antimutagénicas, antitumorígenas y antiinflamatorias. In vitro, la luteolina induce la inhibición en la producción de citoquinas, a través de cambios epigenéticos del FNkB en monocitos hiperglicémicos, reduciendo la expresión de citoquinas proinflamatorias, quimoquinas y enzimas (TNF, IL-1, IL-6, IL8, COX2, iNOS) [63,64]. La luteolina e isotiocianatos, inhiben la activación de AP1, regulador transcripcional de la respuesta inflamatoria sistémica [64], inhibidor de la señal transductora y activadora del factor STAT3 y receptor Toll4, bloquea la vía de los lipopolisacáridos en la producción de citoquinas inflamatorias [63]. Son las cebollas de color y de sabor más pronunciado las que presentan mayor actividad [66].
Algunas crucíferas, como el brócoli, otros como la sábila, apio, tomillo y ajíes, se encuentran en este grupo por su importante contenido de compuestos órgano sulfurados, luteolina, flavanoles e isotiocianatos. La luteolina es el principal componente del brócoli, considerado mediador de los procesos antioxidantes y antiinflamatorios asociados con la edad, actuando de forma sinérgica con el contenido de vitaminas y minerales. La luteolina muestra ser efectiva como inductora de la expresión de HO-1, capaz de inhibir los mecanismos proinflamatorios derivados de los macrófagos [70]. Existe evidencia de que puede ejercer efectos citoprotectores aún a bajas concentraciones, aspecto concordante con el aporte alimentario continuo.
TUBÉRCULOS
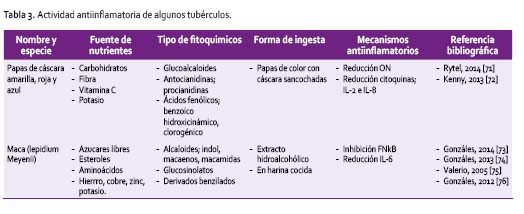
En general, se establece que existe una relación entre la concentración del pigmento de los alimentos y su contenido en fitoquímicos. Las frutas, verduras, legumbres y tubérculos, de presentación coloreada disponen de procianidinas, antocianinas y ficocianinas además de otros fitoquímicos [84]. Los tipos de fitoquímicos y los mecanismos anti-inflamatorios de los tubérculos se encuentran en la Tabla 3.
Las papas son productos base de la alimentación peruana y son consumidas en una variedad de formas como fresca, congelada, seca, fermentada, cocida, y horneada. Las papas contienen glucoalcaloides y las de pulpa roja y azul son particularmente ricas en cianidinas, y representan el 90% del contenido fenólico en los tubérculos.
Estos compuestos, se encuentran en la cáscara, 3-10 veces más que en la pulpa y es más alta que en papas de pulpa blanca. Las variedades de color azul (43,3 a 56,7 mg/100g) tienen más ácido clorogénico que las de color amarillo (23,3 mg/100g), aunque depende de factores como cosechas/año, condiciones climáticas, enfermedades, tratamiento y manipulación. Prácticas de reducción de los fitoquímicos son el pelado (80%), picado (70-80%) aclarado (43%), cocción de papa pelada al agua (60%), en microondas (45%), secados prolongados (100%). La práctica de cocción sin pelar al horno, hervidas, o en microondas protegen de la pérdida de los compuestos fenólicos pues migran de la piel y la corteza a la pulpa del tubérculo [71], favoreciendo tras su ingesta un efecto antiinflamatorio, mediante la reducción del ON y citoquinas: IL2 e IL8 [72].
Estos principios son compartidos también en los porotos morados [88], poroto de soya negro [64], maíz morado, y alimentos en la gama del rojo al azul [89] y algas azul-verde como la espirulina [90], aunque sus efectos han sido ensayados con extractos, la información es escasa respecto a intervenciones dietéticonutricionales, lo que no impide recomendar su consumo por el contenido nutricional y fitoquímico.
El hipocótilo de la maca (Lepidium meyenii) que pertenece a la familia brassicaceae o cruciferae, crece en los andes centrales del Perú a más de 4000 metros de altitud. Han sido descritas hasta 13 fenotipos caracterizados por el color externo, de los cuales la maca negra, roja y amarilla son las más estudiadas. El hipocótilo, que constituye la zona reservante de la planta, dispone de azúcares libres, esteroles, aminoácidos, minerales (hierro, calcio, cobre, zinc y potasio), así como principios activos; macaenos (0,09-0,45%), macamidas, glucosinolatos [73], y derivados benzilados como la macaridina [91], oxindoles y alcaloides tipo indol, que determinan una amplia variedad de efectos, entre ellos el antiinflamatorio, a través de la inhibición del FNkB, en alteraciones inflamatorias crónicas, [75].
Su efecto antinflamatorio, ha sido observado en consumidores crónicos de maca, en los cuales se encontraron niveles más bajos de IL6 [74]. Algunos de sus principios activos están relacionados a otras especies de lepidium como la mostaza, el nabo, col, berros [76], brócoli, reconocidos por sus propiedades preventivas, asociados al contenido de isotiocianatos [92], que a dosis dependiente, inducen la reducción de la expresión de IL1β, TNFα, IL6, óxido nítrico a través de sON y enzimas COX2 asociadas a la producción de citoquinas proinflamatorias [92]. Los isotiocianatos dietarios son eficientemente absorbidos (≥80%), pero aún se requieren estudios respecto a su bioactividad [93].
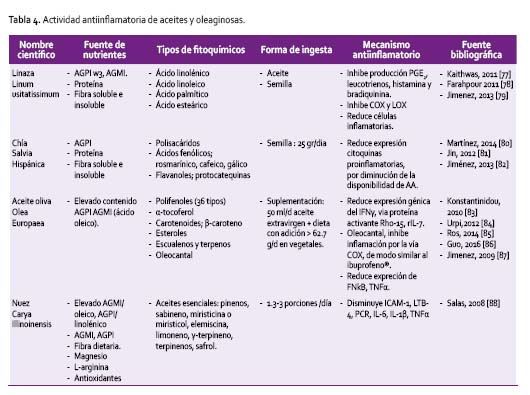
ACEITES Y OLEAGINOSAS
Un grupo de alimentos que son utilizados como aditivos en las preparaciones culinarias son los aceites y oleaginosas, de importancia por el tipo de ácidos grasos en su contenido (Tabla 4).
La linaza, pertenece a este grupo y alcanza importancia por su composición en ácidos grasos esenciales como el ácido linolénico (18:3C), conocido como omega 3, el cual vía desaturasas y elongasas se transforma en EPA (20:5C) y posteriormente en DHA (22:6C), su contenido alcanza el 55,3%, aunque su biodisponibilidad a partir de la dieta es baja, siendo necesario un consumo regular.
Se han documentado efectos con el consumo de la linaza en aceite y extractos, pudiendo establecer capacidad antiinflamatoria, inhibiendo la producción de PGE2, leucotrienos, COX y LOX por la vía del metabolismo del araquidonato [94]. Comparte propiedades con el aceite de sacha inchi, planta de la selva peruana rica en ácido linolénico (omega 3), su consumo como aceite a dosis de 15 ml/día, puede aumentar los niveles plasmáticos de este ácido graso a las 2 horas de ingesta, pudiéndose constituir en un importante protector cardiovascular [95].
Otro de los aceites de suma importancia por sus comprobados efectos es el aceite de oliva extravirgen. Este aceite es fuente de AGPI, principalmente asociado al ácido oleico, que tiene la propiedad de reducir los efectos inflamatorios, inhibiendo la incorporación del ácido esteárico a los fosfolípidos, reduciendo la expresión génica de los marcadores INF-gamma, Rho proteína activante de la GTPasa-15 y rIL-7, con disminución de las concentraciones de TNFα, ICAM-1 y CRP [83]. Sin duda, los efectos que se esperan ante la ingesta de estos productos, son sumativos y complementarios a las características de la dieta. Se han probado efectos a corto y a largo plazo con dietas con contenido de frutas y verduras > a 500g /día [84].
Otro de los productos que van alcanzando protagonismo por sus propiedades son las nueces, término que incluye a la familia de las castañas, maní, almendras, nueces de macadamia. Son fuente de magnesio, mineral asociado inversamente a marcadores de la inflamación; PCR, VCAM-1 [87]. La importancia del consumo radica en el alto contenido de ácido linolénico (omega 3), que reduce la expresión del RNA del TNFα, disminuyendo la formación de citoquinas proinflamatorias [82]. Otro de los constituyentes de las nueces es la L-arginina, importante por ser sustrato de sON en la producción del ON, directamente relacionado con el efecto modulador de la inflamación a nivel del endotelio [84]. Un consumo dietario diario, es decir en conjunto con una dieta rica en antioxidantes, ha probado tener un efecto en la promoción de un ambiente endógeno antiinflamatorio.
La chia, es una semilla de reconocimiento reciente por su contenido nutricional y químico, rico en polisacáridos, acidos fenólicos (rosmarínico, cafeico, gálico), protocatequinas y daidzeína, que le confieren actividad antioxidante [80]. Su contenido graso (25 al 40%) se distribuye en ácido linolénico (Omega 3) (60%) y ácido linoleico (Omega 6) (20%); además son fuente de tocoferoles, fosfolípidos, esfingolípidos y esteroles [79]. Sus funciones están asociadas al control del metabolismo lipídico y expresión de citoquinas anti-inflamatorias [122], aunque su uso requiere aún de más investigación.
PESCADOS AZULES
Se ha sugerido que los síntomas relacionados con la edad mejoran con una dieta enriquecida con substancias activas, vitaminas y minerales. Uno de los campos del conocimiento poco explorado es el referido al mundo marino, que representa una reserva infinita de ingredientes bioactivos, por su contenido de aceites con omega-3, carotenoides, vitaminas, minerales y péptidos procedentes de esponjas, algas y peces de aguas profundas, que proveen una variedad de beneficios en la salud.
En ese marco, la dieta puede representar un potencial agente terapéutico. Así, el pescado es fuente de AGPI, carotenoides, compuestos fenólicos, galactanos, alginatos, sustancias que actúan como inhibidores COX1 y COX2, modulan la expresión del FNkB actuando como potentes antiinflamatorios, pero a partir de un consumo regular [108]. Los ácidos grasos omega-3; DHA, y EPA, han alcanzado una singular importancia, porque son capaces de inhibir un gran número de pasos en la cascada de la inflamación desde la quimotaxia de los leucocitos, expresión de moléculas de expresión e interacciones de la adhesión de los leucocitos con el endotelio, producción de eicosanoides hasta la producción de citoquinas inflamatorias y reactividad de los linfocitos T helper [109].
En los pescados azules o pescados de carne oscura y en el aceite de pescado, se han encontrado importantes cantidades de EPA, DHA y DPA, estableciéndose un efecto dosis dependiente (Tabla 5). El bajo consumo de pescado determina ingestas <0,2 g/d, en tanto que una porción de pescado puede proveer cerca de 0,2-0,3 g/d, pero el consumo de caballa, jurel o bonito aseguraría ingestas entre 1,5 a 3 g/d. Ensayos con 2,1g EPA y 1,1g DHA, demostraron una reducción en el contenido de AA y aumento de EPA en células mononucleares humanas en 12 semanas, con inhibición en la transcripción del FNkB, activación de la transcripción de PPARγ y unión al receptor de la proteína G, para facilitar la incorporación de fosfolípidos a la membrana mejorando su fluidez y funcionalidad [109].
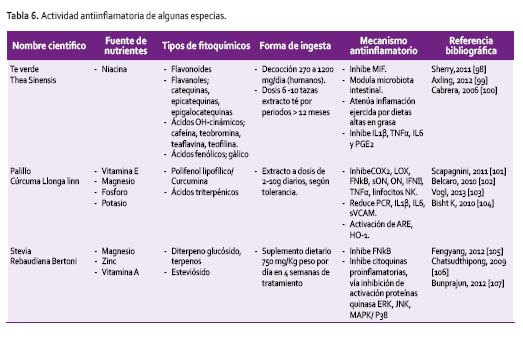
ESPECIAS
La comida peruana es reconocida por el uso de importantes cantidades de condimentos, los mismos que son empleados en pequeñas cantidades como saborizantes y colorantes. Estas especias son compuestos fenólicos que se constituyen en moduladores de la respuesta antiinflamatoria. La información científica generada es amplia, y se tiene que el mecanismo de acción se centra en el hecho de que los polifenoles pueden generar efecto antiinflamatorio sobre la base de su efecto antioxidante, modulando los procesos de señalización celular durante la inflamación. Se ha encontrado que justamente son los condimentos, especias y hierbas las que tienen un poder antioxidante excepcionalmente alto, principalmente en los productos secos y se establece un efecto dosis dependiente [110] (Tabla 6).
El té verde, es la materia prima de una de las bebidas de consumo más antiguas en el mundo. Esta especia contiene polifenoles que incluyen flavanoles, flavandioles, flavonoides, ácidos fenólicos y catequinas, que una vez consumidas se absorben, metabolizan, metilan, sulfatan y glucuronizan para ejercer numerosos efectos, antiinflamatorios y principalmente antioxidantes con dosis muy variables. En un estudio se han empleado extractos equivalentes a un consumo entre 6 a más de 10 tazas de té por día, donde el periodo de ensayo fue de 12 meses [98]. Los resultados mostraron fuerte inhibición en la producción de citoquinas proinflamatorias: IL1β, TNFα, IL6 y PE2 [111], aunque altas concentraciones de epigalocatequinas. En otros estudios mostraron efectos prooxidantes [112]. Esto revela la necesidad de profundizar más los estudios usando protocolos adecuadamente diseñados.
La curcumina es un ácido hidroxicinámico, principal componente de otro de los condimentos de amplia utilización como el palillo. Es una de las especias que mayores efectos determina como antioxidante, antiinflamatorio y analgésico [113]. Se han ensayado tratamientos prolongados de 8 meses con 200 mg de extracto de curcumina, lográndose un efecto antiinflamatorio por disminución de IL1β, IL6, sVCAM y PCR [102] activando múltiples genes de defensa, como la HO-1 a diferente nivel celular activando factores NrF-E2 y ARE, constituyéndose en un factor protectivo contra la inflamación, daño oxidativo y muerte celular [101]. Dosis de 2-10 g/d de cúrcuma doméstica, por periodos > 6 semanas, ejerce similares efectos, aunque depende de la tolerancia [113].
Otra de las especias de amplio uso, es la estevia, en hoja o polvo, que es un endulzante natural no calórico, 250-300 veces más dulce que la sacarosa. El principio activo es el esteviósido, un diterpeno glucósido que a nivel intestinal se modifica a esteviol, ejerce un efecto antiinflamatorio inhibiendo la activación del FNkB vía IkB y la señalización mitogénica de las proteínas kinasa (ERK, JNK y P38) en células monocíticas, obstruyendo el proceso transcripcional y regulando la liberación de citoquinas proinflamatorias [105]; además aún a pequeñas dosis inhibe la absorción de la glucosa en un 40% por reducción en el contenido de ATP en la mucosa del intestino [106].
Es conocida la actividad antioxidante y antiinflamatoria de otras especias empleadas masivamente en la cocina, como la canela, pimienta, clavos de olor, orégano, romero, llantén; sin embargo, el efecto es dosis dependiente, donde la tolerancia es un factor de importancia en la adherencia al tratamiento. El reto está en incorporar el conocimiento generado, en el diseño de intervenciones dietarias, que permitan el logro de los objetivos asociados a la antiinflamación.
COMENTARIOS FINALES
La alimentación, no solo corresponde al acto de respuesta al hambre, sino a la práctica de consumo de nutrientes y substancias necesarias para mantenerse saludable. La naturaleza nos ofrece una diversidad muy grande de alimentos con un gran contenido de nutrientes y compuestos activos: polifenoles, flavonoides, carotenoides, órgano sulfurados, entre otros, que consumidos de forma regular, continua y dirigida, pueden inducir procesos moduladores de la inflamación como forma de prevenir enfermedades asociadas y alcanzar una mejor calidad de vida.
Uno de los más preocupantes problemas de tipo inflamatorio no infeccioso es el cáncer. En la actualidad se ha acumulado bastante evidencia, a veces no suficiente, que asocian determinados productos naturales de la dieta en la prevención y tratamiento de cáncer como por ejemplo del hígado. Entre estas figuran las uvas, la zarzaparrilla negra (Ribes nigrum), ciruela, granada, crucíferas, vainita, tomates, espárragos, ajos, soya, cúrcuma (Curcuma longa), kion (Zingiber officinale), el salvado y algunos macrohongos comestibles. Estos productos pueden actuar en la inmunomodulación protegiendo al hígado contra el cáncer [114]. Un compuesto producido en las crucíferas, el sulforafano, también es reconocido como importante para la prevención y tratamiento del cánceres como el de mama, próstata, colon, piel, pulmón, estómago o vejiga, pero también es útil para otras enfermedades inflamatorias como la enfermedad cardiovascular, las enfermedades neurodegerativas, y la diabetes [115].
Lee W. Wattenberg un famoso estudios de la Universidad de Minnesota descubrió en las crucíferas compuestos derivados de los glucosinolatos como el indol-3-carbinol y la diindolilmetano que se liberan cuando se mastica o se macera la crucífera. Estos compuestos son reconocidos como anticancerígenos [116].
En nuestro país no debemos perder de vista que poseemos una importante crucífera como la maca que se caracteriza por su alto contenido de glucosinolatos [73-76], que estudiado en su real dimensión puede convertirse en uno de los superalimentos que la naturaleza ha prodigado para el bienestar humano.
Conflicto de intereses: Los autores declaran no tener conflicto de interés para publicar el presente artículo.
REFERENCIAS BIBLIOGRÁFICAS
1. Pinazo MD, Boscá L. Propiedades antiinflamatorias de los ácidos grasos poliinsaturados omega-3. Indicaciones en oftalmología. Arch Soc Esp Oftalmol. 2012;87(7):203-5. [ Links ]
2. Medina A, Casas R, Tressserra A, Ros E, Martínez MA, Fitó M, et al. Polyphenol intake from a Mediterranean diet decreases inflammatory biomarkers relatedto atherosclerosis: A sub-study of The PREDIMED trial. Br J Clin Pharmacol. 2016Apr 21. doi: 10.1111/ bcp.12986. [ Links ]
3. Bellik Y, Hammoudi SM, Abdellah F, Iguer-Ouada M, Boukraâ L. Phytochemicals to prevent inflammation and allergy. Recent Pat Inflamm Allergy Drug Discov. 2012;6(2):147-58. [ Links ]
4. Hadad N, Levy R. The synergistic anti-inflammatory effects of lycopene, lutein, β-carotene, and carnosic acid combinations via redox-based inhibition of NF-κB signaling. Free Radic Biol Med. 2012;53(7):1381-91. [ Links ]
5. SalminenA, KauppinencA, Kaarniranta K. Phytochemicals suppress nuclear factor-kB signaling: impact on health span and the aging process. Curr Opin Clin Nutr Metab Care. 2012;15(1):23-8. [ Links ]
6. Young-Joon S. NF-κB and Nrf2 as potential chemopreventive targets of some anti-inflammatory and antioxidative phytonutrients with anti-inflammatoryand antioxidative activities.Asia PacJ ClinNutr. 2008;17(S1):269-72. [ Links ]
7. Mengoni ES, Vichera G, Rigano LA, Rodriguez-Puebla ML, Galliano S, Cafferata EE, et al. Suppression of COX-2, IL-1β and TNF-α expression and leukocyte infiltration in inflamed skin by bioactive compounds from Rosmarinus officinalis L. Fitoterapia. 2011;82(3):414-21.
8.Gómez HA, González KN, Domingo J. Actividad antiinflamatoria de productos naturales. Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas. 2011;(10):182-217. [ Links ]
9. Román JA, Jiménez SA. El factor nuclear –kB como un blanco terapéutico en artritis. Rev Peru Reumatol. 2004;10(3):43-8. [ Links ]
10. Viljoen A, Mncwangi N, Vermaak I. Anti-inflammatory iridoids of botanical origin. Curr Med Chem. 2012;19(14):2104-27. [ Links ]
11. Gonzáles BM. Síndrome Metabólico, Dieta y Marcadores de Inflamación [Tesis Doctoral]. Universitat De Les Illes Balears, España. 2012. [ Links ]
12. Arredondo BA, Amores CJ. La dieta Mediterránea: ¿es cardioprotectiva? Arch Méd Camagüey. 2007;11(4). [ Links ]
13. Organización Mundial de la Salud. Estrategia Mundial sobre régimen alimentario, actividad física y salud. 57ª Asamblea Mundial de la Salud. Informe Grupo Científico de la OMS: 2004. Serie Informes Técnicos; 57.17. [ Links ]
14. Hidalgo JM. Antocianos: metabolismo y actividad biológica [Tesis Doctoral]. Universidad Complutense de Madrid, Madrid. 2013. [ Links ]
15. Latruffe N, Rifler JP. Bioactive polyphenols from grapes and wine emphasized with resveratrol. Curr Pharm Des. 2013;19(34):6053-63. [ Links ]
16. Hashim SN, Lachlan JS, Reinhard IB, Yuanzhong Y, Basil D, Milton TW, et al. Rapid solid-phase extraction and analysis of resveratrol and other polyphenols in red wine. J Chromatogr A. 2013;1313:284-90. [ Links ]
17. Bertelli AA, Das DK. Grapes, wines, resveratrol, and heart health. J Cardiovasc Pharmacol. 2009;54(6):468-76. [ Links ]
18. ChenX, Lu J, AnM, Ma Z, Zong H, Yang J.Anti inflammatoryeffectof resveratrolon adjuvant arthritis rats with abnormalimmunological function via the reduction of cyclooxygenase 2 and prostaglandin E2. Mol Med Rep. 2014;9(6):2592-8. [ Links ]
19. Marchi P, Paiotti AP, Artigiani NR, Oshima CT, Ribeiro DA. Concentrated grape juice (G8000 TM) reducesimmunoexpression of iNOS, TNF-alpha, COX-2 and DNA damage on 2, 4, 6-trinitrobenzene sulfonic acid-induced-colitis. Environ Toxicol Pharmacol. 2014;37(2):819-27. [ Links ]
20. Wang B, Sun J, Li L, Zheng J, Shi Y, Le G. Regulatory effects of resveratrol on glucose metabolism and T-lymphocyte subsets in the development of high-fat diet-induced obesity in C57BL/6 mice. Food Funct. 2014;5(7):1452-63. [ Links ]
21. Aguiar JO, Boiago GA, Bueno de M, Oraes B, Pasquini G. Ramos CR, et al. Grape juice concentrate prevents oxidative DNA damage in peripheral blood cells of rats subjected to a high-cholesterol diet. Br J Nutr. 2011;105(5):694-702. [ Links ]
22. Tomé CJ, Larrosa A, Yáñez-GM, Dávalos A, Gil ZJ, Gonzálvez M, et al. One-year supplementation with a grape extract containing resveratrol modulates inflammatory-related microRNAs and cytokines expression in peripheral blood mononuclear cells of type 2 diabetes and hypertensive patients with coronary artery disease. Pharmacol Res. 2013;72:69-82. [ Links ]
23. Vitaglione P, Sforza S, Galaverna G, Ghidini C, Caporaso N, Vescovi PP, Fogliano V, et al. Bioavailability of trans-resveratrol from red wine in humans. Mol Nutr Food Res. 2005;49(5):495-504. [ Links ]
24. Gresele P, Pignatelli P, Guglielmini G, Carnevale R, Mezzasoma AM, Ghiselli A, et al. Resveratrol at concentrations attainable with moderate wine consumption stimulates human platelet nitric oxide production. J Nutr. 2008;138(9):1602-08. [ Links ]
25. Matsuzaki K, Ishii R, Kobiyama K, Kitanaka S. New benzophenone and quercetin galloyl glycosides fromPsidium guajava L. J Nat Med. 2010;64(3):252-6. [ Links ]
26. Gutiérrez RMP, Mitchell S, Solis RV. Psidium guajava: a review of its traditional uses, phytochemistry and pharmacology. J Ethnopharm. 2008;117(1):1-27. [ Links ]
27. Ojewole JA. Antiinflammatory and analgesic effects of Psidium guajava Linn. (Myrtaceae) leaf aqueous extract in rats and mice. Methods Find Exp Clin Pharmacol. 2006;28(7):441-6. [ Links ]
28.Siani AC, Souza MC, Henriques MG, Ramos MF. Anti-inflammatory activity of essential oils from Syzygium cumini and Psidium guajava. Pharm Biol. 2013;51(7):881-7. [ Links ]
29. Zapata K, Cortes FB, Rojano BA. Polifenoles y actividad antioxidante del fruto deGuayaba Agria (Psidium araca). Inf Tecnol. 2013;24(5):103-12. [ Links ]
30. Kim GJ, Choi HG, Kim JH, Kim SH, Kim JA, Lee SH. Anti-allergic inflammatory effects of cyanogenic and phenolic glycosides from the seed of Prunus persica. Nat ProdCommun. 2013;8(12):1739-40. [ Links ]
31. Shin TY, ParkSB,Yoo JS, Kim IK, Lee HS, Kwon TK, et al. Anti-allergic inflammatory activity ofthefruit ofPrunus persica: Roleofcalcium and NFkB. Food Chem Toxicol. 2010;48(10):2797-2802. [ Links ]
32. Escarpa A, Gonzalez MC. High -performance liquid chromatography with diode array detection for the determination of phenolic compounds in peel and pulp from different apple varieties. J Chromtogr A. 1998;823(1-2):331-7. [ Links ]
33. Gerhauser C. Cancer chemopreventive potential of apples, apple juice, and apple components. Planta Med. 2008;74(13):1608-24. [ Links ]
34. Pastene NE. Actividad de extractos ricos en polifenoles de cáscara de manzana sobre Helicobacter pylori: estudios in vitro e in vivo [Tesis Doctoral]. Facultad Farmacología, Universidad de Chile; 2010. [ Links ]
35. Banerjee N, Kim H, Talcott S, Mertens TS. Pomegranate polyphenolics suppressed azoxymethane-induced colorectal aberrant crypt foci and inflammation: possible role of miR126/VCAM-1 and miR-126/PI3K/AKT/mTOR. Carcinogenesis. 2013;34(12):2814-22. [ Links ]
36. De Oliveira JF, Garreto DV, Da Silva MC, Fortes TS, De Oliveira RB, Nascimento FR, et al. Therapeutic potential of biodegradable microparticles containing Punica granatum L. (pomegranate) in murine model of asthma. Inflamm Res. 2013;62(11):971-80. [ Links ]
37. Bekir J, Mars M, Vicendo P, Fterrich A, Bouajila J. Chemical composition and antioxidant, anti-inflammatory, and antiproliferation activities of pomegranate (Punica granatum) flowers. J Med Food. 2013;16(6):544-50. [ Links ]
38. Mo J, Panichayupakaranant P, Kaewnopparat N, Nitiruangjaras A, Reanmongkol W. Topical anti-inflammatory and analgesic activities of standardized pomegranate rind extract in comparison with its marker compound ellagic acid in vivo. J Ethnopharmacol. 2013;148(3):901-8. [ Links ]
39. Gaggeri R, Rossi D, Daglia M, Leoni F, Avanzini MA, Mantelli M, et al. An eco-friendly enantioselective access to (R)-naringenin as inhibitor of proinflammatory cytokine release. Chem Biodivers. 2013;10(8):1531-8. [ Links ]
40. Chao CL, Weng CS, Chang NC, Lin JS, Kao ST, Ho FM. Naringenin more effectively inhibits inducible nitric oxide synthase and cyclooxygenase-2 expression in macrophages than in microglia. Nutr Res. 2010;30(12):858-64. [ Links ]
41. Yang HL, Chen SC, Senthil KK, Yu KN, Lee CP, Tsai SY, et al. Antioxidant and anti-inflammatory potential of hesperetin metabolites obtained from hesperetin-administered rat serum: an ex vivo approach. J Agric Food Chem. 2012;60(1):522-32. [ Links ]
42. Rampersaud GC, Valim MF. 100% citrus juice: nutritional contribution,dietary benefits,andassociation with anthropometric measures. Crit Rev Food Sci Nutr. 2015 Apr 1:0. [Epub ahead of print] [ Links ]
43. Lopes RC, Coelho A, Hermsdorff HH, Bressan J. Anti-inflammatory properties of orange juice: possible favorable molecular and metabolic effects. Plant Foods Hum Nutr. 2013;68(1):1-10. [ Links ]
44. Márquez L, García BB, Madrigal JL, Leza JC. Mangiferin decreases inflammation and oxidative damage in rat brain after stress. Eur J Nutr. 2012;51(6):729-39. [ Links ]
45. Mohammad S. Lupeol, a novel anti-inflammatory and anti-cancer dietary triterpene. Cancer Lett. 2009;285(2):109-15. [ Links ]
46. Delgado R, Garrido G, Martínez G, Candelario-Jalil ED, León OS, Gil L, et al. Potenciales terapéuticas del extracto de Mangifera indica L. (Vimang), un nuevo producto natural cubano. Rev Fitoter. 2005;5(S1):156. [ Links ]
47. Bhui K, Tyagi S, Srivastava AK, Singh M, Roy P, Singh R, et al. Bromelain inhibits nuclear factor kappa-B translocation, driving human epidermoid carcinoma A431 and melanoma A375 cells through G(2)/M arrest to apoptosis. Mol Carcinog. 2012;51(3):231-43. [ Links ]
48. Pérez RM, Mitchell S, Vargas R. Psidium guajava: A review of its traditional uses, phytochemistry and pharmacology. J Ethnopharmacol. 2008;117(1):1-27. [ Links ]
49. Lopez HL. Nutritional interventions to prevent and treat osteoarthritis. Part II: focus on micronutrients and supportive nutraceuticals. Osteoarthritis Supplement. 2012;4(5 Suppl):S155-68. [ Links ]
50. Paiotti AP, Neto RA, Marchi P, Silva RM, Pazine VL, Noguti J, Pastrelo MM, Gollücke AP, et al. The anti-inflammatory potential of phenolic compounds in grape juice concentrate (G8000™) on 2, 4, 6-trinitrobenzene sulphonic acid-induced colitis. Br J Nutr. 2013;110(6):973-80.
51. Cui X, Jin Y, Hofseth AB, Pena E, Habiger J, Chumanevich A, et al. Resveratrol suppresses colitis and colon cancer associated with colitis. Cancer Prev Res (Phila). 2010;3(4):549-59. [ Links ]
52. Gualdoni GA, Kovarik JJ, Hofer J, Dose F, Pignitter M, Doberer D, et al. Resveratrol enhances TNF-α production in human monocytes upon bacterial stimulation. Biochim BiophysActa. 2014;1840(1):95-105.
53.Serlene J, Manish K. Chatli, Ashim K. Biswas, Jhari Sahoo. Efficacy of pink guava pulp as an antioxidant in raw pork emulsion. J Food Sci Technol. 2014;51(8):1492-1500. [ Links ]
54.Denny C, Melo PS, Franchin M, Massarioli AP, Bergamaschi KB, De Alencar SM, et al. Guava pomace: a new source of antiinflammatory and analgesic bioactives. BMC Complement Altern Med. 2013;13:235. [ Links ]
55.Gasparotto J, Somensi N, Bortolin RC, Moresco KS, Girardi C, Klafke K, et al. Effects of different products of peach (Prunus persica L. Batsch) from a variety developed in southern Brazil on oxidative stress and inflammatory parameters in vitro and ex vivo. J Clin Biochem Nutr. 2014;55(2):110-9. [ Links ]
56. Palu AK, Kim AH, West BJ, Deng S, Jensen J, White L. The effects of Morinda citrifolia L. (noni) on the immune system: Its molecular mechanisms of action. J Ethnopharmacol. 2008;115:502-6. [ Links ]
57. Wagner AE, TerschluesenAM, RimbachG. Health promoting effects of brassica-derived phytochemicals: from chemopreventive and anti-inflammatory activities to epigenetic regulation. Oxid Med Cell Longev. 2013;(2013):964539. [ Links ]
58. Chan-BlancoY, Vaillant F. Perez A, Reynes M, Brillouet J, Brat P. The noni fruit (Morinda citrifolia L): A review of agricultural research, nutritional and therapeutic properties. J FoodComp Anal. 2006;19(6-7):645-54. [ Links ]
59. Lee JK. Anti-inflammatory effects of eriodictyol in lipopolysaccharide-stimulated raw 264.7 murine macrophages. Arch Pharm Res. 2011;34(4):671-9. [ Links ]
60. Straub I, Mohr F, Schaefer M. Citrus fruit and fabacea secondary metabolites potently and selectively block TRPM3. Br J Pharmacol. 2013;168(8):1835-50. [ Links ]
61. Rosenblat T, Meretski S, Segal J, Tarshis M, Schroeder A, Zanin ZA, et al. Polyhydroxylated fatty alcohols derived from avocado suppress inflammatory response and provide non-sunscreen protection against UV-induced damage in skin cells. Arch Dermatol Res. 2011;303(4):239-46. [ Links ]
62. Maczurek A, Hager K, Kenklies M, Sharman M, Martins R, Engel J, et al. Lipoic acid as an anti-inflammatory and neuroprotective treatment for Alzheimer's disease. Adv Drug Deliv Rev. 2008;60(1314):1463-70. [ Links ]
63. Zhang Y. The molecular basis that unifies the metabolism, cellular uptake and chemopreventive activities of dietary isothiocyanates. Carcinogenesis. 2012;33(1):2-9. [ Links ]
64. Kim HJ, Lee W, Yun JM. Luteolin inhibits hyperglycemia-induced proinflammatory cytokine production and its epigenetic mechanism in human monocytes. Phytother Res. 2014;28(9):1383-91. [ Links ]
65. López LM. Distribution and biological activities of the flavonoid luteolin. Mini Rev Medic Chem. 2009;9(1):31-59. [ Links ]
66. Griffiths G, Trueman L, Crowther T, Thomas B, Smith B. Onions--a global benefit to health. Phytother Res. 2002;16(7):603-15. [ Links ]
67. Järvi A, Karlström B, Vessby B, Becker W. Increased intake of fruits and vegetables in overweight subjects: effects on body weight, body composition, metabolic risk factors and dietary intake. Br J Nutr. 2016;115(10):1760-8. [ Links ]
68. Huang HL, Liu CT, Chou MC, Ko CH, Wang CK. Noni (Morinda citrifolia L.) fruit extracts improve colon microflora and exert anti-inflammatoryactivitiesincaco-2 cells.J Med Food.2015;18(6):663-76. [ Links ]
69. López-Cepero JM, Lerma S, Fernández O, Vidal AA. Hepatotoxicidad grave asociada al consumo de Noni (Morinda citrifolia). Rev Esp Enferm Dig. 2007;99(3):179-81. [ Links ]
70. Nabavi SF, Braidy N, Gortzi O, Sobarzo-Sanchez E, Daglia M, Skalicka-Woźniak K, et al. Luteolin as an anti-inflammatory and neuroprotective agent: a brief review. Brain Res Bull. 2015;119(Pt A):1-11.
71. Rytel E,Tajner CA,KitaA,AniołowskaM,KucharskaAZ,Sokół ŁA,et al. Content of polyphenols in coloured and yellow fleshed potatoes during dices processing. Food Chemistry. 2014;161:224-9.
72. Kenny OM, McCarthy CM, Brunton NP, Hossain MB, Rai DK, Collins SG, et al. Anti-inflammatory properties of potato glycoalkaloids in stimulated Jurkat and Raw 264.7 mouse macrophages. Life Sci. 2013;92(13):775-82. [ Links ]
73. Gonzales GF, Villaorduña L, Gasco M, Rubio J, Gonzales C. Maca (Lepidium meyenii Walp), una revisión sobre sus propiedades biológicas. Rev Peru Med Exp Salud Publica. 2014;31(1):100-10. [ Links ]
74. Gonzales GF, Gasco M, Lozada RI. Role of maca (Lepidium meyenii) consumption on serum interleukin-6 levels and health status in populations living in the Peruvian Central Andes over 4000 m of altitude. Plant Foods Hum Nutr. 2013;68(4):347-51. [ Links ]
75. Valerio LG Jr, Gonzales GF. Toxicological aspects of the South American herbs cat's claw (Uncaria tomentosa) and Maca (Lepidium meyenii): a critical synopsis. Toxicol Rev. 2005;24(1):11-35. [ Links ]
76. Gonzales GF. Ethnobiology and ethnopharmacology of Lepidium meyenii (Maca), a plant from the Peruvian highlands. Evid Based Complement Alternat Med. 2012;2012:193496. [ Links ]
77. Kaithwas G, Mukherjee A, Chaurasia AK, Majumdar DK. Antiinflammatory, analgesic and antipyretic activities of Linum usitatissimum L. (flaxseed/linseed) fixed oil. Indian J Exp Biol. 2011;49(12):932-8. [ Links ]
78. Farahpour MR, Taghikhani H, Habibi M, Zandieh MA. Wound healing activity offlaxseedLinumusitatissimumL. in rats. African JPharm Pharmacol. 2011;5(21):2386-9. [ Links ]
79. Jiménez P, Masson LS. Quitral RV. Composición química de semillas de chía, linaza y rosa mosqueta y su aporte en ácidos grasos omega-3. Rev Chil Nutr. 2013;40(2):155-60. [ Links ]
80. Martínez CO, Paredes LO. Phytochemical profile and nutraceutical potential of chia seeds (Salvia hispanica L.) by ultra-high performance liquid chromatography.J Chromatogr A. 2014;1346:43-8. [ Links ]
81. Jin F, Nieman DC, Sha W, Xie G, Qiu Y, Jia W. Supplementation of milled chia seeds increases plasma ALA and EPA in postmenopausal women. Plant Foods Hum Nutr. 2012;67(2):105-10. [ Links ] 82. JimenezY, Lopez J, Blanco LM, Marin C, Perez P, Ruano J, et al. Olive oil and walnut breakfasts reduce the postprandial inflammatory response in mononuclear cells compared with a butter breakfast in healthy men. Atherosclerosis. 2009;204:e70–6 [ Links ]
83. Konstantinidou V, Covas MI, Munoz-Aguayo D, Khymenets O, De la Torre R, Saez G, et al. In vivo nutrigenomic effects of virgin olive oil polyphenols within the frame of the Mediterranean diet: a randomized controlled trial. FASEB J. 2010;24:2546-57. [ Links ]
84. Urpi M,Casas R,Chiva G, Romero E. Valderas P,Arranz S, et al. Virgin olive oil and nuts as key foods of the Mediterranean diet effects on inflammatory biomarkers related to aterosclerosis. Pharmacol Res. 2012;65(6):577-83. [ Links ]
85. Ros E, Miguel A, Martínez MA, Estruch R, Salas J, Fitó M, et al. Mediterranean diet and cardiovascular health: teachings of the PREDIMED Study1–3. American Society for Nutrition. Adv Nutr. 2014;5:330S-336S. [ Links ]
86. Guo X, Tresserra A, Estruch R, Martínez MA, Medina A, Castañer O, et al. Effects of polyphenol, measured by a biomarker of total polyphenols in urine, on cardiovascular risk factors after a long-term follow-up in the PREDIMED study. Oxidative medicine and cellular longevity. 2016 Article ID 2572606, 11 pages. [In press] [ Links ]
87. Salas J, Casas P, Murphy MM, López P, Bulló M. The effect of nuts on inflammation Asia Pac J Clin Nutr. 2008;17(S1):333-6. [ Links ]
88. García LA, Moro C, Manchón N, Ruiz GA, Villares A, Guillamón E, et al. In vitro anti-inflammatory activity of phenolic rich extracts from white and red common beans. FoodChem. 2014;161:216-30. [ Links ]
89. Velásquez LY. Anthocyanin and phenolic contents and lc-based profiling of extracts obtained from colored kernels of maize varieties (Zea mays) from cundiboyacense highland. Proceeding of XXII Congreso SILAE. Costa Rica, 2013. [ Links ]
90. Romay Ch, González R, Ledón N, Remirez D, Rimbau V. C-phycocyanin: a biliprotein with antioxidant, anti-inflammatory and neuroprotectiveeffects. Curr Protein Pept Sci. 2003;4(3):207-16. [ Links ]
91. Muhammad I, Zhao J, Dunbar DC, Khan IA. Constituents of Lepidium meyenii 'maca'. Phytochemistry. 2002;59(1):105-10. [ Links ]
92. De Figueiredo SM, Filho SA, Nogueira-Machado JA, Caligiorne RB. The anti-oxidant properties of isothiocyanates: a review. Recent Pat Endocr Metab Immune Drug Discov. 2013;7(3):213-25. [ Links ]
93. Zhang Y. The molecular basis that unifies the metabolism, cellular uptake and chemopreventive activities of dietary isothiocyanates. Carcinogenesis. 2012;33(1):2-9. [ Links ]
94. Kaithwas G, Mukherjee A, Chaurasia AK, Majumdar DK. Antiinflammatory, analgesic and antipyretic activities of Linum usitatissimum L. (flaxseed/linseed) fixed oil. Indian Journal of Experimental Biology. 2011;12(49):932-8. [ Links ]
95. Gonzales GF, Gonzales C, Villegas L. Exposure of fatty acids after a single oral administration of sacha inchi (Plukenetia volubilis L.) and sunflower oil in human adult subjects. Toxicol Mech Methods. 2014; 24(1):60-9. [ Links ]
96. Al-Attas OS, Al-Daghri NM, Alokail MS, Alkharfy KM, Khan N, Alfawaz HA, et al. Association of dietary fatty acids intake with pro-coagulation and inflammation in Saudi Adults. Asia Pac J Clin Nutr. 2014;23(1):55-64. [ Links ]
97. James MJ, Gibson RA, Cleland LG. Dietary polyunsaturated fatty acids and inflammatory mediator production. Am J Clin Nutr. 2000;71(1 Suppl):343S-8S. [ Links ]
98. Sherry CH, Hakim IA. Pharmacokinetic and chemoprevention studies on tea in humans. Pharmacol Res. 2011;64(2):105-12. [ Links ]
99. Axling U, Olsson C, Xu J, Fernandez C, Larsson S, Ström K, et al. Green tea powder and Lactobacillus plantarum affect gut microbiota, lipid metabolism and inflammation in high-fat fed C57BL/6J mice. Nutr Metab. 2012;9(1):105. [ Links ]
100. Cabrera C, Artacho R, GiménezR. Beneficial effects of green tea--a review. J Am Coll Nutr. 2006;25(2):79-99. [ Links ]
101. Scapagnini G, Vonya V, Nader AG, Calogero C, Zella D, Fabio G. Modulation of Nrf2/ARE pathway by food polyphenols: a nutritional neuroprotective strategy for cognitive and neurodegenerative disorders. Mol Neurobiol. 2011;44(2):192-201. [ Links ]
102. Belcaro G, Cesarone MR, Dugall M, Pellegrini L, Ledda A, Grossi MG, et al. Efficacy and safety of Meriva®, a curcumin phosphatidylcholine complex, during extended administration in osteoarthritis patients. Altern Med Rev. 2010;15(4):337-44.
103. Vogl S, Picker P, Mihaly BJ, Fakhrudin N, Atanasov AG, Heiss EH, et al. Ethnopharmacological in vitro studies on Austria’s folk medicine. An unexplored lore in vitro anti-inflammatory activities of 71 Austrian traditional herbal drugs. J Ethnopharmacol. 2013;149(3):750-71.
104. Bisht K, Wagner KH, Bulmer AC. Curcumin, resveratrol and flavonoids as anti-inflammatory, cyto- and DNA-protective dietary compounds. Toxicology. 2010;278(1):88-100. [ Links ]
105. Fengyang L, Yunhe F, Bo L, Zhicheng L, Depeng L, Dejie L, et al. Stevioside suppressed inflammatory cytokine secretion by downregulation of NF-κB and MAPK signaling pathways in LPS-stimulated RAW264.7 cells. Inflammation. 2012;35(5):1669-75. [ Links ]
106. Chatsudthipong V, Muanprasa Ch. Stevioside and related compounds: therapeutic benefits beyond sweetness. Pharmacol Ther. 2009;121(1):41-54. [ Links ]
107. Bunprajun T, Yimlamai T, Soodvilai S, Muanprasat C, Chatsudthipong V. Stevioside enhances satellite cell activation by inhibiting of NF-κB signaling pathway in regenerating muscle after cardiotoxin-induced injury. J Agric Food Chem. 2012;60(11):2844-51. [ Links ]
108. D’Orazio N, Gammone MA, Gemello E, De Girolamo M, Cusenza S, Riccioni G. Marine bioactives: pharmacological properties and potential applications against inflammatory diseases. Mar Drugs. 2012;10(4):812-33.
109. Calder PC. Marine omega-3 fatty acids and inflammatory processes: effects, mechanisms and clinical relevance. Biochim Biophys Acta. 2015;1851(4):469-84. [ Links ]
110. Rubió L, Motilva MJ, Romero MP. Recent advances in biologically active compounds in herbs and spices: a review of the most effective antioxidant and anti-inflammatory active principles. Crit Rev Food Sci Nutr. 2013;53(9):943-53. [ Links ]
111. Lopez HL. Nutritional interventions to prevent and treat osteoarthritis. Part II: Focus on micronutrients and supportive nutraceuticals. Osteoarthritis Supplement. 2012;4:S155-S68. [ Links ]
112. Lorenz M. Cellular targets for the beneficial actions of tea polyphenols. Am J Clin Nutr. 2013;98(6 Suppl):1642S-50S. [ Links ]
113. Kuptniratsaikul V, Thanakhumtorn S, Chinswangwatanakul P, Wattanamongkonsil L, Thamlikitkul V. Efficacy and safety of Curcuma domestica extracts in patients with knee osteoarthritis. J Altern Complement Med. 2009;15(8):891-7. [ Links ]
114. Zhou Y, Li Y, Zhou T, Zheng J, Li S, Li HB. Dietary natural products for prevention and treatment of liver cancer. nutrients. 2016;8(3). [ Links ]
115. Yang L, Palliyaguru DL, Kensler TW. Frugal chemoprevention: targeting Nrf2 with foods rich in sulforaphane. Semin Oncol. 2016;43(1):146-53. [ Links ]
116. Fujioka N, Fritz V, Upadhyaya P, Kassie F, Hecht SS. Research on cruciferous vegetables, indole-3-carbinol, and cancer prevention: a tribute to Lee W. Wattenberg. Mol Nutr Food Res. 2016 Feb 3. [ Links ]
Correspondencia: Gustavo F. Gonzáles gustavo.gonzales@upch.pe
Recibido: 06/03/2016
Aprobado: 27/04/2016
SIGLAS
AA: Ácido araquidónico
AGPI: Ácidos grasos poliinsaturados
AGMI: Ácidos grasos monoinsaturados
AGE: Ácidos grasos esenciales
AP1: Áctivador proteico 1
ARE: Elementos de respuesta antioxidante
COX: Ciclooxigenasas
CB2: Canabinoides 2
CBP/P300: Proteína de unión a elementos de respuesta (CREB)
DHA: Ácido graso docosahexaenoico
DPA: Ácido graso docosapentaenoico
EPA: Ácido graso eicosapentaenoico
ELAM: Molécula de adhesión leucocitaria al endotelio
ERK: Kinasa regulada por señal extracelular
FNkB: Factor nuclear kappa B
HGF: Factor de crecimiento de hepatocitos
HO- 1: Hemooxigenasa 1
IL-1: Interleucina 1
IL-1β: Interleucina 1 beta
IL-4: Interleucina 4
IL-6: Interleucina 6
IL-7: Interleucina 7
IL8: Interleucina 8
IL10: Interleucina 10
IL-12: Interleucina 12
ICAM-1: Molécula de adhesión intercelular-1
IkB: Kinasa inhibitoria kappa B
IFNγ: Interferón gama
iNOS: Óxido nítrico sintasa inducible
JNK: Kinasa terminal N Jun
JAK2: Kinasa janus dependiente de la tirosina 2
LOX: Lipoxigenasa
LPOX: Lipooxigenasas
LTB4: Leucotrieno tipo B
MAPK: Proteína Kinasa activada del mitógeno
MAPK/p38: Proteína Kinasa activada del mitógeno/p38
MIF: Inhibidor de la migración de los macrófagos.
MCP: Proteína quimotáctica del monocito
MMP: Metaloproteinasa
NK: linfocitos T killer
Nrf2: Factor nuclear eritroide 2
ON: Óxido nítrico
PCR: Proteína C reactiva
PGE2: Prostaglandina E2
PPAR: Receptor activado proliferador del peroxisoma
rIL7: Receptor interleuquina 7
rToll-4: Receptor tipo toll 4
RON: Especies reactivas de nitrógeno
ROS: Especies reactivas de oxígeno
sON: Óxido nítrico sintasa
STAT-3: Señal transductor y activador de transcripción 3
SOCS-2: Supresor de señalización de citoquinas 2
SOCS-3: Supresor de señalización de citoquinas 3
sVCAM: Molécula de adhesión celular vascular en suero
TNF: Factor de necrosis tumoral
TLR-2: Receptor Toll 2
TLR-4: Receptor Toll 4
TXA2: Tromboxanos tipo A2
VCAM: Molécula de adhesión celular vascular