INTRODUCCIÓN
La enfermedad por el coronavirus 2019 (COVID-19), es una enfermedad respiratoria aguda causada por el coronavirus de tipo 2 causante del síndrome respiratorio agudo severo, abreviado SARS-CoV-2, que provoca mayor mortalidad en adultos mayores de 60 años y con afecciones previas como enfermedades cardiovasculares, respiratorias crónicas, diabetes o cáncer. Los síntomas reportados incluyen fiebre, tos, fatiga, dolor de garganta, dificultad para respirar y en muchos casos ageusia y anosmia1. Su diseminación principal es por vía aérea a través de gotitas respiratorias, aerosoles y por fómites, aunque esta última ruta de transmisión es poco probable según las últimas investigaciones2. El COVID-19 viene afectando a cerca de 80 millones de personas en el mundo desde su aparición a finales de 20193y al parecer todo indica que el virus se mantendrá de forma endémica en ciertos lugares del planeta4.
SARS-CoV-2 pertenece al género beta coronavirus, el cual alberga otros virus zoonóticos que afectan relativamente a los seres humanos. Produce principalmente síntomas respiratorios y gastrointestinales. Sin embargo, el virus no sólo afecta de forma aguda las vías respiratorias, sino que se han descrito distintas afecciones a nivel cardiaco, endocrino y neurológico. Reportándose manifestaciones neurológicas al menos el 36 % de los pacientes infectados, lo que justifica el potencial neurotrópico del virus5.
La asociación de COVID-19 con el compromiso neurológico se observa principalmente en casos severos, en pacientes con comorbilidades y en presentaciones atípicas de la enfermedad. Así mismo, las manifestaciones clínicas a nivel neurológico en pacientes infectados se han descrito y sustentado de manera robusta6. Por este motivo, la presente investigación buscó determinar los posibles mecanismos por los cuales SARS-CoV-2 produce las diversas manifestaciones neurológicas en pacientes con COVID-19 durante la actual pandemia, ya que al identificar si el posible daño producido por el virus es directo o indirecto, repercutirá no solo en el esquema diagnóstico sino en el terapéutico, permitiendo un manejo temprano de la enfermedad y de este manera, prevenir la complicación del estado del paciente y la propagación del virus.
MÉTODOS
Para la presente revisión se realizaron búsquedas en las bases de datosMEDLINE, accedida desdePubMed, SciELO, LILACSy repositorios de pre impresiones comobioRxiv, medRxiv y ChinaXivmediante los descriptoresMedical Subject Headings(MeSH) enlazados a términos libres:COVID-19, SARS-CoV-2, coronavirus infection, COVID-19 clinical features, neurologic manifestations, central nervous system, brain, peripheral nervous system. Esta estrategia se adaptó a las bases de datos, sin restricciones en cuanto al idioma de publicación, hasta el 17 de diciembre de 2020. Se consideró como criterio de inclusión a los estudios de observación, caso-control, serie de casos, informes de casos, cartas al editor y revisiones referidas al daño neurológico que produce COVID-19. Se excluyeron estudios sobre coronavirus no humano, informes clínicos de manifestaciones neurológicas con inicio antes de la infección por SARS-CoV-2, estudios duplicados y aquellos que tras la lectura del resumen o del contenido no aportaron información relevante para la investigación.
DESARROLLO
Mecanismos de entrada viral al sistema nervioso central
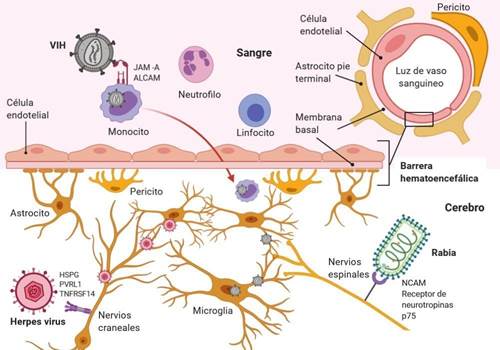
Las infecciones virales que escapan del control local en el sitio de infección primaria pueden propagarse a otros tejidos, donde causan problemas más graves debido a la replicación activa del virus o a la reacción exagerada del sistema inmune innato. Esta última reacción a veces se denomina "tormenta de citoquinas", porque las citocinas proinflamatorias y antiinflamatorias elevadas en el suero conducen a una respuesta inmune sistémica vigorosa. Tal respuesta en el cerebro puede ser devastadora y provocar meningitis, encefalitis, meningoencefalitis y muerte7.
Las mutaciones en los genes de virulencia específicos del virus, la inmunosupresión, la edad, las comorbilidades del huésped o una mezcla de ambas determinan que ciertos virus puedan tener acceso al sistema nervioso central (SNC) (figura 1)7. El SNC, a pesar de estar protegido por las meninges y el líquido cefalorraquídeo (LCR) no es inmune a las alteraciones que conducen las enfermedades neurológicas. Diversos virus poseen la capacidad de invadir el SNC, donde pueden infectar las células residentes, incluidas las neuronas (figura 1). De este modo, existen principalmente dos rutas de invasión al SNC empleadas por los virus, la neuroinvasión por el torrente sanguíneo (ruta retrógrada hematógena) y la neuroinvasión mediante nervios periféricos (ruta neuronal).
Neuroinvasión por el torrente sanguíneo (ruta retrógrada hematógena)
Después de la infección primaria y una vez dentro del torrente sanguíneo, los virus pueden pasar la barrera hematoencefálica (BHE) al tejido nervioso por un mecanismo transendotelial, que es el transporte celular a través de la BHE y los pericitos por vesículas endocíticas8. Algunos virus infectan directamente las células endoteliales vasculares, lo que permite el paso directo desde la BHE hacia el SNC7,8. Además, hay zonas del SNC como el plexo coroideo y los órganos circunventriculares que no están completamente protegidos por la BHE y sirven como puntos de entrada para ciertos virus. Las células hematopoyéticas infectadas también se utilizan como "caballos de Troya" para transportar los virus al SNC. Por último, la infección viral sistémica puede conducir a la descomposición de la BHE inducida por la inflamación, permitiendo que los virus se escapen literalmente por las grietas hacia el SNC9.
Neuroinvasión por el torrente sanguíneo (ruta retrógrada hematógena)
Algunos virus infectan y migran a través de los nervios periféricos como una segunda ruta de entrada al SNC. En este proceso, las neuronas juegan un papel esencial, ya que estas células inervan los órganos periféricos y así, los virus las utilizan como puerta de ingreso al SNC. Una ruta alternativa para la neuroinvasión es el transporte a través de las neuronas olfativas5. Esta vía es un excelente mecanismo para acceder al SNC para los virus que ingresan al cuerpo por vía intranasal7,10.
Probable mecanismo de infección neurológica del SARS-CoV-2
Los coronavirus humanos (HCoV), poseen cuatro proteínas estructurales (E, M, N y S). La principal determinante del tropismo celular del SARS-CoV-2 es la proteína S, que se une a la enzima convertidora de angiotensina 2 (ACE2), un receptor de membrana en las células huésped11y que está presente en diferentes órganos, incluidos el parénquima pulmonar, epitelios de las vías respiratorias, mucosa nasal, tracto gastrointestinal, renal, urinario, tejidos linfoides, órganos reproductivos, endotelio vascular y cerebro11. En cuanto a su distribución en el cerebro, ACE2 se expresa en células gliales y neuronas12, así como en la vasculatura cerebral13. La interacción completa del virus con el receptor ACE2 se habilita una vez que la proteína S viral se escinde por la proteasa de superficie (serina proteasa transmembrana 2) escasamente presente en el cerebro (tronco encefálico, lóbulo temporal y lóbulo occipital)13. Adicional al receptor ACE2, se han identificado otros receptores importantes como el dipeptidil peptidasa 4, presente en el tracto respiratorio inferior, el riñón, el intestino delgado, el hígado y las células del sistema inmunitario(14)y recientemente el receptor de neuropilina-1 (NRP1), cuya mayor expresión en células endoteliales y epiteliales respiratorias y olfatorias, puede facilitar la entrada y la diseminación del SARS-CoV-215,16. También se ha encontrado que la catepsina L y el receptor CD147 juegan un papel importante en la interacción viral inicial con la célula huésped y están ampliamente distribuidas en el SNC13,17.
Es muy probable que el SARS-CoV-2 alcance el SNC a través de las proyecciones neuronales mediado por el nervio olfativo17. La organización anatómica única de los nervios olfativos y el bulbo olfatorio en la cavidad nasal y el prosencéfalo lo convierten efectivamente en un canal entre el epitelio nasal y el SNC7, sobre todo en las primeras etapas de infección (figura 2)18. Luego de ingresar al cerebro, el virus puede extenderse rápidamente a otras áreas cerebrales específicas, como el tálamo y el tronco encefálico19,20. Se debe destacar la importancia de la presencia del virus en el tronco encefálico, debido a que esta estructura contiene el bulbo raquídeo que es el centro primario de control respiratorio21y en los tejidos olfatorios, cuya invasión viral podría causar disfunción olfatoria en los afectados22. Por otra parte, se postula que SARS-CoV-2 puede avanzar el SNC desde la periferia a través del transporte neuronal retrógrado y transináptico, especialmente aferente del nervio vago23y con los crecientes hallazgos de que el SARS CoV-2 infecta las células en el tracto gastrointestinal, el potencial neuroinvasivo podría abarcar incluso el sistema nervioso entérico24.
A pesar de que la ruta hematógena parece imposible, teóricamente SARS-CoV-2 podría alcanzar la BHE a través de la sangre circulante, atacando la capa endotelial para obtener acceso al SNC25. Este mecanismo de invasión se ha propuesto para otros HCoV, incluido el SARS-CoV, debido a que pueden infectar diferentes células mieloides y con ello diseminarse a otros tejidos, incluido el SNC (figura 2)10.
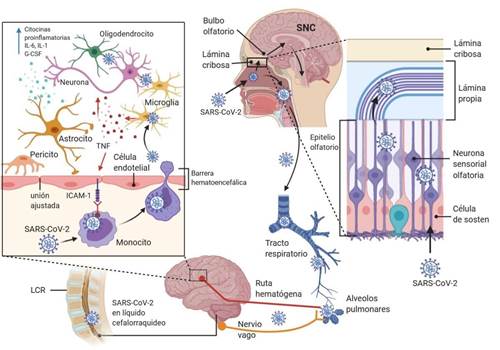
Figura 2. Potencial ruta de infección utilizada por SARS-CoV-2 para el daño neurológico: Entrada directa a través del epitelio nasal, afecta el nervio olfatorio, atraviesa la placa cribiforme, obtiene acceso al bulbo olfatorio y se disemina a otras regiones del cerebro. En su camino hacia el tejido pulmonar puede alcanzar el SNC desde la periferia, a partir del nervio vago y posteriormente ubicarse en el cerebro. En el caso de una posible ruta hematógena, puede dañar y perforar la BHE o movilizarse a través de leucocitos, por un mecanismo llamado “caballo de Troya”. Figura modificada a partir del artículoNervous system involvement after infection with COVID-19 and other coronaviruses. Brain Behav Immun. 2020.doi: 10.1016/j.bbi.2020.03.031.
Manifestaciones clínicas neurológicas asociadas a COVID-19
Las manifestaciones neurológicas de COVID-19 se producen en el sistema nervioso central (SNC) y en el sistema nervioso periférico (SNP). Las complicaciones del SNC incluyen encefalitis, meningitis, encefalomielitis diseminada aguda (EMDA), mielitis, y encefalopatías (tabla 1). Los informes de meningitis/encefalitis asociados a COVID-19 son cada vez más frecuentes desde su aparición a mediados de abril de 2020 en un paciente japonés cuya muestra de líquido cefalorraquídeo dio positivo a SARS-CoV-226. Este hallazgo sugiere que los síntomas neurológicos pueden ser resultado de la invasión viral directa del SNC, tal como lo demostraron Song et al27en autopsias cerebrales de pacientes con COVID-19. Los informes de mielitis asociada a COVID-19, sugieren que la médula espinal es órgano diana de SARS-CoV-2; sin embargo, no ha sido demostrado la invasión neuronal directa del virus en esta región, pero puede ser factible ya que al igual que otros órganos del cuerpo humano, la médula espinal también expresa ACE228.
Tabla 1. Complicaciones del sistema nervioso central en pacientes con COVID-19
| Manifestación clínica | Estudio | País | N | n (sexo, edad en años) | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Encefalitis / Meningitis | Duong et al.(32) | Estados Unidos | 1 | 1 (mujer, 41) | Moriguchi et al.(26) | Japón | 1 | 1 (hombre, 24) | Sohal et al.(33) | Estados Unidos | 1 | 1 (hombre, 72) | Wong et al.(34) | Reino Unido | 1 | 1 (hombre, 40) | Ye et al.(35) | China | 1 | 1 (hombre, NR) | Barreto-Acevedo et al.(36) | Perú | 1 | 1 (hombre, 53) | Xiang et al.(37) | China | 1 | 1 (hombre, 53) | Pilotto et al.(38) | Italia | 1 | 1 (hombre, 60) | Varatharaj et al.(39) | Reino Unido | 125 | 7 (NR) | Paterson et al.(40) | Reino Unido | 43 | 2 (NR) | Bernard-Valnet et al.(41) | Suiza | 2 | 2 (mujeres, 64 y 67) |
| Otras encefalopatías | Filatov et al.(42) | Estados Unidos | 1 | 1 (hombre,74) | Poyiadji et al.(29) | Estados Unidos | 1 | 1 (mujer, 50) | Dugue et al.(43) | Estados Unidos | 1 | 1 (hombre, 6 semanas) | Helms et al.(44) | Francia | 58 | 40 (NR) | Mao et al.(5) | China | 214 | 16 (NR) | Paniz-Mondolfi et al.(45) | Estados Unidos | 1 | 1 (hombre, 74) | Varatharaj et al.(39) | Reino Unido | 125 | 9 (NR) | Paterson et al.(40) | Reino Unido | 43 | 10 (NR) | Zhou et al.(46) | China | 1 | 1 (NR, 56) | ||||||||
| Encefalomielitis diseminada aguda (EMDA) | Zanin et al.(47) | Italia | 1 | 1 (mujer, 54) | Langley et al.(48) | Reino Unido | 1 | 1 (hombre, 53) | Paterson et al.(40) | Reino Unido | 43 | 9 (NR) | Novi et al.(49) | Italia | 1 | 1 (mujer, 64) | Zhang et al.(50) | Estados Unidos | 1 | 1 (mujer, 40) | ||||||||||||||||||||||||
| Mielitis | Zhao et al.(51) | China | 1 | 1 (mujer, 66) | AlKetbi et al.(52) | Emiratos Árabes Unidos | 1 | 1 (hombre, 32) | Chow et al.(53) | Australia | 1 | 1 (hombre, 60) | Sotoca et al.(54) | España | 1 | 1 (mujer, 69) | Paterson et al.(40) | Reino Unido | 43 | 2 (NR) | Sarma et al.(55) | Estados Unidos | 1 | 1 (mujer, 28) |
N: tamaño de la muestra (pacientes COVID-19); n: número de casos; NR: no reportado
Manifestaciones como la encefalopatía y la EMDA pueden ser resultado del daño indirecto a la infección, en donde la respuesta alterada del sistema inmune y la “tormenta de citoquinas” son los mecanismos implicados, cuyas observaciones son más notorias en pacientes críticamente enfermos25,29. Los síntomas como dolor de cabeza, rigidez de nuca, estado de conciencia alterado, letargo e irritabilidad, a pesar de no ser síntomas específicos, se les ha considerado como manifestaciones neurológicas, algunos presentes de mediano a largo plazo después de la enfermedad30,31.
Los hallazgos neurológicos de COVID-19 y el sistema nervioso periférico (SNP) están representados por las disfunciones olfatorias y gustativas, síndrome de Guillain-Barré y variantes, rabdomiólisis y otras enfermedades musculares (tabla 2). La manifestación temprana de anosmia y ageusia indica posibles daños neurológicos durante el desarrollo de la enfermedad. De este modo, se cree que el deterioro quimio sensorial puede llegar a ser al menos 10 veces más común en los casos positivos para COVID-1956. Estas alteraciones han sido muy documentadas, por lo que se ha sugerido la vigilancia de trastornos olfativos y del gusto como una herramienta para la detección de casos sospechosos de la infección56,57, o como indicadores de gravedad para la enfermedad por el potencial prognóstico que representan56, motivando su inclusión dentro de características de alerta temprana para la enfermedad58, por ser considerados por muchas investigaciones como síntomas importantes de la infección por SARS-CoV-257.
Tabla 2. Complicaciones del sistema nervioso periférico y enfermedades cerebrovasculares en pacientes con COVID-19.
| Manifestación clínica | Estudio | Países | N | n (sexo, edad en años) |
|---|---|---|---|---|
| Enfermedad del SNP | ||||
| Síndrome de Guillain-Barré | Virani et al.(60) | Estados Unidos | 1 | 1 (hombre, 54) |
| Zhao et al.(64) | China | 1 | 1 (mujer, 61) | |
| Toscano et al.(59) | Italia | 5 | 5 (NR) | |
| Camdessanche et al.(65) | Francia | 1 | 1 (hombre, 64) | |
| El Otmani et al.(66) | Marruecos | 1 | 1 (mujer, 70) | |
| Guijarro-Castro et al.(67) | España | 1 | 1 (hombre, 70) | |
| Paterson et al.(40) | Reino Unido | 43 | 7 (NR) | |
| Padroni et al.(68) | Italia | 1 | 1 (mujer, 70) | |
| Sedaghat et al.(69) | Irán | 1 | 1 (hombre, 65) | |
| Sancho-Saldaña et al.(70) | España | 1 | 1 (mujer, 56) | |
| Oguz -Akarsu et al.(71) | Turquía | 1 | 1 (mujer, 53) | |
| Coen et al.(72) | Suiza | 1 | 1 (hombre, 70) | |
| Paybast et al.(73) | Irán | 2 | 2 (hombre y mujer de 38 y 14) | |
| Scheidl et al.(74) | Alemania | 1 | 1 (mujer, 54) | |
| Variantes de SGB y otras neuropatías | Gutiérrez-Ortiz et al.(61) | España | 1 | 1 (hombre, 70), síndrome de Miller Fisher |
| Dinkin et al.(75) | Estados Unidos | 1 | 1 (hombre, 36), síndrome de Miller Fisher | |
| Dinkin et al.(75) | Estados Unidos | 1 | 1 (mujer, 71), oftalmoplejía | |
| Sedaghat et al.(69) | Irán | 1 | 1 (hombre, 65), neuropatía axonal sensitivo motora aguda (AMSAN) | |
| Restivo et al.(76) | Italia | 3 | 3 (dos hombres y una mujer, de 64 a 71), miastenia gravis | |
| Caamaño et al.(77) | España | 1 | 1 (hombre, 61), diplejía facial | |
| Pellitero et al.(78) | Estados Unidos | 1 | 1 (mujer, 30), disfunción vestibular aguda | |
| Rabdomiólisis y otras enfermedades musculares | Jin et al.(79) | China | 1 | 1 (hombre, 60) |
| Sing et al.(80) | Estados Unidos | 4 | 4 (NR) | |
| Suwanwongse et al.(81) | Estados Unidos | 1 | 1 (hombre, 88) | |
| Gefen et al.(82) | Estados Unidos | 1 | 1 (hombre, 16) | |
| Disfunción olfatoria y/o gustativa | Beltrán‐Corbellini et al.(83) | España | 79 | 25 y 28 pacientes informaron disfunción olfatoria y gustativa respectivamente |
| Haehner et al.(84) | Alemania | 34 | 22 pacientes informaron disfunción olfatoria y gustativa | |
| Hornuss et al.(85) | Alemania | 45 | 18, 20 y 7 pacientes informaron anosmia, hiposmia y normosmia respectivamente | |
| Giacomelli et al.(22) | Italia | 59 | 31 y 37 pacientes informaron disfunción olfatoria y gustativa | |
| Klopfenstein et al.(86) | Francia | 114 | 54 y 46 pacientes informaron anosmia y disgeusia respectivamente | |
| Lechien et al.(57) | Bélgica,Francia, España e Italia | 417 | 357 y 342 pacientes informaron disfunción olfatoria y gustativa respectivamente | |
| Moein et al.(87) | Irán | 60 | 59 y 14 pacientes informaron disfunción gustativa y olfatoria respectivamente | |
| Vaira et al.(88) | Italia | 72 | 39 y 44 pacientes informaron disfunción gustativa y olfatoria respectivamente | |
| Yan et al.(56) | Estados Unidos | 59 | 42 y 40 pacientes informaron disfunción gustativa y olfatoria respectivamente | |
| Lee et al.(89) | Corea del Sur | 3191 | 389 y 353 pacientes informaron disfunción olfatoria y gustativa respectivamente | |
| Mao et al.(5) | China | 214 | 11 y 12 pacientes informaron disfunción olfatoria y gustativa respectivamente | |
| Bénézit et al.(90) | Francia | 68 | 51 y 63 pacientes informaron disfunción olfatoria y gustativa respectivamente | |
| Enfermedad cerebrovascular | ||||
| Accidente cerebrovascular isquémico | Li et al.(91) | China | 219 | 10 (NR) |
| Helms et al.(44) | Francia | 58 | 3 (NR) | |
| Klok et al.(92) | Países Bajos | 184 | 5 (NR) | |
| Merkler et al.(93) | Estados Unidos | 1916 | 31 (NR) | |
| Avula et al.(94) | Estados Unidos | 4 | 4 (NR) | |
| Beyrouti et al.(95) | Reino Unido | 6 | 6 (cinco hombres y una mujer, de 53 a 85) | |
| Morassi et al.(96) | Italia | 6 | 4 (tres hombres y una mujer, de 75 a 82 años) | |
| Varatharaj et al.(39) | Reino Unido | 125 | 57 (NR) | |
| Paterson et al.(40) | Reino Unido | 43 | 8 (NR) | |
| Mao et al.(5) | China | 214 | 6 (NR) | |
| Hemorragia intracerebral | Li et al.(91) | China | 219 | 1 (NR) |
| Hernández-Fernández et al.(97) | España | 1683 | 5 (NR) | |
| Sharifi-Razavi et al.(98) | Irán | 1 | 1 (masculino, 79 años) | |
| Dogra et al.(99) | Estados Unidos | 755 | 33 (NR) | |
| Varatharaj et al.(39) | Reino Unido | 125 | 9 (NR) | |
| Pavlov et al.(100) | Rusia | 1200 | 3 (NR) | |
N: tamaño de la muestra (pacientes COVID-19); n: número de casos; NR: no reportado
Los informes de síndrome de Guillain-Barré (SGB) y variantes axonales, desmielinizantes asociadas a COVID-19, por lo general se presentan como un patrón post infeccioso (intervalo de cinco a 10 días)59, sin embargo, se ha observado casos de SGB que siguen un perfil “parainfeccioso”60, hecho que necesita ser comprobado en futuras investigaciones. Del mismo modo, se han descrito casos de síndrome de Miller-Fisher, una variante rara de SGB asociada a la respuesta inmune aberrante frente a la infección por SARS-CoV-261, detallados en latabla 2. SARS-CoV-2 ha sido vinculado también con enfermedades cerebrovasculares agudas como la hemorragia e infarto cerebral sobre todo en pacientes que sufren de hipertensión o coagulopatías62, y la presencia de este tipo de complicaciones se asociaría con pacientes más severos5e individuos de edad avanzada63.
DISCUSIÓN
En el presente estudio se encontró que las manifestaciones neurológicas de COVID-19 afectan tanto al SNC y SNP. Las principales limitaciones del estudio están referidas al número de artículos científicos que reportan el hallazgoin situdel virus. Así como el tamaño de la población en la que se describe, siendo principalmente las series de casos los que otorgan la evidencia de este daño directo.
El mecanismo probable por el cual SARS-CoV-2 ingresa al SNC e induce daño cerebral es la invasión olfativa transmucosa mediada por las neuronas olfativas, tal como lo demuestran los estudiosin vitroy post mortem, donde NRP1 es un factor importante para la entrada y la infectividad del epitelio olfatorio por el SARS-CoV-215,16, hallazgos que justifican en parte las distintas manifestaciones neurológicas descritas en los pacientes infectados (tabla 1ytabla 2).
El neurotropismo del SARS-CoV-2 ya ha sido documentado27. Este hecho se ha visto antes en otras infecciones de HCoV como el SARS-CoV, donde el virus fue aislado de tejido cerebral12y OC43, en el que se demostró que el transporte axonal (neurona - neurona) es la forma como el virus accede y se disemina dentro del SNC10. Estos informes muestran el tropismo nervioso que poseen los HCoV y por lo tanto plantean la hipótesis del mecanismo que utiliza el SARS-CoV-2 para invadir el SNC, siendo la ruta neuronal la más probable, sin embargo, estos hallazgos deben ser verificados con otros estudios principalmente en modelos animales, in vitro y autopsias de pacientes.
Se sabe que la familiaHerpesviridae puede persistir en el SNC101, y aunque este evento es menos probable en los virus ARN, se conoce por estudios en ratones que se infectaron con OC43, que el ARN viral persiste por lo menos un año en los casos donde se observó esclerosis múltiple (EM) posterior a la infección46. Punto importante a considerar en las infecciones por SARS-CoV-2, porque si este virus posee la capacidad de latencia en el SNC de pacientes “recuperados”, entonces podría ser un desencadenante de diversas complicaciones neurológicas y neurodegenerativas tardías como la EM, la enfermedad de Parkinson o producir recidivas en individuos predispuestos.
Las disfunciones olfatorias y gustativas son cada vez más frecuentes en pacientes con COVID-19, incluso se sugiere que sean considerados síntomas patognomónicos de la enfermedad56. La pérdida olfativa es un problema clínico desafiante con pocas opciones diagnósticas probadas. Algunos estudios plantean realizar una prueba rápida para determinar la anosmia mediante la percepción por inhalación con el uso de ácido acético incluso antes de otras valoraciones como hipertermia, tos y cefalea102. Aunque esta manifestación no se ha visto en todos los casos reportados de COVID-19, sería importante determinar adecuadamente la presencia de esta variable y su probable asociación con el pronóstico y el desarrollo posterior de manifestaciones neurológicas severas en los pacientes afectados.
A pesar de que la mayor parte de la evidencia actual sugiere que el daño directo o la acumulación de trombos en los alvéolos serían responsables de la dificultad y el fallo respiratorio, se debe considerar que ésta podría estar relacionada en parte con el daño causado por el virus en los centros respiratorios del encéfalo, esto debido a la diseminación de SARS-CoV-2 en el cerebro, específicamente al bulbo encefálico, ya que esta estructura contiene núcleos que regulan el ritmo respiratorio y las alteraciones en estos componentes conducen a un aumento o disminución del esfuerzo respiratorio66. Sin embargo, aunque es una hipótesis plausible es necesario considerar otros signos de disfunción cerebral, siendo otro motivo para continuar con estudios sobre la gravedad del daño que puede ocasionar COVID-19.
La evidencia clínica sobre el compromiso neurológico en pacientes por COVID-19 pertenecen a Asia, Europa y América del Norte principalmente, lo que también muestra la necesidad de la documentación de los mismo en América del Sur con el fin de considerarlos, en muchos casos, como signos de alerta temprana, lo que puede motivar a elaborar estrategias de detección preliminar que eviten desenlaces fatales, sobre todo en un escenario de cuarentena o restricción social, donde pueden ser desestimadas por las ya conocidas manifestaciones respiratorias. En este sentido, diversos especialistas han mostrado su preocupación debido a que durante esta pandemia han disminuido las consultas por infarto de miocardio y ACV, sin embargo, las muertes por las mismas causas han incrementado considerablemente. Prueba de ello es que en la ciudad de Nueva York aumentaron en un 800%103).
CONCLUSIONES
La creciente evidencia de las manifestaciones neurológicas demuestra que la infección por SARS-CoV-2 no se encuentra limitada únicamente al sistema respiratorio y que el virus tiene la capacidad de migrar al tejido nervioso y producir daño. Sin embargo, la extensión y complicaciones de la misma no están del todo claras, por ello es necesario continuar con la documentación y reporte de estas complicaciones neurológicas que puedan presentarse en pacientes con COVID-19. Así mismo ante el incremento de muertes reportadas de forma súbita y en algunas por daño neurológico, el quedarse en aislamiento obligatorio sin determinar la presencia o gravedad de este tipo de manifestaciones, representaría un riesgo que puede empeorar el pronóstico del paciente, lo cual se traducirá en altas chances de muerte o discapacidad.











 texto en
texto en