Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú v.14 n.1 Lima jan./jun. 2003
COMUNICACIÓN
Seroprevalencia de Toxoplasma gondii en vicuñas de Puno
José Pastor V.1; Amanda Chávez V.2,3; Eva Casas A.2y Enrique Serrano M.2
1 Práctica privada
2 Laboratorio de Microbiología y Parasitología Veterinaria, FMV-UNMSM
3 E-mail: a_chavez_g@hotmail.com
ABSTRACT
The objective of this study was to determine the seroprevalence of Toxoplasma gondii in Vicuñas of Puno. For this purpose, 101 mature vicuña were blood sampled in November 2000. The Indirect Hemoaglutination Test for the detection of antibodies was used. The seroprevalence was 14.9 ± 86% (15/101). The study revealed a low seroprevalence as compared with local findings in alpacas and llamas.
Key words: Toxoplasma gondii, seroprevalence, IHA, vicuña, Puno
La toxoplasmosis es una enfermedad parasitaria de difusión mundial y de gran repercusión en la economía pecuaria. Afecta a diversas especies animales de sangre caliente como mamíferos y aves (Atias, 1994), incluyendo especies de animales domésticos como los ovinos, donde se ha determinado seroprevalencias bajas de 12% (Amin y Silsmore, 1993), y altas de 99% (Waltner-Toews et al., 1991). Estas diferencias pueden deberse al tipo de sistema de explotación pecuaria, así como a variaciones climáticas y geográficas.
En el Perú, uno de los camélidos sudamericanos de mayor valor es la vicuña, debido a la finura y valor comercial de su fibra (Bustinza et al., 1997). La población mundial se estima en más de 200,000 animales, de los que 143,526 se encuentran en el Perú (CONACS, 2000). Esta reducida población es consecuencia de la presencia de cazadores furtivos y, probablemente, a problemas sanitarios y reproductivos que afectan a adultos y crías.
Debido al gran valor comercial de la vicuña, así como la escasa información científica que se tiene de la toxoplasmosis y su probable implicancia en problemas repro-ductivos de esta especie, se realizó el presente estudio con el objetivo de determinar la seroprevalencia del Toxoplasma gondii en vicuñas del departamento de Puno.
El estudio se realizó en los distritos de Cabanillas y Santa Lucía, provincias de San Román y Lampa, departamento de Puno, a 4,025 msnm, 15° 46' latitud sur y 70° 36' longitud oeste. La zona presenta dos estaciones marcadas, lluviosa y seca, con una temperatura promedio diaria que varía de - 4.7 a 13.2 ºC (INEI, 2000).
El tamaño de la muestra se obtuvo a través de un muestreo piloto para obtener una prevalencia referencial, que resultó ser de 6.6%. El tamaño mínimo de la muestra fue de 95.
Las muestras fueron obtenidas en noviembre del 2000 por punción de la vena yugular usando vacutainers estériles. Los sueros resultantes obtenidos por centrifugación se conservaron a -20 ºC hasta su análisis. Los sueros fueron evaluados utilizando la prueba de hemoaglutinación indirecta, usando para ello un kit comercial (Toxotest, de Wiener Lab. Toxotest, 2000). Se consideró como positivo los valores HAI ³ 1/16 (punto de corte). Los resultados se expresaron en porcentajes, teniendo en cuenta la positividad de los sueros a la prueba serológica con el respectivo intervalo de confianza.
La evaluación del Toxoplasma gondii en vicuñas constituye el primer estudio realizado en este tipo de animales en el Perú. Este animal, dada su característica silvestre, hace difícil su manejo productivo, el cual se limita a capturas periódicas o chakkus, donde sólo está permitido el manejo de los animales adultos.
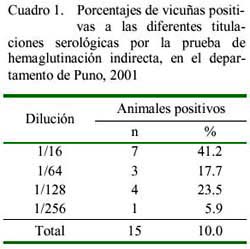
Se muestrearon 101 vicuñas adultas, de los cuales 15 resultaron positivas dando una prevalencia de Toxoplasma gondii de 14.8 ± 5.9%. Este valor sólo se podría comparar con estudios realizados en alpacas y llamas sobre esta enfermedad, ya que no existen estudios previos en vicuñas en la zona estudiada. Gomez (2002), mediante la técnica HAI, determinó seroprevalencias de toxoplasma de 33, 31 y 25% en alpacas machos y en llamas machos y hembras respectivamente, criadas en altitudes superiores a los 4,000 msnm, y de 56% en alpacas hembras criadas en altitudes inferiores a 4,000 msnm. Este autor atribuye la mayor prevalencia en alpacas hembras porque estos animales eran mantenidos en pasturas mejoradas y cercanas a los poblados, y consecuentemente, tenían mayor probabilidad de estar en contacto con las heces de los gatos, quienes constituyen los principales hospederos definitivos de este parásito. Leguía et al. (1988) también reportan seroprevalencias altas (50%) en alpacas del departamento de Puno.
Las vicuñas son generalmente criadas en forma extensiva en zonas alto andinas en
altitudes que varían de 4,200 a más de 5,000 msnm, alimentándose en base a pastos naturales, en donde la presencia de gatos domésticos es infrecuente; por lo que la posibilidad de infectarse con T. gondii sería mediante el consumo de alimentos contaminados con los ooquistes provenientes de felinos silvestres como el puma, el felino silvestre más común en la zona.
Un aspecto que influenciaría en la supervivencia de los ooquistes de T. gondii se debe a la baja temperatura promedio de la zona (INEI, 2000). Se sabe que los ooquistes de T. gondii pueden llegar a sobrevivir por mucho tiempo con humedad adecuada, y que se afectan por periodos prolongados en temperaturas de refrigeración, congelación y desecación (Freij y Sever, 1991). La permanencia de los ooquistes en la zona quechua y puna estaría relacionada a la presencia de bofedales y espejos de aguas.
En estudios realizados en el altiplano chileno, en situaciones ecológicas similares a las zonas de estudio, Rojas et al. (1989), encontraron prevalencias que variaron entre 24 a 27% para alpacas, llamas y vicuñas criadas en forma conjunta. Asimismo, Gorman et al. (1999) observaron un 16.3% de seroprevalencia en alpacas, concluyendo que la baja prevalencia observada se debía a las temperaturas de congelación y desecamiento que hicieron poco viable la esporulación del ooquiste.
El Cuadro 1 muestra los títulos de anticuerpos contra Toxoplasma gondii. Cabe resaltar que la prueba empleada detectó Ig G, la cual indica infección crónica; sin embargo, para confirmar una infección aguda los títulos altos tendrían que ser analizados luego de dos a cuatros semanas, tratando de detectar Ig G e Ig M, usando el 2 mercapto- etanol (Sodikoff, 1995).
La prueba de hemaglutinación indirecta utilizada en el estudio presenta una especificidad del 96.6% y una sensibilidad del 45.9% (Dubey et al.,1992), y constituye una de las técnicas más utilizadas en la mayoría de estudios realizados en camélidos sudamericanos por ser económica y no requerir de equipos sofisticados, mientras que otras técnicas que ofrecen mayor sensibilidad y especificidad como IFI o ELISA necesitan para su aplicación disponer de antígeno y conjugado antillama, que son difíciles de obtener y son costosos.
Comparando los resultados de este trabajo con estudios previos realizados en llamas y alpacas, se podría concluir que la prevalencia de T. gondii en las vicuñas de Puno fue baja debido, probablemente, a los siguientes factores:
- Condiciones medio ambientales extremas tales como altitudes superiores a los 4,200 msnm, y temperaturas bajas, que crearían condiciones adversas para la sobrevivencia de los ooquistes de T. gondii.
- Ausencia de hospederos definitivos, con excepción del puma que es relativamente frecuente en la zona donde se alimentan las vicuñas.
LITERATURA CITADA
1. Amin, J.D.; A.J. Silsmore. 1993. A serological survey of some abortifacien
diseases of sheep and goats in the Maidu-guri area of Nigeria. Bull. Anim. Health and Prod. Africa 41: 123-128.
2. Atias, A. 1994. Parasitología Clínica. 3ra ed. p 81-282. Publicaciones Mediterráneo. Santiago de Chile. [ Links ]
3. Bustinza, V.; G. Rebuffi; V. Ibáñez. 1997. Crecimiento de la vicuña. (Vicugna vicugna). Revista de investigación sobre Camélidos Sudamericanos 6: 61-65. [ Links ]
4. Concejo Nacional de Camélidos Sudamericanos (CONACS). Evaluación poblacional de vicuñas 2000. http://wwwminag.gob.pe/minag/conacs/indice.htm 22/11/2002. [ Links ]
5. Dubey, J.P.; L.G. Rickard.; G.L. Zimmerman; D.M. Mulrooney. 1992. Seroprevalence of Toxoplasma gondii in llamas (Lama glama) in the northwest USA. Vet. Parasitol. 44: 295-298. [ Links ]
6. Freij, B.; J. Sever. 1991. Toxoplas-mosis. Red book / Pediatrics in Review/Self - Assessment Exercises. February. 12: 24. [ Links ]
7. Gomez, F. 2002. Determinación de la seroprevalencia de toxoplasmosis en alpacas y llamas en la estación experimental del INIA - Puno. Tesis Médico Veterinario. Facultad de Medicina Veterinaria, Univ. Nacional Mayor de San Marcos. Lima. 41 p. [ Links ]
8. Gorman, T.; J.P. Arancibia; M. Lorca; D. Hird; H. Alcaino. 1999. Seropre-valence of Toxoplasma gondii infection in sheep and alpacas in Chile. Prev. Vet. Med. 40: 143-149. [ Links ]
9. Instituto Nacional de Estadística e Informática (INEI). 2000. Perú: Compendio Estadístico 1994-95. Tomo I. Sistema Nacional de Estadística e Informática. Lima, Perú. [ Links ]
10. Leguía G.; H. Samamé; C. Guerrero; M. Rojas; A. Nuñez. 1988. Prevalencia de anticuerpos contra Toxoplasma gondii en alpacas. MV Rev. Cienc. Vet. 3:19-21. [ Links ]
11. Rojas, M.; I. Lobato; M. Montalvo. 1989. Prevalencia de Toxoplasma gondii. XII Reunión de la Asociación Peruana de Producción Animal. Lima, Perú. p 97. [ Links ]
12. Sodikoff, C.H. 1996. Pruebas diagnósticas y de laboratorio en las enfermedades depequeños animales. 2da ed. p 105. Ed. Mosby. Madrid, España. [ Links ]
13. Waltner-Toews, D.; R. Monde-Sire; P. Menzies. 1991. The seroprevalence of Toxoplasma gondii in Ontario sheep flocks. Can. Vet. J. 32: 734-737. [ Links ]













