Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú v.23 n.2 Lima abril./jun 2012
IDENTIFICACIÓN DE LAS CÉLULAS DE PANETH EN EL INTESTINO DELGADO DE ALPACAS EN LOS PRIMEROS 21 DÍAS DE EDAD
IDENTIFICATION OF PANETH CELLS IN THE SMALL INTESTINE OF ALPACAS IN THE FIRST 21 DAYS OF AGE
Boris Lira M.1,4, Sergio Cueva M.1, José Rodríguez G.1, Milder Ayón S.1, Carolina Zanuzzi2, Claudio Barbeito2, Néstor Falcón P.3, María Vásquez C.1,5
1 Laboratorio de Fisiología Animal, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima, Perú
2 Facultad de Ciencias Veterinarias, Universidad Nacional de La Plata, Argentina
3 Facultad de Veterinaria y Zootecnia, Universidad Peruana Cayetano Heredia, Lima, Perú
4 E-mail: sirantli@hotmail.com
5 E-mail: evasquezc@gmail.com
RESUMEN
Las células de Paneth cumplen un importante rol en los mecanismos de defensa y protección del tracto gastrointestinal en varias especies animales a través de sus secreciones como lisozima, fosfolipasa A2 secretoria y defensinas. El estudio tuvo por objetivo identificar las células de Paneth en el intestino delgado de crías de alpacas. Se utilizaron 18 animales de descarte entre 1 y 21 días de edad. Se tomaron muestras de duodeno, yeyuno e íleon, que fueron fijadas en formol al 10%. Se prepararon cortes histológicos con hematoxilina-eosina (H-E) y tricrómico de Masson. Mediante inmunohistoquímica con un anticuerpo policlonal antilisozima se identificó la presencia de gránulos de lisozima. Con las coloraciones no se pudo identificar en forma precisa las células típicas de Paneth, mientras que mediante inmunohistoquímica se observó células con presencia de gránulos de lisozima en la base de las criptas de Lieberkühn de duodeno, yeyuno e íleon desde el primer día de edad; siendo mayor el número en yeyuno e íleon entre los 15 y 21 días de edad. Las células presentaron un área de 129.19 a 147.67 μm2, ejes mayores entre 17.96 y 19.92 μm y ejes menores entre 8.68 y 9.79 μm. Se concluye que las células encontradas corresponden a células de Paneth.
Palabras clave: alpaca, células de Paneth, inmunohistoquímica, intestino delgado
ABSTRACT
Paneth cells have an important function in the defense and protection mechanisms of the gastrointestinal tract in several animal species through secretions, e.g. as lysozime, secretory phospholipase A2 and defensins. The aim of this study was to identify the Paneth cells in the small intestine of baby alpacas. Eighteen culled animals between 1 and 21 days of age were used. Duodenum, jejunum and ileum samples were taken. Samples were fixed in 10% formalin, processed and stained with haematoxylin-eosin (H-E) and Masson trichromic. An anti-lizozime polyclonal antibody was used for immunohistochemistry. Typical Paneth cells were not identified with H-E and Masson trichromic stains, whereas lysozime granules were identified in the base of the crypts of Lieberkühn of duodenum, jejunum and ileum by immunohistochemistry since the first day of age. The number in jejunum and ileum was greater between 15 and 21 days of age. The cell area was between 129.19 and 147.67 μm2, major axes between 17.96 and 19.92 μm and minor axes between 8.68 and 9.79 μm. It is concluded that the observed cells corresponded to Paneth cells.
Key words: alpaca, Paneth cells, immunohistochemistry, small intestine
INTRODUCCIÓN
El mantenimiento de la homeostasis intestinal está dado por factores tales como el pH intestinal, secreción de electrolitos, mantenimiento de la microflora intestinal, procesos absortivos y digestivos. La barrera de defensa a nivel intestinal tiene componentes celulares propios, como las células de Paneth (CP), células caliciformes, células neuroendocrinas y las células propias del sistema inmune asociado al intestino; lo cual constituye parte de la defensa inmune innata del tracto gastrointestinal.
Las CP protegen y mantienen la flora intestinal en equilibrio a través de la secreción de proteínas y péptidos antimicrobianos como las lisozimas, defensinas y fosfolipasa A2 secretoria (Keshav, 2006). Las CP se han identificado en el humano, rata, ratón, cobayo, ardilla, hámster, conejo, caballo, oveja y camello (Toth, 1980; Rodning et al., 1982; Ehrmann et al., 1990; Satoh et al., 1990; Abdel-Magied y Taha, 1995; Takehana et al., 1998; Porter et al., 2002; Ergün et al., 2003, Zanuzzi et al., 2008); sin embargo, aún no se disponen de estos estudios en la alpaca.
Las CP están localizadas en la base de las criptas de Lieberkühn y están distribuidas principalmente desde el duodeno hasta el íleon (Porter et al., 2002). Estudios en ratones y humanos mostraron que las CP migran hacia la parte inferior de la zona de células madres pluripotenciales, hacia la base de las criptas de Lieberkühn, con una vida media de 20 días, que es más larga que los 3 a 5 días de los enterocitos (Cheng, 1974; Bry et al., 1994). Dentro de las numerosas acciones atribuidas a las CP, se encuentra la regulación de la composición y el número de microorganismos comensales del tracto gastrointestinal, su participación en el desarrollo y homeostasis de las criptas, principalmente en el cuidado de las células madre. Participa en la regulación del flujo iónico en los enterocitos, regulación de los procesos inflamatorios locales y de defensa contra agentes antibacterianos, y en los procesos de detoxificación y metabolismo de metales pesados (Garabedian et al., 1997; Ouellette, 1999; Porter et al., 2002; Bevins, 2004; Salzman et al., 2007).
Histológicamente, las CP son de forma piramidal, núcleo esférico u ovalado con citoplasma apical basófilo. El citoplasma es altamente eosinofílico en la zona apical debido a la presencia de gránulos de secreción que son vertidos al lumen de la cripta (Geneser, 2000; Ouellette et al., 2000; Porter et al., 2002). Los gránulos de secreción están compuestos de enzimas como lisozima y fosfolipasa A, pépidos antimicrobianos (PAMs) como y defensinas (Hecht, 1999; Hornef et al., 2004), inhibidor de leucocitos tipo secretorio (SLPI), inmunoglobulina A, proteína asociada a pancreatitis (PAP), lectinas, ADNasa, fosfolipasa B, lipasas, tripsinógeno, prostaglandina E2 (PGE2), carboxilesterasa, metales pesados (cadmio, cobre, selenio, zinc), proteínas ligadoras de zinc, factor de necrosis tumoral (TNF) (Porter et al., 2002) y angiogeninas (Eckman, 2005), cuya secreción es regulada por estímulos colinérgicos que pueden derivar de neuronas entéricas y autonómicas, y por productos de los microorganismos incluyendo lipopolisacáridos, péptidoglicanos (Ayabe et al., 2000); así como hormonas como la colecistoquinina (CCK) y gastrina (Balas et al., 1985; Satoh et al., 1989; Porter et al., 2002). Al mismo tiempo, las CP responden a productos de digestión presentes en el lumen, principalmente macromoléculas que actúan como osmoreceptores y a señales secundarias de otras células epiteliales o del tejido conectivo, lo cual le brinda a la CP un rol importante en la comunicación celular durante procesos fisiológicos o fisiopatológicos (Porter et al., 2002). Las CP presentan una autorregulación con los linfocitos T, a quienes estimula a secretar interleucinas, pero estas a su vez inducen la proliferación y diferenciación de las CP (Kamal et al., 2001).
Las CP responden de diversas formas ante distintas condiciones patológicas; así, se puede observar cambios en número, tamaño, localización, y características morfológicas e histoquímicas de sus gránulos, lo cual hace que su función se vea alterada (Porter et al., 2002; Zanuzzi et al., 2008). Diversos estudios han demostrado que el número de las CP se incrementa como consecuencia de un aumento de la carga bacteriana luminal, y en algunos casos se puede observar CP en todo el tracto intestinal incluyendo intestino grueso (Keren et al., 1975). En la enfermedad de Crohn, se observa una disminución del número de CP así como una marcada disminución de defensinas, lo cual favorece el desarrollo del cuadro de ileitis (Wehkamp et al., 2005). También se ha demostrado que ratones con inhibición de expresión de defensinas son más suceptibles a Salmonella enterica serovar typhimorium (Wilson et al., 1999), mientras que los ratones transgénicos con alta expresión de defensinas son más resistentes a los cuadros de salmonelosis (Salzman et al., 2003); por lo cual se puede afirmar que las secreciones de las CP son moléculas efectoras clave en la inmunidad innata del tracto intestinal.
En crías de alpacas se ha identificado y defensinas mediante PCR, siendo su máxima expresión hacia el día 21 (More, 2010), pero no se ha identificado a las células productoras de estas defensinas. El presente estudio fue planteado con el fin de identificar y determinar la presencia y distribución de las CP en las diferentes porciones del intestino delgado de crías de alpacas en los primeros 21 días de edad.
MATERIALES Y MÉTODOS
Lugar de Ejecución
Las muestras se colectaron en comunidades alpaqueras de los departamentos de Puno y Cusco, sobre los 3800 msnm. El procesamiento de las muestras se realizó en el Laboratorio de Fisiología Animal de la Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima.
Animales
Se utilizaron 18 crías de alpacas de 1 a 21 días de edad, aparentemente sanas, criadas bajo similares condiciones de manejo y alimentación, y destinadas al consumo humano. La edad de los animales fue determinada a través de los registros zootécnicos de los propietarios.
El manejo y sacrificio de los animales se realizó siguiendo los Principios Directrices Internacionales para la Investigación Biomédica que implique el Uso de Animales del Consejo de Organizaciones Internacionales de las Ciencias Médicas (CIOMS), Ginebra, 1985.
Estudios Histológicos e Histoquímicos
Después del sacrificio, el intestino delgado fue dividido en duodeno, yeyuno e íleon. De cada porción se tomaron tres muestras de 2 cm, que se colocaron en frascos de plástico conteniendo formol al 10%. Las muestras fueron reducidas y procesadas mediante técnicas histológicas e incluidas en parafina. Se realizaron cortes de 5 μm de espesor, que fueron coloreadas con hematoxilina-eosina (H-E) y tricrómico de Masson (Brancroft y Stevens, 1990; Zanuzzi, 2010).
Inmunohistoquímica
Se utilizaron cortes de 5 μm de espesor que fueron colocados en láminas positivadas con poli-L-lisina (P 8920, Sigma-Aldrich), para luego ser desparafinadas a través de alcoholes en niveles decrecientes e incubados con H2O2 en metanol por 30 minutos, a temperatura ambiente, para inhibir la actividad de la peroxidasa endógena. Las láminas fueron lavadas dos veces con PBS y expuestas a recuperación antigénica en microondas usando solución buffer citrato (pH 6.0) (Taylor et al., 1996; Zanuzzi et al., 2008).
Las láminas fueron incubadas con BSA al 1% en PBS por 30 minutos, y luego se incubaron en anticuerpo policlonal biotinilado de conejo anti-lisozima humana (Accurate Chemical and Scientific Corporation, Westbury, NY, USA), diluido a una concentración de 1:50 por toda la noche. Como sistema de detección se usó el Horseradish Peroxidasa Streptavidin SA 704 (Vector Laboratories, Inc., Burlingame, CA, USA) durante 30 minutos. Las láminas fueron lavadas con PBS durante 5 minutos, para luego activar la peroxidasa con 3´3 diaminobencidina (DAB), incubando entre 1 a 2 minutos. La reacción positiva del DAB fue observada mediante la coloración marrón oscuro. Se corrieron controles positivos que incluyeron glándula lacrimal de ratón y alpaca y yeyuno e íleon de ratón. La coloración de contraste se realizó con Hematoxilina de Harris (Zanuzzi et al., 2008).
Análisis de Imágenes
Las imágenes se capturaron con un microscopio trinocular (Carl Zeiss, modelo Primo Star, Alemania) con un ocular WF 10x/ 20, objetivos de 4X, 10X, 40X y 100X, que tiene adicionado una cámara digital (Canon Powershot G9, 12 megapixels, Japón). Las imágenes capturadas fueron procesadas y analizadas usando el programa AxioVision LE Canon para Carl Zeiss. Las variables evaluadas fueron eje mayor, eje menor y área de cada CP.
El número de CP fue evaluado mediante el conteo de 30 criptas por porción intestinal por animal, utilizando el objetivo 40x. Las criptas que se eligieron para contar CP fueron las que se encontraban en forma perpendicular a la muscular de la mucosa, y presentaban estructura completa.
Análisis Estadístico
Las diferencias entre grupos se establecieron mediante la prueba de ANOVA y las diferencias significativas fueron definidas como p<0.05. Para el análisis estadístico se usó el programa SPS 15.0.
RESULTADOS
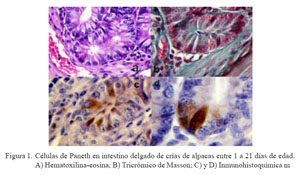
En las láminas con H-E de duodeno y yeyuno no se pudo observar con facilidad células con características de CP, tal como se observa en otras especies. En íleon se observaron células que tenían una coloración más eosinofílica, que se ubicaban en la base de las criptas de Lieberkühn y que podrían ser CP, pero no se pudieron realizar estudios morfométricos a partir de estas láminas (Fig. 1a).
Con la tinción de tricrómico de Masson se logró observar células en la base de las criptas de duodeno y yeyuno, y en mayor cantidad en íleon, con gránulos característicos de las CP de color rojizo, tal como se describen en otras especies (Fig. 1b).
Mediante la técnica de inmohistoquímica se pudo observar fácilmente a todas las células que contenían gránulos de lisozima y que eran compatibles con CP, tanto por su ubicación en la cripta de Lieberkühn así como por coloración marrón a nivel del citoplasma celular, a manera de una estructura vacuolar de borde irregular que algunas veces alcanzaba el borde del perinúcleo y en otras entraba en contacto con la membrana nuclear. El núcleo era casi esférico y desplazado hacia la parte basal de la célula. La forma no fue piramidal como en otras especies (rata, ratón, hombre, etc.), pues la mayoría tenía características de células columnares altas (Figs.1c y 1d).
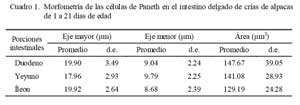
Las CP presentaron un eje mayor comprendido entre 17.96 a 19.92 μm, eje menor entre 8.68 a 9.79 μm, y área celular comprendida entre 129.19 a 147.67 μm2 (Cuadro 1).
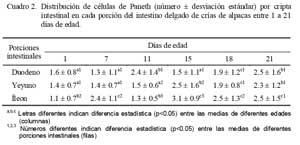
Al evaluar el número de CP por cripta intestinal se observó una distribución heterogénea en el duodeno, mientras que en el yeyuno se encontró un aumento significativo (p<0.05) a partir de los 15 días de edad. Asimismo, en el íleon se encontró una tendencia al aumento a partir de los 15 días de edad. Cabe indicar que a los 21 días de edad, el número de CP fue mayor en las tres porciones comparados a los demás días de edad; sin embargo, no hubo diferencia significativa (p>0.05) entre las tres porciones en esa edad (Cuadro 2).
DISCUSIÓN
Las CP se ubicaron en la base de las criptas de Lieberkühn, en las tres porciones del intestino delgado, siendo esta distribución similar a lo encontrado en humanos, ratones, monos, ratas, hámsters dorados, equinos y conejos (Satoh et al., 1990; Abdel-Magied y Taba, 1995; Takehana et al., 1998). Las CP, sin embargo, no se han observado en el gato, perro y cerdo (Bloom y Fawcett, 1994; Dellman y Eurell, 1998). Su presencia desde el nacimiento coincide con hallazgos de estas células en la etapa prenatal en humanos (Mallow et al., 1996) y en ratones mantenidos bajo condiciones libres de gérmenes (Ouellette et al., 1989; Putsep et al., 2000), lo cual indica que su diferenciación no depende exclusivamente de la presencia de bacterias luminales en el intestino.
La exposición a bacterias Gram positivas y Gram negativas, así como a sus productos como lipopolisacáridos, ácido lipoteico, lípido A y muramil dipéptido, estimulan la secreción de péptidos antimicrobianos (predominantemente defensinas) y lisozimas (Ayabe et al., 2000; Elphick y Mahida, 2005). Por otro lado, la regulación de las CP se da por estímulos colinérgicos que pueden derivar de neuronas autónomas y entéricas (Keshav, 2006). En esta actividad también intervienen los genes NOD2 que median la respuesta a los componentes de la pared celular bacteriana, principalmente dipéptido muramil de los peptidoglicanos (Inohara et al., 2003).
En las crías de 21 días de edad, el número de CP por cripta intestinal observado en el duodeno (2.47), yeyuno (2.32) e íleon (2.53) fue similar al 2.49 observado en yeyuno de ovejas adultas (Ergün et al., 2003), aunque inferiores a los 4.28 CP por cripta intestinal en conejos de tres meses de edad (Zanuzzi et al., 2008) y de 5 a 12 CP por cripta en ratones (Cheng y Leblond, 1974).
El número de CP se incrementó entre los 15 a 21 días de edad en yeyuno y en íleon; resultado similar al reporte de More (2010), quien encontró detección genómica y expresión de péptidos antimicrobianos (a-defensina y b-defensina) en mucosa intestinal yeyunal de crías de alpacas con niveles crecientes hacia los 21 días de edad, lo que sugiere que estos péptidos antimicrobianos podrían ser de origen epitelial secretados por las células de Paneth.
Los valores morfométricos de las CP fueron mayores a reportes en otras especies como el conejo (Zanuzzi et al., 2008). Estos valores son importantes ya que constituyen la base para la interpretación ante cambios, no solo en su número sino en sus medidas debido a diversas condiciones patológicas (Kelly et al., 2004).
En camellos, las típicas CP no fueron observadas con H-E, sino células columnares altas que fueron visualizadas con facilidad en secciones con azul de toloudina, las cuales presentaban finos gránulos acidófilos en la parte apical de la célula en las criptas de Lieberkühn de las diferentes partes del intestino delgado. Las presumibles CP del camello, con microscopía electrónica, presentaron gránulos de secreción de menor tamaño y menor número comparado con las de los conejos y otros animales (Abdel-Magied y Taba, 1995). La forma columnar alta fue similar a la observada en alpacas en el presente estudio; y esta similitud estaría reforzada por la estrecha relación entre ambas especies ya que pertenecen a la misma familia.
CONCLUSIONES
-
En el intestino delgado de crías de alpacas se observaron, desde el primer día de edad, las células de Paneth mediante la técnica de inmunohistoquímica, utilizando el anticuerpo antilisozima.
-
Las células de Paneth se ubicaron en mayor cantidad en las criptas de Lieberkühn del yeyuno e íleon entre los 15 a 21 días de edad.
-
Con las técnicas de coloración de hematoxilina-eosina y tricrómico de Masson no se logró precisar la identificación de células de Paneth.
LITERATURA CITADA
1. Abdel-Magied EM, Taba AAM. 1995. A comparison of the structure of granular cell T type in the intestinal epithelium of the camel with Paneth cells of the rabbit. J King Saud Univ 7(1): 51-62.
2. Ayabe T, Satchell DP, Wilson CL, Parks WC, Selsted ME, Ouellette AJ. 2000. Secretion of microbicidal defensins by intestinal Paneth cells in response to bacteria. Nat Inmunol 1: 113- 118.
3. Balas D, Senegas F, Pradayrol L, Vayssette J, Bertrand C, Ribert A. 1985. Long-term comparative effect of cholecystokinin and gastrin on mouse stomach, antrum, intestine and exocrine pancreas. Am J Anat 174: 27-43.
4. Bancroft JD, Stevens A. 1990. Theory and practice of histological techniques. 3a ed. Edinburgh: Churchill Livinsgtone. 740 p.
5. Bevins CL. 2004. Paneth cell and the innate immune response. Curr Opin Gastroenterol 20: 572-580.
6. Bloom W, Fawcett DW. 1994. A textbook of histology. 12a ed. New York: Chapman and Hall. 964 p.
7. L Bry, Falk P, Huttner K, Ouellette A, Midtvedt T, Gordon JI. 1994. Paneth cell differentiation in the developing intestine of normal and transgenic mice. Proc Natl Acad Sci USA 91: 10335- 10339.
8. Cheng H. 1974. Origin, differentiation and renewal of the four main epithelial cell types in the mouse small intestine. IV. Paneth cells. Am J Anat 141: 521- 535.
9. Cheng H, Leblond CP. 1974. Origin, differentiation and renewal of the four main epithelial cell types in the mouse small intestine. V. Unitarian theory of the origin of the four main epithelial cell types. Am J Anat 141: 537-561.
10. Dellman HD, Eurell JA. 1998. Textbook of veterinary histology. 5th ed. Baltimore, USA: Williams and Wilkins. 380 p.
11. Eckmann L. 2005. Defence molecules in intestinal innate immunity against bacterial infections. Curr Opin Gastroenterol 21: 147-151.
12. Ehrmann J, Malinsky J, Gregar I. 1990. Paneth cells and coeliac diseasequantitative, morphometric analysis. Acta Univ Palacki Olomic Fac Med 126: 187- 201.
13. Elphick DA, Mahida R. 2005. Paneth cells: their role in innate immunity and inflammatory disease. Gut 54: 1802- 1809.
14. Ergün E, Ergün L, Asti RN, Kürüm A. 2003. Light and electron microscopic morphology of Paneth cells in the sheep small intestine. Rev Med Vet 154: 351- 355.
15. Garabedian EM, Roberts JM, Nevin MS, Gordon JI. 1997. Examining the role of Paneth cells in the small intestine by lineage ablation in transgenic mice. J Biol Chem 272: 23729-2374.
16. Geneser F. 2000. Aparato digestivo. En: Histología. 3º ed. Buenos Aires: Ed Médica Panamericana. p 498-510.
17. Hecht G. 1999. Innate mechanisms of epithelial host defense: spotlight on intestine. Am J Physiol 277: 351-358.
18. Hornef MW, Putsep K, Karlsson J, Refai E, Andersson M. 2004. Increased diversity of intestinal antimicrobial peptides by covalent dimer formation. Nat Immunol 5: 836-843.
19. Inohara N, Ogura Y, Fontalba A, Gutierrez O, Pons F, Crespo J, Fukase K, et al. 2003. Host recognition of bacterial muramyl dipeptide mediated through NOD2. Implications for Crohn´s disease. J Biol Chem 278: 5509-5512.
20. Kamal M, Wakelin D, Ouellette AJ, Smith A, Podolsky DK, Mahida YR. 2001. Mucosal T cells regulate Paneth and intermediate cell numbers in the small intestine of T. Spiralis-infected mice. Clin Exp Inmunol 126: 117-125.
21. Kelly P, Feakins R, Domizio P, Murphy J, Bevins C, Wilson J, McPhail G, et al. 2004. Paneth cell granule depletion in the human small intestine under infective and nutritional stress. Clin Exp Immunol 135: 303-309.
22. Keren DF, Elliott HL, Brown GD, Yardley JH. 1975. Atrophy of villi with hypertrophy and hyperplasia of Paneth cells in isolated (thiry-Vella) ileal loops in rabbits. Light-microscopic studies. Gastroenterology 68: 83-93.
23. Keshav S. 2006. Paneth cells: leukocytelike mediators of innate immunity in the intestine. J Leukocyte Biol 80: 500-508.
24. Mallow EB, Harris A, Salzman N, Russell JP, DeBerardinis RJ, Ruchelli E, Bevins CL. 1996. Human enteric defensins: gene structure and developmental expression. J Biol Chem 271: 4038-4045.
25. More J. 2010. Detección genómica y expresión de péptidos antimicrobianos (a y b defensinas) en mucosa intestinal de crías de alpacas. Tesis de Médico Veterinario. Lima: Univ Nac Mayor de San Marcos. 82 p.
26. Nolte M, Kotze A, van der Bank FH, Grobler JP. 2005. Microsatellite markers reveal low genetic differentiation among southern African Camelus dromedarius populations. SA J Anim Sci 35: 152-161.
27. Ouellette AJ, Greco RM, James M, Frederick D, Naftilan J, Fallon JT. 1989. Developmental regulation of cryptdin, a corticostatin/defensin precursor mRNA in mouse small intestinal crypt epithelium. J Cell Biol 108: 1687-1695.
28. Ouellette AJ. 1999. Mucosal immunity and inflamation IV. Paneth cell antimicrobial peptides and the biology of the mucosal barrier. Am J Physiol 277: g257-g261.
29. Ouellette AJ, Satchell DP, Hsieh MM, Hagen SJ, Selsted ME. 2000. Characterization of luminal Paneth cell alpha-defensins in mouse small intestine: Attenuated antimicrobial activities of peptides with truncated amino termini. J Biol Chem 275: 33969-33973.
30. Porter EM, Bevins CL, Ghosh D, Ganz T. 2002. The multifaceted Paneth cell. Cell Mol Life Sci 59: 156-170.
31. Putsep K, Axelsson LG, Boman A, Midtvedt T, Normark S, Boman HG, Andersson M. 2000. Germ-free and colonized mice generate the same products from enteric prodefensins. J Biol Chem 275: 40478-40482.
32. Rodning CB, Erlandsen SL, Wilson ID, Carpenter AM. 1982. Light microscopic morphometric analysis of rat ileal mucosa: II. Component quantifi-cation of Paneth cells. Anat Rec 204: 33-38.
33. Salzman NH, Ghosh D, Huttner KM, Paterson Y, Bevins CL. 2003. Protection against enteric salmonellosis in transgenic mice expressing a human intestinal defensin. Nature 422: 522-526.
34. Salzman N, Underwood MA, Bevins CL. 2007. Paneth cells, defensins, and the commensal microbiota: a hypothesis on intimate interplay at the intestinal mucosa. Semin Immunol 19(2): 70-83.
35. Satoh Y, Ishikawa K, Oomori Y, Ono K. 1989. Effects of cholecystokinin and carbamylcholine on Paneth cell secretion in mice: a comparison. Anat Rec 255: 124-132.
36. Satoh Y, Yamano M, Matsuda M, Ono K. 1990. Ultrastructure of Paneth cells in the intestine of various mammals. J Electron Microsc Tech 16: 69-80.
37. Takehana K, Masty J, Yamaguchi M, Kobayashi A, Yamada O, Kuroda M, et al. 1998. Fine structural and histochemical study of equine Paneth cells. Anat Histol Embryol 27: 125-129.
38. Taylor C, Shi S, Cote R. 1996. Review: Antigen retrieval for immunohistochemistry. Appl Immunohistochem 4: 144-166.
39. Toth D. 1980. Ultrastructural changes in Paneth cells during hibernation in the ground squirrel Spermophilus lateralis. Cell Tissue Res 211: 293-301.
40. Wehkamp J, Salzman NH, Porter E, Nuding S, Weichenthal M, Petras RE, Shen B, et al. 2005. Reduced Paneth cell alpha-defensins in ileal Crohns disease. Proc Natl Acad Sci USA 102: 18129-18134.
41. Wilson CL, Ouellette AJ, Satchell DP, Ayabe T, Lopez-Boado YS, Stratman JL, Hultgren SJ, et al. 1999. Regulation of intestinal alpha-defensin activation by the metalloproteinase matrilysin in innate host defense. Science 286: 113-117.
42. Zanuzzi CN, Fontana PA, Barbeito CG, Portiansky EL, Gimeno EJ. 2008. Paneth cells: histochemical and morphometric study in control and Solanum glaucophyllum intoxicated rabbits. Eur J Histochem 52: 93-100.
43. Zanuzzi CN. 2010. Efectos de la intoxicación con Solanum glaucophyllum (duraznillo blanco) sobre la proliferación, diferenciación y muerte celular en el intestino de conejos. Tesis de Doctorado. La Plata, Argentina: Fac Ciencias Veterinarias, Univ Nac de la Plata. 286 p.