Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú v.23 n.4 Lima dez./dic. 2012
COMUNICACIÓN
Presencia de enterocytozoon bieneusi en cerdos de traspatio en Tumbes, Perú
Presence of enterocytozoon bieneusi in backyard pigs in Tumbes, Peru
Ivette Avalos M.1, Rosa Perales C.1,4, Teresa López U.2, Eloy Gonzáles G.3, Armando González Z.3
1 Laboratorio de Histología, Embriología y Patología Veterinaria,
2 Laboratorio de Microbiología y Parasitología Veterinaria,
3 Laboratorio de Medicina Veterinaria Preventiva, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima
4 E-mail : rperales_fmv@hotmail.com
RESUMEN
El presente estudio tuvo como objetivo determinar la presencia de esporas de Enterocytozoon bieneusi en cerdos de traspatio, en el departamento de Tumbes, Perú. Se tomaron 300 muestras de heces y 300 muestras de bilis de cerdos en dos oportunidades entre marzo y octubre de 2009. Se empleó la coloración Chromotrope 2R (exclusiva para microsporidios) para la detección del hongo. Todas las muestras resultaron negativas.
Palabras clave: microsporidiosis, Enterocytozoon bieneusi, cerdos
ABSTRACT
The present study aimed to determine the presence of spores of Enterocytozoon bieneusi in pigs under extensive breeding in the department of Tumbes, Peru. Three hundred samples of feces and 300 of bile were taken twice between March and October 2009. Samples were processed by the staining technique using Chromotrope 2R (microsporidia exclusive). All samples resulted negative.
Key words: microsporidia, Enterocytozoon bieneusi, pigs
INTRODUCCIÓN
Enterocytozoon bieneusi es un microsporidio intracelular obligado de distribución mundial, reclasificado como un hongo perteneciente al Phylum Microspora (Mathis et al., 2005). Es un eucariota primitivo, que se caracteriza por producir esporas y poseer un mecanismo complejo de extrusión tubular, el cual es utilizado para inyectar el esporoplasma (material infeccioso) a las células (Acha y Szyfres, 2003).
E. bieneusi es la especie más común de microsporidio que está asociado a infecciones oportunistas en individuos inmunosuprimidos, y en el hombre está principalmente asociado al Síndrome de Inmunodeficiencia Adquirida (SIDA) (Angela y Suresh, 2007). Se localiza en el intestino delgado y en el epitelio de los conductos biliares, y al igual que en el humano, en los animales se le asocia con poca frecuencia con enfermedad clínica (Watchman y Mansfield, 2008); no obstante, es responsable de diversos procesos patológicos. La enfermedad que produce se puede presentar como una infección asintomática, como una diarrea autolimitante o como una infección refractaria o incurable (Barros et al., 2004).
E. bieneusi se ha detectado en diversos animales, tanto domésticos como silvestres. La presencia de esporas de E. bieneusi en heces de cerdos de crianza intensiva ha sido confirmada mediante la prueba de reacción en cadena de la polimerasa (PCR) y la tinción tricrómica (Deplazes et al., 1996; Breintenmoser et al., 1999; Buckholt et al., 2002; Jeong et al., 2007; Sak et al., 2008). Los genotipos encontrados en cerdos están muy relacionados a los hallados en humanos, y por ello se sugirió que este patógeno producía una infección potencialmente zoonótica (Rinder et al., 2000).
En el Perú, mediante la prueba de PCR, se encontraron esporas de E. bieneusi en cuyes y en un niño, siendo del mismo genotipo. Además, se determinó que este genotipo era genéticamente diferente a los otros genotipos conocidos de E. bieneusi en humanos (Cama et al., 2007).
El presente estudio tuvo por objetivo determinar la presencia de esporas del microsporidio Enterocytozoon bieneusi en heces y bilis de cerdos de traspatio.
MATERIALES Y MÉTODOS
El presente estudio de investigación fue de tipo explorativo. Se trabajó con cerdos criollos de traspatio del departamento de Tumbes entre marzo y octubre de 2009. Tumbes se encuentra localizado en la parte nor-occidental del Perú, y presenta un clima semitropical, temperatura anual de 24 ºC (desde 18 ºC en invierno hasta 40 ºC en verano) (Tumbes, 2011).
Para el cálculo del tamaño de muestra se utilizó el modelo teórico de la distribución binomial, fijándose arbitrariamente una prevalencia crítica del 1% y una confianza del 95%, es decir que la probabilidad de encontrar positivos en la muestra sería del 5% (González, 1986), llegándose a requerir 300 animales.
Se emplearon animales que fueron sacrificados en el camal local, y se colectaron 300 muestras de heces y 300 de bilis por periodo de estudio. En el primer periodo se trabajó con cerdos de 2 a 60 meses de edad, en tanto que en el segundo periodo fueron de 6 a 8 meses de edad.
Las muestras de heces se obtuvieron directamente del recto. Se colectaron 10 g que se mezclaron con 30 ml de formol-PBS al 5% en tubos Falcon. Para la obtención de las muestras de bilis, se separó la vesícula biliar del hígado y se vertió todo el contenido en un tubo Falcon de 50 ml. Las muestras fueron rotuladas, almacenadas a 4 °C y trasladadas al Laboratorio de Histología, Embriología y Patología Veterinaria de la Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima.
En el procesamiento de las muestras de bilis se realizó una modificación de la técnica usada por Alvarado (2004), donde las muestras fueron centrifugadas a 2500 rpm por 10 min con NaCl al 0.9%. Se colocó 50 µl del sedimento en un portaobjeto, se hizo una extensión de la muestra haciendo círculos y se fijó con metanol.
Las muestras de heces fueron analizadas por el método de concentración de Ritchie, siguiendo el protocolo descrito por Alvarado (2004). La muestras fueron centrifugadas a 2500 rpm por 10 min, se tomó 50 µl del sedimento, y se fijó con metanol absoluto durante 10 min. Posteriormente, las muestras fueron fijadas y coloreadas con Chromotrope 2R (específica para microsporidios).
En ambos tipos de muestras, se colocó una gota de permount (pegamento) sobre la lámina y un cubreobjeto de 22 x 40 mm. Se observó a microscopio de luz, con el objetivo de 100X y aceite de inmersión.
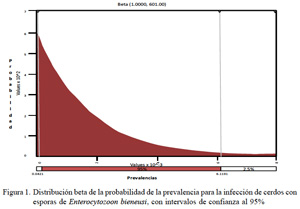
Para el análisis de datos, se utilizó la técnica de evaluación de riesgo mediante la simulación beta (@Risk), y las proporciones se expresaron con un intervalo de confianza al 95%.
RESULTADOS
Todas las muestras resultaron negativas a esporas de E. bieneusi. Los valores máximo y mínimo obtenidos a través de la simulación estocástica fueron de 0.0000421 y 0.0061191, respectivamente (Fig. 1).
DISCUSIÓN
En los últimos años se ha podido apreciar el surgimiento de enfermedades emergentes y oportunistas. Tal es el caso de la microsporidiosis humana, causada por el E. bieneusi, donde el cerdo es considerado como una de las fuentes de diseminación de este patógeno, y por lo tanto, constituye un riesgo potencial en la salud pública (Dengjel et al., 2001). Se tiene escaso conocimiento de esta enfermedad en el país, por lo que en el presente estudio se evaluó el rol del cerdo criado en forma extensiva como diseminador de esporas del E. bieneusi.
Trabajos previos demuestran una relación entre la presencia de E. bieneusi y el tipo de crianza. Estudios hechos en cerdos de crianzas intensivas o tecnificadas demos-traron prevalencias variadas (Desplazes et al., 1996; Breintenmoser et al., 1999; Buckholt et al., 2002; Jeong et al., 2007; Sak et al., 2008). El presente trabajo se hizo con cerdos criados de forma extensiva o no tecnificada, donde se esperaba encontrar animales positivos, debido a las medidas sanitarias inadecuadas e insalubres para controlar cualquier tipo de enfermedad, además de presentar un ambiente rústico y sin asistencia médica; sin embargo, todas las muestras resultaron negativas.
La crianza intensiva es un factor que predispone a los animales a padecer de diversas enfermedades, en parte debido al estrés crónico en que se encuentran (Santana, 1996); mientras que el ambiente en la crianza extensiva es más natural, con menos estrés.
La coloración Chromotrope 2R fue empleada por sus ventajas comparativas sobre el PCR, a pesar que posee una sensibilidad del 80% y podrían dejarse de detectar algunas muestras positivas. Por ello, se disminuyó la prevalencia límite al 0.75%, para que fuese más probable encontrar un animal positivo. La tinción Chromotrope 2R favorece un buen contraste entre las esporas de microsporidios y otros elementos que se puedan encontrar en heces. Además, esta coloración puede utilizarse con otro tipo de muestras, como la orina. Las esporas se tiñen de color rojo violeta y permite, a veces, visualizar la zona vacuolar; aunque es más fácil ver las esporas cuando se encuentran en grupo (Castro y Guerrero, 2006).
La técnica de PCR es la más usada para el diagnóstico de E. bieneusi en muestras de heces (Desplazes et al., 1996; Breintenmoser et al., 1999; Jeong et al., 2007; Sak et al., 2008) y bilis (Buckholt et al., 2002). Sin embargo, a pesar que la prueba de PCR se considera como gold estándar para el diagnóstico de microsporidios por su mayor sensibilidad y especificidad, la coloración Chromotrope 2R es muy usada, sobre todo, como prueba tamiz (Mohammed et al., 2009). Así mismo, la coloración es más económica que el PCR, al no requerir reactivos y equipos costosos.
LITERATURA CITADA
1. Acha P, Szyfres B. 2003. Zoonosis y enfermedades transmisibles comunes al hombre y los animales. 3° ed. Vol 3. Publicación Científica y Técnica No. 580. Washington DC: Organización Panamericana de la Salud. 989 p.
2. Alvarado J. 2004. Infección experimental en cerdos de un mes de edad con esporas de Enterocytozoon bieneusi. Tesis de Médico Veterinario. Lima: Facultad de Medicina Veterinaria, Univ Nac Mayor de San Marcos. 52 p.
3. Angela R, Suresh K. 2007. Microsporidia in stool from cancer patients. J Med Sci 1(2): 88-90.
4. Barros M, Quintino V, Cesar J, Penna F. 2004. Parasitoses intestinais. Rev Med Minas Gerais 14(Supl 1): S3-S12.
5. Breitenmoser A, Mathis A, Burgi E, Weber R, Deplazes P. 1999. High prevalence of Enterocytozoon bieneusi in swine with four genotypes that differ from those identified in humans. Parasitology 118: 447-453.
6. Buckholt M, Lee J, Tzipori S. 2002. Prevalence of Enterocytozoon bieneusi in swine: an 18-month survey at a slaughterhouse in Massachusetts. Appl Environ Microbiol 68: 2595-2599.
7. Cama V, Pearson J, Cabrera L, Pacheco L, Gilman R, Meyer S, et al. 2007. Transmission of Enterocytozoon bieneusi between a child and guinea pigs. J Clin Microbiol 45: 2708-2710.
8. Castro A, Guerrero O. 2006. Técnicas de diagnóstico parasitológico. 2° ed. San José: Universidad de Costa Rica. 115 p.
9. Dengjel B, Zahler M, Hermanns W, Heinritzi K, Spillmann T, Thomschke A, Loscher T, et al. 2001. Zoonotic potential of Enterocytozoon bieneusi. J Clin Microbiol 39: 4495-4499.
10. Deplazes P, Mathis A, Muller C, Weber R. 1996. Molecular epidemiology of Encephalitozoon cuniculi and first detection of Enterocytozoon bieneusi in faecal samples of pigs. J Eukaryot Microbiol 43(5): 93s.
11. González A. 1986. Presencia de anticuerpos de influenza en aves. Tesis de Médico Veterinario. Lima: Facultad de Medicina Veterinaria, Univ Nac Mayor de San Marcos. 36 p.
12. Jeong D, Won G, Park B, Hur J, You J, Kang S, et al. 2007. Occurrence and geno-typic characteristics of Enterocy-tozoon bieneusi in pigs with diarrhea. Parasitol Res 102: 123-128.
13. Mathis A, Weber R, Deplazes P. 2005. Zoonotic potencial of the microsporidia. Clin Microbiol Rev 18: 423-445.
14. Mohammed H, Endeshaw T, Kebede A, Defera M. 2009. Comparison of Chromotrope 2R and Uvitex 2B for the detection of intestinal microsporidial spores in stool specimens of VIH patients attending Nekempte Hospital, West Ethiopia. Ethiop Med J 47: 233-237.
15. Rinder H, Thomschke A, Dengjel B, Gothe R, Loscher T, Zahler M. 2000. Close genotypic relationship between Enterocytozoon bieneusi from humans and pigs and first detection in cattle. J Parasitol 86: 185-188.
16. Sak B, Kvac M, Hanzlíková D, Cama V. 2008. First report of Enterocytozoon bieneusi infection on a pig farm in the Czech Republic. Vet Parasitol 153: 220-224.
17. Santana I. 1996. Integración del cerdo criollo a los sistemas de explotación porcina. Instituto de Investigaciones Porcinas. La Habana, Cuba. [Internet], [18 de abril 2011]. Disponible en: http://www.sian.info.ve/porcinos/publicaciones/producerdos/articulo8.htm
18. Tumbes. 2011. Tumbes.com: Tierra de bosques, playas y manglares. [Internet], [20 de agosto 2011]. Disponible en: http://www.tumbes.com/
19. Wachtman L, Mansfield K. 2008. Opportunistic infections in immuno-logically compromised nonhuman primates. ILAR J 49: 191-207.