Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú vol.24 no.4 Lima dez./dic. 2013
Asociación de agentes virales y bacterianos en cuadros de neumonías agudas en alpacas tuis
Association of bacterial and viral agents in acute pneumonia in young alpacas
Karol Guzmán M.1, Raúl Rosadio A.1,2, Lenin Maturrano H.1, Alberto Manchego S.1
1 Laboratorio de Microbiología y Parasitología Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima, Perú
2 E-mail: rrosadio@gmail.com
RESUMEN
Se describen lesiones macroscópicas, histopatológicas y análisis microbiológicos de muestras de 27 alpacas recién destetadas en la sierra del sur del Perú que murieron por neumonía aguda. En 15/27 muestras patológicas se buscó la presencia in situ de antígenos virales, mediante inmunofluorescencia directa, para los virus Parainfluenza 3 (PI3), respiratorio sincitial bovino (RSB) y adenovirus bovino tipo 3 (BAdV-3) y en las 27 muestras se realizaron cultivos bacterianos. Las alteraciones macroscópicas correspondieron mayoritariamente a neumonía extensiva multilobar (11/27) asociadas con pleuritis fibrinosa (8/27), y cuadros de congestión y edema pulmonar (8/27). Con excepción de la presencia de agregado linfocítico peribronquial observado en un solo caso, los cambios histopatológicos fueron muy similares a los descritos en la literatura para neumonías agudas de alpacas neonatas. En 9 de las 15 muestras se detectaron 14 presencias virales (5 como infecciones únicas, 3 dobles y 1 triple). El virus RSB fue detectado 5 veces, PI3 5 veces y BAdV3 4 veces, y mayoritariamente coexistiendo con infecciones bacteriales, principalmente Pasteurella multocida (n=15) y Mannheimia haemolytica (n=10). Estos resultados evidencian que los procesos neumónicos agudos en alpacas tuis, de manera similar a los neonatos y otros rumiantes, son productos de interacciones virus y bacteria.
Palabras clave: neumonías agudas, alpaca, Pasteurella multocida, Manhemia haemolytica, BRSV, PI-3, BAdV-3
ABSTRACT
Gross lesions, histopathology and microbiological analysis of samples from 27 weaned alpaca tuis from southern Peru that died from acute pneumonia are described. In situ viral antigens [Parainfluenza 3 (PI3), bovine respiratory syncytial (BRSB) and bovine adenovirus type 3 (BAdV-3)] were searched in 15 of the 27 samples by direct immunofluorescent test and bacteriology cultures were performed on all 27 samples. The gross alterations corresponded mostly to extensive multilobar pneumonia (11/27) associated with fibrinous pleuritis (8/27), and congestion and pulmonary edema (8/27).
With the exception of peribronquial lymphocitic aggregates observed in one case, the histopathological changes were similar to those described in the literature for acute pneumonia in neonatal cases. In 9 out of 15 pneumonic tissues, 14 viral antigens were detected (5 as single, 3 dual and 1 triple infections). BRSV was detected 5 times, PI3 5 times, and BAdV3 4 times, coexisting most frequently with Pasteurella multocida (n=15) and Mannheimia haemolytica (n=10). These results show that the acute pneumonia process in alpaca tuis is produced by viral and bacterial interactions, as has previously been documented for alpaca neonates and in other ruminants.
Key words: acute pneumonia, alpaca, Pasteurella multocida, Manhemia haemolytica, BRSV, PI-3, BAdV-3
INTRODUCCIÓN
En el Perú, la crianza de camélidos sudamericanos constituye una importante fuente de ingresos económicos para las empresas asociativas, pequeños productores y comunidades campesinas de la región andina (Ameghino y DeMartini, 1991). La productividad de esta ganadería, sin embargo, no es la adecuada, pues se presenta una elevada mortalidad neonatal y de animales jóvenes (Ramírez, 1991). La neumonía aguda es la segunda causa de muertes neonatales y la principal en alpacas jóvenes. Los procesos neumónicos en la mayoría de los animales domésticos son usualmente producto de interacciones microbiológicas (virus/bacteria) asociados con un inadecuado manejo productivo o estrés ambiental (Rosadio et al., 1990; Cirilo, 2008).
Históricamente, en el Perú se han realizado estudios sobre las neumonías agudas en neonatos con el fin de detectar la presencia de agentes bacterianos, y en donde mayormente se ha reportado aislamientos de Pasteurella multocida (Ameghino y Calle, 1989; Ameghino, 1990). La participación de P. haemolytica (ahora Mannheimia haemolytica) ha sido, además, frecuentemente observada en procesos neumónicos similares (Ameghino y DeMartini, 1991). En estudios más recientes realizados en 24 casos de neumonías agudas se confirmó la presencia de Pasteurella y Manheimia asociados a agentes virales (Cirilo, 2008; Rosadio et al., 2011).
Las neumonías agudas en alpacas, al parecer, son entidades complejas pues existen evidencias de anticuerpos contra Mycoplasma spp (Hung et al., 1988), identificaciones y aislamientos de coronavirus bovino tipo 2 (Crossley et al., 2010; Luna, 2012), adenovirus bovino tipo 3 (Pardon et al., 2011), aislamientos de estafilococos y estreptococos α-hemolíticos y Klebsiella spp (Arratia y Herrera, 1992), así como presencia de Streptococcus spp, Staphylococcus aureus, Neisseria spp y E. coli como microorganismos invasores en procesos neumónicos (Ameghino, 1990).
En estudios serológicos en alpacas andinas se han identificado animales serorreactores a agentes virales de localización pulmonar tales como la Parainfluenza tipo 3 (PI-3) y el virus respiratorio sincitial bovino (BRSV) (Rivera et al., 1987; Victorio et al., 2004). Asimismo, se ha determinado una baja prevalencia de anticuerpos contra Herpesvirus Bovino tipo 1 en 31 hatos alpaqueros de medianos y pequeños productores en la región de Canchis, Cusco (Victorio et al., 2004) y 18% de seropositivos en una explotación de crianza mixta en el altiplano arequipeño (Manchego et al., 1998). En ovinos y bovinos se acepta que los virus son agentes patógenos primarios con capacidad de producir lesiones pulmonares (Sharp y Nettleton, 2007), que por pequeñas que sean, favorecen el ingreso de microorganismos oportunistas como los del género Pasteurella (Dabo et al., 2008).
En un estudio más reciente se ha demostrado que las neumonías agudas en alpacas crías son productos de interacciones de virus y bacteria, con presencia del PI3 y BRSV coexistiendo con P. multocida y M. haemolytica (Cirilo, 2008). En esta interacción, las infecciones virales favorecerían la proliferación bacteriana (Cirilo, 2008; Rosadio et al., 2011). Por tal motivo, el presente estudio, utilizando similar diseño, tuvo como objetivo evaluar la presencia de agentes virales y bacterianos en 27 procesos neumónicos en alpacas jóvenes (tuis).
MATERIALES Y MÉTODOS
Las muestras fueron obtenidas durante la época de esquila (en los meses de octubre de los años 2007 a 2009) en el Centro de Investigación y Producción C.I.P. La Raya UNA-Puno, a una altitud de 4250 msnm. Se trabajó con 27 muestras de pulmones de tuis con procesos neumónicos, identificados por medio de signos clínicos y lesiones macroscópicas. Los animales estaban recién destetados, con ocho meses de edad en promedio, y habían muerto como resultado del proceso neumónico.
Las muestras consistieron principalmente de hisopados tomados directamente de la secreción y exudados de la tráquea y bronquios pulmonares, que fueron transportadas al laboratorio en medio Cary Blair. Las muestras del parénquima pulmonar se tomaron de las zonas más afectadas y se almacenaron en tubos estériles con agar semisólido BHI y en crioviales para el análisis bacteriológico y detección de antígenos virales. Además, se tomaron muestras del tejido pulmonar afectado (aproximadamente 2 cm3), y conservadas en formol tamponado al 10% para análisis histopatológico.
La identificación de antígenos virales [BRSV, PI-3 y Adenovirus Bovino tipo 3 (BAdV-3)] se hizo mediante la técnica de inmunofluorescencia directa, usando antisuero policlonal conjugado con isotiocianato de fluoresceína anti-BRSV, anti-PI-3 y anti- BAdV-3 (VMRD, Pullman, WA), siguiendo las instrucciones del fabricante y solamente, por restricciones presupuestales, en 15 de las 27 muestras obtenidas.
Para el aislamiento de agentes bacterianos, las muestras fueron sembradas en Agar Sangre y Agar McConkey e incubadas a 37 ºC por 24 horas. La identificación de las colonias se hizo observando características morfológicas, tintoriales (tinción Gram) y bioquímicas utilizando el kit comercial API 20NE (Biomerux®) y siguiendo las instrucciones del fabricante.
Para el estudio histopatológico, los tejidos fueron procesados con técnicas de histopatología convencional, embebidos en parafina y coloreados con hematoxilinaeosina, y los cortes fueron observados al microscopio. Las lesiones fueron clasificadas según el tipo de exudación y grado de lesión del parénquima (Trigo y Valero, 2004; Cirilo, 2008).
RESULTADOS
Histopatología
Lesiones macroscópicas
Las alteraciones macroscópicas de campo muestran una predominancia de lesiones correspondientes a bronconeumonía extensiva y pleuritis fibrinosa (11/27), seguida de bronconeumonía multilobal (8/27) y congestión y edema pulmonar (8/27).
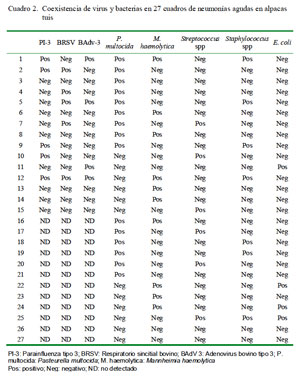
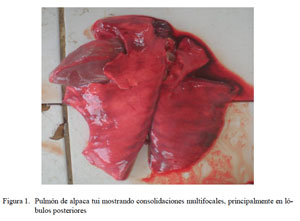
En los casos de bronconeumonía extensiva/ multilobal, los cambios patológicos estuvieron asociados a consolidaciones multifocales, principalmente en las áreas cráneo ventrales, comprometiendo los lóbulos craneales y cardiacos, y en menor grado el lóbulo posterior (Figs. 1 y Fig 2). Ocho de estos pulmones afectados presentaron, además, severas adherencias fibrinosas a las paredes costales (pleuritis fibrinosa) y en algunos casos la superficie pulmonar se mostró crepitante, presentando formaciones bullosas. La incisión de las partes afectadas evidenció zonas consolidadas rojizas con abundante exudado sanguinolento espumoso, comprometiendo también las mucosas traqueales y bronquiales que se mostraban congestionadas y con presencia mínima a moderada de espuma blanquecina, a veces de color cremoso.
Los nódulos pulmonares bronquiales estaban congestionados y aumentados de tamaño.
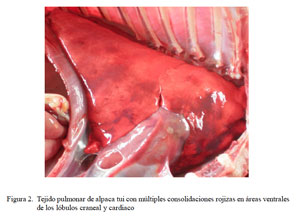
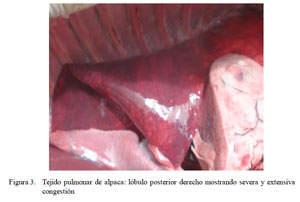
En la mayoría de los ocho casos descritos como congestión difusa y edema pulmonar, los pulmones se encontraban aumentados de tamaño, observándose una congestión externa uniforme; a veces abarcando todo el lóbulo (Fig. 3), dando un aspecto húmedo y brilloso, con abundante exudado serosanguinolento al corte, que se mezclaba con espuma rosada.
Los nódulos linfáticos adyacentes estaban ligeramente aumentados de tamaño y con el parénquima enrojecido.
Lesiones microscópicas
Las alteraciones microscópicas simularon los cambios observados a la necropsia. Seis de los 27 casos mostraron perturbaciones asociadas a severa y difusa bronconeumonía fibrino-supurativa, 13 casos correspondieron a moderada bronconeumonía difusa aguda de tipo supurativa (n=7) y no supurativa (n=6), en tanto que los ocho casos restantes mostraron una moderada y difusa congestión y edema pulmonar.
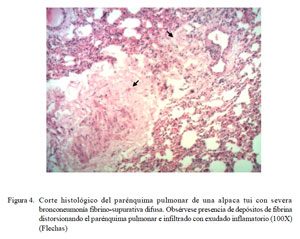
En los cuadros de severa bronconeumonía fibrino-supurativa difusa aguda, los cambios más comunes fueron de moderadas a severas infiltraciones de células polimorfonucleares que engrosaban las paredes alveolares y, que algunas veces, ingresaban al interior de los espacios alveolares y bronquiales. En algunos casos (n=6) se observaron extensos depósitos de fibrina que distorsionaban y destruían el parénquima pulmonar (Fig. 4). En otros casos se tuvo la pérdida de la arquitectura parenquimal, asociada a descamaciones epiteliales intrabronquiolares (bronquiolitis necrotizante).
Los vasos sanguíneos se hallaron generalmente pletorizados con extravasaciones focales de eritrocitos y presencia de material eosinifílico (edema). En todos los casos, la pleura estuvo engrosada mostrando depósitos de fibrina e infiltración de polimorfo nucleares.
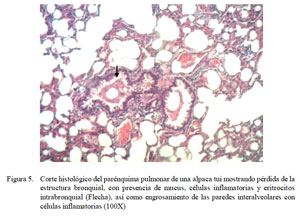
En el grupo de moderada bronconeumonía supurativa difusa aguda, con excepción de depósitos de fibrinas, se encontraron alteraciones similares al grupo anterior. Las infiltraciones de células inflamatorias, en estos casos, fueron mucho más intensas, no solamente ocupando el intersticio sino además los espacios alveolares y aún intraluminalmente en los vasos sanguíneos (Fig. 5). El epitelio de los bronquiolos, dependiendo del grado destructivo, estaba difusamente necrosado, descamado o hiperplásico.
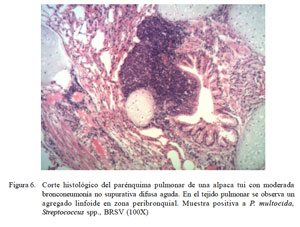
Se observó también, depósitos de material membranoso proteico (mucus), y edema en lúmenes de los alveolos y bronquios, algunas veces asociados a presencia de nidos bacterianos. Los cambios en los casos tipificados como moderada bronconeumonía no supurativa mostraron infiltraciones inflamatorias mononucleares, invadiendo el parénquima, luz alveolar y bronquios. En uno de estos casos se visualizaron células inflamatorias agregadas alrededor de los bronquios (Fig. 6). En todos los casos se observaron mínimas alteraciones epiteliales bronquiolares.
Los cambios histopatológicos en los cuadros de moderada a severa congestión y edema pulmonar se concentraron en los vasos sanguíneos pletorizados acompañado de una moderada a severa congestión asociada a depósitos de material eosinofílico (edema), ocupando, en algunos casos, espacios bronquiales.
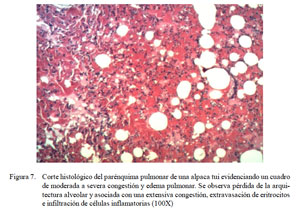
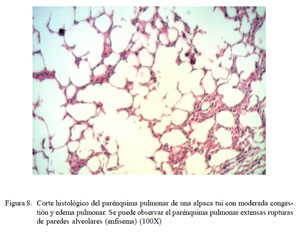
Paralelamente, se observó la presencia de eritrocitos infiltrando y engrosando las paredes alveolares (Fig. 7), así como mínima a moderada infiltración de células inflamatorias mixtas de polimorfonucleares y linfocitos en el parénquima pulmonar. En algunos casos se observó ruptura de paredes alveolares (enfisema) (Fig. 8), así como depósitos focales parduzcos (hemosiderosis) y ligera descamación epitelial e hiperplasia en bronquios.
Agentes Virales y Bacterianos
En la detección de agentes virales se trabajó con 15 de las 27 muestras, encontrándose positividad en 53.3% (n=9) de ellas y con un total de 14 detecciones de antígenos virales, 5 de las cuales correspondieron a infecciones únicas y las restantes a infecciones dobles o triples (Cuadro 1).
Bacterias de varias especies se aislaron en 25 de los 27 pulmones (dos muestras fueron negativas), donde P. multocida se aisló en el 55.6% (n=15) de los casos. Asimismo, se encontró M. haemolytica (37.0%), Staphylococcus spp (25.9%), Streptococcus spp (22.2%) y E. coli (14.8%). Además, se pudo determinar una interacción de agentes bacterianos en un mismo animal, es decir, presencia de más de una especie bacteriana.
P. multocida y M. haemolytica fueron aislados como agentes únicos pero también coexistiendo con otras bacterias, siendo más predominante la interacción con Staphylococcus spp (Cuadro 2). Asimismo, se ha detectado la presencia de agentes bacterianos aun en muestras negativas a antígenos virales (n=6), particularmente P. multocida (n=3) y M. haemolytica (n=4) (Cuadro 2).
Se observó una interacción de patógenos virales y bacterianos en 9 de las 15 muestras que fueron analizadas para antígenos virales, siendo más común la asociación P. multocida, M. haemolytica y Staphilococcus spp (Cuadro 2).
DISCUSIÓN
La neumonía aguda, principal causa de las mortalidades de alpacas jóvenes (tuis), es al parecer producto de factores múltiples que incluyen agentes microbiológicos, manejo estresante derivado del destete, primera esquila y/o exposiciones a inclemencias climáticas particulares de los Andes (Rosadio et al., 1990). Los animales destetados en el presente estudio presentaron cuadros neumónicos evidenciando cambios macroscópicos e histopatológicos, y donde pudieron identificarse interacciones de virus y bacterias de manera muy similar a lo observados en neonatos (Cirilo 2008; Rosadio et al., 2010).
Las alteraciones macroscópicas muestran una predominancia de lesiones correspondientes a bronconeumonía extensiva de tipo multilobal (Figs. 2 y Fig. 3) asociada con pleuritis fibrinosa en muchos de los casos, así como alteraciones correspondientes a cuadros congestivos y edema pulmonar muy simila res a lo reportado por Cirilo (2008). Con excepción de la presencia de agregado linfocítico peribronquial (Fig. 8), los cambios histopatológicos son igualmente similares a lo descrito por Cirilo (2008) y Rosadio et al. (2011). La infiltración linfocítica no ha sido descrita en patologías pulmonares en alpacas, pero denota un cambio de tipo subagudo similar a las descripciones asociadas a infecciones adenovirales (Narita et al., 2002) y Mycoplasma spp en ovinos (Dungworth, 1985; Ayling y Nicholas, 2007). En el presente estudio se logró detectar antígenos de BAdV-3 e igualmente existen reportes de anticuerpos contra Mycoplasma spp en animales aparentemente normales (Hung et al., 1988) que podrían explicar este tipo de patología pulmonar.
El virus sincitial bovino predomina en infecciones únicas, duales y aun en infeciones triples, seguido del virus de la Parainfluenza tipo 3 y del adenovirus bovino tipo 3 (Cuadro 1).
La mayor frecuencia de BRSV y PI3 corrobora la alta prevalencia de estos virus en poblaciones andinas (Victorio et al., 2004), y sobre todo demuestran la habilidad de estos dos virus de infectar poblaciones jóvenes de manera similar a alpacas neonatas, tales como la infecciones descritas en niños, terneros y vaquillas por el virus respiratorio sincitial (Baker y Velicer, 1991). Los aislamientos bacterianos revelan que P. multocida es la más prevalente seguido de M. haemolytica, mostrando concordancia con estudios previos realizados en alpacas (Ameghino y Calle, 1989; Ameghino y DeMartini, 1991; Rosadio et al., 1990; Arratia y Herrera, 1992), pero distintos a los identificados en procesos similares en bovinos, ovinos y caprinos, donde M. haemolytica es la bacteria de mayor presencia (Baker y Velicer, 1991).
Las lesiones observadas, caracterizadas por daño vascular, infiltración celular, exudado, necrosis y descamación, son atribuidas a cuadros neumónicos causados por la replicación viral (Davies et al., 1981; Domachowske y Rosenberg, 1999). Las lesiones necrotizantes del epitelio bronquiolar, las inflamaciones parenquimales y exudación alveolar son usualmente observadas en infecciones por el BAdV tipo 3 o el BRSV (Baker y Velicer, 1991; Narita et al., 2002).
Por otro lado, la acumulación mononuclear peribronquial corresponde a cambios subagudos y responderían a infecciones virales o de Mycoplasma spp, similares a los descritos en ovinos (Ayling y Nicholas, 2007).
Los daños más severos caracterizados por deposiciones de fibrina y compromiso de la pleura son generalmente atribuidas a superinfecciones pasteurolósicas en bovinos y ovinos.
Con excepción del BAdV-3, los virus identificados intralesionalmente son muy similares a los descritos en crías por Cirilo (2008) y Rosadio et al. (2011), corroborando la presencia de estos patógenos en poblaciones de alpacas andinas. La capacidad patogénica de los virus identificados, sin embargo, necesita ser elucidada en forma individual, así como buscar explicaciones patológicas de las superinfecciones bacterianas, principalmente las ocasionadas por bacterias de los géneros Pasteurella y Mannhiemia.
CONCLUSIONES
Las alpacas jóvenes (tuis) padecen de neumonías agudas con cambios macroscópicos e histipatológicos muy similares a las alpacas crías. Intralesionalmente se logran identificar antígenos del virus respiratorio sincitial bovino, parainfluenza tipo 3 y adenovirus bovino tipo 3 coexistiendo predominantemente con Pasteurella multocida y Mannheimia haemolytica.
LITERATURA CITADA
1. Ameghino E. 1990. Neumonías. En: Avances sobre investigación en salud animal – Camélidos sudamericanos. Bol Div IVITA-UNMSM 23: 25-30.
2. Ameghino E, Calle S. 1989. Aislamiento de Pasteurella multocida de procesos neumónicos en crías de alpaca. En: XII Reunión Científica Anual de la Asociación Peruana de Producción Animal (APPA). Lima.
3. Ameghino E, DeMartini J. 1991. Mortalidad en crías de alpacas. Perú: Martegraf. 128 p.
4. Arratia V, Herrera JP. 1992. Agentes etiológicos de las neumonías en alpacas de la Cat. Santa Lucía Nº 179. En: XI Congreso Nacional de Ciencias Veterinarias del Perú. Puno.
5. Ayling RD, Nicholas RAJ. 2007. Mycoplasma respiratory infections. En: Aiken ID (ed). Diseases of sheep. 4th ed. UK: Blackell Publishing. p 231-235.
6. Baker JC, Velicer LF. 1991. Bovine respiratory syncytial virus vaccination: current status and future vaccines development. Contin Educ 13: 1323- 1335.
7. Cirilo E. 2008. Identificación de agentes virales y bacterianos causantes de neumonías agudas en crías de alpacas. Tesis de Maestría. Lima: Univ Nacional Mayor de San Marcos. 93 p.
8. Crossley BM, Barr BC, Magdesian KG, Ing M, Mora D, Jensen D, Loretti AP, et al. 2010. Identification of a novel coronavirus possibly associated with acute respiratory syndrome in alpacas (Vicugna pacos) in California. J Vet Diagn Invest 22: 94-97.
9. Dabo SM, Taylor JD, Confer AW. 2008. Pasteurella multocida and bovine respiratory disease. Anim Hlth Res Rev 8: 129-150.
10. Davies DH, Jones BA, Thurley DC. 1981. The pathogenesis of sequential infection with Parainfluenza virus type 3 and Pasteurella haemolytica in sheep. Vet Microb 6: 173-182.
11. Domachowske JB, Rosenberg HF. 1999. Respiratory syncytial virus infection: immune response, immunopathogenesis and treatment. Clin Microbiol Rev 12: 298-309.
12. Dungworth DC. 1985. The respiratory system. In: Jubb KVF, Kennedy PC, Palmer N (eds). Pathology of domestic animals. USA: Academic Press. p 448- 489.
13. Hung A, López T, Perales R, Noé N. 1988. Mycoplasmosis en camélidos sudamericanos. En: XI Congreso Panamericano de Ciencias Veterinarias. Lima, Perú.
14. Luna L. 2012. Caracterización molecular de coronavirus (CoV) detectados en crías de alpacas (Vicugna pacos). Tesis de Maestría. Lima: Univ Nacional Mayor de San Marcos. 59 p.
15. Manchego A, Rivera H, Rosadio R. 1998. Seroprevalencia de agentes virales en rebaño mixto de una comunidad andina peruana. Rev Inv Pec IVITA 9(2): 1-10.
16. Narita M, Yamada M, Tsuboi T, Kawashima K. 2002. Immunohistopathology of calf pneumonia induced by endobronchial inoculation with bovine adenovirus 3. Vet Pathol 39: 565-571.
17. Pardon B, DeBleeker K, Dewulf J, Callens J, Boyen F, Catry B, Deprez P. 2011. Prevalence of respiratory disease, non vaccinated, routinely medicated veal calves. Vet Rec 169: 278.
18. Ramírez A. 1991. Enfermedades infecciosas. En: Fernández-Baca S (ed). Avances y perspectivas del conocimiento de los camélidos sudamericanos. Santiago de Chile: FAO. p 263-324.
19. Rivera H, Madewell B, Ameghino E. 1987. Serological survey of viral antibodies in Peruvian alpacas (Lama pacos). Am J Vet Res 48: 189-191.
20. Rosadio R, Ameghino E, Ramírez A. 1990. Diagnosis and control of diseases in sheep and alpaca in Peru. In: McCorkle CM (ed). Improving Andean sheep and alpaca production. USA: University of Missoury-Columbia. p 141- 220.
21. Rosadio R, Cirilo E, Manchego A, Rivera H. 2011. Respiratory syncytial and parainfluenza type 3 viruses coexisting with Pasteurella multocida and Mannheimia hemolytica in acute pneumonias of neonatal alpacas. Small Ruminant Res 97: 110-116.
22. Sharp JM, Nettleton PF. 2007. Acute respiratory virus infections. In: Diseases of sheep. 4th ed. Australia: Blackwell Publ. p 8-12.
23. Trigo F, Valero G. 2004. Patología general veterinaria. 4° ed. México: McGraw-Hill. 437 p.
24. Victorio W, Rosadio R, Rivera H, Manchego A. 2004. Seroprevalencia de virus neumopatógenos en alpacas adultas de la provincia de Canchis, Cusco. Rev Inv Vet Perú 15: 127-131.
Recibido: 21 de octubre de 2011
Aceptado para publicación: 21 de enero de 2013